L'Observateur des médicaments émergents - Juillet 2008
Le CEPMB
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987.
Le CEPMB est investi d'un double rôle : veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs et faire rapport des tendances des prix de vente de tous les médicaments ainsi que des dépenses de recherche et développement (R-D) des brevetés.
Le CEPMB rend annuellement compte au Parlement, par l'intermédiaire du ministre de la Santé, de ses activités, des tendances des prix de tous les médicaments et des dépenses de R-D des brevetés.
L'initiative du SNIUMP
Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) fournit des analyses critiques des tendances des prix des médicaments d'ordonnance, de l'utilisation faite de ces médicaments et des coûts en médicaments au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d'assurance médicaments fédéral, provinciaux et territoriaux participants.
L'initiative du SNIUMP est un partenariat entre le CEPMB et l'Institut canadien d'information sur la santé (ICIS). Elle a vu le jour en 2001 à la suite d'une entente entre les ministres fédéral, provinciaux et territoriaux de la Santé.
Remerciements
Le présent rapport a été rédigé par le Conseil d'examen du prix des médicaments brevetés (CEPMB) au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP).
Le CEPMB reconnaît les contributions des membres du Comité directeur du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport.
1. Introduction
Voici la deuxième livraison de L'Observateur des médicaments émergents (OMÉ). L'OMÉ détermine les médicaments rendus à un stade assez avancé de leur développement qui peuvent, à court terme, avoir une incidence sur les dépenses des régimes fédéral, provinciaux et territoriaux d'assurance-médicaments. Il vise les nouveaux médicaments qui auront vraisemblablement une incidence importante en ce qui a trait à la valeur thérapeutique et à l'utilisation.
Chaque rapport de l'OMÉ renferme une liste de médicaments « émergents » qui sont en cours de développement. Ces médicaments sont sélectionnés d'après les critères suivants : la phase du développement; l'indication et le domaine thérapeutique; la description du médicament; l'incidence clinique. Chacun des rapports contient également une liste actualisée des médicaments présentés dans le rapport précédent. Certains médicaments peuvent être retirés de la liste en fonction de nouveaux renseignements.
2. Mise à jour de la liste de l'OMÉ
L'OMÉ a pour objet de présenter une liste actuelle des médicaments qui en sont au processus de développement et d'autorisation. C'est pourquoi il est nécessaire de vérifier régulièrement les statuts réglementaires de ces médicaments et de les mettre à jour, le cas échéant.
2.1 Ajout de nouveaux médicaments
La liste de l'OMÉ est mise à jour d'après les renseignements contenus dans la base de données BioPharm InsightMD. Cette base de données détaillée résume les renseignements fournis par les sociétés qui sont responsables de la recherche et de la commercialisation de médicaments. Un pharmacien surveille régulièrement ces données afin de déterminer les ajouts éventuels à la liste. Elles sont examinées par renvoi aux critères de sélection précisés dans le premier rapport de l'OMÉ : la phase du développement, l'indication et le domaine thérapeutique, la description du médicament et l'incidence clinique ou autre. Seuls les médicaments qui satisfont à tous les critères sont ajoutés à la liste.
Une première interrogation de la base de données BioPharm Insight, effectuée aux fins du présent rapport, a permis de relever 554 ajouts éventuels à la liste de l'OMÉ (voir le tableau 1). En appliquant les critères de sélection définis dans le premier rapport de l'OMÉ, ce nombre a été réduit à six médicaments. Le tableau 2 précise les médicaments sélectionnés.
Comme dans le rapport précédent, la première interrogation attestait une proportion élevée de nouveaux médicaments pour le cancer en phase III des essais cliniques, ou ayant fait l'objet d'une présentation de drogue nouvelle (NDA) ou d'une demande de licence biologique (BLA). L'application des autres critères de sélection a permis d'éliminer la majorité d'entre eux. En dernier ressort, un seul nouveau médicament pour le cancer a été ajouté à la liste.
Tableau 1. Nombre d'ajouts éventuels à la liste de l'OMÉ, selon le domaine thérapeutique
| Domaine thérapeutique |
En phase III ou présentation NDA/BLA |
Avec descripteurs clés |
Résultats préliminaires positifs |
Médicaments retenus par l'OMÉ |
| Cancer |
130 |
67 |
10 |
1 |
| Cardiovasculaire* |
50 |
29 |
11 |
1 |
| Système nerveux central |
71 |
37 |
12 |
0 |
| Dermatologie |
12 |
2 |
1 |
0 |
| Agents diagnostiques et d'imagerie |
9 |
5 |
3 |
0 |
| Yeux et oreilles |
10 |
3 |
1 |
0 |
| Système gastro-intestinal |
30 |
10 |
2 |
0 |
| Système génito-urinaire |
18 |
2 |
1 |
1 |
| Hématologique |
14 |
6 |
4 |
0 |
| Infections au VIH |
15 |
0 |
0 |
0 |
| Système hormonal* |
49 |
17 |
9 |
2 |
| Système immunitaire |
27 |
15 |
5 |
2 |
| Maladies infectieuses |
42 |
13 |
2 |
0 |
| Système musculosquelettique |
26 |
7 |
3 |
0 |
| Douleurs |
39 |
8 |
5 |
0 |
| Système respiratoire |
13 |
7 |
2 |
0 |
| TOTAL |
554 |
227 |
70 |
6 |
* Un médicament (le tolvaptan) est indiqué à la fois pour le système cardiovasculaire et le système hormonal. Il est compris dans le compte de chacune des deux utilisations thérapeutiques, mais n'est compté qu'une seule fois dans le total.
Tableau 2. Médicaments ajoutés à la liste de l'OMÉ
| Produit chimique/Nom de marque/Codes/Société |
Catégorie thérapeutique/Indication/Voie d'administration |
Statut réglementaire |
Considérations thérapeutiques |
|
Ecallantide
Dx-88
Dyax Corp. Genzyme Corp.
|
ATC B02 Antihémorragiques
Angio-œdème héréditaire (AOH)
Voie intraveineuse
|
Essais en phase III
Médicament orphelin aux États-Unis et en Europe
Sous examen de la FDA (processus rapide)
|
Le DX-88 est une petite protéine qui inhibe une enzyme contenue dans le sang, qu'on appelle la kallicréine. La kallicréine est un élément clé de la régulation de l'inflammation et de la coagulation sanguine. On pense que la kallicréine activée pourrait jouer un rôle dans un bon nombre de maladies ou d'états inflammatoires et auto‑immuns, dont notamment l'angio-œdème héréditaire, les pertes sanguines à la suite de chirurgies majeures (comme le pontage aortocoronarien par greffe et le remplacement de la hanche) et l'arthrite rhumatoïde. En raison de sa haute spécificité à la kallicréine, le DX-88 est susceptible d'entraîner moins d'effets secondaires ou d'être plus efficace que les inhibiteurs naturels dans le traitement de l'inflammation.
Source : BioPharm Insight
|
|
Eculizumab
Soliris
Alexion Pharmaceuticals, Inc.
|
ATC L04
Agents immunosuppresseurs
Hémoglobinurie paroxystique nocturne (HPN)
Voie intraveineuse
|
Essais en phase III
Médicament orphelin aux États-Unis
Approuvé aux États-Unis et en Europe
|
L'eculizumab, un inhibiteur à action prolongée du facteur C5 du complément, est un anticorps monoclonal humanisé, qui est conçu pour bloquer de façon sélective l'activation de la voie terminale du complément prévenant ainsi la destruction des globules rouges par le complément chez les patients atteints d'hémoglobinurie paroxystique nocturne (HPN). Il n'existe actuellement aucun traitement particulier de l'HPN. L'eculizumab semblait être sécuritaire et bien toléré et permettait d'apporter des améliorations cliniquement et statistiquement significatives au niveau de l'hémolyse intravasculaire, de l'anémie, de la fatigue et de la qualité de vie chez les patients atteints de l'HPN.
Source : Eculizumab prescribing information for physicians (Information posologique sur l'eculizumab destinée aux médecins); téléconférence de la société Alexion en date du 26 mars 2007.
|
|
Plerixafor
Mozobil
Genzyme Corp.
|
ATC L03
Immunostimulants
Myélome multiple Lymphome non hodgkinien
Voie intraveineuse
|
Essais en phase III
Médicament orphelin
aux États-Unis
|
Il a été démontré dans de multiples études antérieures que le Mozobil, une nouvelle petite molécule antagoniste du récepteur de chimiokine CXCR4, accroît rapidement et efficacement le nombre de cellules souches dans la circulation du sang. Une fois en circulation dans le sang, les cellules souches peuvent être recueillies afin d'être utilisées dans une greffe. Le Mozobil fait actuellement l'objet d'une recherche clinique en Amérique du Nord et en Europe, à titre d'agent potentiel de mobilisation des cellules souches chez les cancéreux qui subissent une greffe de cellules souches.
Source : BioPharm Insight; communiqué de la société Genzyme Corp. en date du 2 août 2007.
|
|
Sapropterin
Kuvan, Phenoptin
Biomarin Pharmaceutical, Inc.
Daiichi Asubio Pharmaceuticals, Inc.
Merck Serono S.A.
|
ATC A16
Autres produits liés au tractus digestif et au métabolisme
Phénylcétonurie (PCU)
Voie orale
|
Essais en phase III
Médicament orphelin aux États-Unis
Approuvé aux États-Unis
En développement au Canada
|
Le Kuvan (Phenoptin) consiste en une petite molécule de recherche qui est administrée par voie orale pour le traitement de la phénylcétonurie (PCU). Ledichlorhydrate de saproptérine est la formulation synthétique de la 6R‑BH4 (R‑tétrahydrobioptérine), un cofacteur naturel de l'enzyme qui travail de concert avec la phénylalanine hydroxylase (PAH) pour métaboliser la phenylalanine. Les données cliniques préliminaires laissent penser que le Phenoptin peut réduire notablement la concentration de phénylalanine dans le sang chez le sous‑groupe de patients qui sont sensibles à la BH4. Les sociétés BioMarin et Serono estiment que le Phenoptin pourrait offrir une solution de traitement pour 30 à 50 % des quelque 50 000 personnes du monde industrialisé qui ont reçu un diagnostic de PCU.
Source : Communiqué de la société Biomarin Pharmaceutical, Inc. en date du 3 décembre 2007.
|
|
Tolvaptan
Otsuka Maryland Research Institute (OMRI)
Otsuka Pharmaceutical Co., Ltd.
|
ATC C03
Diurétiques
Insuffisance cardiaque congestive (ICC)
Hyponatrémie
Voie orale
|
Phase III
Agrément (processus rapide)
Présentation NDA
|
Le tolvaptan est une nouvelle petite molécule de recherche, conçue pour être un antagoniste du récepteur de la vasopressine V2, qui joue un rôle dans la régulation rénale de l'excrétion de fluide. La majorité des patients hospitalisés pour une insuffisance cardiaque en décompensation aiguë (ICDA) sont atteints d'œdème ou d'un excès de fluide corporel. On traite cet état au moyen de diurétiques, afin d'éliminer l'excès de fluide. Contrairement aux diurétiques, le tolvaptan est conçu pour favoriser l'aquarèse (l'excrétion d'eau sans électrolytes). Ce médicament a la possibilité de devenir le premier antagoniste du récepteur de la vasopressine, actif par voie orale, à être offert sur le marché.
Source : BioPharm Insight
|
|
Rivaroxaban
Xarelto, inhibiteur du facteur Xa
Bayer Ag
Bayer Schering Pharma
Johnson & Johnon
|
ATC B01
Agents antithrombotiques
Prévention de la thrombo‑embolie veineuse
Syndrome coronarien aigu
Accident vasculaire cérébral (AVC)
Voie orale
|
Essais en phase III
Présentation MAA
En développement au Canada
|
Le rivaroxaban est un nouvel inhibiteur direct du facteur Xa (FXa) qui en est actuellement à la phase du développement clinique, aux fins de la prévention et du traitement des troubles thrombo‑emboliques artériels et veineux. Le rivaroxaban inhibe la thrombogenèse en diminuant l'activité du FXa de façon sélective et puissante, et il ne requiert aucun cofacteur tel que l'antithrombine. Le rivaroxaban fait actuellement l'objet d'essais en phase III pour quatre indications : la prévention des AVC chez les patients en fibrillation auriculaire, la thrombo‑embolie veineuse, la thrombose veineuse profonde et la prophylaxie de la thrombo‑embolie veineuse. L'usage du rivaroxaban a été autorisé par l'EMEA lorsqu'il s'agit de prévenir la thrombo‑embolie veineuse à la suite d'une chirurgie orthopédique majeure d'un membre inférieur.
Source : BioPharm InsightMD
|
* La catégorie thérapeutique est une estimation au moment de la publication. Comme ces médicaments n'ont pas encore été approuvés, on ne leur a pas encore attribué un code de classification ATC.
2.2 Mise à jour des statuts réglementaires
Un pharmacien examine la liste dans les rapports précédents de l'OMÉ, afin de voir si les statuts réglementaires des médicaments ont été modifiés. Pour chacun des médicaments inscrits dans la liste de l'OMÉ, le pharmacien a trois choix :
- laisser le médicament et la description du médicament tels quels;
- mettre à jour la description du médicament en ajoutant les renseignements qu'il estime pertinents et utiles pour les gestionnaires des régimes d'assurance-médicaments;
- retirer le médicament de la liste.
Si aucune modification importante n'a été apportée au statut réglementaire du médicament depuis l'examen précédent, la description demeurera inchangée. À l'inverse, si des modifications dignes de mention ont été apportées au statut réglementaire du médicament, la description du médicament sera mise à jour. Ces modifications pourraient comprendre, entre autres, des résultats détaillés concernant l'efficacité, le lancement d'essais visant l'élargissement de l'indication ou l'autorisation à l'échelle internationale. De nouveaux renseignements seront ajoutés à la section des considérations thérapeutiques de l'OMÉ, ainsi que la date de la dernière révision. Les modifications telles que la mention des fusions d'entreprises ou des contrats de commercialisation (qui n'ont aucune incidence sur l'intention de mettre le médicament en marché au Canada), ainsi que les modifications mineures concernant les essais cliniques (p. ex., la modification des lieux), ne sont pas considérées comme suffisamment importantes pour modifier le statut réglementaire.
Dans quelques cas seulement, il serait nécessaire de retirer un médicament de la liste de l'OMÉ (voir le graphique 1). En particulier, un médicament sera retiré de la liste de l'OMÉ :
- si les études menées sur ce médicament ont été interrompues (p. ex. en raison des résultats négatifs des essais cliniques ou des preuves insuffisantes que le médicament émergent offre des bienfaits thérapeutiques par rapport à ses comparateurs);
- si les sociétés pharmaceutiques précisent qu'elles ne souhaitent pas obtenir l'autorisation de distribuer le médicament au Canada;
- si le médicament a obtenu l'accès au marché et n'est donc plus en voie de commercialisation.
Il est à noter qu'un renversement de la situation pourrait éventuellement ramener dans la liste de l'OMÉ un médicament qui en aurait été retiré antérieurement. À titre d'exemple, un médicament pourrait avoir été retiré de la liste parce que les essais cliniques étaient suspendus afin d'enquêter sur ses effets indésirables potentiels. Au terme de ses recherches, la société pourrait conclure que les preuves des effets indésirables du médicament sont insuffisantes et reprendre les essais cliniques. Les données du médicament seraient saisies de nouveau dans la base de données BioPharm Insight et son nom pourrait réapparaître dans la liste de l'OMÉ.
Le tableau 3 présente les mises à jour des statuts réglementaires qui ont été apportées depuis la dernière livraison du présent rapport.
Figure 1. Mises à jour et suppressions de la liste de l'OMÉ
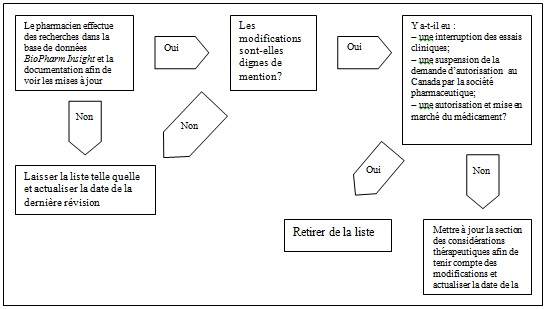
Tableau 3. Liste actuelle de l'OMÉ, comprenant la mise à jour des statuts réglementaires
| Produit chimique/Nom de marque/Codes/Société |
Catégorie thérapeutique/Indication/Voie d'administration |
Statut réglementaire |
Considérations thérapeutiques |
|
Agomélatine
Valdoxan
Servier
|
ATC N06
Psychoanaleptiques
Troubles dépressifs majeurs
Voie orale
|
Essais en phase III
En développement au Canada
Sous examen par l'EMEA
|
L'agomélatine est le premier médicament d'agoniste mélatonergique et d'antagoniste sérotonergique. Même chez les patients atteints de dépression grave, il associe l'efficacité d'un antidépresseur à des effets indésirables peu importants. Il présente en outre l'avantage de régulariser le sommeil des patients dépressifs.
|
|
Efaproxiral
Efaproxyn, Revaproxyn
RSR13
Allos Therapeutics
|
ATC L01
Agents antinéoplasiques
Métastases cérébrales
Voie
intraveineuse
|
Essais en phase III
Sous examen par l'EMEA
|
L'efaproxiral est un modificateur allostérique de l'hémoglobine et un agent de radiosensibilisation. Il peut renforcer l'efficacité de la radiothérapie standard. L'efaproxiral est actuellement sous examen comme traitement complémentaire à la radiothérapie du cerveau entier pour les patients atteints d'un cancer solide métastasé au niveau du cerveau (p. ex., cancer du sein, cancer du poumon). Les résultats préliminaires démontrent une amélioration statistiquement significative dans le taux médian de survie et la qualité de vie d'un sous‑groupe formé de patientes atteintes d'un cancer du sein métastasé.
|
|
Istradefylline
KW-6002
Kyowa Hakko
Kogyo Co Ltd.
|
ATC N04
Anti-parkinsoniens
Maladie de Parkinson
Voie orale
|
Essais en phase III
Présentation NDA*
|
L'istradefylline est le premier antagoniste sélectif des récepteurs A2A. Les antagonistes des récepteurs A2A améliorent les déficiences motrices sans induire une dyskinésie et amortissent les tremblements parkinsoniens. L'istradefylline réduit les complications comme la perte d'efficacité qui existent avec les traitements actuels.
|
|
Lapatinib
Tykerb
GSK
|
ATC L01
Agents antinéoplasiques
Cancer du sein
Voie orale
|
En développement au Canada
Approuvé aux États‑Unis et en Europe dans le cadre d'une polythérapie pour le traitement du cancer du sein évolué ou métastatique dans les cas de croissance tumorale lors d'une thérapie antérieure*
|
Le lapatinib est une petite molécule qui inhibe la tyrosine kinase, une composante du facteur de croissance épidermique (EGFR) (ErbB1) et des récepteurs HER2. En association avec la capécitabine, il retarde de presque deux fois la croissance des tumeurs chez les femmes atteintes d'un cancer du sein ErbB2 positif réfractaire avancé ou métastatique, et dont la maladie a progressé à la suite d'un traitement au trastuzumab ou d'autres cancérothérapies. Son profile de risque d'effets indésirables est peu important.
|
|
Raltegravir
Isentress
MK-0518
Merck & Co Inc.
|
ATC J05
Antiviraux pour usage systémique
Infections au VIH
Voie orale
|
Approuvé aux États‑Unis en association avec d'autres antirétroviraux pour le traitement de l'infection à VIH-1 chez les patients adultes prétraités présentant des signes de réplication virale et infectés par des souches de VIH-1 résistantes à plusieurs agents antirétroviraux*
Santé Canada a approuvé l'utilisation du médicament sous réserve, en association avec d'autres médicaments antirétroviraux pour le traitement des infections au VIH-1 chez des patients adultes « prétraités » présentant des signes de réplication virale et de résistance aux médicaments*
|
Le raltegravir est le premier inhibiteur d'intégrase, une nouvelle catégorie d'agents antirétroviraux.
|
|
Phenoxodiol
Marshall Edwards Inc.
|
ATC L01
Agents antinéoplasiques
Cancer ovarien
Voie orale
|
Essais en phase III
|
Le phenoxodiol est un succédané synthétique d'une plante, l'isoflavone genistein. Il constitue une nouvelle génération de médicaments oncologiques qui agissent comme de multiples régulateurs de la transduction des signaux. En association avec le paclitaxel ou la cisplatine, cette substance prolonge la survie considérablement. Le phenoxodiol serait utilisé comme traitement d'appoint afin d'augmenter la survie.
|
|
Pirfenidone
Intermune Inc.
|
ATC R07
Autres produits en relation avec le système respiratoire
Fibrose pulmonaire
Voie orale
|
Essais en phase III
Médicament orphelin aux États-Unis et en Europe
|
Le pirfenidone, un nouvel agent, a des propriétés anti-inflammatoires, antioxydantes et antifibrotiques. Selon les résultats préliminaires, le pirfenidone peut agir sur la fonction pulmonaire et sur la progression de la maladie chez les patients atteints d'une fibrose pulmonaire idiopathique. Le pirfenidone est également en développement pour la sclérose en plaques.
|
|
Satraplatin
LA 12
GPC Biotech AG;
Spectrum Pharmaceuticals Inc.
Pharmion Corp.
|
ATC L01
Agents antinéoplasiques
Cancer de la prostate
Voie orale
|
Sous examen de la FDA (processus rapide)
Présentation MAA*
|
Le satraplatin est un composé de platine biodisponible administré par voie orale.
|
|
Sipuleucel-T
Provenge
Dendrion Corporation
|
ATC L01
Agents antinéoplasiques
Cancer de la prostate
Voie
intraveineuse
|
Sous examen de la FDA (processus rapide)
Présentation NDA*
|
Le sipuleucel-T est le premier médicament d'une nouvelle catégorie d'immunothérapies cellulaires actives (ICA), conçues pour stimuler le système immunitaire du patient.
|
|
Tramiprosate
Alzhemed
Neurochem Inc.
|
ATC N06
Psychoanaleptiques
Maladie d'Alzheimer
Voie orale
|
Essais en phase III
Agrément (processus rapide)*
|
Le tramiprosate est un antagoniste du bêta-amyloïde (ß amyloïde), conçu pour franchir la barrière hématoencéphalique, se lier à la forme soluble du peptide alpha bêta (Aß) et nuire au cascade amyloïde, menant ainsi à la prévention ou à l'inhibition des dépôts amyloïdes et des effets toxiques du peptide Aß sur le cerveau. Cette substance peut ralentir la progression de la maladie d'Alzheimer. Selon les résultats préliminaires, la substance apporte des bienfaits cliniques importants sur le plan cognitif ainsi qu'au niveau de la performance globale. Elle semble également stabiliser la maladie chez 44 % des patients légèrement atteints par la maladie après trois années de traitement.
|
Nota : Tableau mis à jour le 14 février 2008. Les développements récents sont écrits en caractères gras dans la liste.
* Développement récent.