L'Observateur des médicaments émergents – avril 2013
Le CEPMB
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987.
Le CEPMB est investi d'un double rôle : veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs et faire rapport des tendances des prix de vente de tous les médicaments ainsi que des dépenses de recherche et développement (R-D) des brevetés.
Le CEPMB rend annuellement compte au Parlement, par l'intermédiaire du ministre de la Santé, de ses activités, des tendances des prix de tous les médicaments et des dépenses de R-D des brevetés.
L'initiative du SNIUMP
Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) fournit des analyses critiques des tendances des prix des médicaments d'ordonnance, de l'utilisation faite de ces médicaments et des coûts en médicaments au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux participants.
L'initiative du SNIUMP est un partenariat entre le CEPMB et l'Institut canadien d'information sur la santé. Elle a vu le jour en 2001 à la suite d'une entente entre les ministres fédéral, provinciaux et territoriaux de la Santé.
Remerciements
Le CEPMB tient à remercier les personnes suivantes pour leurs contributions :
- les membres du Comité directeur du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport;
- Greg McComb, économiste principal et membre du SNIUMP, au CEPMB, pour sa contribution au contenu analytique du présent rapport, de même que le groupe scientifique et l'équipe de révision du CEPMB;
- Patricia Carruthers-Czyzewski (B.Sc.[phm.], M.Sc.) de Sintera Inc., pour son expertise pharmaceutique dans le cadre de l'élaboration de la méthodologie et les contributions scientifiques du rapport.
1. Introduction
Voici la quatrième livraison de L'Observateur des médicaments émergents (OMÉ), une publication qui présente des renseignements sur les médicaments en cours de développement qui peuvent avoir une incidence sur les dépenses des régimes fédéral, provinciaux et territoriaux (F-P-T) d'assurance-médicaments. Chaque rapport comprend une liste de médicaments émergents trouvés dans le cadre d'une recherche dans la base de données BioPharm InsightMD 1 une base de données spécialisée qui présente des renseignements sur plus de 21 000 médicaments ayant atteint la phase des essais cliniques. Cette recherche est appuyée par des documents pharmaceutiques publiés, tout particulièrement des études canadiennes.
Seuls les médicaments qui répondent à un ensemble de critères de sélection pourraient intéresser l'OMÉ. Les critères de sélection, préparés pour le CEPMB en 2006, sont les suivants : la phase du développement, l'indication, le mécanisme d'action et l'incidence sur la pratique clinique. Un algorithme sous forme d'arbre décisionnel a été élaboré afin que les critères soient appliqués de façon uniforme, une étape à la fois. Une fois qu'une liste préliminaire est sélectionnée, on s'emploie à y inclure les médicaments émergents tirés d'un ensemble varié de catégories thérapeutiques dont les médicaments sont admissibles à un remboursement par les régimes publics d'assurance-médicaments. Une attention particulière est accordée aux nouveaux médicaments à coût élevé qui pourraient avoir une incidence financière, aux catégories auxquelles appartiennent ces médicaments ainsi qu'aux catégories comprenant une part élevée de médicaments génériques.
Puisqu'il s'agit de la quatrième livraison de l'OMÉ, elle met à jour l'état des médicaments émergents identifiés dans les trois rapports précédents. Certains médicaments ont été retirés de la liste, soit parce qu'ils ont été introduits sur le marché canadien, soit parce que leur fabricant n'effectue plus d'essais cliniques. Réciproquement, les médicaments ont été conservés dans la liste si les essais en cours soutiennent l'évaluation initiale qui a justifié l'ajout à la liste.
La présente livraison comporte six sections. Suivant l'introduction, la section 2 donne un aperçu des critères utilisés aux fins de sélection des médicaments, tandis que la section 3 décrit l'algorithme qui a servi à appliquer les critères. La section 4 porte sur la recherche dans la base de données BioPharm Insight ainsi que sur l'examen des documents publiés, et elle présente une liste des médicaments identifiés aux fins du présent rapport. La section 5 donne des mises à jour sur les médicaments émergents identifiés dans les rapports précédents, alors que la section 6 présente une liste des références citées dans le rapport.
2. Critères de sélection des médicaments
La présente section décrit brièvement les critères ayant servi à sélectionner les médicaments émergents.
2.1 Phase du développement
L'OMÉ ne traitera que des médicaments ayant atteint la phase III des essais cliniques. Les médicaments qui atteignent ce niveau sont plus susceptibles d'être soumis à l'approbation réglementaire et d'être commercialisés dans un avenir prochain. D'autre part, les médicaments se trouvant à des stades de développement moins avancés ne passent pas nécessairement toute la filière de l'approbation.
2.2 Indication et domaine thérapeutique
Les médicaments sont jugés des candidats potentiels de l'OMÉ s'ils peuvent servir à traiter des affections virtuellement mortelles, des affections pour lesquelles il n'existe aucun traitement, des maladies rares ou, encore, s'ils sont susceptibles de faire changer la pratique clinique à l'intérieur d'un domaine thérapeutique.
2.3 Description du médicament
Parmi les éléments descriptifs des médicaments qui indiquent qu'un nouveau médicament pourrait donner lieu à un changement de la pratique clinique, citons les suivants : premier médicament de sa catégorie, mécanisme d'action différent, technologie nouvelle, thérapie d'appoint, médicament-niche, médicament existant administré pour une indication nouvelle.
2.4 Incidence clinique et autre
Les médicaments doivent être susceptibles d'avoir une incidence clinique importante ou une incidence marquée sur d'autres secteurs du régime de soins de santé. Mentionnons, entre autres, une meilleure efficacité par rapport aux médicaments existants, des bienfaits pour la santé des patients tels qu'une plus grande espérance de vie ou une meilleure qualité de vie, des résultats nouveaux ou redéfinis et un profil d'innocuité amélioré.
3. Méthode d'application des critères de sélection
L'OMÉ tire surtout son information de la base de données BioPharm Insight. Cette base de données fait le suivi des médicaments depuis leur découverte préclinique jusqu'aux données sur leurs ventes, en passant par les essais cliniques et leur commercialisation. Cette base de données contient de vastes renseignements sur plus de 21 000 médicaments expérimentaux. Son moteur de recherche permet de sélectionner les médicaments selon différents critères, notamment la phase de développement, le domaine thérapeutique, l'indication, le mécanisme du médicament, les médicaments orphelins, la filière d'approbation rapide et le type de molécule.
Vous trouverez dans la figure 1 l'algorithme établi pour faire la sélection des médicaments. Il combine la capacité de recherche de la base de données BioPharm Insight avec le critère clé utilisé pour identifier les médicaments susceptibles d'avoir une grande incidence. Étant donné que les sources d'information de cette base de données sont en large partie américaines, des sources supplémentaires sont utilisées pour vérifier si les nouveaux médicaments sont en développement au Canada.
Figure 1. Algorithme de sélection des médicaments pour L'Observateur des médicaments émergents
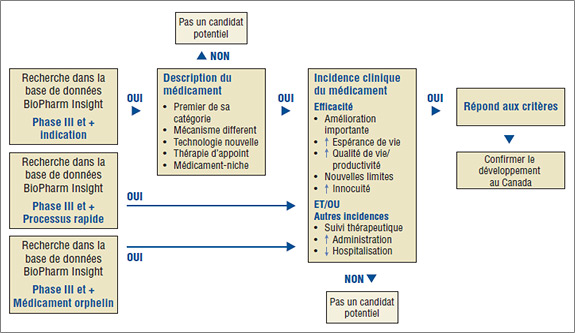
La première étape est l'identification des médicaments auxquels pourrait s'intéresser l'OMÉ. À cette fin, une recherche est faite dans la base de données BioPharm Insight pour trouver les médicaments en phase III du développement. Dans certains cas, les essais de phase III peuvent être à leurs tout débuts et dans d'autres, des résultats seront disponibles. Les médicaments en phase III du développement sont soumis à une procédure de sélection selon le domaine thérapeutique sur lequel agit le médicament et selon l'indication. Un médicament est considéré un candidat potentiel pour l'OMÉ si la US Food and Drug Administration (FDA) l'inscrit comme médicament orphelin, qui traite une maladie rare, si son processus d'approbation est accéléré étant donné qu'il doit traiter une affection grave ou virtuellement mortelle ou, encore, si le médicament semble pouvoir traiter des affections pour lesquelles il n'existe encore aucun médicament.
Pour les médicaments dont le processus de développement n'est pas accéléré ou qui ne sont pas désignés orphelins, la recherche de leur profil est faite à l'aide de mots clés se rapportant à un descripteur précis, comme premier de sa catégorie thérapeutique, mécanisme différent, technologie nouvelle, thérapie d'appoint, médicament-niche, ou médicament existant avec une nouvelle indication. Par la suite, les résultats de la phase III de ces médicaments sont analysés pour valider les caractéristiques du médicament identifiées dans le profil, comme une bien meilleure efficacité ou innocuité. À ce point-ci, les médicaments arrivant au stade des essais cliniques de phase III sont rejetés du fait que l'information n'est pas suffisante pour l'évaluation scientifique.
Ensuite, les sources canadiennes sont consultées pour déterminer si le médicament est en cours de développement au Canada. La principale source d'information est le Pharmacy Practice, qui publie une liste annuelle de nouveaux médicaments prometteurs ayant atteint les derniers stades de développement (phase III ou au-delà) au Canada. La prochaine étape d'identification des médicaments dont pourrait traiter l'OMÉ est l'évaluation scientifique des médicaments dont les résultats préliminaires de la phase III révèlent une incidence au niveau de l'efficacité ou de l'innocuité.
Enfin, pour confirmer l'ajout d'un nouveau médicament à l'OMÉ, on vérifie si le médicament est susceptible d'être inscrit sur la liste des médicaments admissibles à un remboursement par les régimes F-P-T d'assurance-médicaments, à la lumière de l'indication du médicament et de sa forme posologique.
4. Identification des médicaments auxquels pourrait s'intéresser L'Observateur des médicaments émergents
4.1. Recherche dans la base de données BioPharm Insight
La première étape de l'identification des médicaments consistait en une recherche dans la base de données BioPharm Insight. Comme lors des analyses précédentes, seuls les médicaments qui étaient en phase III du développement ou qui faisaient l'objet d'un examen par la FDA (c.-à-d. une présentation de drogue nouvelle [NDA] ou une demande de licence biologique [BLA]2) ont été sélectionnés à la première étape. Seuls les agents présentés depuis le 1er mars 2011 ont été pris en compte puisque les médicaments présentés avant cette date auraient été identifiés dans l'OMÉ de 2011. La recherche de médicaments a été effectuée en date du 22 mars 2012, conformément à l'algorithme décrit dans la section précédente. Un examen complémentaire a été mené en date du 18 février 2013 pour mettre à jour les changements relatifs aux stades de développement des médicaments sélectionnés.
Le tableau 1 résume les résultats de la recherche par domaine thérapeutique. On a examiné le profil de chacun de ces médicaments dans la base de données, en accordant une attention particulière au champ « drug description » (description du médicament). La recherche a porté sur des mots clés précis comme « premier de sa catégorie » et « mécanisme différent ». Si ces mots clés étaient trouvés, l'étape suivante consistait à déterminer les résultats des essais cliniques de phase III, le cas échéant. Sous le critère « development history » (historique du développement) du profil du médicament, les détails concernant les résultats de la phase III de ces médicaments ont été analysés pour valider de façon plus approfondie les caractéristiques du médicament, p. ex. une meilleure efficacité ou innocuité. Si cette analyse révélait une efficacité insuffisante ou un problème d'innocuité, le médicament était rejeté à la sélection.
Tableau 1. Résultats de la recherche dans BioPharm Insight par domaine thérapeutique
| Domaine thérapeutique |
Nombre de résultats pertinents |
| En phase III |
Présentation NDA/BLA |
| Cancer |
287 |
27 |
| Cardiovasculaire |
97 |
14 |
| Système nerveux central |
107 |
17 |
| Dermatologie |
39 |
4 |
| Yeux et oreilles |
30 |
7 |
| Système gastro-intestinal |
44 |
17 |
| Système génito-urinaire |
46 |
8 |
| Hématologique |
64 |
9 |
| Infections au VIH |
28 |
5 |
| Système hormonal |
93 |
17 |
| Système immunitaire |
95 |
5 |
| Maladies infectieuses |
99 |
27 |
| Système musculosquelettique |
54 |
7 |
| Néphrologie |
12 |
1 |
| Douleur |
58 |
17 |
| Système respiratoire |
34 |
5 |
| Total* |
1181 |
187 |
* Le nombre total des résultats pertinents des essais de phase III ne correspond pas forcément au nombre total rapporté; ceci est attribuable au fait que certains médicaments peuvent être classés dans plus d'une catégorie thérapeutique.
Le tableau 2 présente une liste fonctionnelle des médicaments qui ont été sélectionnés aux fins de cette étape. Les médicaments biologiques sont indiqués séparément, puisqu'il s'agit de médicaments onéreux susceptibles d'avoir une incidence sur les régimes d'assurance-médicaments. Des 135 médicaments sélectionnés, 37 étaient des médicaments biologiques; ces derniers constituent une nouvelle catégorie de médicaments. Dans la plupart des domaines thérapeutiques, on a identifié un ou plusieurs médicaments biologiques, le plus grand nombre de résultats pertinents ayant été rapportés au chapitre des classifications du cardiovasculaire (9), du système immunitaire (5) et du cancer (4).
Tableau 2. Médicaments particuliers sélectionnés par domaine thérapeutique
| Domaine thérapeutique |
Nombre de résultats pertinents |
| En phase III |
Présentation NDA/BLA |
| Chimique |
Biologique |
Chimique |
Biologique |
| Cancer |
2 |
1 |
2 |
3 |
| Cardiovasculaire |
16 |
9 |
1 |
0 |
| Système nerveux central |
12 |
0 |
0 |
0 |
| Dermatologie |
2 |
2 |
0 |
0 |
| Yeux et oreilles |
4 |
1 |
2 |
1 |
| Système gastro-intestinal |
3 |
1 |
5 |
0 |
| Système génito-urinaire |
4 |
1 |
1 |
0 |
| Hématologique |
3 |
2 |
0 |
0 |
| Infections au VIH |
3 |
0 |
1 |
0 |
| Système hormonal |
13 |
2 |
2 |
1 |
| Système immunitaire |
5 |
5 |
0 |
0 |
| Maladies infectieuses |
7 |
2 |
2 |
1 |
| Système musculosquelettique |
0 |
2 |
0 |
1 |
| Néphrologie |
1 |
0 |
0 |
1 |
| Douleur |
3 |
0 |
3 |
0 |
| Système respiratoire |
0 |
1 |
1 |
0 |
| Total : En phase III et présentation NDA/BLA |
78 |
29 |
20 |
8 |
| Total : Tous les médicaments |
135 |
Pour réduire davantage la liste, tous les médicaments sélectionnés ont été vérifiés par rapport à la plus récente liste des médicaments émergents publiée dans Pharmacy Practice3 afin de vérifier s'il s'y trouvait des renseignements relatifs à des développements sur le marché canadien. L'étape suivante consistait en l'évaluation scientifique de cette liste préliminaire. À la suite de l'évaluation, on a passé en revue les détails concernant les résultats de la phase III tirés des profils de médicaments dans la base de données BioPharm Insight, en cherchant tout particulièrement d'importantes améliorations aux résultats en matière d'efficacité et d'innocuité. De plus, on a effectué une recherche dans la base de données MEDLINEMD afin d'avoir une idée de la façon dont le médicament était perçu dans les documents publiés.
À la dernière étape du processus de sélection, on s'est employé à inclure les médicaments émergents tirés d'un ensemble varié de catégories thérapeutiques dont les médicaments sont admissibles à un remboursement par les régimes publics d'assurance-médicaments. On a aussi tenu compte de l'incidence financière potentielle sur les régimes publics d'assurance médicaments. On peut s'attendre à ce que les nouveaux médicaments introduits dans une catégorie à utilisation élevée (p. ex. cardiovasculaire) ou comportant des médicaments coûteux (p. ex. cancer) augmentent l'ensemble des dépenses associées à un régime d'assurance médicaments. La même logique s'applique aux médicaments introduits dans des catégories thérapeutiques comprenant une part élevée de médicaments génériques. Par exemple, bon nombre de médicaments coûteux conçus pour réduire le taux élevé de cholestérol (atorvastatine, simvastatine et pravastatine) se sont récemment vu retirer leur protection associée au brevet et ont été remplacés par des médicaments génériques moins coûteux. Si un nouveau médicament est lancé sur ce marché, il peut s'avérer un important facteur de coût.
4.2 Médicaments ajoutés à L'Observateur des médicaments émergents
Le tableau 3 présente une liste de nouveaux médicaments ajoutés à l'OMÉ. Chaque médicament a satisfait aux critères de sélection mentionnés à la section 3. La liste comprend le nom de marque du médicament, l'entreprise, le domaine thérapeutique et la justification de son ajout à l'OMÉ.
Tout comme lors des précédentes étapes du processus de sélection, on a identifié les médicaments biologiques comme nouvelle catégorie de médicaments; 5 des 12 médicaments ajoutés à la présente livraison de l'OMÉ appartiennent à cette catégorie. Ils sont mis en évidence dans le tableau pour faciliter leur identification.
Tableau 3. Médicaments ajoutés à L'Observateur des médicaments émergents
| Médicament (nom de marque* – entreprises**) |
Domaine thérapeutique (ATC) – Indications |
Justification de l'ajout à l'OMÉ |
| Cardiovasculaire |
|
Serelaxin (Relaxin – Corthera Inc.; Novartis AG; Paladin Labs, Inc.)
|
Thérapie cardiaque(C01)
Insuffisance cardiaque
Médicament biologique
|
- En essais de phase III
- Médicament hormonal
- Constitue une importante progression à l'égard de l'insuffisance cardiaque aiguë puisqu'il aborde deux des plus importants aspects du traitement de l'affection, soit l'amélioration hémodynamique et la protection rénale4.
|
|
Selexipag (Actelion Pharmaceuticals Ltd; Nippon Shinyaku Co., Ltd)
|
Antihypertenseurs (C02)
Hypertension artérielle pulmonaire
|
- En essais de phase III
- Agoniste sélectif des récepteurs de la prostacycline à action prolongée, administré par voie orale pour le traitement de l'hypertension artérielle pulmonaire
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
|
|
Macitentan (Opsumit – Actelion Pharmaceuticals Ltd.)
|
Thérapie cardiaque (C01) et troubles liés à l'acidité (A02)
Hypertension artérielle pulmonaire et ulcères digitaux
|
- Essais de phase III en cours sur les ulcères digitaux. Présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative à l'hypertension artérielle pulmonaire (base de données Biopharm Insight)
- Antagoniste double oralement actif des récepteurs de l'endothéline qui améliore l'issue à long terme des affections cardiovasculaires
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- Les ulcères digitaux récidivants sont une manifestation d'une affection vasculaire chez les patients souffrant de sclérodermie systémique et constituent une importante source de morbidité.
- On s'attend à ce que le macitentan puisse protéger les tissus des effets dommageables de l'endothéline en gênant complètement son mécanisme d'action. L'endothéline est un agent vasoconstricteur qui augmente la tension artérielle.
|
|
Cancer
|
|
Nintedanib (Boehringer Ingelheim GmbH)
|
Cancer (L01)
Cancer à grandes cellules et cancer ovarien
Médicament biologique
|
- Essais de phase III en cours sur le cancer à grandes cellules et le cancer ovarien (base de données Biopharm Insight)
- Administré par voie orale
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- Inhibiteur triple de l'angiokinase qui agit au niveau de trois récepteurs de facteurs de croissance : le récepteur du facteur de croissance vasculaire endothéliale, le récepteur du facteur de croissance d'origine plaquettaire et le récepteur du facteur de croissance fibroblastique
- Entrave la cascade de signalisation de l'angiogenèse et surmonte la résistance aux médicaments5.
|
|
Système immunitaire
|
|
Laquinimod (Active Biotech AB; Teva Pharmaceutical Industries Ltd.)
|
Immunostimulants (L03) et immunosuppresseurs (L04)
Sclérose en plaques, maladie de Crohn et lupus
Médicament biologique
|
- Présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative à la sclérose en plaques; essais de phase II en cours sur la maladie de Crohn et le lupus (base de données Biopharm Insight)
- Nouveau composé immunomodulateur administré par voie orale une fois par jour
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- A ralenti la progression de la déficience et a réduit le taux de rechute chez les patients souffrant de la sclérose en plaques rémittente. (NEJM, 20126)
|
|
Ponesimod (Actelion Pharmaceuticals Ltd; Roche)
|
Immunostimulants (L03) and Immunosuppressants (L04)
Sclérose en plaques et psoriasis
Médicament biologique
|
- Essais de phase III en cours sur le psoriasis; essais de phase III sur la sclérose en plaques (base de données BioPharm Insight)
- Premier agoniste sélectif des récepteurs de la sphingosine-1-phosphate
- Possibilité d'une dose administrée par voie orale une fois par jour pour divers troubles auto-immuns
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
|
|
Système nerveux central
|
|
Ispronicline (AstraZeneca PLC; Targacept, Inc.)
|
Psycholeptiques (N05) et psychoanaleptiques (N06)
Maladie d'Alzheimer, trouble d'hyperactivité avec déficit de l'attention, troubles dépressifs, stress et anxiété
|
- Essais de phase II sur la maladie d'Alzheimer et le trouble d'hyperactivité avec déficit de l'attention; essais de phase III sur les troubles dépressifs, le stress et l'anxiété
- Administré par voie orale
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- Agoniste partiel neuronal des récepteurs nicotiniques de l'acétylcholine provoquant des effets antidépressifs, nootropes et neuroprotecteurs
- Résultats statistiquement significatifs obtenus au chapitre de tous les principaux critères d'évaluation, correspondant à un meilleur rendement cognitif chez les personnes âgées souffrant d'un affaiblissement de la mémoire
|
|
Système génito-urinaire
|
|
Mirabegron (Myrbetriq – Astellas Pharma Inc.)
|
Produits urologiques (G04)
Incontinence, vessie hyperactive
|
- Approuvé par la FDA pour l'indication relative à la vessie hyperactive; présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative à l'incontinence (base de données Biopharm Insight)
- Premier de sa catégorie thérapeutique : agoniste du récepteur bêta-3-adrénergique agissant comme relaxant des muscles lisses de la vessie
- Population importante de personnes qui pourraient souffrir d'une vessie hyperactive
- Administré par voie orale une fois par jour
- Différent mécanisme d'action sur les anticholinergiques : pourrait offrir d'autres possibilités de traitement
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- A réduit de façon importante le nombre moyen d'incidents d'incontinence et de miction survenant dans une période de 24 heures, et s'est avéré sûr et bien toléré7.
|
|
Diabète/obésité
|
|
Albiglutide (Syncria – GlaxoSmithKline plc; Human Genome Sciences, Inc.)
|
Diabète (A10) et thérapie cardiaque (C01)
Diabète de type 2 et insuffisance cardiaque
Médicament biologique
|
- Présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative au diabète de type 2; essais de phase II en cours sur l'insuffisance cardiaque (base de données Biopharm Insight)
- Médicament hormonal
- Agoniste du GLP-1 de longue durée (une injection par semaine)
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- Taux global de satisfaction plus élevé à l'égard du traitement chez les patients en raison de la facilité d'emploi et de la possibilité de doses moins fréquentes8
- Il peut y avoir des indications thérapeutiques potentielles directes susceptibles d'accroître l'énergétique et la fonction cardiaques9.
|
|
Cetilistat (Alizyme Therapeutics Ltd.; Norgine BV; Takeda Pharmaceutical Company Limited)
|
Agents antiobésité (A08)
Obésité
|
- Essais de phase III sur l'obésité terminés aux États-Unis; présentation de drogue nouvelle (NDA) soumise au Japon10
- Administré par voie orale
- Inhibiteur de la lipase gastro-intestinale
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- Perte de poids semblable à celle observée avec l'orlistat (Xenical), mais avec jusqu'à 90 % moins d'effets secondaires gastro-intestinaux11; pourrait donc s'avérer une meilleure option
|
|
Yeux et oreilles
|
|
Rebamipide (Mucosta – Acucela, Inc.; Novartis AG; Otsuka Pharmaceutical Co., Ltd)
|
Préparations ophtalmologiques (S03)
Syndrome de l'œil sec
|
- Essais cliniques de phase III aux États-Unis (base de données Biopharm Insight); approuvé pour le traitement du syndrome de l'œil sec au Japon12
- Besoin d'une thérapie efficace visant le syndrome de l'œil sec qui traite la cause fondamentale du syndrome
- Population importante : 22 millions de patients à l'échelle mondiale consultent un ophtalmologue lorsqu'ils souffrent de symptômes associés au syndrome de l'œil sec.
- Nouveau mécanisme d'action qui favorise la sécrétion de larmes et augmente les niveaux de mucine couvrant la conjonctive et la cornée de l'œil
- Inducteur de la prostacycline
|
|
Voclosporin (Luveniq – 3sbio Inc.; Iljin Life Science, Co., Ltd.; Isotechnika, Inc.; Lux Biosciences; Paladin Labs, Inc.; Roche)
|
Préparations ophtalmologiques (S03) et immunosuppresseurs (L04)
Uvéite, greffes de rein et autres greffes, psoriasis
|
- Essais de phase III sur l'uvéite; présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative au psoriasis; essais de phase III sur les greffes de rein (base de données Biopharm Insight)
- Une étude canadienne de phase III a révélé une nette amélioration de la qualité de vie chez les patients souffrant du psoriasis13.
- Administré par voie orale
- Il pourrait s'agir du premier agent d'épargne de corticostéroïde pour le traitement de l'uvéite, une affection caractérisée par la tuméfaction et l'irritation de l'uvée (couche intermédiaire de l'œil).
- Nouvel immunomodulateur et inhibiteur puissant de la calcineurine
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
|
|
* Si le nom du médicament et le nom de marque sont les mêmes, seulement une entrée figure sur la liste.
** Entreprises qui « développent un médicament » selon la définition de la base de données BioPharm InsightMD. Plus d'une entreprise peut mettre au point un médicament et le commercialiser, et leur relation peut être définie par voie d'un contrat de licence.
Abréviation : FDA, US Food and Drug Administration.
|
5. Mises à jour
5.1. Médicaments conservés dans la liste des médicaments émergents
Le tableau 4 présente la liste des médicaments inclus dans les livraisons antérieures de l'OMÉ qui demeurent des candidats aux fins de la liste des médicaments émergents. On y trouve des mises à jour fondées sur les documents scientifiques récemment publiés ainsi que la raison pour laquelle on a conservé les médicaments dans la liste des médicaments émergents.
Tableau 4. Médicaments conservés dans la liste des médicaments émergents
|
Médicament (nom de marque* – entreprises)
|
Domaine thérapeutique (ATC) – Indications
|
Mise à jour et justification de la conservation dans la liste des médicaments émergents
|
|
Agomélatine (Valdoxan – Les Laboratoires Servier; Novartis AG)
|
Antidépresseurs (N06A)
Troubles dépressifs majeurs
|
Description précédente :
- Approuvé par la FDA et l'EMA (base de données Biopharm Insight)
- Premier médicament d'une nouvelle catégorie d'antidépresseurs doté d'un mécanisme d'action unique
- Efficacité comparable et bienfait clinique supplémentaire de la régulation du sommeil
- Décrit comme un « antidépresseur idéal » dans les documents publiés
Mise à jour :
- [Traduction] « Constitue possiblement un ajout pharmacologique unique à la lutte contre la dépression clinique dans les milieux de soins de santé primaires et de soins psychiatriques, en supposant qu'une évaluation complémentaire effectuée lors d'essais cliniques permette un risque raisonnable. » (Innov Clin Neurosci., 201114)
Justification : Les documents publiés continuent d'indiquer que l'agomélatine constitue une importante nouvelle approche en matière de lutte contre la dépression, son efficacité étant à tout le moins comparable, et peut-être supérieure, avec possiblement moins d'effets secondaires. À conserver dans la liste des médicaments émergents.
|
|
Darapladib (diaDexus, LLC; GlaxoSmithKline plc; Human Genome Sciences, Inc.)
|
Thérapie cardiaque (C01)
Athérosclérose
|
Description précédente :
- Essais de phase III au tout dernier stade (base de données Biopharm Insight)
- Nouvelle catégorie : inhibiteur de la phospholipase A2 associée aux lipoprotéines (Lp-PLA2)
- Population importante (cardiovasculaire)
- Différent mécanisme d'action sur l'athérosclérose comparativement aux statines
- Thérapie d'appoint
- Risque cardiovasculaire réduit; entrave la formation de plaques d'athérosclérose; peut affecter les résultats pour le patient (infarctus du myocarde, accident vasculaire cérébral décès cardiovasculaire)
Mise à jour :
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada (Pharmacy Practice 2011/2012)
Justification : Les documents publiés continuent d'indiquer que le darapladib pourrait s'avérer un important médicament cardiovasculaire. À conserver dans la liste des médicaments émergents..
|
|
Ecallantide (Kalbitor – Dyax Corporation; Sigma-Tau Pharmaceuticals)
|
Antihémorragiques (B02)
Angio-œdème héréditaire (AOH)
|
Description précédente :
- Nouvel inhibiteur de la kallicréine plasmatique
- Besoin médical non satisfait : première thérapie propre aux épisodes aigus – l'AOH est une maladie débilitante et potentiellement fatale.
Mise à jour :
- Approuvé par la FDA et mis en marché aux États-Unis sous le nom Kalbitor (27 novembre 2009)
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice 2011/2012)
Justification : Les documents publiés continuent d'indiquer que l'ecallantide satisfait à un besoin médical à l'égard du traitement de l'AOH aigu. On note un risque d'anaphylaxie qui doit être géré. Cela touche une petite partie de la population. À conserver dans la liste des médicaments émergents.
|
|
Istradefylline (Kyowa Hakko Kirin Pharma, Inc; Valeant Pharmaceuticals International, Inc.)
|
Antiparkinsoniens (N04)
Maladie de Parkinson
|
Description précédente :
- Études de phase III en cours (base de données BioPharm Insight)
- Premier médicament d'une nouvelle catégorie thérapeutique
- Incidences sur la progression de la maladie plutôt que sur le traitement des symptômes
Mise à jour :
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice 2011/2012)
Justification : Les documents publiés continuent d'indiquer que l'istradefylline peut constituer une thérapie non dopaminergique prometteuse pour le traitement de la maladie de Parkinson. À conserver dans la liste des médicaments émergents.
|
|
Phenoxodiol (Marshall Edwards, Inc.; Novogen Limited)
|
Cancer (L01)
Cancer ovarien, cancer du col de l'utérus, cancer de la tête et du cou, cancer du rein, leucémie, cancer de la prostate
|
Description précédente :
- La FDA a autorisé le développement rapide du phenoxodiol en tant que radiosensibilisateur destiné aux médicaments au platine et au taxane utilisés pour traiter le cancer ovarien récurrent.
- Taux de survie accru chez les patients atteints d'un cancer difficile à traiter
Mise à jour :
- Études en cours sur un grand nombre d'indications relatives à divers cancers :
- cancer du col de l'utérus (phase I)
- cancer de la tête et du cou (phase II)
- cancer du rein (phase I)
- leucémie (phase II)
- cancer ovarien (phase III)
- cancer de la prostate (phase II)
Justification : Bien qu'il existe peu de documents publiés à ce sujet, le phenoxodiol pourrait éventuellement améliorer le taux de survie. L'ajout d'indications à la liste indique que le médicament pourrait servir à traiter un vaste groupe de cancers. À conserver dans la liste des médicaments émergents.
|
|
Safinamide (Meiji Seika Pharma Co., Ltd.; Merck Serono SA; Newron Pharmaceuticals; Zambon Group)
|
Antiparkinsoniens (N04) et antiépileptiques (N03)
Maladie de Parkinson, épilepsie et syndrome des jambes sans repos
|
Description précédente :
- Population importante
- Multiples mécanismes d'action et multiples indications
- Statut de drogue expérimentale au Canada (Pharmacy Practice, décembre 2011/janvier 2012)
- Si ce médicament s'avérait plus efficace que les agents existants, il pourrait remplacer des médicaments de rechange peu coûteux comme la quinine pour traiter le syndrome des jambes sans repos.
Mise à jour :
- Essais de phase III sur la maladie de Parkinson et de phase II sur l'épilepsie et le syndrome des jambes sans repos (base de données Biopharm Insight)
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice 2011/2012)
Justification : Les documents publiés continuent d'indiquer que le safinamide peut être un traitement efficace de la maladie de Parkinson. À conserver dans la liste des médicaments émergents.
|
|
Satraplatin (Agennix AG; Celgene Corporation; GPC Biotech AG; Spectrum Pharmaceuticals, Inc.)
|
Cancer (L01)
Cancer de la prostate et cancer pulmonaire à petites cellules
|
Description précédente :
- Premier composé de platine administré par voie orale
- Désignation de processus rapide aux États Unis à titre de traitement chimiothérapeutique en seconde intervention du cancer de la prostate
- En cours d'examen par la FDA
- L'un des quatre composés de platine administrés par voie orale faisant l'objet d'une enquête
- Le médicament a retardé la progression de la maladie et de la douleur chez les patients atteints de cancer métastatique de la prostate androgéno indépendant en progression après la première chimiothérapie, mais n'a pas présenté de bienfait important quant au taux de survie.
Mise à jour :
- Présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative au cancer de la prostate; essais de phase III sur le cancer général et de phase II sur le cancer pulmonaire à petites cellules
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice 2011/2012)
Justification : Bien que les documents publiés indiquent que le satraplatin peut ne pas augmenter le taux de survie, s'il est le premier composé de platine administré par voie orale approuvé, il aura une incidence sur la pratique clinique. À conserver dans la liste des médicaments émergents.
|
|
Sipuleucel-T (Provenge – Dendreon Corporation)
|
Cancer (L01)
Cancer de la prostate
Médicament biologique
|
Description précédente :
- Nouvelle approche immunothérapeutique en matière de gestion du cancer de la prostate à un stade précoce
- Désignation de processus rapide aux États-Unis
- Approuvé par la FDA
- Dans une étude randomisée à double insu et contrôlée réalisée auprès de patients atteints de cancer métastatique de la prostate androgéno-indépendant, le Sipuleucel-T a été associé à une réduction relative de 22 % du risque de décès (HR 0,78; p = 0,03), qui était le paramètre primaire de l'essai.
Mise à jour :
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice 2011/2012)
Justification : Les documents publiés continuent d'indiquer que le sipuleucel-T représente une nouvelle approche en matière de traitement du cancer de la prostate et qu'il diminue le risque de décès. À conserver dans la liste des médicaments émergents.
|
|
Tofacitinib (Xeljanz – Pfizer Inc/ Takeda Pharmaceutical)
|
Immunosuppresseurs (L04)
Multiples indications : spondylarthrite ankylosante, polyarthrite rhumatoïde, maladie de Crohn, psoriasis, greffes, autres.
|
Description précédente :
- En essais de phase III
- Population importante : polyarthrite rhumatoïde
- Forme posologique orale; les produits injectables sont actuellement la pratique standard.
- Nouveau mécanisme d'action : antagoniste de la JAK-1/JAK-3
- Multiples indications : polyarthrite rhumatoïde, maladie de Crohn, psoriasis
Mise à jour :
- Approbation de la FDA pour l'indication relative à la polyarthrite rhumatoïde, et essais cliniques en cours sur d'autres indications :
- spondylarthrite ankylosante (phase II);
- colite (phase III);
- maladie de Crohn (phase II);
- maladie intestinale inflammatoire (phase II);
- greffe de rein (phase II);
- psoriasis (phase III); et
- greffes (phase II)
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada (Pharmacy Practice 2011/2012)
- Peut présenter un risque de réactivation de la tuberculose15
Justification : Les documents publiés continuent d'indiquer que le tofacitinib peut être un traitement efficace des conditions chroniques d'inflammation. L'indication relative à la polyarthrite rhumatoïde a été approuvée par la FDA en novembre 2012. Comme le médicament est présenté sous forme de pilule pour la première fois dans cette catégorie thérapeutique, on s'attend à ce qu'il fasse concurrence avec les médicaments injectables.
|
|
Abréviations : AOH, angio-œdème héréditaire; EMA, Agence européenne des médicaments; FDA, US Food and Drug Administration; JAK, Janus kinase
|
5.2 Médicaments retirés de la liste des médicaments émergents
Les tableaux 5 et 6 présentent la liste des médicaments inclus dans les livraisons antérieures de l'OMÉ qui ont été retirés de la liste des médicaments émergents. Les médicaments présentés dans le tableau 5 ont été retirés de la liste parce que leur fabricant a été autorisé à les commercialiser sur le marché canadien. Santé Canada accorde cette autorisation dans un avis de conformité (AC). Le tableau 5 présente également des renseignements relatifs aux recommandations faites par le Comité canadien d'expertise sur les médicaments (CCEM), un organe consultatif de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS)16. Le CCEM adresse des recommandations quant au contenu de la liste des médicaments assurés aux régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux.
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) examine les prix des médicaments brevetés pour s'assurer qu'ils ne sont pas excessifs. On a déterminé que, des sept médicaments figurant au tableau 5, le prix de cinq d'entre eux soumis à un examen respecte les Lignes directrices, alors que le prix d'un médicament est sous enquête. Un médicament n'avait pas encore été vendu au Canada en date de mars 201317.
Le tableau 6 comprend les médicaments qui ont été retirés de la liste des médicaments émergents parce que leur maintien sur cette liste n'est plus soutenu par une évaluation scientifique. Les raisons du retrait comprennent l'insuffisance d'information et des essais cliniques ultérieurs qui ont révélé une insuffisance d'efficacité ou d'innocuité.
Tableau 5. Médicaments retirés de la liste des médicaments émergents : autorisation de commercialisation accordée par Santé Canada
| Médicament (nom de marque — entreprises) |
Domaine thérapeutique (ATC) – Indication |
Date de délivrance de l'AC* / Date de la première vente** |
Recommandations de l'ACMTS† |
Examen du CEPMB |
|
Pirfenidone (Esbriet – Ildong Pharmaceutical Co., Ltd.; Intermune, Inc.; Shanghai Genomics, Inc.; Shionogi & Co., Ltd)
|
Système respiratoire (R07)
Fibrose pulmonaire idiopathique
|
1er octobre 2012 / 31 mai 2012
|
La présentation de l'ACMTS relative au pirfenidone faisait l'objet d'une étude en février 2013. Le 27 mars 2013 constitue la date limite à laquelle l'ACMTS doit faire parvenir ses recommandations aux régimes d'assurance-médicaments et au fabricant.
|
Prix sous enquête
|
|
Rétigabine (Potiga – GlaxoSmithKline plc; Meda AB; Valeant Pharmaceuticals International Inc.)
|
Antiépileptiques (N03)
Épilepsie
|
21 octobre 2012 / Aucune vente en date de mars 2013
|
— |
—
|
|
Ipilimumab (Yervoy – Bristol-Myers Squibb)
|
Cancer (L01)
Mélanome
Médicament biologique
|
1er février 2012 / 7 novembre 2011
|
— |
Prix conforme aux Lignes directrices
|
| Plerixafor (Mozobil – Genzyme Corp) |
Immunostimulants (L03)
Mobilisation des cellules souches
|
8 décembre 2011 / 8 février 2011
|
L'ACMTS a recommandé, en septembre 2012, que le plerixafor soit retiré de la liste des régimes publics d'assurance-médicaments.
Raison : Aucun essai clinique randomisé effectué dans le cadre de l'examen systématique n'a pu identifier de façon adéquate des patients qui pourraient bénéficier des bienfaits offerts par le plerixafor. Par conséquent, l'efficacité clinique et l'efficience du plerixafor dans la population étudiée pertinente était incertaine.
|
Prix conforme aux Lignes directrices |
| Télaprévir (Incivek – Janssen-Ortho) |
Antiviraux pour usage systémique (J05)
Hépatite C
|
16 août 2011 / 3 octobre 2011 |
L'ACMTS a recommandé, en janvier 2012, que le télaprévir soit inscrit sur la liste à titre de traitement d'une infection chronique à l'hépatite C de génotype 1 chez les patients souffrant d'une maladie compensée du foie, en association avec un péginterféron alfa, s'il satisfait à tous les critères suivants :
- un prix réduit;
- niveaux décelables de l'ARN du virus de l'hépatite C (VHC) observés dans les derniers six mois;
- un stade de fibrose, selon les résultats d'une biopsie du foie, de F2, F3, ou F4;
- le patient n'est pas co-infecté par le VIH;
- une série de traitements seulement (durée de 12 semaines).
|
Prix conforme aux Lignes directrices |
|
Ticagrélor (Brilinta – AstraZeneca)
|
Agents antithrombotiques (B01)
Insuffisance cardiaque
|
30 mai 2011 / 8 juin 2011
|
L'ACMTS a recommandé, en décembre 2011, que le ticagrélor soit retiré de la liste au prix soumis.
Raison : On n'a fourni aucune preuve démontrant que le ticagrélor est supérieur par rapport au clopidogrel chez les populations étudiées en Amérique du Nord à l'appui du médicament offert à un prix plus élevé.
|
Prix conforme aux Lignes directrices
|
|
Vandetanib (Caprelsa – AstraZeneca)
|
Inhibiteurs de la protéine kinase (L01XE)
Cancer thyroïdien
|
12 janvier 2012 / 23 février 2012
|
— |
Prix conforme aux Lignes directrices
|
| Pérampanel (Fycompa – Eisai Ltd.) |
Antiépileptiques (N03)
Épilepsie
|
4 avril 2013 / — |
— |
— |
|
* Un avis de conformité est émis par Santé Canada et indique qu'un produit médicamenteux satisfait aux exigences réglementaires relatives à l'usage humain ou vétérinaire et que la vente dudit produit est autorisée au Canada.
** La date de la première vente correspond à la date déclarée au CEPMB. Cette date peut précéder la date d'émission de l'AC par Santé Canada puisqu'un produit peut être vendu en vertu du Programme d'accès spécial ou d'une demande d'essais cliniques, ou parce qu'il s'agit d'une drogue nouvelle de recherche.
† Les recommandations de l'ACMTS sont faites par le Comité canadien d'expertise sur les médicaments (CCEM), un organisme consultatif indépendant formé de spécialistes de la pharmacothérapie et de l'évaluation de médicaments. Les présentations par les fabricants sont déposées volontairement et, par conséquent, il est possible qu'il n'y ait pas de recommandations pour certains médicaments.
|
Tableau 6. Médicaments retirés de la liste des médicaments émergents : évaluation scientifique
|
Médicament (nom de marque - entreprises)
|
Justification du retrait
|
|
Bapineuzumab (Pfizer, Inc)
Médicament biologique
|
- Bien que l'immunothérapie en association avec le bapineuzumab ait permis une clairance des plaques amyloïdes chez les patients atteints de la maladie d'Alzheimer, cette clairance n'a révélé aucune incidence significative sur le plan cognitif.
|
|
Oxycodone et ingrédients supplémentaires (Oxecta/Acura Pharmaceuticals, Pfizer Inc.)
|
- Oxecta se sert de la technologie AVERSION. Lorsque le comprimé écrasé est dissout dans de l'eau ou de l'alcool, il se convertit en mélange gélifié visqueux, ce qui le rend difficile à injecter. Un comprimé écrasé et inhalé par le nez entraîne une sensation de brûlure et d'irritation. On n'a pas déterminé si la nouvelle préparation empêchera réellement l'abus du médicament18.
|
6. References
1 Base de données BioPharm InsightMD. Sur Internet : http://www.infinata5.com/biopharm/AccessPoint.aspx?action=Login.ShowLogin&datakey=biopharm.
2 US FOOD AND DRUG ADMINISTRATION (FDA) – Présentation de drogue nouvelle ou demande de licence biologique (NDA/BLA).
3 MURDOCH, L.A. « Promising drugs in the late stages of development in Canada », Pharmacy Practice (décembre 2010- janvier 2011). Sur Internet : www.CanadianHealthcareNetwork.ca (22 mars 2013).
4 BANI, D. et M. BIGAZZI. « Relaxin as a cardiovascular drug: a promise kept », Curr Drug Saf., vol. 6, no 5 (2011), p. 324-328.
5 GORI, B., S. RICCIARDI, A. FULVI et coll. « New antiangiogenics in non-small cell lung cancer treatment: Vargatef™ (BIBF 1120) and beyond », Ther Clin Risk Manag., vol. 7 (2011), p. 429-440.
6 COMI, G., D. JEFFERY, L. KAPPOS et coll.; pour ALLEGRO Study Group. « Placebo-controlled trial of oral laquinimod for multiple sclerosis », N Engl J Med., vol. 366, no 11 (2012), p. 1000-1009.
7 GRAS, J. « Mirabegron for the treatment of overactive bladder » Drugs Today (Barc), vol. 48, no 1 (2012), p. 25-32.
8 TZEFOS, M., K. HARRIS, A. BRACKETT. « Clinical efficacy and safety of once-weekly glucagon-like peptide-1 agonists in development for treatment of type 2 diabetes mellitus in adults », Ann Pharmacother., vol. 46, no 1 (2012), p. 68-78.
9 BAO, W., K. ARAVINDHAN, H. ALSAID et coll. « Albiglutide, a long lasting glucagon-like peptide-1 analog, protects the rat heart against ischemia/reperfusion injury: evidence for improving cardiac metabolic efficiency », PLoS One., vol. 6, no 8 (2011), e23570.
10 TAKEDA PHARMACEUTICAL CO. Communiqué de l'entreprise (octobre 2012).
11 KOPELMAN, P., H. GDE GROOT, A. RISSANEN et coll. « Weight loss, HbA1c reduction, and tolerability of cetilistat in a randomized, placebo-controlled Phase II trial in obese diabetics: comparison with orlistat (Xenical) », Obesity (Silver Spring), vol. 18, no 1 (2010), p. 108-115.
12 OTSUKA PHARMACEUTICAL CO. Communiqué de l'entreprise (juillet 2012).
13 KUNYNETZ, R., W. CAREY, R. THOMAS et coll. « Quality of life in plaque psoriasis patients treated with voclosporin: a Canadian Phase III, randomized, multicenter, double-blind, placebo-controlled study », Eur J Dermatol., vol. 21, no 1 (2011), p. 89-94.
14 SANSONE, R.A., L.A. SANSONE. « Agomelatine: A novel antidepressant », Innov Clin Neurosci., vol. 8, no 11 (2011), p. 10-14.
15 MAIGA M., S. LUN, H. GUO et coll. « Risk of tuberculosis reactivation with Tofacitinib (CP-690550) », J Infect Dis., (2012), [Publication électronique en avance de l'impression] (3 avril).
16 Base de données des médicaments du Programme commun d'évaluation des médicaments. Sur Internet : http://www.cadth.ca/fr/products/cdr/search. (25 février 2013) [Seules les informations publiquement accessibles y sont mentionnées].
17 Base de données des nouveaux médicaments brevetés déclarés au CEPMB. Sur Internet : http://www.pmprb-cepmb.gc.ca/francais/pmpmedicines.asp?x=1. (5 mars 2013) [Seules les informations publiquement disponibles y sont mentionnées].
18 « In Brief: Immediate-Release Oxycodone (Oxecta) for Pain », The Medical Letter for Drugs and Therapeutics, vol. 1385, p. 20.