Partie III - Rapports ministériels sur le rendement (RMR) de 2011-2012
2011-2012
Rapport ministériel sur le rendement
Conseil d'examen du prix des médicaments brevetés
La version originale a été signée par
L'honorable Leona Aglukkaq
Ministre de la Santé
Table des matières
Message de la présidente
Section I: Survol de l'organisme
Section II: Analyse des activités de programme par résultat stratégique
Section III: Renseignements supplémentaires
Section IV: Autres sujets d'intérêt
Message de la présidente
C'est avec plaisir que je vous présente le Rapport ministériel sur le rendement 2011-2012 du Conseil d'examen du prix des médicaments brevetés (CEPMB).
Le CEPMBest un organisme indépendant qui détient des pouvoirs quasi judiciaires. Créé par le Parlement en 1987 en vertu de la Loi sur les brevets, le Conseil est investi d'un double mandat, à savoir de réglementation et de rapport. En vertu de son mandat de réglementation, le CEPMB veille à ce que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs alors qu'au titre de son mandat de rapport, il fait rapport des tendances des prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement.
Le CEPMB contribue à l'atteinte du grand objectif visant à améliorer la santé de la population canadienne en protégeant les intérêts des consommateurs et le régime canadien de soins de santé. À cette fin, il veille à ce que les médicaments brevetés ne soient pas vendus à des prix excessifs et tente d'éclairer la prise de décisions relatives aux politiques sur les médicaments.
La capacité du CEPMB d'exécuter son mandat statutaire repose sur des lignes directrices pertinentes et efficaces sur les prix excessifs (Lignes directrices) et sur sa capacité de tenir des audiences au besoin. Depuis l'entrée en vigueur des nouvelles Lignes directrices le 1er janvier 2010, le CEPMB surveille et évalue de façon continue l'application et l'incidence des modifications apportées aux Lignes directrices. En juin 2011, le CEPMB a publié le Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices, et, en décembre, la première évaluation annuelle dans le cadre du Plan a été présentée au Conseil.
En 2011‑2012, dans le cadre de ses activités de liaison auprès des brevetés, le CEPMB a continué de mieux faire comprendre son rôle et son mandat aux divers intervenants.
Le Conseil s'est également axé sur un examen complet de ses Règles de pratique et de procédure (Règles) aux fins des audiences dans le but de codifier ses pratiques et procédures et de tenir compte des pratiques courantes pertinentes des autres tribunaux administratifs fédéraux. Les Règles proposées ont été prépubliées dans la Partie I de la Gazette du Canada. La promulgation des Règles et leur publication dans la Partie II de la Gazette du Canada sont prévues à l'automne 2012.
Au moyen du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB poursuit son partenariat avec l'Institut canadien d'information sur la santé et Santé Canada de même qu'avec les provinces et les territoires. En 2011‑2012, le CEPMB a publié cinq nouveaux rapports analytiques. La publication des résultats des études réalisées au titre du SNIUMP permet à la collectivité des soins de santé dans son ensemble de jouir des avantages que présentent ces travaux.
Une évaluation des activités de programme du CEPMB a été réalisée au cours de la dernière année; le Rapport d'évaluation définitif sera présenté au Conseil en septembre 2012. Selon les indications préliminaires, les deux programmes du CEPMB sont toujours aussi pertinents et s'harmonisent avec les priorités pangouvernementales et le résultat stratégique du CEPMB.
Le CEPMB est toujours aussi résolu à servir les Canadiens et à contribuer à la solidité du système de soins de santé.
Mary Catherine Lindberg
Présidente
Section I : Survol de l'organisme
Raison d'être
Créé par le Parlement en 1987, le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il est investi d'un double mandat :
- Réglementation — Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs.
- Rapport — Faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des brevetés dans la R-D au Canada.
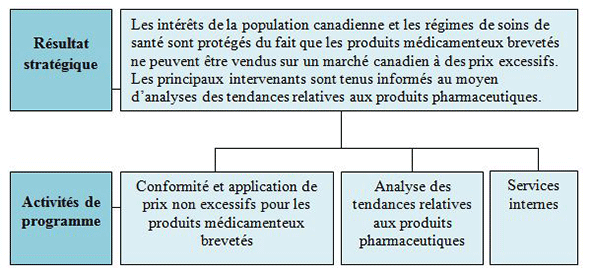
Dans l'exécution de son mandat, le CEPMB s'efforce de veiller à la protection des intérêts de la population canadienne et de leur système de soins de santé en s'assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs et que les principaux intervenants sont tenus informés au moyen d'analyses des tendances relatives aux produits pharmaceutiques.
Responsabilités
Le CEPMB a deux responsabilités :
Responsabilité en matière de réglementation
Le CEPMB vérifie les prix départ-usine, à savoir les prix auxquels les brevetés vendent à leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre et veille à ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté, plus précisément de chaque concentration de chaque forme posologique de chaque produit médicamenteux breveté offert sur le marché canadien. C'est généralement à ce niveau que Santé Canada attribue le numéro d'identification du médicament (DIN) en vertu du processus d'attribution de l'Avis de conformité. Le mandat du Conseil couvre également les produits médicamenteux qui sont distribués au titre du Programme d'accès spécial, par suite d'une demande d'essai clinique et en tant que drogues nouvelles de recherche.
La compétence du Conseil s'applique non seulement aux produits médicamenteux dont le brevet porte sur son ingrédient actif, mais également aux produits médicamenteux dont le brevet est lié, mais non de manière exhaustive, au procédé de fabrication, au mode d'administration, à la forme posologique, à l'indication/utilisation ou autre.
Les produits médicamenteux brevetés ne sont pas nécessairement non plus des produits de marque. En effet, nombre de sociétés productrices de produits génériques sont assujetties à la compétence du Conseil du fait qu'elles vendent, par l'intermédiaire de titulaires d'une licence d'exploitation, le même produit que le produit de marque ou, encore, parce que diverses sociétés productrices de produits génériques sont titulaires d'un brevet visant le procédé de conditionnement ou de traitement de produits.
Le CEPMB n'est pas habilité à réglementer les prix des produits médicamenteux non brevetés. Il n'a aucun droit de regard sur les prix de vente en gros et au détail des produits médicamenteux brevetés et non brevetés ni sur les honoraires des pharmaciens. Des questions telles que le remboursement des médicaments par les régimes publics d'assurance-médicaments, les canaux de distribution et les habitudes d'ordonnance ne relèvent pas non plus de sa compétence.
En vertu de la Loi, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté. Après leur première vente, les brevetés doivent, conformément au Règlement sur les médicaments brevetés, faire rapport du prix de vente de leur produit médicamenteux et de la quantité vendue. Par la suite, pour chaque semestre (de janvier à juin et de juillet à décembre), ils doivent faire rapport des prix et des ventes de chaque concentration de chaque forme posologique de chaque médicament breveté offert sur le marché canadien aux fins de l'examen du prix, et ce, tant qu'un brevet est lié au produit médicamenteux.
Même s'ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs produits médicamenteux brevetés ne soient pas jugés excessifs. Lorsqu'un produit médicamenteux breveté est vendu au Canada avant l'attribution de son brevet, l'examen de son prix est rétroactif à la date de sa première vente si celle-ci est ultérieure à la date à laquelle la demande de brevet a été rendue publique.
Lorsque, à l'issue d'une audience publique, il apparaît que le prix d'un médicament vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu'il a tirées de la vente de son médicament à un prix excessif.
Responsabilité en matière de rapport
Chaque année, le CEPMB rend compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel présente une analyse des tendances relatives à la vente et aux prix des produits médicamenteux brevetés ainsi que des dépenses des brevetés dans la R-D.
Au moyen du programme du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB effectue des analyses critiques des tendances relatives aux prix, à l'utilisation et aux coûts des produits médicamenteux au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux participants.
Résultat stratégique et Architecture des activités de programme
[D]
Priorités organisationnelles
Sommaire des progrès par rapport aux priorités
| Priorité |
Type1 |
Résultats stratégiques et (ou)
activités de programme |
| Surveiller et évaluer l'incidence des nouvelles Lignes directrices |
Déjà établie |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat. Cette priorité est liée à l'activité de programme 1. |
- Depuis l'entrée en vigueur des nouvelles Lignes directrices le 1er janvier 2010, le CEPMB surveille et évalue de façon continue l'application et l'incidence des modifications apportées aux Lignes directrices. En juin 2011, le CEPMB a publié le Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices sur son site Web. En décembre 2011, la première évaluation annuelle dans le cadre du Plan a été présentée au Conseil. Les résultats de cette évaluation se trouvent dans le Plan.
- Le Groupe de travail technique sur la méthodologie de la majoration (GTMM) s'est réuni de nouveau au début de 2012 pour discuter des expériences à ce jour concernant l'application pilote de la méthodologie de la majoration. Au cours de l'application pilote, on s'est prévalu de la méthodologie de la majoration à 40 reprises; cette dernière a contribué à la clôture de 22 enquêtes ouvertes avant 2010 et de 12 enquêtes ouvertes en 2010 ou après. Le GTMM a proposé des options pour aplanir les difficultés relatives à l'application qui ont été recensées au cours de l'application pilote, et a recommandé l'adoption de la méthodologie de la majoration (simplifiée et régulière) de façon permanente. Le Conseil était du même avis.
- Deux autres questions relatives aux Lignes directrices ont été cernées comme faisant l'objet d'une évaluation en instance : (1) un examen du prix sur un marché des produits médicamenteux brevetés existants, et (2) le remboursement des recettes excessives (ne justifiant pas la tenue d'une enquête; seuils pour engager une enquête). Dans La Nouvelle d'avril 2012, le Conseil a fourni une précision quant à l'application des examens du prix « sur un marché ». À la suite de consultations auprès des intervenants, le Conseil a apporté des modifications à la Ligne directrice sur le « remboursement des recettes excessives » afin de permettre aux brevetés de rembourser les recettes en temps opportun, et les critères d'enquête visant les produits médicamenteux brevetés existants ont été révisés de manière à éliminer le critère de 5 %.
|
| Priorité |
Type |
Résultats stratégiques et (ou)
activités de programme |
| Sensibiliser davantage les divers intervenants au mandat et au cadre réglementaire du CEPMB et en favoriser la compréhension |
Nouvelle |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat. Cette priorité est liée aux activités de programme 1 et 2. |
- Le CEPMB fait le point sur ses activités d'engagement à venir dans sa publication trimestrielle La Nouvelle.
- Afin de sensibiliser davantage les brevetés au cadre réglementaire du CEPMB et de favoriser leur compréhension des Lignes directrices, le personnel du CEPMB a tenu un grand nombre de séances d'information et de webinaires en 2011 et 2012.
- Des séances d'information ont été tenues à Montréal et à Toronto les 2 et 3 mars 2011. Soixante‑douze (72) brevetés et consultants y ont assisté.
- Un webinaire sur la méthodologie de la majoration a été tenu le 20 avril 2011. Trente‑sept (37) brevetés et consultants y ont assisté.
- Des séances d'information ont été tenues à Montréal et à Toronto les 28 et 29 février 2012. Quatre‑vingt‑deux (82) brevetés et consultants y ont assisté.
- Un webinaire sur la méthodologie de la majoration a été tenu le 7 juin 2012. Quarante-et-un (41) brevetés et consultants y ont assisté.
En ce qui a trait aux séances d'information, les commentaires des participants ont été en grande partie positifs; la vaste majorité des participants ont dit avoir obtenu lors des séances des réponses à leurs questions concernant les Lignes directrices et des sujets connexes.
- La présidente et la directrice exécutive ont tenu une série de réunions avec les représentants provinciaux des systèmes de soins de santé et des régimes publics d'assurance-médicaments de même qu'avec divers autres intervenants, pour discuter des sujets de préoccupation des participants et de la compréhension qu'ont ces derniers du rôle du CEPMB. Elles ont toutes deux présenté des exposés dans le cadre de nombreuses conférences et d'autres événements tout au long de l'exercice.
- En 2011‑2012, le CEPMB a poursuivi ses travaux relatifs à l'amélioration du contenu de son site Web. Le 31 janvier 2012, le CEPMB a lancé son application Web conviviale pour les nouveaux médicaments brevetés déclarés au CEPMB. Cette nouvelle application comprend une liste exhaustive des médicaments déclarés au CEPMB depuis 1998 et permet d'effectuer des recherches selon l'année de déclaration et le statut de l'examen des prix (à compter de 2001 à ce jour).
- Dans le cadre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB poursuit son partenariat avec l'Institut canadien d'information sur la santé et Santé Canada de même qu'avec les provinces et les territoires. Au cours de l'exercice 2011‑2012, le CEPMB a publié cinq nouveaux rapports analytiques.
- De plus, la réunion annuelle du Comité directeur du SNIUMP, qui a eu lieu en octobre 2011, a donné au CEPMB l'occasion de communiquer les résultats d'études de recherche terminées et en cours, de discuter des priorités pour la recherche future et d'amorcer un dialogue avec les membres du Consortium de recherche en politiques pharmaceutiques (CRPP), un réseau de chercheurs universitaires de l'ensemble du Canada subventionné par l'État.
|
| Priorité |
Type |
Résultats stratégiques et (ou)
activités de programme |
| Planification de la relève et gestion des connaissances |
Nouvelle |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat. Cette priorité est liée aux activités de programme 1, 2 et 3. |
- Le CEPMB a adopté son cadre de planification de la relève et met actuellement en œuvre les activités connexes. Comme elle s'attend à ce que quelques postes clés de cadre supérieur deviennent vacants au cours des 12 à 24 prochains mois, la direction a désigné les postes de l'équipe des cadres supérieurs comme des postes clés. Le CEPMB examine actuellement les profils des postes clés, notamment les compétences et aptitudes requises pour l'équipe.
|
| Priorité |
Type |
Résultats stratégiques et (ou)
activités de programme |
| Évaluation de programme |
Déjà établie |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat. Cette priorité est liée aux activités de programme 1 et 2. |
- Corrélativement à l'obtention de plus de ressources en 2008‑2009 et au-delà, le CEPMB s'est engagé à évaluer en 2011-2012 la mesure dans laquelle l'augmentation des ressources l'a aidé à atteindre ses objectifs.
- Le modèle logique, la matrice d'évaluation et le cadre de mesure du rendement du CEPMB ont servi à structurer des activités d'évaluation du rendement en fonction des résultats visés.
- L'évaluation comprenait les éléments suivants :
- des entrevues avec 46 principaux enquêtés;
- un sondage public auprès de 74 répondants;
- un examen de la documentation;
- une analyse des données sur le rendement fournies par le CEPMB.
- L'ébauche définitive du rapport d'évaluation est en cours d'examen. La mise au point du rapport et une réponse de la direction sont prévues d'ici la fin de l'année civile.
|
Analyse des risques
Afin de pouvoir exécuter son mandat statutaire, le CEPMB effectue des examens de prix et des enquêtes et mène des audiences, s'il y a lieu, en temps opportun. Les nouvelles Lignes directrices sur les prix excessifs entrées en vigueur en janvier 2010 visent à favoriser l'efficacité, l'équité, la transparence, la prévisibilité et la pertinence continues du processus d'examen des prix dans un milieu pharmaceutique actuel et en constante évolution.
Le CEPMB a constaté des changements dans le milieu pharmaceutique, à la fois à l'échelle nationale et internationale, au fur et à mesure que les pratiques de distribution évoluent, que les modèles de vente changent, que les brevetés introduisent différents types de programmes d'avantages sociaux et que de nouveaux types de médicaments continuent d'être lancés sur le marché. D'autres pays adoptent en ce moment des politiques de contrôle des prix et édictent de nouvelles lois. Compte tenu de ces virages, le CEPMB s'est concentré sur l'évaluation de sa pertinence et de son efficacité de même que de son orientation stratégique.
Le CEPMB a continué de faire face à des défis liés à la mise en œuvre des Lignes directrices révisées, notamment la complexité accrue des examens scientifiques (attribuable à l'ajout de facteurs d'amélioration thérapeutique) et des examens des prix. Le personnel du Conseil continue de surveiller et d'évaluer l'application et l'incidence des Lignes directrices révisées. Conformément à l'engagement du Conseil visant à adapter et à modifier ses Lignes directrices au besoin, le Conseil a publié une précision concernant la Ligne directrice sur les examens du prix « sur un marché » ainsi qu'une demande d'Avis et commentaires concernant l'élimination du critère d'enquête de 5 % dans le numéro d'avril 2012 de La Nouvelle. À la suite d'un examen exhaustif des commentaires reçus, une version mise à jour du Compendium des politiques, des Lignes directrices et des procédures a été publiée en juin 2012.
En décembre 2011, le personnel du Conseil a présenté au Conseil la première évaluation annuelle des principales modifications aux Lignes directrices. Les résultats de cette évaluation se trouvent dans le Plan de surveillance et d'évaluation des lignes directrices. La prochaine évaluation annuelle sera présentée au Conseil en décembre 2012.
Depuis 2010‑2011, le CEPMB s'emploie à développer une nouvelle base de données sur la conformité. En 2011‑2012, la nouvelle base de données a été soumise à des essais rigoureux; les rapports qu'ont présentés les brevetés en juillet 2011 ont été traités à la fois dans l'ancien système et le nouveau système. L'exploitation en parallèle des deux systèmes a donné des résultats moins satisfaisants que prévu. En conséquence, on a décidé que les deux systèmes serviraient également pour les rapports de janvier 2012. Depuis ce temps, de légères modifications ont été apportées à la nouvelle base de données, et le personnel du Conseil est maintenant satisfait des résultats qu'il a produits. Les rapports qu'ont présentés les brevetés en juillet 2012 seront traités dans le nouveau système seulement, alors que la Direction de la réglementation et de la liaison auprès des brevetés a pris la relève de tout le processus de saisie des données. L'adoption et la mise en œuvre complètes du nouveau système devraient se traduire par des gains en efficience et de possibles épargnes financières au cours de l'exercice à venir.
En conséquence d'un plus grand nombre de ressources ayant été mises à la disposition du CEPMB en 2009-2010, ce dernier a été en mesure d'éliminer l'arriéré d'enquêtes et continue de réaffecter, au besoin, des ressources pour surmonter les obstacles découlant des modifications apportées aux Lignes directrices.
Les Règles de pratique et de procédure (Règles)2 du Conseil aux fins d'audience ont été révisées dans le but de codifier les pratiques et les procédures du Conseil et de tenir compte des pratiques courantes pertinentes des autres tribunaux administratifs fédéraux. Les Règles proposées ont été prépubliées dans la Partie I de la Gazette du Canada. Le Conseil cherchera à faire édicter les Règles et à les faire publier dans la Partie II de la Gazette du Canada cet automne.
En 2011‑2012, le CEPMB a évalué ses deux programmes, à savoir la conformité et l'application de prix non excessifs pour les produits médicamenteux brevetés (Programme de conformité et d'application) et l'analyse des tendances relatives aux produits pharmaceutiques. Dans le cadre de cette évaluation, on a interrogé 46 intervenants et réalisé une enquête auprès des intervenants, un examen de la documentation et une analyse des données sur le rendement. Le rapport définitif sera présenté au Conseil en septembre pour acceptation. Le personnel du Conseil préparera, compte tenu de l'orientation proposé par la présidente, une réponse de la direction et un plan d'action, dont la publication est prévue d'ici la fin de l'année civile. Un système de suivi sera mis en place pour assurer le suivi des plans d'action de la direction découlant de cet exercice.
Sommaire du rendement
Ressources financières pour 2011-2012 (en milliers de dollars)
| Dépenses prévues |
Total des autorisations* |
Dépenses réelles* |
|
*L'écart entre les dépenses prévues et le total des autorisations découle des fonds supplémentaires de 2 512 878 $ reçus par l'intermédiaire d'un mandat de rajustement pour rembourser les montants crédités aux recettes des exercices précédents, et de 46 900 $ pour couvrir un paiement d'intérêt et de frais accordé par la Cour fédérale. De plus, le CEPMB a reçu une somme supplémentaire d'un million de dollars pour les versements d'indemnités de départ et le report de 2010‑2011.
À la suite d'une audience du Conseil tenue en 2008‑2009 en vertu de la Loi sur les brevets, le Conseil a conclu que le breveté avait vendu deux médicaments brevetés au Canada à des prix excessifs. Le Conseil a ordonné au breveté de payer à l'État la somme de 2 512 878 $. Le breveté s'est conformé à l'ordonnance du Conseil, mais a présenté une demande de contrôle judiciaire de l'ordonnance. La Cour fédérale a annulé l'ordonnance du Conseil et a ordonné, dans son jugement, que la somme de 2 512 878 $ soit retournée rapidement au breveté, ainsi que les intérêts appropriés et les frais déterminés.
|
| 11 855,0 $ |
15 248,9 $ |
11 754,4 $ |
Ressources humaines pour 2010-2011 (équivalents temps plein [ETP])
| Prévues |
Réelles* |
Écart* |
|
*On a annoncé dans le budget de 2010 que les ministères ne recevraient aucun financement pour les hausses salariales résultant de conventions collectives pour les exercices 2010-2011 à 2012-2013. Le CEPMB a estimé que l'incidence de cette initiative gouvernementale serait de 177 937 $ en 2011‑2012. Afin d'aborder cette question relative aux ressources, le CEPMB a déterminé qu'en conséquence des gains en efficience découlant d'autres initiatives, il était en mesure de ne pas doter certains postes vacants, sans que cela n'ait d'incidence importante sur ses activités.
|
| 76 |
63 |
13 |
Tableaux du sommaire du rendement
Progrès réalisés par rapport au résultat stratégique
| Résultat stratégique : Les intérêts de la population canadienne et les régimes de soins de santé sont protégés du fait que les produits médicamenteux brevetés ne peuvent être vendus sur un marché canadien à des prix excessifs. Les principaux intervenants sont tenus informés au moyen d'analyses des tendances relatives aux produits pharmaceutiques. |
| Indicateurs de rendement |
Objectifs |
Rendement de 2011-2012 |
| Au Canada, les prix des médicaments brevetés sont conformes aux prix de vente pratiqués dans les sept pays de comparaison nommés dans le Règlement. |
Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane des prix pratiqués dans les différents pays de comparaison ou sous celle-ci |
Le ratio de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix au Canada s'est maintenu à 1,05 en 2011. Cela indique que la médiane des prix des produits médicamenteux brevetés pratiqués dans les sept pays de comparaison était 5 % supérieure aux prix pratiqués au Canada l'année dernière. |
Sommaire du rendement, à l'exclusion des Services internes
| Activité de programme |
Dépenses réelles 2010-2011 |
2011-2012 (en milliers de dollars) |
Concordance avec les résultats du gouvernement du Canada |
| Budget principal des dépenses |
Dépenses prévues |
Total des autorisations* |
Dépenses réelles** |
|
* L'écart entre les dépenses prévues et le total des autorisations découle des fonds supplémentaires de 2 512 878 $ reçus par l'intermédiaire d'un mandat de rajustement pour rembourser les montants crédités aux recettes des exercices précédents. Ces fonds ont été remboursés au breveté.
|
|
** AP 1 – L'écart entre le total des autorisations et les dépenses réelles découle d'une péremption de 2,4 millions de dollars dans l'affectation à but spécial (ABS). Le financement pour l'AP 1 comprend une ABS de 3,1 millions de dollars pour la tenue d'audiences publiques, dans le crédit 35 (Dépenses du programme). L'ABS ne peut être utilisée que pour couvrir les coûts associés à la tenue d'audiences publiques, comme le recours à des conseillers juridiques et à des témoins experts, entre autres. Tout montant non utilisé pour la fin prévue doit être retourné au Trésor. En 2011 2012, les dépenses découlant de l'ABS se sont élevées à 668 000 $.
|
AP 1 :
Conformité et application de prix non excessifs pour les produits médicamenteux brevetés |
4 232,0 |
7 464,8 |
7 464,8 |
10 318,0 |
7 346,7 |
Des Canadiens en santé |
AP 2 :
Analyse des tendances relatives aux produits pharmaceutiques |
890,4 |
1 438,7 |
1 438,7 |
1 425,0 |
1 010,5 |
Des Canadiens en santé |
| Total |
5 122,4 |
8 903,5 |
8 903,5 |
11 743,0 |
8 357,3 |
|
Tableau du sommaire du rendement des Services internes
| Activité de programme |
2011-2012 Dépenses réelles |
2011-2012
(en milliers de dollars) |
| Budget principal des dépenses |
Dépenses prévues |
Total des autorisations* |
Dépenses réelles |
|
* L'augmentation du total des autorisations s'explique par l'attribution de la totalité du report de 2010 2011 aux Services internes pour permettre l'exécution des travaux liés à la nouvelle base de données essentielle
|
| Services internes |
4 348,3 |
2 951,5 |
2 951,5 |
3 505,9 |
3 397,1 |
Évaluation environnementale stratégique
Aucune des initiatives soutenues par le CEPMB n'étaient assujetties à la Directive du Cabinet sur l'évaluation environnementale des projets de politiques, de plans et de programmes 3 en 2011-2012.
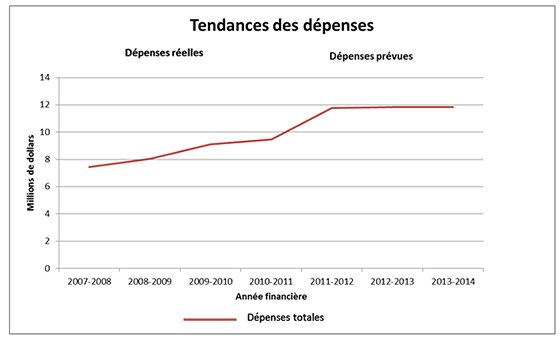
Profil des dépenses
[D]
Budget des dépenses par crédit voté
En septembre 2008, le CEPMB a reçu une somme de 4,7 millions de dollars (sans compter les régimes d'avantages sociaux des employés [RASE]), qui s'ajoute aux 5,8 millions de dollars de son budget des services votés afin de pouvoir affronter les pressions découlant de la charge de travail et de poursuivre les activités en cours liées à l'exercice de son mandat. Le crédit 35 (Dépenses de programme) a été augmenté de 5,6 millions de dollars pour 2009-2010, de 6,2 millions de dollars pour 2010-2011 et de 5,8 millions de dollars pour 2011-2012 et au-delà (y compris les coûts des RASE et excluant les frais de logement de Travaux publics et Services gouvernementaux Canada).
Le financement total du CEPMB comprend une affectation à but spécial (ABS) de 3,1 millions de dollars pour la tenue d'audiences publiques. L'ABS ne peut être utilisée que pour couvrir les coûts associés à la tenue d'audiences publiques, comme le recours à des conseillers juridiques et à des témoins experts, entre autres. Tout montant non utilisé pour la fin prévue doit être retourné au Trésor.
En 2011-2012, le CEPMB déclare une augmentation du total des autorisations découlant des fonds supplémentaires de 2 559 748 $ reçus pour couvrir un remboursement accordé par la Cour à la suite de l'annulation d'une ordonnance du Conseil. À la suite d'une audience du Conseil tenue en 2008-2009 en vertu de la Loi sur les brevets, le Conseil a conclu que le breveté avait vendu deux médicaments brevetés au Canada à des prix excessifs. Le Conseil a ordonné au breveté de payer à l'État la somme de 2 512 878 $. En 2011-2012, la Cour fédérale a annulé l'ordonnance du Conseil et a ordonné que la somme de 2 512 878 $ soit retournée rapidement au breveté, ainsi que les intérêts appropriés et les frais déterminés totalisant 46 900 $.
L'écart entre le total des autorisations et les dépenses réelles en 2011‑2012 découle d'une péremption de 2,4 millions de dollars dans l'ABS. En 2011‑2012, les dépenses provenant de l'ABS se sont élevées à 668 000 $ du fait du Conseil ayant tenu moins d'audiences qu'au cours des années précédentes, en partie en raison de la présentation d'Engagements de conformité volontaire.
Le CEPMB avait prévu une péremption d'environ 400 000 $ afin de maximiser le report de son budget d'exploitation. Toutefois, des fonds supplémentaires s'élevant à 400 000 $ sont restés inutilisés en conséquence de postes vacants non prévus et d'un plus grand nombre d'employées en congé de maternité.
Pour de plus amples renseignements sur les crédits organisationnels et (ou) les dépenses législatives du CEPMB, veuillez consulter les Comptes publics du Canada 2011 (Volume II). Une version électronique de cette publication4 se trouve sur le site Web de Travaux publics et Services gouvernementaux Canada.
Section II : Analyse des activités de programme par résultat stratégique
Résultat stratégique
Les intérêts de la population canadienne et les régimes de soins de santé sont protégés du fait que les produits médicamenteux brevetés ne peuvent être vendus sur un marché canadien à des prix excessifs. Les principaux intervenants sont tenus informés au moyen d'analyses des tendances relatives aux produits pharmaceutiques.
| Indicateur de rendement |
Objectif |
|
Au Canada, les prix des médicaments brevetés sont conformes aux prix de vente pratiqués dans les sept pays de comparaison nommés dans le Règlement.
|
Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane des prix pratiqués dans les différents pays de comparaison ou sous celle-ci.
|
Chaque année, le CEPMB mène des comparaisons bilatérales et multilatérales de prix pour chacun des sept pays de comparaison en utilisant les taux d'échange du marché pour la conversion des devises.
Comme par les années antérieures, les prix pratiqués au Canada en 2011 se situaient habituellement dans la fourchette des prix observés dans les pays de comparaison. Les résultats indiquent que les prix pratiqués au Canada étaient sensiblement conformes aux prix pratiqués en Suède et en Suisse (5 % plus bas et 3 % plus élevés, respectivement). Les prix pratiqués en Italie, en France et au Royaume-Uni étaient beaucoup moins élevés que les prix pratiqués au Canada (16 %, 16 % et 18 %, respectivement), alors que ceux pratiqués en Allemagne et aux États-Unis étaient beaucoup plus élevés (20 % et 98 %, respectivement).
Le prix international médian, qui correspond à la médiane des prix de vente des produits médicamenteux observés dans les sept pays de comparaison, est l'une des mesures utilisées dans les comparaisons multilatérales de prix. Le ratio de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada s'est maintenu à 1,05 en 2011. Cela indique que la moyenne des prix des produits médicamenteux brevetés pratiqués dans les sept pays de comparaison était 5 % supérieure à ceux pratiqués au Canada l'année dernière. Depuis 2006, le ratio est demeuré quelque peu constant, se situant entre 1,07 et 1,03.
Activité de programme 1: Conformité et application de prix non excessifs pour les produits médicamenteux brevetés
Description de l'activité de programme
Le CEPMB exerce un contrôle sur les prix moyens non excessifs des produits médicamenteux brevetés pour usage humain et pour usage vétérinaire vendus au Canada. Dans le cadre de cette activité de programme, le CEPMB examine les prix auxquels les brevetés vendent leurs produits médicamenteux brevetés en fonction des facteurs d'examen des prix prévus par la Loi sur les brevets pour veiller à ce que ces prix ne soient pas excessifs. Lorsque, à l'issue d'une audience publique, il apparaît que le prix d'un produit médicamenteux est excessif sur un marché, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son produit et à prendre les mesures qui lui sont dictées pour rembourser les recettes excessives qu'il a tirées de la vente de son produit à des prix excessifs.
Ressources financières pour 2011-2012 (en milliers de dollars)
| Dépenses prévues |
Total des autorisations* |
Dépenses réelles* |
| *L'écart entre le total des autorisations et les dépenses réelles découle d'une péremption de 2,4 millions de dollars dans l'ABS. Le financement pour l'AP 1 comprend une ABS de 3,1 millions de dollars pour la tenue d'audiences publiques. L'ABS ne peut être utilisée que pour couvrir les coûts associés à la tenue d'audiences publiques, comme le recours à des conseillers juridiques et à des témoins experts, entre autres. Tout montant non utilisé pour la fin prévue doit être retourné au Trésor. En 2011‑2012, les dépenses découlant de l'ABS se sont élevées à 668 000 $. |
| 7 464,8 |
10 318,0 |
7 346,8 |
Ressources humaines pour 2011-2012 (équivalent temps plein [ETP])
| Prévues |
Réelles |
Écart |
| 44,0 |
35,0 |
9,0 |
Sommaire du rendement par activité de programme
| Résultats attendus |
Indicateurs de rendement |
Objectifs |
Résultats obtenus |
| Selon les facteurs prévus par la Loi sur les brevets, les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs. |
Pourcentage des médicaments brevetés qui sont jugés conformes aux Lignes directrices |
Les prix de 95 % des médicaments brevetés sont jugés conformes aux Lignes directrices. |
Les prix de 84,2 % des médicaments brevetés sont jugés conformes aux Lignes directrices.
Les prix de 10,5 % des médicaments brevetés ne justifient pas une enquête. |
Sommaire du rendement et analyse de l'activité de programme
En 2011‑2012, le personnel du Conseil a effectué l'examen des prix de tous les produits médicamenteux brevetés pour usage humain déclarés comme faisant l'objet d'un examen dans son rapport annuel de 2010, des 109 nouveaux produits médicamenteux brevetés5 pour usage humain déclarés comme vendus en 2011 et des 1 173 produits médicamenteux brevetés existants6.
La Politique de conformité et d'application permet au Conseil d'établir des critères pour repérer les instances justifiant la tenue d'une enquête. Ces critères établissent un juste équilibre entre la latitude accordée aux brevetés au niveau de l'établissement des prix de leurs produits médicamenteux et le mandat du CEPMB visant à protéger les intérêts des consommateurs en veillant à ce que les produits médicamenteux brevetés ne soient pas vendus au Canada à des prix excessifs. Aux termes de l'annexe 5 de l'ancien Compendium intitulé « Critères justifiant la tenue d'une enquête »7, le prix d'un produit médicamenteux breveté était considéré comme conforme aux Lignes directrices sauf lorsqu'il répondait au critère qui justifiait la tenue d'une enquête sur son prix.
On a ajouté, à la mise en application des Lignes directrices révisées, la Politique appliquée lorsque le prix semble excessif8. En résumé, la politique stipule que si le prix fixé par le breveté est supérieur au Prix moyen maximal potentiel ou au Prix moyen non excessif national, mais qu'il ne justifie la tenue d'une enquête, le prix du produit médicamenteux breveté sera déclaré sur le site Web du CEPMB comme « ne justifiant pas la tenue d'une enquête » et non comme « conforme aux Lignes directrices », comme par le passé.
Il s'avère difficile, en raison de ce changement, de faire rapport de cet indicateur de rendement. Aux termes des Lignes directrices révisées, les prix de 84,2 % des produits médicamenteux brevetés nouveaux et existants sont jugés conformes aux Lignes directrices, soit une hausse de 4,4 % par rapport à 2010‑2011. En 2011‑2012, les prix de 10,5 % des produits médicamenteux nouveaux et existants étaient supérieurs à ce que permettaient les Lignes directrices, mais d'un montant jugé trop minime pour justifier la tenue d'une enquête, soit une baisse de 0,7 % par rapport à 2010‑2011. Sous le régime des anciennes Lignes directrices, selon lesquelles les prix qui ne justifiaient pas la tenue d'une enquête étaient jugés conformes aux Lignes directrices, les prix de 94,7 % des produits médicamenteux brevetés nouveaux et existants en 2011‑2012 seraient jugés conformes aux Lignes directrices par rapport à un taux de conformité de 91 % en 2010‑2011 et de 89,5 % en 2009‑2010.
Leçons apprises
On a modifié l'indicateur de rendement de cette activité de programme pour l'exercice 2012‑2013 afin de tenir compte du libellé des nouvelles Lignes directrices et d'assurer une mesure plus exacte de la conformité des brevetés aux Lignes directrices.
| Indicateurs de rendement |
Objectif |
| Pourcentage des prix des médicaments brevetés qui, en raison de conformité volontaire, sont conformes aux Lignes directrices ou ne justifient pas la tenue d'une enquête |
Les prix de 95 % des médicaments brevetés sont volontairement conformes aux Lignes directrices ou ne justifient pas la tenue d'une enquête |
| Pourcentage des médicaments brevetés qui sont visés par une ordonnance du Conseil |
On se conforme à 100 % des ordonnances du Conseil |
Activité de programme 2 : Analyse des tendances relatives aux produits pharmaceutiques
Description de l'activité de programm
Le CEPMB effectue des recherches et des analyses sur les tendances relatives aux produits pharmaceutiques. Chaque année, il rend compte au Parlement, par le truchement du ministre de la Santé, de ces tendances de même que des dépenses des brevetés dans la recherche et développement. Au moyen du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB effectue également des recherches et produit des analyses critiques des prix, de l'utilisation et des coûts des produits médicamenteux brevetés et non brevetés distribués sous ordonnance.
Ressources financières pour 2011-2012 (en milliers de dollars)
| Dépenses prévues |
Total des autorisations* |
Dépenses réelles |
| *L'écart entre le total des autorisations et les dépenses réelles s'explique par le fait qu'il est difficile de doter les postes et que la direction a décidé de ne pas doter d'autres postes vacants. |
| 1 438,7 |
1 425,0 |
1 010,5 |
Ressources humaines pour 2011-2012 (équivalent temps plein [ETP])
| Prévues |
Réelles |
Écart |
| 13,0 |
7,0 |
6,0 |
Sommaire du rendement par activité de programme
| Résultats attendus |
Indicateurs de rendement |
Objectifs |
Résultats obtenus |
| Les intervenants sont davantage conscients des tendances relatives aux prix des produits pharmaceutiques et des facteurs de coûts des médicaments. |
Nombre de demandes de publications du CEPMB reçues |
Augmentation de 5 % du nombre de demandes de publication ar rapport à l'exercice précédent |
Voir la section « Leçons apprises » |
| Nombre d'exposés présentés par le CEPMB lors de réunions externes |
Tenue de 10 événements par année |
Tenue de 11 événements, de même que de nombreuses réunions avec divers intervenants |
Sommaire du rendement et analyse de l'activité de programme
Toutes les publications du CEPMB, y compris les études, les décisions du Conseil et les documents de référence, peuvent être consultées sur le site Web du CEPMB. Le CEPMB a effectué l'examen complet et l'actualisation de l'architecture et du contenu de son site Web. Le contenu a été réorganisé et rationalisé afin d'offrir plus de contexte et un environnement plus convivial. La réorganisation du site Web permettra d'améliorer toutes les activités de communication externe du CEPMB et d'accroître la prise de conscience générale de son rôle et de ses activités globales, y compris les tendances relatives aux produits pharmaceutiques et les renseignements sur les facteurs de coûts des médicaments.
Dans le cadre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB poursuit son partenariat avec l'Institut canadien d'information sur la santé et Santé Canada de même qu'avec les provinces et les territoires. En cours de l'exercice 2011‑2012, le CEPMB a publié cinq nouveaux rapports analytiques, à savoir :
- L'Observateur des médicaments émergents – troisième édition (juillet 2011)
- Médicaments génériques au Canada : Comparaisons des prix internationaux et économies de coûts potentielles (septembre 2011)
- Analyse des facteurs de coût associés aux frais d'exécution d'ordonnance assumés par les régimes publics d'assurance-médicaments de 2001-2002 à 2007-2008
(septembre 2011)
- Incidence de l'arrivée sur le marché de médicaments génériques sur l'utilisation de l'ingrédient (septembre 2011 – Révisé mai 2012)
- Politiques sur les frais accessoires facturés par les grossistes des régimes publics d'assurance-médicaments du Canada (décembre 2011 – révisé en janvier 2012)
Ces rapports et ceux qui suivront contribueront à la prise de décisions éclairées dans le domaine pharmaceutique.
La réunion annuelle du Comité directeur du SNIUMP, tenue en octobre 2011 à Ottawa, a permis aux membres du Comité de communiquer les résultats d'études de recherche achevées et en cours, de discuter des priorités en matière de projets de recherche futurs, et de s'entretenir avec des membres du Consortium de recherche en politiques pharmaceutiques (CRPP), un réseau de chercheurs universitaires de l'ensemble du Canada subventionné par l'État.
En 2011‑2012, outre la tenue de nombreuses réunions avec divers intervenants, le CEPMB a participé à 11 activités externes et s'est adressé à divers auditoires, y compris ses principaux intervenants, notamment les brevetés, les provinces, les tiers payeurs et les groupes de défense des droits des patients. Le CEPMB continue d'utiliser de nouveaux supports d'information, comme les vidéoconférences et les webinaires pour entrer en contact avec un plus grand nombre d'intervenants. De plus, en octobre 2011, le CEPMB a publié son premier résumé analytique9, Tendances relatives aux ventes des produits médicamenteux brevetés.
Leçons apprises
Les intervenants comptent beaucoup sur le site Web du CEPMB pour y trouver des renseignements; il attire en moyenne 13 000 visiteurs mensuellement. Il est probable que les demandes de publications imprimées continuent de diminuer en raison d'une meilleure accessibilité au site Web. Par conséquent, on a modifié les indicateurs de rendement de cette activité de programme pour l'exercice 2012‑2013 afin de mieux tenir compte de l'environnement dans lequel le CEPMB évolue actuellement.
| Indicateurs de rendement |
Objectifs |
| Nombre de visites du site Web du CEPMB |
Augmentation de 5 % par rapport à l'exercice précédent |
| Nombre d'exposés présentés par le CEPMB lors de réunions externes |
Tenue de 10 événements par année |
| Achèvement du rapport annuel en temps opportun |
Rapport achevé à 100 % |
| Achèvement des études analytiques et des rapports sur les tendances et questions relatives aux produits pharmaceutiques |
50 % des études amorcées sont achevées chaque année |
On a modifié l'indicateur de rendement de cette activité de programme pour l'exercice 2012‑2013 afin de tenir compte du libellé des nouvelles Lignes directrices et d'assurer une mesure plus exacte du taux de conformité des brevetés aux Lignes directrices.
Activité de programme 3 : Services internes
Description de l'activité de programme
L'activité de programme Services internes englobe des activités et des ressources connexes gérées de façon à répondre aux besoins des programmes et autres obligations générales d'une organisation. Ces groupes sont les suivants : services de gestion et de surveillance, services de communications, services juridiques, services de gestion des ressources humaines, services de gestion financière, services de gestion de l'information, services de technologie de l'information, services des biens immobiliers, services du matériel, services des acquisitions et services de voyages et autres services administratifs. L'activité de programme Services internes comprend uniquement les activités et les ressources destinées à l'ensemble d'une organisation et non celles fournies à un programme particulier.
Ressources financières pour 2011-2012 (en milliers de dollars)
| Dépenses prévues* |
Total des autorisations* |
Dépenses réelles* |
| *L'augmentation du total des autorisations s'explique par l'attribution de la totalité du report de 2010‑2011 aux Services internes pour permettre l'exécution des travaux liés à la nouvelle base de données essentielle. |
| 2 951,5 |
3 505,9 |
3 397,1 |
Ressources humaines pour 2011-2012 (équivalent temps plein [ETP])
| Prévues |
Réelles |
Écart* |
| *On a réaffecté deux ressources provenant d'activités de programme afin d'appuyer la mise en œuvre de la base de données essentielle. |
| 19,0 |
21,0 |
(2,0) |
Section III : Renseignements supplémentaires
Principales données financières
État condensé de la situation financière (non vérifié)
Au 31 mars 2012
(en dollars) |
|
Variation
$ |
2011-2012 |
2010-2011 |
| Total du passif net |
(239 639) |
2 120 210 |
2 359 851 |
| Total des actifs financiers nets |
(269 238) |
615 099 |
884 337 |
| Dette nette ministérielle |
29 599 |
1 505 111 |
1 475 541 |
|
|
|
|
| Situation financière nette ministérielle |
(29 599) |
(1 505 111) |
(1 475 541) |
Total des revenus*
État condensé des résultats et situation financière nette ministérielle (non vérifiés)
Pour l'exercice terminé le 31 mars 2012
(en dollars) |
|
Variation
% |
2011-2012 |
2010-2011 |
|
* Le total des revenus comprend les recettes non disponibles. Les sommes comptabilisées dans les recettes non disponibles ne représentent pas les recettes générées par le CEPMB. Ce sont plutôt les sommes que les brevetés ont versées au gouvernement du Canada en application des modalités d'un Engagement de conformité volontaire ou d'une ordonnance du Conseil aux fins de rembourser les recettes excessives. Le ministre peut conclure avec toute province des ententes concernant le partage avec celle-ci de sommes versées par les brevetés au receveur général, déduction faite des frais de perception et de partage. Les recettes non disponibles sont réalisées pour le compte du gouvernement. En 2011-2012, les recettes non disponibles ont été compensées par la prévision d'un passif éventuel qui serait versé pour le compte du gouvernement, au montant de 2,8 millions de dollars.
|
| Total des dépenses |
(3,62) |
10 506 665 |
10 900 802 |
| (63,93) |
(8 394 187) |
(23 272 642) |
| Coût d'exploitation net avant le financement public et les paiements de transfert |
(117,07) |
2 112 478 |
(12 371 840) |
|
|
|
|
| Situation financière nette ministérielle |
2,01 |
(1 505 111) |
(1 475 514) |
États financiers
Les principales données financières présentées dans ce rapport ministériel sur le rendement visent à fournir un aperçu général de la situation financière du CEPMB et de ses activités. Les états financiers10 du CEPMB se trouvent sur le site Web du Conseil.
Liste des tableaux de renseignements supplémentaires
Les versions électroniques de tous les tableaux de renseignements supplémentaires qui figurent dans le Rapport ministériel sur le rendement 2011-2012 sont disponibles sur le site Web du Conseil11.
- Écologisation des opérations gouvernementales
- Vérifications internes et évaluations
- Sources des revenus disponibles et des revenus non disponibles
Section IV : Autres sujets d'intérêt
Coordonnées de l'organisme
Le Conseil d'examen du prix des médicaments brevetés
Case L40
Centre Standard Life
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : (613) 952-7360
1-877-861-2350
Télécopieur : (613) 952-7626
ATMT : (613) 957-4373
Courriel: pmprb@pmprb-cepmb.gc.ca
Site Web: www.pmprb-cepmb.gc.ca
Renseignements supplémentaires
Rapport annuel 2011 du CEPMB - CEPMB" href="http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=91">http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=91
Publication trimestrielle La Nouvelle - http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=287
Guide du breveté - http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=146
Compendium des politiques, des Lignes directrices et des procédures (Mise à jour : juin 2012) - http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1206&mp=8088
Loi sur les brevets - http://laws-lois.justice.gc.ca/fra/lois/P-4/index.html
Règlement sur les médicaments brevetés - http://laws-lois.justice.gc.ca/fra/reglements/DORS-94-688/index.html
Notes en fin de document
1 Les différents types de priorités sont les suivants : priorité déjà établie – établie au cours du premier ou du deuxième exercice précédant l'exercice visé par le rapport; priorité permanente – établie au moins trois exercices précédant l'exercice visé par le rapport; priorité nouvelle – établie au cours de l'exercice visé par le RMR ou le RPP.
2 Des renseignements sur les Règles de pratique et de procédure révisées proposées du Conseil se trouvent sur le site Web du CEPMB, sous la rubrique « Consultations/Avis et commentaires ».
3 La Directive du Cabinet sur l'évaluation environnementale des projets de politiques, de plans et de programmes peut être consultée sur le site Web de l'Agence canadienne d'évaluation environnementale à l'adresse suivante : http://www.ceaa.gc.ca/default.asp?lang=Fr&n=B3186435-1.
4 Une version électronique des Comptes publics du Canada se trouve sur le site Web de Travaux publics et Services gouvernementaux Canada, à l'adresse suivante : http://www.tpsgc-pwgsc.gc.ca/recgen/txt/72-fra.html.
5 Aux fins du présent rapport, tout produit médicamenteux breveté lancé ou vendu sur le marché canadien avant l'attribution de son premier brevet entre le 1er décembre 2010 et le 30 novembre 2011 est réputé avoir été breveté en 2011.
6 Aux fins du présent rapport, l'expression « produits médicamenteux brevetés existants » désigne tous les produits médicamenteux brevetés vendus sur le marché canadien et ayant fait l'objet d'un rapport au CEPMB avant le 1er décembre 2010.
7 Pour des renseignements détaillés sur les critères justifiant la tenue d'une enquête avant le 1er janvier 2010, veuillez consulter l'appendice 5 du Compendium des Lignes directrices, des politiques et des procédures publié en mars 2008. Le Compendium (jusqu'à 2009) est disponible sur le site Web du CEPMB à l'adresse http://www.pmprb-cepmb.gc.ca, sous la rubrique « Publications ».
8 Pour de plus amples renseignements sur la Politique appliquée lorsque le prix semble excessif, veuillez consulter la Partie B – Les politiques, par. B.5 du Compendium des politiques, des Lignes directrices et des procédures – Mise à jour : juin 2012. Le Compendium est disponible sur le site Web du CEPMB, à l'adresse http://www.pmprb-cepmb.gc.ca, sous la rubrique « Loi, Règlement et Lignes directrices ».
9 Les résumés analytiques sont des rapports sommaires sur les activités de recherche et d'analyse réalisées au sein du CEPMB. Ils peuvent traiter de sujets tels que les tendances relatives aux ventes et aux prix des produits pharmaceutiques au Canada, les marchés pharmaceutiques au Canada par rapport aux marchés internationaux, les dépenses en R–D, ou des résumés de rapports de recherche.
10 Les états financiers du CEPMB se trouvent sur le site Web du CEPMB, à l'adresse http://www.pmprb-cepmb.gc.ca, sous la rubrique « Rapports au Parlement ».
11 Les versions électroniques des tableaux de renseignements supplémentaires qui figurent dans le Rapport ministériel sur le rendement de 2011‑2012 se trouvent sur le site Web du CEPMB, à l'adresse htt