Rapport ministériel sur le rendement 2015-2016
L’honorable Jane Philpott
Ministre de la Santé
Numéro de catalogue : H79-2F-PDF
ISSN : 2368-1071
Table des matières
Message de la ministre
Les résultats en bref
Section I : Survol de l’organisation
Section II : Vue d’ensemble des dépenses
Section III : Analyse des programmes et des Services internes
Section IV : Renseignements supplémentaires
Annexe : Définitions
Notes de fin de document
Message de la ministre
À titre de ministre du portefeuille de la Santé, j’ai le plaisir de vous présenter le rapport ministériel sur le rendement du Conseil d’examen du prix des médicaments brevetés (CEPMB) pour 2015-2016. Ce rapport souligne la façon dont le CEPMB appuie les engagements du gouvernement visant à aider les Canadiens à garder et à améliorer leur santé.
Le CEPMB est un organisme administratif quasi judiciaire indépendant ayant un double mandat : protéger la population canadienne contre les prix excessifs des médicaments brevetés; faire rapport des tendances relatives aux prix de tous les médicaments ainsi qu’aux dépenses des brevetés dans la recherche et le développement au Canada.
La dernière année a été particulièrement productive pour le CEPMB. Le CEPMB a collaboré étroitement avec les administrations responsables par l’entremise de l’Alliance pancanadienne pharmaceutique (APP), afin d’offrir des analyses de prix et des études de marché pertinentes visant à réduire le coût des médicaments génériques et d’origine au Canada. Par son travail, le CEPMB a contribué à réduire le prix de 18 médicaments génériques couramment utilisés, et continue de soutenir l’élaboration de politiques en vue d’un cadre national pour les médicaments génériques. Par ces efforts, entre autres, le CEPMB travaille à s’assurer que les tiers payeurs obtiennent l’information dont ils ont besoin pour faire de bons choix en matière de remboursement et que les Canadiens ont accès à des médicaments brevetés à des prix abordables.
En décembre 2015, le CEPMB a publié son plan stratégique pour la période 2015 à 2018. Ce plan contient une nouvelle vision, un énoncé de mission révisé et de nouvelles priorités stratégiques. Son objectif global est de réorienter l’organisation en fonction des changements récents de son cadre réglementaire pour qu’elle mettre à profit sa compétence juridique unique pour mieux compléter les efforts de ses partenaires fédéraux provinciaux et territoriaux ainsi que ceux d’autres partenaires axés sur la réalisation de leur but commun qui est l’établissement d’un système de santé durable au Canada.
L’une des nouvelles priorités du CEPMB est la modernisation du cadre. Comme première étape pour réaliser cette priorité, le CEPMB publiera en 2016 un document de discussion sur une éventuelle réforme des lignes directrices relatives à l’établissement du prix des médicaments. La publication de ce document sera suivie de consultations nationales auprès des parties intéressées du public, des ministères provinciaux et territoriaux de la Santé, des assureurs privés, de l’industrie et d’autres groupes d’intervenants.
Je compte sur le soutien continu du CEPMB pour la réalisation des principales priorités de mon mandat i, notamment l’amélioration de l’accès aux médicaments sur ordonnance essentiels en réduisant le coût de ces médicaments et en les rendant plus abordables pour les Canadiens.
L’honorable Jane Philpott, C.P., députée
Ministre de la Santé
Les résultats en bref
Fonds utilisés : Dépenses réelles - 9 498 361 $
Personnel : ETP réels - 62,5
Mandat de réglementation
- 1 359 produits médicamenteux brevetés pour usage humain ont fait l’objet d’un rapport au CEPMB, dont 86 nouveaux produits médicamenteux brevetés.
- Le CEPMB a accepté neuf engagements de conformité volontaire, qui ont eu pour effet la réduction du prix de certains médicaments et le remboursement de recettes excédentaires totalisant 7 272 305,55 $ au gouvernement du Canada. Outre ce montant, selon l’un des engagements de conformité volontaire, le breveté est tenu de rembourser 5 522 632,96 $ aux hôpitaux qui ont acheté le médicament en question à un prix excessif.
- La procédure contre Alexion Canada Inc. concernant le prix du médicament breveté Soliris se poursuit, et une audience est prévue en janvier et en février 2017.
- Le CEPMB a entrepris deux audiences pour défaut de présenter des rapports : l’une visant Baxalta Canada Corporation et l’autre, Galderma Canada Inc.
- Le 6 novembre 2015, la Cour d’appel a confirmé la décision initiale du personnel du Conseil selon laquelle Sandoz et ratiopharm, fabricants de produits génériques, sont des brevetés aux termes de l’article 79 de la Loi sur les brevets. La décision a également confirmé la constitutionnalité des articles 79 à 103 de la Loi. À cet égard, la Cour d’appel fédérale a jugé que le Conseil avait, à juste titre, établi que la réglementation des prix exigés pour les médicaments brevetés est une compétence conférée au Parlement en vertu du paragraphe 91 (22) de la Loi constitutionnelle de 1867 lorsqu’il s’agit de titulaires, de détenteurs ou de propriétaires de brevet ou de toute autre personne exerçant des droits en vertu d’un brevet (comme un titulaire de permis).
Mandat de rapport
- En 2015-2016, en plus du dépôt du rapport annuel de 2014, le CEPMB a publié sept présentations par affiches, une présentation par diapositives, son Plan stratégique 2015-2018 et les cinq études analytiques suivantes : Génériques360 – Médicaments génériques au Canada, 2014, en février 2016; Régimes privés d’assurance-médicaments au Canada – Partie 1 : Marché des produits génériques, 2005-2013, en décembre 2015; L’Observateur des médicaments émergents, 7e livraison, en décembre 2015; CompasRx du SNIUMP : Rapport annuel sur les dépenses des régimes publics d’assurance-médicaments, 1ère édition, le 31 mars 2016; Résumé analytique : CompasRx du SNIUMP, 1ère édition, le 31 mars 2016.
- Le CEPMB a aussi travaillé en étroite collaboration avec les gouvernements provinciaux et territoriaux dans le cadre du SNIUMP et collaboré directement avec les administrations responsables par l’intermédiaire du Conseil de la fédération, afin d’offrir des analyses de prix et des études de marché pertinentes visant à réduire le prix des médicaments génériques achetés par les tiers payants publics au Canada.
Section I : Survol de l’organisation
Profil de l’organisation
Ministre compétent : L’honorable Jane Philpott
Directeur de l’organisation : Douglas Clark, directeur exécutif
Portefeuille ministériel : Santé
Instruments habilitants : Loi sur les brevets ii et Règlement sur les médicaments brevetés iii
Année d’incorporation ou de création : 1987
Autre : Le ministre de la Santé est responsable de l’application des dispositions de la Loi sur les brevets (la Loi) formulées aux articles 79 à 103. Le Conseil d’examen du prix des médicaments brevetés (CEPMB) fait partie du portefeuille de la Santé, qui comprend Santé Canada, l’Agence de la santé publique du Canada, les Instituts de recherche en santé du Canada et l’Agence canadienne d’inspection des aliments. Le portefeuille de la Santé aide le ministre de la Santé à maintenir et à améliorer la santé des Canadiens.
Même s’il fait partie du portefeuille de la Santé, le CEPMB exerce son mandat en toute indépendance vis-à-vis du ministre de la Santé. Il fonctionne d’une façon indépendante des autres organismes, dont Santé Canada, qui autorise la vente des médicaments au Canada après avoir vérifié leur innocuité, leur efficacité et leur qualité; les régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments qui autorisent l’inscription des médicaments sur leurs formulaires de médicaments admissibles à un remboursement; et le Programme commun d’examen des médicaments, géré par l’Association canadienne des médicaments et des technologies de la santé qui évalue l’efficience des médicaments avant leur inscription sur les formulaires des régimes publics d’assurance-médicaments participants.
Contexte organisationnel
Raison d’être
Créé par le Parlement en 1987, le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il est investi d’un double mandat :
- Réglementaire – Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs;
- Production de rapports – Sur les tendances pharmaceutiques de tous les médicaments et sur les dépenses de la recherche et le développement (R-D) effectuées par les titulaires de brevet.
Dans l’exécution de son mandat, le CEPMB veille à la protection des Canadiens en s’assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs et que les intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques.
Responsabilités
Le CEPMB a été créé à la suite des modifications apportées à la Loi en 1987 (projet de loi C-22) et ses pouvoirs de redressement ont été complétés par d’autres modifications en 1993 (projet de loi C-91). Ces modifications faisaient partie de réformes politiques visant à équilibrer le mandat portant sur la protection du consommateur du CEPMB avec des mesures de protection des brevets visant à encourager les efforts des titulaires de brevets pharmaceutiques en matière de recherche et de développement.
Le CEPMB a un double mandat :
Réglementation
Il incombe au CEPMB de s’assurer que les prix départ-usine, à savoir les prix auxquels les brevetés vendent, au Canada, à leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs médicaments brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre, ne sont pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté auquel Santé Canada a attribué un numéro d’identification du médicament (DIN) dans le cadre de son processus d’examen. Le mandat du CEPMB porte également sur des médicaments qui sont offerts en vertu du Programme d’accès spécial, par l’entremise d’une demande d’essai clinique et en tant que drogues nouvelles de recherche. Les médicaments brevetés en vente libre et les médicaments brevetés à usage vétérinaire sont également réglementés par le CEPMB en fonction des plaintes reçues.
Rapport
Chaque année, le CEPMB rend compte au Parlement, par le truchement du ministre de la Santé, de ses activités d’analyse des prix, des prix des médicaments brevetés, des tendances des prix de l’ensemble des médicaments d’ordonnance et des dépenses en R-D déclarées par les sociétés pharmaceutiques brevetées. De plus, à la suite de l’établissement du Système national d’information sur l’utilisation des médicaments prescrits iv (SNIUMP) par les ministres de la Santé fédéral, provinciaux et territoriaux (FPT) en septembre 2001, le CEPMB réalise des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts des médicaments brevetés et non brevetés, pour que le système de santé au Canada dispose de renseignements plus complets et plus justes sur l’utilisation des médicaments d’ordonnance et les facteurs à l’origine de l’augmentation des coûts. Cette fonction a pour objet de fournir aux gouvernements FPT et à d’autres intervenants intéressés une source crédible centralisée d’information sur les tendances pharmaceutiques. De plus en plus, conformément à son mandat en matière de rapport, le CEPMB travaille en étroite collaboration avec les gouvernements provinciaux et territoriaux dans le cadre du SNIUMP et collabore directement avec les administrations responsables par l’intermédiaire du Conseil de la fédération, afin d’offrir des analyses de prix et des études de marché pertinentes visant à réduire le prix des médicaments génériques achetés par les tiers payants publics au Canada.
Résultat stratégique et architecture d’alignement des programmes
1. Résultat stratégique : Les médicaments brevetés ne peuvent pas être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne. La population canadienne est également tenue informée sur les tendances concernant les produits pharmaceutiques.
1.1 Programme : Programme de réglementation du prix des médicaments brevetés
1.2 Programme : Programme sur les tendances relatives aux produits pharmaceutiques
Services internes
Environnement opérationnel et analyse des risques
Principaux risques
| Risque |
Stratégie d’atténuation du risque |
Lien avec les programmes de l’organisation |
| À mesure que le nombre de prix négociés par l’entremise de l’Alliance pancanadienne pharmaceutique (APP), comme celui des régimes d’assurance-médicaments publics participants, augmente et que les rabais sur les prix courants sont plus élevés, il y a un risque que les prix plafonds fixés par le CEPMB deviennent de moins en moins pertinents pour les payeurs publics. |
- Le CEPMB a travaillé en étroite collaboration avec les gouvernements provinciaux et territoriaux dans le cadre du SNIUMP et collaboré directement avec les administrations responsables par l’intermédiaire du Conseil de la fédération, afin d’offrir des analyses de prix et des études de marché pertinentes visant à aider les tiers payants publics dans leurs efforts pour réduire le prix qu’ils paient pour des médicaments.
- Le CEPMB a modifié ses lignes directrices pour s’assurer que les prix courants publics, qui servent souvent de point de départ des négociations entre les tiers payants et l’industrie, ne dépassent pas le prix moyen maximal potentiel (PMMP) établi par le test appliqué au prix de lancement, afin qu’aucun Canadien ne paie plus que le prix plafond réglementé par le CEPMB.
- Comme première étape de la modernisation de son cadre juridique dans le but d’accroître son efficacité en tant qu’organisme de réglementation des prix, le CEPMB publiera un document de travail et consultera le public sur la réforme de ses lignes directrices relatives à l’établissement du prix des médicaments.
|
Ce risque est lié au programme de réglementation du prix des médicaments brevetés et au programme sur les tendances relatives aux produits pharmaceutiques. |
| Les efforts déployés par les responsables du remboursement dans l’UE pour réduire les prix pourraient faire en sorte que le Canada se classe au deuxième rang des prix des médicaments brevetés les plus élevés, dépassé seulement par les États-Unis, des sept pays de comparaison du CEPMB et (ou) que les prix soient plus élevés que la médiane internationale. |
- Comme première étape de la modernisation de son cadre juridique dans le but d’accroître son efficacité en tant qu’organisme de réglementation des prix, le CEPMB publiera un document de travail et consultera le public sur la réforme de ses lignes directrices relatives à l’établissement du prix des médicaments.
- Le CEPMB continue de renforcer ses liens avec les autorités responsables de l’établissement des prix des médicaments dans d’autres pays afin d’échanger des renseignements sur le marché, et se tient au courant des derniers développements relatifs à la limitation des coûts des médicaments à l’échelle mondiale, notamment grâce à sa participation à l’initiative Pharmaceutical Pricing and Reimbursement Information (PPRI), mais aussi grâce à sa collaboration avec l’Organisation mondiale de la Santé (OMS) sur la question du juste prix des médicaments.
- Dans le cadre de ses efforts continus pour obtenir de meilleures sources, plus fiables et plus exhaustives, de prix à l’étranger pour son processus d’examen des prix, le CEPMB a changé sa source de prix reconnue pour l’Allemagne, de Rote Liste à Lauer-Taxe, à partir de janvier 2016. En outre, le CEPMB utilise de plus en plus d’autres sources d’information sur les prix pour valider et évaluer les prix étrangers soumis au CEPMB par les titulaires de brevet.
|
Ce risque est lié au programme de réglementation du prix des médicaments brevetés. |
| La mise en œuvre de l’Accord économique et commercial global (AECG) pourrait alimenter le débat quant à la possibilité d’atteindre comme prévu l’équilibre entre la protection des brevets et celle des consommateurs. |
- Comme première étape de la modernisation de son cadre juridique dans le but d’accroître son efficacité en tant qu’organisme de réglementation des prix, le CEPMB publiera un document de travail et consultera le public sur la réforme de ses lignes directrices relatives à l’établissement du prix des médicaments.
|
Ce risque est lié au programme de réglementation du prix des médicaments brevetés. |
| Incidence des litiges en cours sur la compétence du CEPMB |
- En novembre 2015, la Cour d’appel fédérale a rendu une décision créant un précédent en confirmant qu’une personne n’a pas besoin de posséder le brevet d’un médicament donné pour être considérée comme « brevetée » (titulaire du brevet) pour ce médicament au sens du paragraphe 79 (1) de la Loi sur les brevets.
Par conséquent, le statut d’une entreprise comme fabricant de produits « génériques » ou « d’origine » n’est pas lié à la question de la compétence du CEPMB relativement à un médicament particulier.
- La décision a aussi confirmé la constitutionnalité des articles 79 à 103 de la Loi, selon lesquels la réglementation des prix exigés pour les médicaments brevetés est une compétence conférée au Parlement en vertu du paragraphe 91 (22) de la Loi constitutionnelle de 1867 lorsqu’il s’agit de titulaires, de détenteurs ou de propriétaires de brevet ou de toute autre personne exerçant des droits en vertu d’un brevet, comme un titulaire de licence.
- Les Services juridiques du CEPMB continuent aussi de collaborer avec leurs homologues du bureau du procureur général du Canada pour veiller à ce que les litiges en attente devant la Cour fédérale et la Cour suprême qui touchent le CEPMB et portent sur sa compétence et des questions connexes soient bien gérés afin d’obtenir les résultats les plus favorables possible.
|
Ce risque est lié au programme de réglementation du prix des médicaments brevetés. |
| Étant donné la nature très spécialisée de son mandat de protection des consommateurs, le CEPMB dépend de sa capacité à attirer et à maintenir en poste des experts en la matière. |
- Le CEPMB a fait de la mobilisation de ses employés l’une de ses priorités stratégiques et continue de recruter de nouveaux employés, tant dans la fonction publique que dans le secteur privé, qui possèdent les compétences nécessaires pour réaliser les priorités de l’organisation.
- Les Ressources humaines du CEPMB ont créé une équipe chargée d’améliorer le milieu de travail qui recueillera les idées des employés sur la façon dont l’organisation peut mettre en œuvre sa stratégie de mobilisation. Dans le cadre de son mandat, l’équipe conseille la direction sur les moyens de créer un milieu de travail respectueux, sain et dynamique qui favorise le changement et les communications efficaces, et reconnaît le rendement élevé.
- Le CEPMB a embauché un consultant chargé d’élaborer et de réaliser un sondage auprès des employés sur leur satisfaction générale à l’égard du milieu de travail, et de recueillir les commentaires des employés sur la mesure dans laquelle les gestionnaires respectent leurs objectifs de mobilisation.
- Des séances de formation sur la façon de faire face aux changements, la diversité des valeurs, la façon de communiquer de manière respectueuse et de collaborer à la résolution de différends ont été offertes à tous les employés.
|
Ce risque est lié au programme de réglementation du prix des médicaments brevetés et au programme sur les tendances relatives aux produits pharmaceutiques. |
Plan stratégique 2015-2018 du CEPMB
En décembre 2015, le CEPMB a publié son plan stratégique triennal selon lequel l’organisation s’engage à atteindre les quatre objectifs stratégiques suivants :
- Réglementation et rapports axés sur le consommateur
- Modernisation du cadre
- Partenariats stratégiques et sensibilisation du public
- Mobilisation des employés
Priorités organisationnelles
Nom la priorité – Traiter des prix actuels et des lacunes en matière d’information
Description
L’environnement pharmaceutique actuel est dynamique et évolue rapidement. Pour fonctionner efficacement en tant qu’organisme de réglementation des prix, le CEPMB doit avoir un aperçu complet et exact des recettes de la partie réglementée générées par la vente de ses produits. Cependant, le CEPMB fait face à deux obstacles à cet égard, car les sources des prix à l’étranger accessibles au public sur lesquelles il s’appuie et les renseignements qui lui sont déclarés par les brevetés ne tiennent pas compte des ristournes et des rabais confidentiels qui sont maintenant la norme à l’échelle nationale et internationale dans les ententes négociées entre les fabricants pharmaceutiques et de nombreux tiers payants. Au Canada, il semble que ces rabais confidentiels entraînent un écart de prix croissant entre les tiers payants publics, qui sont en mesure de négocier collectivement par l’entremise de l’Alliance pancanadienne pharmaceutique (APP), les tiers payants privés, qui n’ont peut-être pas la souplesse nécessaire pour faire de même en vertu des lois sur la concurrence, et les clients payants, qui ne disposent d’aucune capacité de négociation.
Type de priorité1 Nouvelle
Initiatives clés appuyant les priorités
| Initiatives prévues |
Date de début |
Date de fin |
État |
Lien avec les programmes de l’organisation |
Réglementation :
- Chercher des occasions de répondre aux cas de prix excessifs sous la forme de discrimination par les prix et de segmentation du marché |
1er avril 2015 |
Printemps/été 2017 |
En bonne voie |
Ce risque est lié au programme de réglementation du prix des médicaments brevetés. |
|
Production de rapports :
- Renforcer son partenariat avec les payeurs publics afin de fournir de l’information sur les prix encore plus pertinente et opportune
- Élargir la portée des enjeux pharmaceutiques sur lesquels il rend compte afin de fournir aux payeurs privés et aux consommateurs de l’information qui les aidera à faire des choix plus éclairés et plus rentables
|
2014-2015 |
2018 |
En bonne voie |
Cette initiative est liée au programme de réglementation du prix des médicaments brevetés. |
| Progrès vers la réalisation de la priorité |
Sur le plan de la réglementation, le CEPMB a fait des progrès en s’attaquant aux lacunes actuelles en matière d’information et de prix. Il a notamment :
- modifié ses lignes directrices pour s’assurer que les prix courants publics ne dépassent pas le prix moyen maximal potentiel (PMMP) établi par le test appliqué au prix de lancement, afin qu’aucun Canadien ne paie plus que le prix plafond réglementé par le CEPMB;
- changé de source de prix reconnue pour l’Allemagne, passant de Rote Liste à Lauer-Taxe, qui est considéré comme un indicateur plus fiable des prix réels, moins les rabais et les ristournes, payés pour les médicaments en Allemagne;
- mis davantage l’accent sur les questions de segmentation du marché dans le cadre des enquêtes sur les prix excessifs.
|
Sur le plan de la production de rapports, le CEPMB a aussi fait des progrès. Il a notamment :
- travaillé en étroite collaboration avec les gouvernements provinciaux et territoriaux dans le cadre du SNIUMP et collaboré directement avec les administrations responsables par l’intermédiaire du Conseil de la fédération, afin d’offrir des analyses de prix et des études de marché pertinentes visant à réduire le prix des médicaments payés par les tiers payants publics au Canada;
- publié, le 31 mars 2015, la première édition du rapport CompasRx, un rapport phare annuel, le premier du genre, qui cerne les principaux facteurs des changements observés en matière de dépenses en médicaments sur ordonnance au sein des régimes publics d’assurance-médicaments au Canada – un élément important permettant aux stratèges et aux chercheurs de bien comprendre les tendances actuelles et de prévoir les futures pressions sur les coûts et les niveaux de dépenses;
- révisé le programme de recherche du SNIUMP v pour qu’il reflète les priorités les plus récentes en matière d’analyse établies par le Comité consultatif du SNIUMP qui doivent être réalisées et publiées en 2015-2016 et en 2016-2017.
|
Nom de la priorité – Sensibiliser davantage le public
Description
Pour se tenir bien informé des changements pertinents dans son environnement et y répondre, le CEPMB doit susciter la participation d’un réseau hétérogène d’intervenants de l’industrie pharmaceutique, où chacun a son propre intérêt et son point de vue sur ces changements. Pour le faire de façon efficace, le CEPMB doit accroître la sensibilisation à l’égard de son mandat de protection des consommateurs et s’appuyer sur sa réputation de courtier honnête auprès des parties prenantes et du grand public.
Type de priorité : Nouvelle
Initiatives clés appuyant les priorités
| Initiatives prévues |
Date de début |
Date de fin |
État |
Lien avec les programmes de l’organisation |
- Adopter une approche plus proactive pour communiquer ses réalisations en matière de réglementation et de production de rapports aux intervenants et au public
- Chercher des occasions de tirer parti des partenariats stratégiques
- Élargir la portée des questions pharmaceutiques sur lesquelles il rend compte
|
Avril 2015 |
2018 |
En bonne voie |
Cette priorité est liée au programme de réglementation du prix des médicaments brevetés et au programme sur les tendances relatives aux produits pharmaceutiques. |
| Progrès vers la réalisation de la priorité |
|
Le CEPMB a continué d’intensifier ses activités de communication, en adoptant une approche plus proactive pour accroître sa présence dans les médias traditionnels et les médias sociaux. Il a entre autres publié des communiqués, lancé des campagnes ciblées sur les médias sociaux et collaboré plus directement avec le public. Cela s’est traduit par des entrevues et une couverture accrue dans les médias nationaux et internationaux, notamment la Société Radio-Canada, la CPAC (chaîne d’affaires publiques par câble), le Globe and Mail, le Wall Street Journal et CBS.
Le CEPMB suit de près l’utilisation des médias sociaux dans le cadre de ses activités de communication et en rend compte en interne, en tenant compte de ses activités et rapports principaux.
Le CEPMB a apporté des améliorations à son site Web et à ses publications au chapitre de la clarté du langage et de l’accessibilité du contenu et continue de répondre aux demandes du public et d’informer ce dernier en publiant des mises à jour sur les délibérations et les décisions du Conseil ainsi que les résultats de recherche.
Le CEPMB a aussi travaillé en étroite collaboration avec les gouvernements FPT dans le cadre du SNIUMP et collaboré directement avec les administrations responsables par l’intermédiaire du Conseil de la fédération, afin d’offrir des analyses de prix et des études de marché pertinentes visant à réduire le prix des médicaments génériques payés par les tiers payants publics au Canada.
Le CEPMB a organisé des séances d’information externes à l’intention de divers groupes d’intervenants, et a préparé et fait des présentations lors d’événements visant à mobiliser les intervenants pour éveiller leur sensibilisation à l’égard des initiatives du SNIUMP et aux résultats des recherches. De plus, le CEPMB a organisé les réunions du Comité consultatif du SNIUMP vi visant à cerner les priorités du programme de recherche du SNIUMP, et participé à ces réunions.
Le CEPMB continue de participer à titre de membre ou d’observateur à divers comités externes, notamment le Réseau canadien pour l’analyse de l’environnement en santé (RCAES), le Comité consultatif sur les médicaments et les produits thérapeutiques (CCMPT) dans le cadre du Programme des services de santé non assurés (SSNA) et le Comité consultatif sur les politiques en matière de médicaments (CCPM) de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS).
Le CEPMB a tenu le deuxième Forum de chercheurs dans le cadre duquel des universitaires et experts en la matière ont été invités à discuter de questions d’actualité pertinentes du point de vue stratégique en ce qui concerne le marché pharmaceutique.
Le CEPMB continue de participer et d’assister à des réseaux, des conférences et des colloques au Canada comme à l’étranger, notamment dans le cadre de l’initiative PPRI, de l’OMS et du groupe de Vancouver.
Le CEPMB a abordé un plus grand nombre de plaintes en 2015-2016 de la part du public concernant le prix des médicaments par rapport aux années précédentes.
|
Nom de la priorité – Modernisation réglementaire
Description
Au Canada, les tiers payants publics ont conclu des ententes confidentielles relatives à l’inscription des produits avec les fabricants pharmaceutiques, que ce soit individuellement ou par l’entremise de l’APP. Comme il a été mentionné, cela nuit à la capacité du CEPMB de vérifier le vrai prix d’un médicament, ce qui peut conduire à une pression à la hausse sur les prix dans le marché privé. D’autres pays essaient de nouvelles méthodes de contrôle des coûts, et les prix des médicaments brevetés au Canada ont augmenté par rapport aux prix observés dans les sept pays auxquels le Canada se compare conformément au Règlement sur les médicaments brevetés. L’engagement du Canada en vertu de l’Accord économique et commercial global (AECG) avec l’Union Européenne visant à modifier la Loi sur les brevets afin de prolonger la durée d’un brevet pharmaceutique de deux ans pourrait rouvrir le débat sur le juste équilibre entre la propriété intellectuelle et la protection des consommateurs.
Type de priorité : Nouvelle
Initiatives clés appuyant les priorités
| Initiatives prévues |
Date de début |
Date de fin |
État |
Lien avec les programmes de l’organisation |
| Examiner l’éventuelle nécessité d’apporter des changements à ses fonctions de détermination du prix et de production de rapports – et dans quelle mesure – s’il doit continuer d’atteindre son résultat stratégique de veiller à ce que les Canadiens ne paient pas un prix excessif pour les médicaments brevetés |
Avril 2015 |
Été 2017 |
En cours |
Cette priorité est liée au programme de réglementation du prix des médicaments brevetés. |
| Progrès vers la réalisation de la priorité |
| Comme première étape de la modernisation de son cadre juridique dans le but d’accroître son efficacité en tant qu’organisme de réglementation des prix, le CEPMB publiera un document de travail qui servira de fondement aux consultations publiques sur la réforme de ses lignes directrices relatives à l’établissement du prix des médicaments. |
Document de discussion sur la Modernisation des lignes directrices
En juin 2016, le CEPMB a publié un document de discussion comme première étape de son objectif stratégique de 2015-2018 visant la modernisation du cadre. Au moyen d’un document de discussion, le CEPMB cherche à amorcer un dialogue ouvert et éclairé avec les intervenants et le public, au sujet de certains éléments de ses lignes directrices relatives à l’établissement du prix des médicaments qui nécessitent une révision à la suite des changements qui touchent le milieu pharmaceutique au Canada et à l’étranger. Les commentaires doivent être envoyés au plus tard le 24 octobre 2016.
Le document de discussion sur la modernisation des lignes directrices vii se trouve sur le site Web du CEPMB.
Nom de la priorité – Engagement des employés et synergie organisationnelle
Description
En réponse aux commentaires provenant du Sondage auprès des fonctionnaires fédéraux de 2011 et à un rapport de planification de la relève produit par des experts indépendants, le CEPMB a lancé un processus pour susciter l'engagement du personnel et obtenir leurs commentaires et leur appui relativement à la direction stratégique et aux priorités du CEPMB au cours des trois prochaines années. Dans le cadre de ce processus, le personnel acquerra une meilleure compréhension du cadre opérationnel du CEPMB et de la façon dont chaque direction peut contribuer à l’atteinte du résultat stratégique de l’organisation.
Type de priorité : Nouvelle
Initiatives clés appuyant les priorités
| Initiatives prévues |
Date de début |
Date de fin |
État |
Lien avec les programmes de l’organisation |
Le CEPMB mettra l’accent sur :
- une communication plus claire et plus structurée entre le personnel et la direction ainsi qu’en leur sein;
- une plus grande collaboration interne;
- une meilleure intégration de ses processus d’affaires;
- une utilisation optimale de l’éventail de compétences diversifiées des employés.
|
Février 2015 |
Mars 2018 |
En cours |
Cette priorité est liée au programme de réglementation du prix des médicaments brevetés et au programme sur les tendances relatives aux produits pharmaceutiques. |
| Progrès vers la réalisation de la priorité |
Les progrès touchant cette priorité comprennent entre autres :
- La création d’une série de conférences où des leaders d’opinion et des experts dans divers domaines liés au travail du CEPMB viennent régulièrement parler aux employés des derniers développements dans l’environnement réglementaire touchant les médicaments;
- Des réunions régulières de tous les employés où ceux-ci ont l’occasion de présenter leur travail à leurs collègues des autres directions;
- Des séances de formation offertes aux employés sur la façon de faire face aux changements, la diversité des valeurs, la façon de communiquer de manière respectueuse et de collaborer à la résolution de différends;
- Les Ressources humaines du CEPMB ont créé une équipe chargée d’améliorer le milieu de travail qui recueillera les idées des employés sur la façon dont l’organisation peut mettre en œuvre sa stratégie de mobilisation. Dans le cadre de son mandat, l’équipe conseille la direction sur les moyens de créer un milieu de travail respectueux, sain et dynamique qui favorise le changement et les communications efficaces, et reconnaît le rendement élevé;
- Le CEPMB a embauché un consultant chargé d’élaborer et de réaliser un sondage auprès des employés sur leur satisfaction générale à l’égard du milieu de travail, et de recueillir les commentaires des employés sur la mesure dans laquelle les gestionnaires respectent leurs objectifs de mobilisation;
- La conception d’un nouveau site intranet amélioré qui permettra aux employés d’échanger de l’information et de suivre plus facilement les activités de développement dans l’organisation, tout en favorisant une plus grande socialisation et collégialité.
|
Pour obtenir de plus amples renseignements sur les priorités organisationnelles, veuillez consulter le Plan stratégique 2015-2018 du CEPMB viii et la lettre de mandat de la ministre. ix
Section II: Vue d’ensemble des dépenses
Dépenses réelles
Ressources financières budgétaires (en dollars)
2015-2016
Budget principal des dépenses |
2015-2016
Dépenses prévues |
2015-2016
Autorisations totales
disponibles |
2015-2016
Dépenses réelles
(autorisations utilisées) |
Différence
(dépenses réelles moins dépenses prévues) |
| 10 945 181 |
10 945 181 |
11 249 206 |
9 498 361 |
(1 446 820) |
| L’écart de 1 446 820 $ entre les dépenses prévues et les dépenses réelles est principalement dû au fait que les dépenses prévues étaient fondées sur l’hypothèse que la totalité des fonds de l’affectation à but spécial (ABS) réservée à la tenue des audiences publiques (2,47 millions de dollars) sera dépensée chaque année. En 2015-2016, les dépenses de l’ABS ont totalisé 1 213 627 $. |
Ressources humaines (équivalents temps plein [ETP])
2015-2016
Nombre prévu |
2015-2016
Nombre réel |
2015-2016
Différence
(nombre réel moins nombre prévu) |
| 71,0 |
62,5 |
(8,5) |
| Remarque : L’écart entre les ETP réels et prévus s’explique principalement par les efforts de la gestion pour stabiliser et contrôler les exigences salariales, du départ d’employés et du report des dotations. |
Sommaire du rendement budgétaire
Sommaire du rendement budgétaire pour le ou les programmes et les services internes (en dollars)
| Programmes et services internes |
2015-2016
Budget principal des dépenses |
2015-2016
Dépenses prévues |
2016-2017
Dépenses prévues |
2017-2018
Dépenses prévues |
2015-2016
Autorisations totales pouvant être utilisées |
2015-2016
Dépenses réelles (autorisations utilisées) |
2014-2015
Dépenses réelles (autorisations utilisées) |
2013-2014
Dépenses réelles (autorisations utilisées) |
| Programme de réglementation du prix des médicaments brevetés |
6 834 096 |
a 6 834 096 |
6 646 758 |
6 646 758 |
7 030 734 |
b 5 399 127 |
3 543 891 |
c 6 395 602 |
| Programme sur les tendances relatives aux produits pharmaceutiques |
1 506 994 |
1 506 994 |
1 704 508 |
1 704 508 |
1 546 129 |
1 688 584 |
1 301 871 |
1 146 790 |
| Services internes |
2 604 091 |
2 604 091 |
2 613 842 |
2 613 842 |
2 672 343 |
2 410 650 |
3 084 518 |
2 998 175 |
| Total |
10 945 181 |
10 945 181 |
10 965 108 |
10 965 108 |
11 249 206 |
9 498 361 |
7 930 280 |
10 540 567 |
Notes de bas de page
- a Le CEPMB prévoit toujours ses dépenses en se fondant sur l’hypothèse qu’il dépensera la totalité des 2,47 millions de dollars de l’ABS réservés à la tenue d’audiences publiques. La raison en est que ces dépenses dépendent du nombre d’audiences, de la durée et de la complexité des audiences qui se dérouleront, ce qui est difficile à prévoir.
- b Les dépenses réelles pour 2015-2016 ont été considérablement plus élevées que celles de 2014-2015. Cet écart est dû en grande partie aux dépenses de l’ABS de 1 213 627 $, dont la majorité est liée aux coûts associés à l’audience relative au prix du médicament Soliris.
- c Les dépenses réelles pour 2013-2014 ont été considérablement plus élevées que celles de 2014-2015. Cet écart est principalement attribuable à une décision rendue par la Cour fédérale qui a annulé une ordonnance du Conseil et a contraint le CEPMB à rendre à un breveté la somme de 2 801 275 $ qu’il avait versé au Conseil en tant que paiement pour des revenus excédentaires gagnés, en plus des intérêts et des frais pertinents.
|
Tendances relatives aux dépenses du ministère
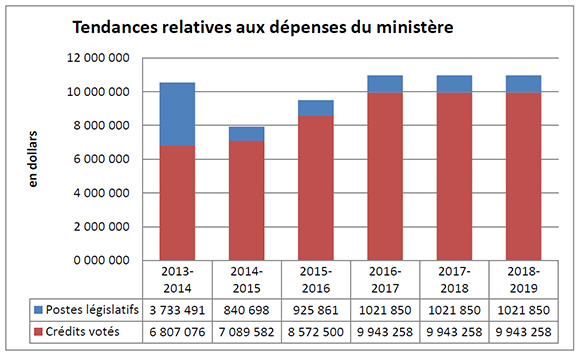
Description de la figure
Le graphique illustre la tendance des dépenses du CEPMB. Il présente les dépenses législatives pour les exercices 2013-2014, 2014-2015, and 2015-2016, ainsi que les dépenses votées pour les exercices 2016-2017, 2017-2018 et 2018-2019.
Les dépenses législatives en 2013-2014 ont été considérablement plus élevées que celles des années ultérieures, en grande partie en raison du financement supplémentaire reçu au moyen d’un mandat de rajustement pour couvrir le montant que la Cour fédérale a ordonné de rembourser à un breveté. La Cour fédérale a annulé une ordonnance du Conseil et ordonné dans sa décision qu’un revenu excédentaire de 2 801 285 $ soit remboursé par le CEPMB au breveté, avec l’intérêt approprié et les frais déterminés.
Dépenses par crédit voté
Pour obtenir de plus amples renseignements au sujet des dépenses votées et législatives de CEPMB, veuillez consulter les Comptes publics du Canada 2016 x.
Harmonisation des dépenses avec le cadre pangouvernemental
Harmonisation des dépenses réelles de 2015-2016 avec le cadre pangouvernemental xi (en dollars)
| Programme |
Secteur des dépenses |
Résultat pour le gouvernement du Canada |
Dépenses réelles 2015-2016 |
| Programme de réglementation du prix des médicaments brevetés |
Affaires sociales |
Des Canadiens en santé |
5 399 127 |
| Programme sur les tendances relatives aux produits pharmaceutiques |
Affaires sociales |
Des Canadiens en santé |
1 688 584 |
Total des dépenses par secteur de dépenses (en dollars)
| Secteur des dépenses |
Dépenses totales prévues |
Total des dépenses réelles |
| Affaires économiques |
|
|
| Affaires sociales |
8 341 090 |
7 087 711 |
| Affaires internationales |
|
|
| Affaires gouvernementales |
|
|
États financiers et Faits saillants des états financiers
Faits saillants des états financiers
État condensé des opérations (non audité)
Pour l’exercice se terminant le 31 mars 2016 (en dollars)
| Information financière |
Résultats prévus
2015-2016 |
Résultats réels
2015-2016 |
Résultats réels
2014-2015 |
Écart (résultats réels 2015-2016 moins résultats prévus 2015-2016) |
Écart (résultats réels 2015-2016 moins résultats réels 2014-2015) |
| Total des charges |
12 016 985 |
10 716 714 |
8 806 161 |
(1 300 271) |
1 910 553 |
| Total des revenus |
- |
2 265 |
114 |
2 265 |
2 151 |
| Coût de fonctionnement net avant le financement du gouvernement et les transferts |
12 016 985 |
10 714 449 |
8 806 047 |
(1 302 536) |
1 908 402 |
En 2015-2016, les dépenses du CEPMB ont totalisé 10 716 714 $, une augmentation de 1 910 553 $ par rapport à 2014-2015, qui s’explique principalement par ce qui suit :
- une augmentation de 910 529 $ au titre des salaires et des avantages sociaux des employés;
- une augmentation de 877 448 $ au titre des services professionnels et spéciaux;
- une augmentation de 181 296 $ au titre des services d’information;
- une diminution de 90 099 $ au titre des services publics, fournitures et approvisionnements.
Les revenus du CEPMB, généralement constitués des frais des demandes d’accès à l’information et du produit de l’aliénation d’immobilisations, ont totalisé 2 265 $ en 2015-2016, soit une augmentation de 2 151 $ par rapport aux revenus annuels de l’exercice précédent. Cette augmentation s’explique principalement par des rajustements apportés au taux de change.
État condensé de la situation financière (non audité)
Au 31 mars 2016 (en dollars)
| Information financière |
2015-2016 |
2014-2015 |
Différence
(2015-2016 moins
2014-2015) |
| Total des passifs nets |
1 995 264 |
1 510 991 |
484 273 |
| Total des actifs financiers nets |
1 291 599 |
851 654 |
439 945 |
| Dette nette du ministère |
703 665 |
659 337 |
44 328 |
| Total des actifs non financiers |
155 071 |
165 738 |
(10 667) |
| Situation financière nette du ministère |
(548 594) |
(493 599) |
(54 995) |
Le total des passifs nets du CEPMB était de 1 995 264 $ à la fin de 2015-2016, soit une augmentation de 484 273 $ par rapport à l’exercice précédent. L’augmentation comportait principalement ce qui suit :
- une augmentation de 440 028 $ au titre des créditeurs et charges à payer;
- une diminution de 14 733 $ au titre des indemnités de vacances et congés compensatoires;
- une augmentation de 58 978 $ au titre des avantages sociaux futurs.
Le total des actifs du CEPMB était de 1 446 670 $ à la fin de 2015-2016, une augmentation de 429 278 $ par rapport à l’exercice précédent. Les écarts dans les actifs comportaient principalement ce qui suit :
- une augmentation de 624 935 $ au titre du montant à recevoir du Trésor;
- une diminution de 184 990 $ au titre des débiteurs et avances;
- une diminution de 10 667 $ au titre des immobilisations corporelles.
Section III: Analyse des programmes et des Services internes
Programmes
Le programme de réglementation du prix des médicaments brevetés
Description
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires et qui est responsable de s’assurer que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs en vertu des facteurs d’examen du prix prévus à la Loi sur les brevets (la Loi). Pour décider si un prix est excessif, le Conseil doit tenir compte des facteurs suivants : les prix de vente du médicament et des autres médicaments de la même catégorie thérapeutique au Canada et dans les sept pays de comparaison nommés dans le Règlement sur les médicaments brevetés (le Règlement); les variations de l’Indice des prix à la consommation (IPC); et, conformément à la Loi, tous les autres facteurs précisés par les règlements d’application visant l’examen du prix. En vertu de la Loi et du Règlement, les brevetés sont tenus de faire rapport des renseignements sur les prix et les ventes pour chaque médicament breveté vendu au Canada, jusqu’à échéance du brevet ou des brevets. Le personnel du Conseil examine les renseignements soumis par les brevetés au lancement et à chaque période de rapport, et ce, pour tous les médicaments brevetés vendus au Canada. S’il conclut que le prix d’un médicament breveté semble excessif, le personnel du Conseil mène une enquête sur le prix. Une enquête peut mener aux résultats suivants : la fermeture de l’enquête lorsqu’il apparaît que le prix est non excessif; un Engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son produit et à rembourser les recettes excessives au moyen d’un paiement et (ou) d’une réduction du prix d’un autre produit médicamenteux breveté; ou une audience publique dont l’objet est de déterminer si le prix du produit médicamenteux est ou non excessif, y compris une ordonnance corrective rendue par le Conseil. Si le Panel d’audience du Conseil conclut, à l’issue d’une audience publique, qu’un prix est ou était excessif, il peut ordonner au breveté de réduire le prix et de prendre des mesures qui lui sont dictées pour rembourser les recettes excessives. Ce programme assure la protection des Canadiens et de leur système des soins de santé en effectuant l’examen des prix auxquels les brevetés vendent leurs médicaments brevetés au Canada afin d’éviter les prix excessifs.
157 millions de dollars en recettes excessives ont été recouvrés
Depuis 1993, lorsque les pouvoirs de redressement du CEPMB ont été modifiés, des recettes excessives de plus de 157 millions de dollars ont été remboursées au gouvernement du Canada à l’aide des engagements de conformité volontaire et des ordonnances du Conseil.
Analyse du rendement du programme et leçons retenues
Le CEPMB a été créé en 1987 dans le cadre d’une réorganisation majeure du régime de brevets sur les médicaments du Canada qui visait à maintenir l’équilibre entre des objectifs de politiques susceptibles d’être en concurrence. D’une part, le gouvernement a renforcé la protection que confèrent les brevets aux médicaments afin d’encourager davantage d’investissement en R-D de la part de l’industrie pharmaceutique au Canada. D’autre part, le gouvernement a créé le CEPMB en vue d’atténuer pour les Canadiens les répercussions financières des changements apportés à la loi. Le CEPMB était décrit comme le pilier de la protection des intérêts des consommateurs du projet de loi C-22. Cette description a été appuyée à de multiples occasions par les tribunaux, y compris la Cour suprême du Canada en 2011. L’objectif énoncé du CEPMB était de veiller à ce que les brevetés n’abusent pas de leurs droits de brevet nouvellement renforcés en imposant aux consommateurs des prix « excessifs » pendant la période de monopole de droit.
Au moment où le projet de loi C-22 a été adopté, les décideurs étaient d’avis que la protection conférée par brevet et les prix étaient les facteurs clés de l’investissement de l’industrie pharmaceutique en R-D. On a donc décidé d’offrir un niveau de protection et de prix pour les médicaments comparable à celui d’autres pays ayant une industrie pharmaceutique forte parce qu’on croyait que le Canada aurait des niveaux comparables de R-D. En échange des changements apportés à la Loi, lesquels ont renforcé la protection que confèrent les brevets aux médicaments, Compagnies de recherche pharmaceutique du Canada (récemment rebaptisé « Médicaments novateurs Canada » ou MNC) s’est engagé à doubler son niveau de R-D à 10 % des ventes.
Les répercussions de la politique au fil du temps ont été à l’opposé de ce qui était prévu. Le prix des médicaments brevetés au Canada a augmenté de façon constante par rapport aux prix observés dans les sept pays auxquels se compare le Canada en vertu de sa réglementation (France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis – les sept pays de comparaison du CEPMB) et se trouve maintenant au troisième rang, n’étant devancé que par l’Allemagne et les États-Unis. Depuis 2000, les dépenses en médicaments brevetés du Canada exprimées en pourcentage du PIB ont connu une hausse de 184 %, dépassant les sept pays de comparaison du CEPMB au cours de cette période. Outre les sept pays de comparaison du CEPMB, les prix en Australie, en Autriche, en Espagne, en Finlande, aux Pays-Bas et en Nouvelle-Zélande sont de 14 % à 34 % inférieurs à ceux du Canada. Si l’on tient compte de tous les médicaments prescrits et non seulement des médicaments brevetés, les dépenses par habitant au Canada et en tant que pourcentage du PIB sont plus élevées que celles de la plupart des autres pays.
Tandis que les prix au Canada augmentent, l’investissement en R-D diminue. Depuis 2003, les membres de MNC n’ont pas respecté leur engagement de 10 %, et le ratio actuel s’établit à 5 % des ventes. Il s’agit du ratio enregistré le plus faible depuis 1988, quand le CEPMB a commencé à faire rapport sur la R-D. Par opposition, le ratio moyen de R-D des sept pays de comparaison du CEPMB est constamment supérieur à 20 %.
Le prix élevé des médicaments brevetés et le creux record de l’investissement en R-D remettent beaucoup en question l’efficacité du CEPMB pour atteindre les objectifs de la politique du gouvernement de 1987. Ces préoccupations ont été exprimées à nouveau récemment par le Groupe consultatif sur l’innovation des soins de santé dans son rapport du 17 juillet 2015 intitulé « Libre cours à l’innovation : Soins de santé excellents pour le Canada », qui conclut que le CEPMB doit être renforcé afin d’assurer « une protection des consommateurs plus efficace contre les médicaments brevetés à prix élevé ». Ces mêmes préoccupations sont ce qui a incité le CEPMB à entreprendre un processus de planification stratégique d’un an, qui permettra à l’organisation de s’affirmer à nouveau en tant que garantie efficace contre l’abus des prix excessifs des fabricants pharmaceutiques et en tant que source précieuse de renseignements sur le marché pour les décideurs et les tiers payants. Pour atteindre le premier de ces deux objectifs, il faudra apporter des changements au cadre juridique du CEPMB. Ces changements sont en harmonie avec les efforts en cours des ministres de la Santé fédéral, provinciaux et territoriaux consistant à « réduire le prix des produits pharmaceutiques » tout en « améliorant la capacité financière, l’accessibilité et l’utilisation appropriée des médicaments d’ordonnance » et sont complémentaires à ces efforts.
Comme première étape de ce processus, le CEPMB effectuera des consultations publiques pour obtenir les observations des intervenants et du grand public au sujet de l’éventuelle réforme de son Compendium des politiques, des lignes directrices et des procédures (les « Lignes directrices »). Le processus de consultation publique est une invitation à toutes les parties intéressées à repenser collectivement les Lignes directrices afin de s’assurer qu’elles continuent d’offrir au CEPMB un moyen pertinent et efficace pour protéger les consommateurs contre les prix excessifs dans un marché pharmaceutique dynamique et évolutif.
Ressources financières budgétaires (en dollars)
Budget principal des dépenses
2015-2016 |
Dépenses prévues
2015-2016 |
Autorisations totales pouvant être utilisées
2015-2016 |
Dépenses réelles (autorisations utilisées)
2015-2016 |
Écart (réelles moins prévues)
2015-2016 |
| 6 834 096 |
6 834 096 |
7 030 734 |
5 399 127 |
(1 434 969) |
Ressources humaines (équivalents temps plein [ETP])
Prévu
2015-2016 |
Réel
2015-2016 |
Écart 2015-2016
(réel moins prévu) |
| 42,0 |
31,1 |
(10,9) |
Résultats
| Résultats attendus |
Indicateurs de rendement |
Objectifs |
Résultats obtenus |
| La conformité des brevetés à la Loi sur les brevets, à la réglementation et aux Lignes directrices sur les prix excessifs (les « Lignes directrices ») |
Pourcentage de médicaments brevetés dont les prix sont fixés en conséquence de la conformité volontaire, suivant les Lignes directrices, ou ne justifient pas la tenue d’une enquête |
95 % |
93 % xiii |
| Taux de conformité aux ordonnances du Conseil relatives au prix ou à la compétence et aux engagements de conformité volontaire |
100 % |
100 % |
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette des prix pratiqués dans les sept pays de comparaison nommés dans le Règlement |
Les prix canadiens des nouveaux médicaments brevetés correspondent à la moyenne du prix médian international ou se trouvent en dessous de la médiane |
100 % |
100 % |
| Les prix canadiens des médicaments brevetés existants correspondent à la moyenne du prix médian international ou se trouvent en dessous de la médiane |
100 % |
100 % |
Programme sur les tendances relatives aux produits pharmaceutiques
Description
Le CEPMB rend annuellement compte au Parlement, par le truchement du ministre de la Santé, de ses activités d’examen du prix, des prix des médicaments brevetés et des tendances observées au niveau des prix de tous les médicaments ainsi que des dépenses de R–D rapportées par les brevetés pharmaceutiques. En soutien à cette exigence en matière de rapport, le programme sur les tendances relatives aux produits pharmaceutiques fournit des renseignements complets et précis sur les tendances relatives aux prix auxquels les fabricants vendent les médicaments brevetés au Canada et aux dépenses de l’intention des intervenants intéressés, notamment : l’industrie (de marque, biotechnologique et générique); les gouvernements fédéral, provinciaux et territoriaux; les groupes de défense de droits des consommateurs et des patients; les tiers payants; et autres. Ces renseignements permettent également de rassurer les Canadiens que les prix des médicaments brevetés ne sont pas excessifs. De plus, par suite de l’établissement du SNIUMP par les ministres de la Santé fédéral, provinciaux et territoriaux, le ministre fédéral de la Santé a demandé que le CEPMB réalise des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts pour les médicaments brevetés et non brevetés distribués sous ordonnance pour que le système de santé au Canada ait des renseignements plus complets et plus justes sur la façon dont on utilise les médicaments d’ordonnance et sur les facteurs à l’origine des augmentations de coûts. Cette fonction vise à fournir aux gouvernements fédéral, provinciaux et territoriaux ainsi, qu’aux autres intervenants intéressés, une source d’information centrale et fiable concernant les prix de tout médicament d’ordonnance.
Analyse du rendement du programme et leçons retenues
En 2015-2016, en plus de la présentation de son rapport annuel pour 2014, le CEPMB a publié sept présentations par affiches xiv, une présentation par diapositives xv, son Plan stratégique 2015-2018 xvi et les cinq études analytiques suivantes :
Au cours des dernières années, le CEPMB a aussi travaillé en étroite collaboration avec les gouvernements provinciaux et territoriaux dans le cadre du SNIUMP et collaboré directement avec les administrations responsables par l’intermédiaire du Conseil de la fédération, afin d’offrir des analyses de prix et des études de marché pertinentes visant à réduire le prix des médicaments génériques achetés par les tiers payants publics.
Le CEPMB a organisé des séances d’information externes à l’intention de divers groupes d’intervenants, et a préparé et fait des présentations lors d’événements visant à mobiliser les intervenants pour éveiller leur sensibilisation à l’égard des initiatives du SNIUMP et aux résultats des recherches. De plus, le CEPMB a organisé les réunions du Comité consultatif du SNIUMP visant à cerner les priorités du programme de recherche du SNIUMP, et a participé à ces réunions.
Le CEPMB continue de participer à titre de membre ou d’observateur à divers comités externes, notamment le Réseau canadien pour l’analyse de l’environnement en santé (RCAES), le Comité consultatif sur les médicaments et les produits thérapeutiques (CCMPT) dans le cadre du Programme des services de santé non assurés (SSNA) et le Comité consultatif sur les politiques en matière de médicaments de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS). Le CEPMB continue de participer et d’assister à des réseaux, des conférences et des colloques au Canada comme à l’étranger, notamment dans la cadre de l’initiative Pharmaceutical Pricing and Reimbursement Information, de l’Organisation mondiale de la Santé et du groupe de Vancouver.
Le CEPMB a tenu le deuxième Forum de chercheurs dans le cadre duquel des universitaires et experts en la matière ont été invités à discuter de questions d’actualité pertinentes du point de vue stratégique en ce qui concerne le marché pharmaceutique.
Au cours de la dernière année, le CEPMB a continué d’intensifier ses activités, en adoptant une approche plus proactive pour accroître sa présence dans les médias traditionnels et les médias sociaux. Il a notamment publié des communiqués, lancé des campagnes ciblées sur les médias sociaux, collaboré directement avec le public et donné des entrevues dans divers médias canadiens et internationaux, comme la Société Radio-Canada, la CPAC, le Globe and Mail, le Wall Street Journal et CBS. Le CEPMB a apporté des améliorations à son site Web et à ses publications au chapitre de la clarté du langage et de l’accessibilité du contenu et continue de répondre aux demandes du public et d’informer ce dernier en publiant des mises à jour sur les délibérations et les décisions du Conseil ainsi que les résultats de recherche.
Le CEPMB collabore avec l’Alliance pancanadienne pharmaceutique
Les provinces et les territoires considèrent les rapports du CEPMB comme un élément qui a grandement contribué à la réduction des prix des médicaments génériques au cours des dernières années.
Ressources financières budgétaires (en dollars)
Budget principal des dépenses
2015-2016 |
Dépenses prévues
2015-2016 |
Autorisations totales pouvant être utilisées
2015-2016 |
Dépenses réelles (autorisations utilisées)
2015-2016 |
Écart (réelles moins prévues)
2015-2016 |
| 1 506 994 |
1 506 994 |
1 546 129 |
1 688 584 |
181 590 |
Ressources humaines (équivalents temps plein [ETP])
Prévu
2015-2016 |
Réel
2015-2016 |
Écart 2015-2016
(réel moins prévu) |
| 10,0 |
12,8 |
2,8 |
Résultats du rendement
| Résultats attendus |
Indicateurs de rendement |
Cibles |
Résultats réels |
| Information sur les tendances pharmaceutiques et les facteurs à l’origine des coûts offerte aux intervenants |
Nombre de nouveaux rapports/nouvelles études sur le site Web du CEPMB |
12 rapports et études |
15 nouveaux rapports et études en date du 31 mars 2016 |
| Nombre de présentations du CEPMB à un public externe |
10 séances d’information |
13 séances d’information en date du 31 mars 2016 xxii |
Services internes
Description
Les services internes sont des groupes d’activités et de ressources connexes qui sont gérés de façon à répondre aux besoins des programmes et des autres obligations générales d’une organisation. N’en font partie que les activités et les ressources propres à l’ensemble de l’organisation et non à un programme en particulier. Les groupes d’activités sont les suivants : services de gestion et de surveillance, services de communications, services juridiques, services de gestion des ressources humaines, services de gestion des finances, services de gestion de l’information, services de technologies de l’information, services de gestion des biens, services de gestion du matériel et services de gestion des acquisitions.
Analyse du rendement du programme et leçons retenues
En décembre 2015, le CEPMB a publié son Plan stratégique pour les années 2015 à 2018. L’un des objectifs stratégiques énoncés dans ce document est la mobilisation des employés. À cette fin, au cours des dernières années, le CEPMB a mené les activités suivantes :
- La création d’une série de conférences où des leaders d’opinion et des experts dans divers domaines liés au travail du CEPMB viennent régulièrement parler aux employés des derniers développements dans l’environnement réglementaire touchant les médicaments;
- Des réunions régulières de tous les employés où ceux-ci ont l’occasion de présenter leur travail à leurs collègues des autres directions;
- Des séances de formation offertes aux employés sur la façon de faire face aux changements, la diversité des valeurs, la façon de communiquer de manière respectueuse et de collaborer à la résolution de différends;
- Les Ressources humaines du CEPMB ont créé une équipe chargée d’améliorer le milieu de travail qui recueillera les idées des employés sur la façon dont l’organisation peut mettre en œuvre sa stratégie de mobilisation. Dans le cadre de son mandat, l’équipe conseille la direction sur les moyens de créer un milieu de travail respectueux, sain et dynamique qui favorise le changement et les communications efficaces, et reconnaît le rendement élevé;
- Le CEPMB a embauché un consultant chargé d’élaborer et de réaliser un sondage auprès des employés sur leur satisfaction générale à l’égard du milieu de travail, et de recueillir les commentaires des employés sur la mesure dans laquelle les gestionnaires respectent leurs objectifs de mobilisation;
- La conception d’un nouveau site intranet amélioré qui permettra aux employés d’échanger de l’information et de suivre plus facilement les activités de développement dans l’organisation, tout en favorisant une plus grande socialisation et collégialité.
Le CEPMB a mis en œuvre son plan de sécurité ministériel (PSM). Il a aussi examiné ses pratiques de production des rapports financiers dans le but de simplifier le processus et d’améliorer la qualité des renseignements financiers fournis à la haute direction.
Ressources financières budgétaires (en dollars)
Budget principal des dépenses
2015-2016 |
Dépenses prévues
2015-2016 |
Autorisations totales pouvant être utilisées
2015-2016 |
Dépenses réelles (autorisations utilisées)
2015-2016 |
Écart (réelles moins prévues)
2015-2016 |
| 2 604 091 |
2 604 091 |
2 672 343 |
2 410 650 |
(193 441) |
Ressources humaines (ETP)
Prévu
2015-2016 |
Réel
2015-2016 |
Écart 2015-2016
(réel moins prévu) |
| 19,0 |
18,6 |
(0,4) |
Section IV: Renseignements supplémentaires
Tableaux des renseignements supplémentaires
Les tableaux de renseignements supplémentaires ci-dessous sont disponibles sur le site Web du CEPMB.
Dépenses fiscales fédérales
Il est possible de recourir au régime fiscal pour atteindre des objectifs de la politique publique en appliquant des mesures spéciales, comme de faibles taux d’impôt, des exemptions, des déductions, des reports et des crédits. Le ministère des Finances Canada publie annuellement des estimations et des projections du coût de ces mesures dans une publication intitulée Rapport sur les dépenses fiscales fédérales. xxv Ce rapport donne aussi des renseignements généraux détaillés sur les dépenses fiscales, y compris les descriptions, les objectifs, les renseignements historiques et les renvois aux programmes des dépenses fédéraux connexes. Les mesures fiscales présentées dans ladite publication relèvent de la seule responsabilité du ministre des Finances.
Coordonnées de l’organisation
Conseil d’examen du prix des médicaments brevetés
C.P. L40
Centre Standard Life
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 613-952-7360
Sans frais : 1-877-861-2350
Télécopieur : 613-952-7626
ATS : 613-957-4373
Courriel : pmprb@pmprb-cepmb.gc.ca
Site Web : http://www.pmprb-cepmb.gc.ca
Annexe : Définitions
architecture d’alignement des programmes (program alignment architecture) : Répertoire structuré des programmes d’une organisation qui illustre les liens hiérarchiques entre les programmes et les résultats stratégiques auxquels ils contribuent.
brevet (patent) : Instrument émis par le Commissaire des brevets sous forme de lettres patentes conférant à l’inventeur un monopole d’une durée limitée pour les allégations formulées. Le brevet confère également à son titulaire et à ses représentants légaux le droit exclusif de fabriquer, de construire, d’exploiter ou de vendre son invention.
breveté ou titulaire d’un brevet (patentee) : Selon la définition donnée au paragraphe 79 (1) de la Loi sur les brevets, il s’agit de la « personne ayant pour le moment droit à l’avantage d’un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d’un brevet pour une telle invention ou exerce ou a exercé les droits d’un titulaire dans un cadre autre qu’une licence prorogée en vertu du paragraphe 11 (1) de la Loi de 1992 modifiant la Loi sur les brevets ».
cadre pangouvernemental (whole-of-government framework) : Schéma représentant la contribution financière des organisations fédérales qui dépendent de crédits parlementaires en harmonisant leurs programmes avec un ensemble de 16 secteurs de résultat pangouvernementaux de haut niveau regroupés sous 4 secteurs de dépenses.
CEPMB7 (PMPRB7) : Les sept pays de comparaison pour lesquels les brevetés doivent faire rapport des prix de leurs produits médicamenteux brevetés accessibles au public aux fins d’examen des prix. Ces pays sont : la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
cible (target) : Niveau mesurable du rendement ou du succès qu’une organisation, un programme ou une initiative prévoit atteindre dans un délai précis. Une cible peut être quantitative ou qualitative.
crédit (appropriation) : Autorisation donnée par le Parlement d’effectuer des paiements sur le Trésor.
dépenses budgétaires (budgetary expenditures) : Les dépenses budgétaires comprennent les dépenses de fonctionnement et en capital; les paiements de transfert à d’autres ordres de gouvernement, à des organisations ou à des particuliers; les paiements à des sociétés d’État.
dépenses législatives (statutory expenditures) : Dépenses approuvées par le Parlement à la suite de l’adoption d’une loi autre qu’une loi de crédits. La loi établit l’objet des dépenses et les dispositions en vertu desquelles elles peuvent être engagées.
dépenses non budgétaires (non-budgetary expenditures) : Recettes et décaissements nets au titre de prêts, de placements et d’avances, qui modifient la composition des actifs financiers du gouvernement du Canada.
dépenses prévues (planned spending) : En ce qui a trait aux rapports sur les plans et priorités (RPP) et aux rapports ministériels sur le rendement (RMR), les dépenses prévues s’entendent des montants approuvés par le Conseil du Trésor au plus tard le 1er février. Elles peuvent donc comprendre des montants qui s’ajoutent aux dépenses prévues indiquées dans le budget principal des dépenses.
dépenses votées (voted expenditures) : Dépenses approuvées annuellement par le Parlement à la suite de l’adoption d’une loi de crédits. Le libellé du crédit constitue les dispositions qui régissent l’engagement de ces dépenses.
équivalent temps plein (full-time equivalent) : Indicateur de la mesure dans laquelle un employé représente une année-personne complète dans le budget ministériel. L’équivalent temps plein est calculé en fonction du coefficient des heures de travail assignées et des heures normales de travail. Les heures normales de travail sont établies dans les conventions collectives.
indicateur de rendement (performance indicator) : Moyen qualitatif ou quantitatif de mesurer un extrant ou un résultat en vue de déterminer le rendement d’une organisation, d’un programme, d’une politique ou d’une initiative par rapport aux résultats attendus.
médicament (medicine) : Toute substance ou mélange de substances fabriqué par quelque moyen biologique, chimique ou autre et qui est appliqué ou administré in vivo à des humains ou à des animaux pour faciliter le diagnostic, le traitement, l’atténuation ou la prévention d’une maladie, de symptômes, de troubles ou d’états physiques anormaux ou, encore, qui modifie des fonctions organiques chez les humains ou chez les animaux, sans égard à son mode d’administration. Il est entendu que cette définition du mot « médicament » comprend également les vaccins, les préparations topiques, les anesthésiques et les produits de diagnostic utilisés in vivo, sans égard au mode d’administration (p. ex. administration transdermique, gélule, solution injectable, inhalation, etc.). Cette définition exclut les appareils médicaux, les produits diagnostiques in vitro et les désinfectants non utilisés in vivo.
numéro d’identification du médicament (DIN) (drug identification number [DIN]) : Numéro d’identification que la Direction générale des produits de santé et des aliments de Santé Canada attribue à chaque produit médicamenteux vendu sous ordonnance ou en vente libre et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN est attribué en tenant compte des éléments suivants : le fabricant du produit, le ou les ingrédients actifs, la concentration du ou des éléments actifs, la forme pharmaceutique, la marque ou le nom commercial du produit et le mode d’administration.
plan (plan) : Exposé des choix stratégiques qui montre comment une organisation entend réaliser ses priorités et obtenir les résultats connexes. De façon générale, un plan explique la logique qui sous-tend les stratégies retenues et tend à mettre l’accent sur des mesures qui se traduisent par des résultats attendus.
priorités (priority) : Plans ou projets qu’une organisation a choisi de cibler et dont elle rendra compte au cours de la période de planification. Il s’agit de ce qui importe le plus ou qui doit être fait en premier pour appuyer la réalisation du ou des résultats stratégiques souhaités.
production de rapports sur le rendement (performance reporting) : Processus de communication d’information sur le rendement fondée sur des éléments probants. La production de rapports sur le rendement contribue à la prise de décisions, à la responsabilisation et à la transparence.
produit générique (generic product) : Produit médicamenteux ayant les mêmes ingrédients actifs, la même concentration et la même forme galénique qu’un produit médicamenteux d’origine.
produit médicamenteux (drug product) : Présentation d’un médicament qui se distingue par la forme pharmaceutique et la concentration des ingrédients actifs.
programme (program) : Groupe d’intrants constitué de ressources et d’activités connexes qui est géré pour répondre à des besoins précis et obtenir les résultats prévus, et qui est considéré comme une unité budgétaire.
programme temporisé (sunset program) : Programme ayant une durée fixe et dont le financement et l’autorisation politique ne sont pas permanents. Lorsqu’un tel programme arrive à échéance, une décision doit être prise quant à son maintien. Dans le cas d’un renouvellement, la décision précise la portée, le niveau de financement et la durée.
rapport ministériel sur le rendement (departmental performance report) : Rapport traitant des réalisations concrètes d’une organisation qui dépend de crédits parlementaires au regard des plans, des priorités et des résultats attendus exposés dans le rapport sur les plans et les priorités correspondant. Ce rapport est déposé au Parlement à l’automne.
rapport sur les plans et les priorités (Report on Plans and Priorities) : Rapport fournissant des renseignements au sujet des plans et du rendement prévu sur trois ans d’une organisation qui dépend de crédits parlementaires. Ce rapport est déposé au Parlement chaque printemps.
rendement (performance) : Utilisation qu’une organisation a faite de ses ressources en vue d’obtenir ses résultats, mesure dans laquelle ces résultats se comparent à ceux que l’organisation souhaitait obtenir, et mesure dans laquelle les leçons apprises ont été cernées.
résultat stratégique (Strategic Outcome) : Avantage durable et à long terme pour les Canadiens qui est rattaché au mandat, à la vision et aux fonctions de base d’une organisation.
résultats (results) : Conséquence externe attribuable en partie aux activités d’une organisation, d’une politique, d’un programme ou d’une initiative. Les résultats ne relèvent pas d’une organisation, d’une politique, d’un programme ou d’une initiative unique, mais ils s’inscrivent dans la sphère d’influence de l’organisation.
résultats du gouvernement du Canada (Government of Canada outcomes) : Ensemble de 16 objectifs généraux établis pour l’ensemble du gouvernement et regroupés en 4 secteurs de dépenses : affaires économiques, affaires sociales, affaires internationales et affaires gouvernementales.
structure de la gestion, des ressources et des résultats (Management, Resources and Results Structure) : Cadre exhaustif comprenant l’inventaire des programmes, des ressources, des résultats, des indicateurs de rendement et de l’information de gouvernance d’une organisation. Les programmes et les résultats sont présentés d’après le lien hiérarchique qui les unit, et les résultats stratégiques auxquels ils contribuent. La Structure de la gestion, des ressources et des résultats découle de l’architecture d’alignement des programmes.
Un ministère est censé être au courant des autorisations qu’il a demandées et obtenues. La détermination des dépenses prévues relève du ministère, et ce dernier doit être en mesure de justifier les dépenses et les augmentations présentées dans son RPP et son RMR.
Notes de fin de document
i Vous trouverez les priorités du mandat de la ministre dans la lettre de son mandat à : http://pm.gc.ca/fra/lettre-de-mandat-de-la-ministre-de-la-sante
ii Loi sur les brevets : http://laws-lois.justice.gc.ca/fra/lois/P-4/
iii Règlement sur les médicaments brevetés : http://laws-lois.justice.gc.ca/fra/reglements/DORS-94-688/
iv Vous trouverez plus de renseignements sur le Système national d’information sur l’utilisation des médicaments prescrits sur le site Web du CEPMB : http://www.pmprb-cepmb.gc.ca/fr/sniump/à-propos-du-sniump.
v Programme de recherche du SNIUMP, http://www.pmprb-cepmb.gc.ca/fr/sniump/programme-de-recherche
vi Comité consultatif du SNIUMP, http://www.pmprb-cepmb.gc.ca/fr/sniump/%C3%A0-propos-du-sniump
vii Modernisation des Lignes directrices du CEPMB – Document de discussion – Juin 2016, http://www.pmprb-cepmb.gc.ca/fr/nouvelles-et-activit%C3%A9s/consultations/grandes-consultations-actuelles/repenser-les-lignes-directrices/document-de-discussion
viii Plan stratégique 2015-2018, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1197&lang=fr
ix Lettre de mandat de la ministre http://pm.gc.ca/fra/lettre-de-mandat-de-la-ministre-de-la-sante
x Comptes publics du Canada 2016, http://www.tpsgc-pwgsc.gc.ca/recgen/cpc-pac/index-fra.html
xi Cadre pangouvernemental, http://www.tbs-sct.gc.ca/hgw-cgf/finances/rgs-erdg/wgf-ipp-fra.asp
xii 2015-2016 États financiers ministériels, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1280&lang=fr
xiii Ce pourcentage, fondé sur le nombre d’examens des prix effectués en date du 31 mars 2016, est calculé comme suit : la somme du nombre d’examens des prix dont les résultats respectent les Lignes directrices, plus le nombre d’examens des prix qui n’ont pas donné lieu à une enquête, plus le nombre d’engagements de conformité volontaire; divisé par le nombre total de produits pharmaceutiques brevetés en date du 31 mars 2016 moins le nombre de produits pharmaceutiques qui faisaient encore l’objet d’un examen.
xiv Affiches pour des conférences en 2016, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=472&lang=fr#postpresent
xv Règlement sur les propriétés de résistance à l’altération des drogues (RPRDA), http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1240
xvi Plan stratégique 2015-2018, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1197&lang=fr
xvii Génériques360 – Médicaments génériques au Canada, 2014, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1233&lang=fr
xviii Les régimes privés d’assurance-médicaments au Canada Partie I : Marché des médicaments génériques 2005-2013, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1200&lang=fr
xix L’Observateur des médicaments émergents, 7e livraison – Décembre 2015, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1199&lang=fr
xx CompasRx du SNIUMP, 1ère édition, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1159&lang=fr
xxi Résumé analytique CompasRx du SNIUMP, 1ère édition, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1167&lang=fr
xxii Le CEPMB a tenu 13 séances d’information sur 8 sujets différents (5 présentations liées au CompasRx). Deux de ces séances d’information comportaient quatre parties distinctes : premièrement, lors du Symposium de l’ACMTS, le CEPMB a fait un exposé oral et trois présentations par affiches et, deuxièmement, lors de la conférence de l’Association canadienne pour la recherche sur les services et les politiques de la santé (ACRSPS), il a fait trois exposés oraux et une présentation par affiches.
xxiii Stratégie ministérielle de développement durable 2015-2016, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1281&lang=fr
xxiv Audits internes et évaluations 2015-2016, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1279&lang=fr
xxv Rapport sur les dépenses fiscales fédérales, http://www.fin.gc.ca/purl/taxexp-fra.asp