Rapport final
Le 30 juin 2012
Présenté par :
Mira Svoboda, associée directrice
Beechwood Consulting and Research
Ellie Beals, dirigeante
Beals, Lalonde & Associates
Présenté à :
Marian Eagen et Pauline Lahey
Conseil d'examen du prix des médicaments brevetés
333, rue Laurier Ouest, bureau 1400
Ottawa (Ontario) K1P 1C1
Table des matières
Liste d’abbres
- ABS : Affectation à but spécial
- ACMTS : Agence canadienne des médicaments et des technologies de la santé
- CEPMB : Conseil d'examen du prix des médicaments brevetés
- EIP : Entente relative à l'inscription des produits
- ETP : Équivalent temps plein
- EVL : En vente libre (médicament)
- FPT : Fédéral, provincial et territorial
- GCMUH : Groupe consultatif sur les médicaments pour usage humain
- ICIS : Institut canadien d'information sur la santé
- IPC : Indice des prix à la consommation
- IPMB : Indice des prix des médicaments brevetés
- OCDE : Organisation de coopération et de développement économiques
- ONG : Organisation non gouvernementale
- PCEM : Programme commun d'évaluation des médicaments
- PD : Premier dirigeant
- RASE : Régime d'avantages sociaux des employés
- R-D : Recherche et développement
- RS&DE : Activités de recherche scientifique et de développement expérimental
- Rx&D : Les compagnies de recherche pharmaceutique du Canada (association industrielle)
- SC : Santé Canda
- SCT : Secrétariat du Conseil du Trésor
- SMR : Stratégie de mesure du rendement
- SNIUMP : Système national d'information sur l'utilisation des médicaments prescrits
Résumé
La présente évaluation
Objectifs
La présente évaluation aborde la pertinence et le rendement du Programme de réglementation du prix des médicaments brevetés et du Programme sur les tendances relatives aux produits pharmaceutiques, au cours de la période de 2008-2009 à 2011-2012. En plus des enjeux et des questions indiqués ci‑dessous, elle aborde la mesure dans laquelle une augmentation des ressources accordée par le Secrétariat du Conseil du Trésor en 2008-2009 a permis au CEPMB d'exécuter son mandat.
| Pertinence |
| Enjeu 1 : Besoin continu de programmes |
Évaluation de la mesure dans laquelle les programmes continuent de répondre à un besoin concret et d'être adaptés aux besoins des Canadiens. |
| Enjeu 2 : Harmonisation avec les priorités gouvernementales |
Évaluation des liens entre les objectifs des programmes et (i) les priorités du gouvernement fédéral et (ii) les résultats stratégiques ministériels. |
| Enjeu 3 : Harmonisation avec les rôles et responsabilités du gouvernement fédéral |
Évaluation des rôles et responsabilités du gouvernement fédéral dans le cadre de l'exécution des programmes. |
| Rendement |
| Enjeu 4 : Réalisation des résultats escomptés |
Évaluation des progrès réalisés dans l'atteinte des résultats escomptés par rapport aux objectifs de rendement et à la portée et conception des programmes. |
| Enjeu 5 : Démonstration d'efficience et d'économie |
Évaluation de l'utilisation des ressources relativement à la production des extrants et aux progrès réalisés dans l'atteinte des résultats escomptés |
Source : Stratégie de mesure du rendement du Conseil d'examen du prix des médicaments brevetés (janvier 2011).
Méthodologie
Les méthodologies employées pour effectuer une recherche évaluative comprenaient notamment :
- des entrevues réalisées auprès de 46 intervenants, dont les gestionnaires du CEPMB et les membres du Conseil, de même qu'avec des représentants d'organismes et d'associations de brevetés, des groupes de défense des droits des patients, des compagnies d'assurance-maladie, des gouvernements provinciaux et territoriaux, de Santé Canada et des chercheurs d'agences et de groupes de réflexion;
- un sondage effectué auprès des intervenants; des invitations ont été envoyées à 700 personnes, desquelles 74 réponses ont été reçues;
- un examen des documents et une analyse documentaire;
- une analyse des données sur le rendement du CEPMB.
Ces multiples champs d'enquête ont été utilisés afin d'obtenir un haut degré de confiance dans les constatations qui sont ressorties. Cependant, les résultats du sondage ont dû être traités avec circonspection parce que les résultats globaux étaient dominés par les brevetés. Cela ne posait pas de problème pour le Programme de réglementation, dont les brevetés constituent le principal public cible. C'était le cas par contre pour le Programme sur les tendances relatives aux produits pharmaceutiques, qui est conçu principalement pour les décideurs dont les intérêts sont souvent très différents de ceux des brevetés et qui y sont parfois opposés.
Pertinence
La pertinence d'un programme doit être évaluée en fonction de l'environnement dans lequel ce programme est exécuté. Ainsi, les changements qui se sont produits dans l'environnement depuis la mise en œuvre des programmes doivent être formulés et compris. D'importants changements ont été apportés dans l'environnement pharmaceutique au cours des trois à cinq dernières années, dont les suivants :
- la fin de l'ère des « médicaments vedettes » et l'émergence des médicaments génériques à faible coût lancés sur le marché à l'échéance des brevets liés aux médicaments vedettes;
- l'émergence de médicaments ou de traitements (souvent très coûteux) dans les marchés à créneaux;
- les coûts des médicaments à la hausse et les efforts actifs liés aux régimes d'assurance‑médicaments pour contrôler ces coûts;
- la mondialisation accrue;
- les changements survenus dans l'industrie pharmaceutique, notamment une transparence réduite des prix en conséquence de rabais consentis après l'achat.
Dans le cas du Programme de réglementation, les changements survenus dans l'environnement pharmaceutique ont eu des répercussions. Cependant, comme il est indiqué ci-dessous, les conséquences les plus importantes ont tendance à s'équilibrer les unes les autres, de sorte que le programme demeure pertinent :
- La hausse du nombre de médicaments génériques et les efforts provinciaux dynamiques visant à limiter les coûts ont réduit la pertinence du programme pour les personnes couvertes par un régime public. Toutefois, seulement 32 % des dépenses en matière de médicaments brevetés étaient couvertes par des régimes publics.
- L'émergence des médicaments très coûteux dans les marchés à créneaux a augmenté la nécessité et la pertinence du programme.
Le Programme sur les tendances relatives aux produits pharmaceutiques demeure lui aussi pertinent, mais il y aurait lieu d'accroître davantage sa pertinence. Parmi les facteurs qui contribuent le plus à réduire la pertinence de ce programme, soulignons le manque d'opportunité dans l'élaboration et la diffusion de produits d'information et les grandes préoccupations des brevetés quant au caractère approprié des aspects du programme prescrits par la loi (c.‑à‑d. faire rapport des dépenses de recherche-développement des brevetés).
Le Programme de réglementation et le Programme sur les tendances relatives aux produits pharmaceutiques peuvent tous les deux être exécutés par un organisme fédéral et cadrent bien avec les priorités gouvernementales et le résultat stratégique du CEPMB.
Réalisation des résultats : Le Programme de réglementation
Le Programme de réglementation a donné de bons résultats. La mesure dans laquelle le CEPMB a réalisé chacun des résultats escomptés du programme est indiquée en détail ci-dessous :
- Enrichir les connaissances et accroître la sensibilisation : Les efforts du CEPMB ont porté fruit en ce qui concerne ce résultat. Le CEPMB a pris de nombreuses mesures pour enrichir les connaissances et accroître la sensibilisation à l'égard de la Loi, du Règlement, des politiques et des Lignes directrices de même que des conséquences du non-respect. Une forte proportion des intervenants ont dit être satisfaits des efforts du CEPMB visant à approfondir leurs connaissances du cadre législatif, des Lignes directrices et des politiques et à accroître leur sensibilisation à cet égard.
- Respect du Règlement : Le CEPMB a atteint un niveau très élevé de succès dans la réalisation de ce résultat. On a observé un très haut degré de respect chez les brevetés au cours de la période d'évaluation.
- Clarté, transparence et prévisibilité : Le CEPMB a atteint un bon niveau de succès dans la réalisation de l'aspect clarté de ce résultat intermédiaire. Les intervenants étaient d'avis que le niveau de clarté offert par le CEPMB (explications et interprétations opportunes et cohérentes) était bon. Cependant, il conviendrait de simplifier les Lignes directrices et les procédures afin de les rendre plus transparentes. Ce manque de transparence a fait en sorte que l'industrie est moins en mesure de prévoir les résultats qui la touchent. Ainsi, le niveau de complexité actuel a nui à la capacité du CEPMB de réaliser pleinement le résultat visant à fournir à l'industrie un environnement de réglementation transparent et prévisible.
- Caractère raisonnable des Lignes directrices : Le CEPMB a connu un succès modéré dans la réalisation de ce résultat. Bien que les intervenants aient formulé de bons commentaires sur les Lignes directrices révisées, ils ont tout de même exprimé de grandes préoccupations devant le caractère approprié et (ou) la complexité des Lignes directrices révisées. Certaines de ces préoccupations découlent des aspects du mandat et de la méthodologie établis par la loi. Toutefois, il semble être possible et valorisant que le CEPMB cherche à simplifier davantage les Lignes directrices dans la mesure du possible.
- Prix non excessifs : Le CEPMB a connu beaucoup de succès dans la réalisation de son dernier résultat, soit celui de veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs, comme le précise la Loi.
Réalisation des résultats : Le Programme sur les tendances relatives aux produits pharmaceutiques
Le Programme sur les tendances relatives aux produits pharmaceutiques a connu beaucoup de succès dans la réalisation de certains de ses résultats escomptés et moins de succès relativement à d'autres.
- Accessibilité, exhaustivité, opportunité et exactitude : Les contraintes législatives ont fait en sorte que le CEPMB avait peu de contrôle sur l'accessibilité, l'exhaustivité, l'opportunité et l'exactitude des renseignements sur les dépenses de recherche-développement. Le CEPMB a sensiblement bien fait au chapitre de la fourniture de produits d'information accessibles, exhaustifs et exacts pour les produits qu'il peut contrôler, soit les produits du SNIUMP et les produits d'information sur les tendances relatives aux prix. Cependant, aucun de ces produits n'est présenté en temps opportun.
- Utilité des produits de recherche du CEPMB : Aucun des produits d'information du Programme sur les tendances relatives aux produits pharmaceutiques n'a été bien utilisé. Pour ce qui est des renseignements sur les dépenses de recherche-développement, les contraintes législatives sont encore une fois concernées. Dans le cas des produits du SNIUMP et des produits d'information sur les tendances relatives aux prix, la faible utilisation semble être fondée, du moins en partie, sur le manque de rapidité dans la présentation des produits; ces produits serviraient probablement mieux à l'élaboration de politiques et à la prise de décisions s'ils étaient présentés en temps plus opportun. Le fait qu'il y ait une tendance vers une utilisation accrue plutôt que réduite au cours des dernières années confirme cette probabilité.
- Sensibilisation à l'égard des tendances : Même si les intervenants soutiennent être très conscients des tendances dans le secteur pharmaceutique et en font preuve, les offres du Programme sur les tendances relatives aux produits pharmaceutiques ne semblent pas avoir contribué de façon importante à l'accroissement de cette sensibilisation.
Efficience et économie
Les constatations de l'évaluation viennent appuyer le niveau de financement actuel au chapitre des salaires et des dépenses d'exploitation du CEPMB. Selon ces constatations, le financement par reconduction approuvé par le Secrétariat du Conseil du Trésor en 2008 a été utilisé de manière convenable pour obtenir les résultats pour lesquels il a été autorisé.
En l'absence de programmes semblables auxquels pourraient être comparés les programmes du CEPMB, les seules conclusions valides que l'on peut tirer relativement à l'efficience et à l'économie des programmes évalués sont qu'aucune des données n'est préoccupante ou inquiétante. Rien n'indique que le CEPMB ne fonctionne pas d'une façon rentable. Bien qu'aucune analyse coûts-avantages officielle n'ait été effectuée dans le cadre de cette évaluation, des données empiriques indiquent un équilibre raisonnable des coûts-avantages.
Même si l'efficience opérationnelle semble être adéquate, il serait possible d'améliorer l'efficience interne du CEPMB en envisageant de simplifier les Lignes directrices et de les réviser plus souvent, et en réduisant les exigences en matière de rapport des brevetés de deux fois à une fois par année. En plus de simplifier les Lignes directrices, les constatations de l'évaluation suggèrent également qu'il serait approprié d'examiner de nouveau certains aspects méthodologiques des Lignes directrices afin de s'assurer qu'elles correspondent bien à l'environnement actuel dans lequel fonctionne le CEPMB.
Conclusions sommaires globales
Les conclusions sommaires globales présentées ci‑dessous proviennent des conclusions susmentionnées portant sur un sujet particulier. Ces conclusions sommaires abordent les principaux enjeux et questions d'évaluation indiqués plus tôt dans le résumé.
Pertinence
Pertinence continue des programmes du CEPMB
Le Programme de réglementation demeure pertinent. Bien que l'environnement pharmaceutique ait changé considérablement, le Programme de réglementation répond toujours aux besoins pour lesquels il a été créé.
Le Programme sur les tendances relatives aux produits pharmaceutiques demeure aussi pertinent, mais à un moindre degré que le Programme de réglementation. Sa pertinence réduite est attribuable en partie à l'évolution de l'industrie pharmaceutique, qui n'est plus conforme aux importants paramètres de programme comme la définition de recherche-développement. Un autre facteur important ayant contribué à cette réduction est le manque d'opportunité dans l'élaboration et la diffusion de produits.
Harmonisation avec les priorités gouvernementales et les rôles et responsabilités du gouvernement fédéral
Les deux programmes du CEPMB peuvent être exécutés par un organisme fédéral et cadrent bien avec les priorités gouvernementales et le résultat stratégique du CEPMB.
Rendement
Réalisation des résultats escomptés pour le Programme de réglementation
Le Programme de réglementation a donné de très bons résultats. Il a atteint un haut degré de conformité et a veillé à ce que les prix ne soient pas excessifs conformément aux critères législatifs. De plus, le programme a réussi à enrichir les connaissances et à accroître la sensibilisation des intervenants et à créer un environnement de réglementation que ces derniers perçoivent comme de plus en plus clair et transparent. La réussite du programme en ce qui concerne la prévisibilité de l'environnement est plus modérée, principalement parce que les Lignes directrices, qui ont été considérablement améliorées, doivent être davantage simplifiées.
Réalisation des résultats escomptés pour le Programme sur les tendances relatives aux produits pharmaceutiques
Le Programme sur les tendances relatives aux produits pharmaceutiques a connu beaucoup de succès dans certains aspects de ses activités. Compte tenu de la façon dont le programme a répondu aux besoins des décideurs pour lesquels il a été conçu, on constate qu'il a donné de bons résultats au chapitre de l'accessibilité, l'exhaustivité et l'exactitude des produits qu'il contrôlait – les extrants du SNIUMP et ceux se rapportant aux renseignements sur les tendances relatives aux prix. Toutefois, le programme n'a pas réalisé ces produits de manière suffisamment rapide pour les décideurs qui représentent le principal public de ces produits.
Le programme n'a pas réussi à produire des renseignements utilisés dans le cadre de l'élaboration de politiques et de la prise de décisions. C'est le manque de rapidité qui est visé dans ce cas, et il est probable que l'utilisation s'améliorera considérablement lorsque la question d'opportunité sera abordée.
Efficience et économie
Les constatations de l'évaluation viennent appuyer le niveau de financement actuel au chapitre des salaires et des dépenses d'exploitation du CEPMB. Le financement par reconduction pour 2008-2009 a été bien utilisé, ayant permis d'obtenir les résultats escomptés pour lesquels il a été approuvé. Bien qu'aucune analyse coûts-avantages officielle n'ait été entreprise, des données empiriques indiquent que les activités du CEPMB sont rentables.
Certains gains d'efficience et d'économie seront probablement réalisés en modernisant ou en rationalisant certains aspects des cadres opérationnels et méthodologiques du CEPMB. Le plus important parmi ces aspects est la simplification des Lignes directrices.
1. Introduction
1.1 Contexte
1.1.1 Mandat
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de modifications apportées à la Loi sur les brevets (la Loi), lesquelles ont été conçues pour fournir aux brevetés une plus longue période d'exclusivité du marché pendant la durée de leur brevet. D'autres modifications apportées à la Loi en 1993 ont effectivement établi qu'un breveté avait l'exclusivité du marché pour toute la durée de son brevet, sauf dans une situation d'urgence nationale, en plus d'augmenter les pouvoirs de redressement du CEPMB.
Le mandat du CEPMB comporte deux volets :
- Réglementation – Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs, protégeant ainsi les consommateurs et contribuant au système de soins de santé canadien.
- Rapport ‑ Faire rapport des tendances des prix de tous les médicaments et des dépenses de recherche-développement (R-D) des brevetés pharmaceutiques, contribuant ainsi à la prise de décisions éclairées et à l'élaboration de politiques.
1.1.2 Compétence
a. La fonction de réglementation
En vertu de la Loi et du Règlement sur les médicaments brevetés, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté sur le marché canadien et faire rapport des renseignements pertinents relatifs aux prix et aux ventes. Le CEPMB veille à ce que les prix moyens auxquels les brevetés vendent leurs produits médicamenteux brevetés pour usage humain et pour usage vétérinaire distribués sous ordonnance ou en vente libre aux grossistes, aux hôpitaux, aux pharmacies et autres clients au Canada ne soient pas excessifs. Afin de trancher cette question, le personnel de la Direction de la réglementation et de la liaison auprès des brevetés examine les renseignements présentés par les brevetés afin de veiller à ce que les prix auxquels ces derniers vendent leurs produits respectent le cadre réglementaire.
Bien qu'ils ne soient pas tenus de faire approuver au préalable par le CEPMB les prix de vente de leurs médicaments brevetés, les brevetés doivent observer les dispositions de la Loi pour s'assurer que les prix de leurs médicaments brevetés vendus au Canada ne sont pas considérés comme excessifs. Lorsque le CEPMB conclut, à l'issue d'une audience publique, que le prix d'un médicament vendu sur un marché canadien est excessif, il peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu'il a tirées de la vente de son produit.
b. La fonction de rapport
En vertu de l'article 88 de la Loi, les brevetés pharmaceutiques sont tenus de déclarer au CEPMB leurs dépenses de recherche-développement pour l'année. L'article 90 de la Loi permet au ministre de la Santé de demander que d'autres enquêtes soient entreprises par le CEPMB.
Le CEPMB rend compte chaque année au Parlement, par le truchement du ministre de la Santé, des tendances pharmaceutiques observées et des dépenses de recherche-développement. Les rapports sur les dépenses de recherche-développement sont destinés aux décideurs du gouvernement.
Au moyen du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB prépare, en collaboration avec les intervenants fédéraux, provinciaux et territoriaux et l'Institut canadien d'information sur la santé (ICIS), des analyses critiques sur les tendances relatives aux prix, à l'utilisation et aux coûts des médicaments brevetés et non brevetés distribués sous ordonnance. Le CEPMB publie également des rapports particuliers du SNIUMP fondés sur les priorités en matière de recherche précisées par le Comité directeur du SNIUMP, dont les membres sont des représentants des régimes publics d'assurance-médicaments provinciaux et territoriaux et de Santé Canada.
Le CEPMB vise, par le biais de ses études et de ses analyses sur les tendances des prix des produits pharmaceutiques, à contribuer à l'élaboration éclairée de politiques en matière de santé à l'échelle fédérale et provinciale.
1.1.3 Structure organisationnelle et programmes
Le Conseil est formé d'au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi, le président du Conseil assume également les fonctions de chef de la direction du CEPMB et, à ce titre, assure la supervision et la direction des activités du Conseil.
La directrice exécutive assure la gouverne générale des activités du CEPMB et avise le Conseil. Elle supervise le travail des employés du Conseil et en assume le leadership.
L'équipe de la haute direction relève de la directrice exécutive et se compose des membres suivants : la directrice de la Direction de la réglementation et de la liaison auprès des brevetés, le directeur de la Direction des politiques et de l'analyse économique, la directrice de la Direction des services généraux, la directrice du Secrétariat du Conseil et communications et la directrice des Services juridiques et avocate générale.
La Direction de la réglementation et de la liaison auprès des brevetés est responsable du volet opérationnel du Programme de réglementation du prix des médicaments brevetés (le Programme de réglementation). La Direction fait l'examen des prix des produits médicamenteux brevetés pour s'assurer qu'ils ne sont pas excessifs. Elle encourage en outre les brevetés à se conformer volontairement aux Lignes directrices du Conseil, veille à la bonne application des politiques de conformité et fait enquête sur les plaintes reçues concernant les prix de certains produits médicamenteux brevetés. De plus, la Direction sensibilise les brevetés sur les Lignes directrices du Conseil et les informe de leurs obligations en matière de présentation de rapports.
La Direction des politiques et de l'analyse économique est responsable des politiques et de l'analyse économique liées au Programme de réglementation du prix des médicaments brevetés, dont la tenue à jour des Lignes directrices qui délimitent l'examen scientifique, l'examen des prix et les processus d'enquête, la tenue d'analyses des politiques, la transmission de conseils en matière de politique et la préparation d'analyses économiques. La Direction se charge également de la majorité des activités liées à la deuxième activité de programme du CEPMB, soit le Programme sur les tendances relatives aux produits pharmaceutiques, qui consiste à faire rapport des analyses susmentionnées. La Direction des services juridiques fournit des opinions juridiques au CEPMB et dirige l'équipe de la poursuite dans les audiences du Conseil.
Le Secrétariat du Conseil et le groupe des Communications gèrent les réunions et les audiences du Conseil, dont les dossiers de procédure, à l'appui des panels d'audience. La Direction planifie et orchestre également le programme des communications du CEPMB, les relations avec les médias et le suivi aux demandes de renseignements du grand public, y compris la production de la publication trimestrielle du CEPMB, le rapport annuel et les rapports sur les tendances relatives aux produits pharmaceutiques.
La Direction des services généraux offre des conseils et des services en matière de gestion, tout en s'occupant de la planification stratégique et financière de même que des rapports, des ressources humaines, de la gestion de l'information et des services technologiques.
Les deux programmes du CEPMB sont décrits en détail dans la Stratégie de mesure du rendement du Conseil d'examen du prix des médicaments brevetés. Les modèles logiques compris dans ce document figurent à l'annexe A du présent rapport.
1.1.4 Ressources affectées aux programmes
Le budget total affecté au CEPMB pour les quatre exercices allant de 2008-2009 à 2011-2012, à l'exclusion de l'affectation à but spécial (ABS), des régimes d'avantages sociaux des employés (RASE) et des loyers, s'élève à 33,4 M$, dont :
- une somme de 15,5 M$ affectée au Programme de réglementation;
- une somme de 5,7 M$ affectée au Programme sur les tendances relatives aux produits pharmaceutiques;
- une somme de 12,2 M$ affectée aux internes1
Les fonds de l'ABS disponibles varient de 2,2 M$ en 2008-2009 à 3,1 M$ en 2010-2011 et au-delà. Le budget total affecté à l'ABS au cours de la même période est de 10,9 M$. La capacité de tenir des audiences publiques au besoin est une composante fondamentale du mandat et des pouvoirs du CEPMB. En raison de la difficulté à prévoir le nombre d'audiences et leur complexité pour une année donnée, les montants se rapportant aux coûts externes des audiences (conseiller juridique, témoins experts, etc.) sont inscrits dans l'ABS afin qu'ils soient strictement réservés à cette fin. Tout montant non utilisé pour la fin prévue devient périmé à la fin de l'année et doit être retourné au Trésor.
Le tableau 1.1 présente un sommaire du budget total du CEPMB et de chacun de ses trois secteurs d'activité pour les exercices allant de 2008-2009 à 2011‑2012. Une comparaison plus détaillée du budget total du CEPMB et de ses dépenses réelles est fournie à l'annexe B.
Tableau 1.1 Budget du CEPMB par secteur d'activité, de 2008-2009 à 2011-2012
| |
2008-2009 |
2009-2010 |
2010-2011 |
2011-2012 |
| Programmes |
ETP |
Budget |
ETP |
Budget |
ETP |
Budget |
ETP |
Budget |
| Exploitation et salaires |
|
|
|
|
|
|
|
|
| Services internes |
16,8 |
3 121 930 |
18 |
2 768 801 |
19 |
3 255 564 |
19 |
3 060 060 |
| Tendances relatives aux produits pharmaceutiques |
16,0 |
1 760 454 |
13 |
1 451 789 |
13 |
1 307 925 |
13 |
1 130 946 |
| Conformité et application |
37,8 |
3 412 232 |
45 |
4 260 400 |
44 |
3 941 648 |
44 |
3 890 635 |
| Total de l'exploitation et des salaires |
70,6 |
8 294 616 |
76 |
8 480 990 |
76 |
8 505 137 |
76 |
8 081 641 |
| Affectation à but spécial |
|
2 200 000 |
|
2 500 000 |
|
3 100 000 |
|
3 100 000 |
| Total pour le CEPMB |
70,6 |
10 494 616 |
76 |
10 980 990 |
76 |
11 605 137 |
76 |
11 181 641 |
Source : Données financières du CEPMB, mai 2012.
1.1.5 Gouvernance
Le CEPMB rend compte au Parlement par le truchement du ministre de la Santé. Le ministre de la Santé est responsable de l'application des dispositions de la Loi relatives aux produits pharmaceutiques prévues aux articles 79 à 103. Le CEPMB fait partie du portefeuille de la Santé, qui est également constitué de Santé Canada, de l'Agence de la santé publique du Canada, des Instituts de recherche en santé du Canada, du Conseil de contrôle des renseignements relatifs aux matières dangereuses et de l'Agence canadienne de contrôle de la procréation assistée. Le portefeuille de la Santé aide le ministre de la Santé à maintenir et à améliorer la santé des Canadiens. Le CEPMB contribue au résultat stratégique du gouvernement fédéral, « Canadiens en santé ».
Bien qu'il fasse strictement parlant partie du portefeuille de la Santé, le CEPMB exerce son mandat en toute indépendance vis-à-vis du ministre de la Santé. Il fonctionne également de façon indépendante d'autres organismes qui font partie du portefeuille global de la Santé.
Les membres du Conseil sont collectivement responsables de la mise en œuvre des dispositions applicables de la Loi. Ensemble, ils établissent les Lignes directrices, les règles, les règlements administratifs et les autres politiques du Conseil comme le prévoit la Loi et consultent au besoin des intervenants, y compris les ministres de la Santé provinciaux et territoriaux et les représentants de groupes de consommateurs, l'industrie pharmaceutique et d'autres personnes.
1.1.6 Intervenants
Parmi les principaux intervenants du CEPMB, on compte :
- les consommateurs;
- l'industrie pharmaceutique (en particulier les sociétés qui vendent des médicaments brevetés au Canada, qu'elles soient dans les secteurs des médicaments de marque, génériques ou biotechnologiques);
- les régimes publics d'assurance-médicaments provinciaux, territoriaux et fédéraux;
- des compagnies d'assurance-maladie privées;
- les grossistes, pharmacies et hôpitaux;
- les ONG, notamment (sans s'y limiter), les groupes de défense des droits des patients (comme Patients Canada, la Coalition canadienne de la santé, la Best Medicines Coalition, l'Association canadienne du diabète), les personnes handicapées et les aînés;
- les chercheurs et groupes de réflexion (p. ex., l'Institut Fraser, le Centre canadien de politiques alternatives, le Consortium de recherche en politiques pharmaceutiques);
- les parlementaires, à qui le CEPMB rend compte par le truchement du ministre de la Santé;
- les gouvernements étrangers et des organisations internationales telles que l'Organisation de coopération et de développement économiques (OCDE), qui, par le passé, ont parfois intégré les constatations et analyses du Programme sur les tendances relatives aux produits pharmaceutiques dans leur processus décisionnel.
1 Les services internes englobent des groupes d'activités et de ressources connexes gérés de façon à répondre aux besoins des programmes et autres obligations générales d'une organisation. Ces groupes sont les suivants : services de gestion et de surveillance, services des communications, services juridiques, services de gestion des ressources humaines, services de gestion financière, services de gestion de l'information, services de technologie de l'information, services des biens immobiliers, services du matériel, services des acquisitions et services de voyages et autres services administratifs. Les services internes comprennent uniquement les activités et les ressources destinées à l'ensemble d'une organisation et non celles fournies à un programme particulier.
2. La présente évaluation
2.1 Besoin de la présente évaluation
En 2008-2009, le Secrétariat du Conseil du Trésor (SCT), après avoir financé la charge de travail accrue du CEPMB au moyen du Fonds pour l'intégrité des programmes pendant deux ans, a approuvé un financement permanent supplémentaire d'environ 6 millions de dollars par année afin de permettre au Conseil de réaliser des activités jugées essentielles au mandat du CEPMB. L'approbation du SCT comprenait une condition exigeant qu'une évaluation soit menée au cours de l'exercice 2011-2012 afin d'évaluer la mesure dans laquelle l'augmentation des ressources a permis au CEPMB d'exécuter plus efficacement son mandat.
2.2 Portée des travaux
La présente évaluation porte sur la pertinence et le rendement du Programme de réglementation du prix des médicaments brevetés et du Programme sur les tendances relatives aux produits pharmaceutiques, au cours de la période de 2008-2009 à 2011-2012. Des renseignements détaillés sur le plan d'évaluation pour cette étude figurent dans la Stratégie de mesure du rendement du Conseil d'examen du prix des médicaments brevetés (janvier 2011). Bien qu'aucune partie du financement supplémentaire du SCT décrit ci-dessus n'ait visé les efforts liés au SNIUMP du CEPMB, ce travail a tout de même été abordé dans cette évaluation afin de tirer une évaluation plus complète du rendement du CEPMB au cours des dernières années.
En octobre 2011, le Groupe des services généraux du CEPMB (le chargé de projet) a conclu un marché avec les dirigeants de Beechwood Consulting et de Beals, Lalonde & Associates pour la réalisation de la présente évaluation. L'évaluation a été menée conformément à la Politique sur l'évaluation et à la Directive sur la fonction d'évaluation du Secrétariat du Conseil du Trésor, qui sont entrées en vigueur le 1er avril 2009. Selon les exigences du Conseil du Trésor, les évaluations du gouvernement fédéral doivent aborder la pertinence et le rendement. Le tableau ci-dessous indique les cinq principaux enjeux qui ont été abordés dans le cadre de l'évaluation.
Tableau 2.1 Principaux enjeux et questions d'évaluation
| Pertinence |
| Enjeu 1 : Besoin continu de programmes |
Évaluation de la mesure dans laquelle les programmes continuent de répondre à un besoin concret et d'être adaptés aux besoins des Canadiens. |
| Enjeu 2 : Harmonisation avec les priorités gouvernementales |
Évaluation des liens entre les objectifs des programmes et (i) les priorités du gouvernement fédéral et (ii) les résultats stratégiques ministériels. |
| Enjeu 3 : Harmonisation avec les rôles et responsabilités du gouvernement fédéral |
Évaluation des rôles et responsabilités du gouvernement fédéral dans l'exécution des programmes. |
| Rendement |
| Enjeu 4 : Réalisation des résultats escomptés |
Évaluation des progrès réalisés dans l'atteinte des résultats escomptés par rapport aux objectifs de rendement et à la portée et conception des programmes. |
| Enjeu 5 : Démonstration de l'efficience et de l'économie |
Évaluation de l'utilisation des ressources relativement à la production des extrants et aux progrès réalisés dans l'atteinte des résultats escomptés |
Source : Stratégie de mesure du rendement du Conseil d'examen du prix des médicaments brevetés (janvier 2011).
L'équipe d'évaluation a travaillé de concert avec le chargé de projet pour mettre à jour la matrice d'évaluation comprise dans la Stratégie de mesure du rendement du Conseil d'examen du prix des médicaments brevetés en vue d'obtenir la matrice figurant à l'annexe C.
Le public principal escompté à qui s'adresse ce rapport d'évaluation comprend notamment :
- la présidente, les membres du Conseil et le personnel du CEPMB;
- le Secrétariat du Conseil du Trésor, qui a été consulté lors de l'étape d'orientation de l'étude afin de veiller à ce que ses attentes soient prises en compte dans la planification et la réalisation de l'étude;
- Santé Canda.
2.3 Méthodologie
Cette évaluation comportait de multiples sources de données. Cette approche favorise l'examen des enjeux d'évaluation à partir de divers points de vue et l'utilisation de diverses méthodes de collecte de données et d'analyse, en plus d'être conforme aux normes du Conseil du Trésor en matière d'évaluation. L'utilisation de sources et de méthodes multiples assure une évaluation plus complète qui permettrait un meilleur degré de confiance à l'égard des résultats. Dans les chapitres 3 à 6 du présent rapport, les constatations de tous les champs d'enquête sont reliées afin de donner une analyse équilibrée. La combinaison des données qualitatives et quantitatives établit de solides assises qui viennent appuyer les conclusions et les recommandations.
2.3.1 Entrevues
Les entrevues avec les intervenants ont contribué à une compréhension nuancée des perceptions et des avis des personnes qui ont joué un rôle important ou qui ont eu beaucoup d'expérience avec le CEPMB ou encore qui en sont touchées. Un guide d'entrevue distinct a été élaboré pour chacune des catégories de personne interrogée énumérées ci-dessous. Au total, 46 entrevues ont été menées auprès des catégories suivantes :
- membres du Conseil (actuels et anciens), cadres supérieurs et employés sélectionnés du CEPMB (9);
- représentants d'organismes de brevetés (11);
- représentants de groupes de défense des droits des consommateurs et des patients (5);
- représentants de compagnies d'assurance-maladie privées (3);
- représentants des gouvernements provinciaux et territoriaux et représentants de Santé Canada (14);
- chercheurs d'agences et de groupes dont l'utilisation des produits de recherche du CEPMB est prévue (4).
Les catégories de personne interrogée sont plutôt artificielles puisque de nombreuses personnes interrogées pouvaient appartenir à plus d'une des catégories susmentionnées. Dans les cas où les personnes interrogées choisissaient elles-mêmes plus d'une catégorie, on leur demandait d'indiquer la catégorie qui les désigne le mieux.
Le guide d'entrevue général, qui présente les questions que chaque catégorie de personne interrogée devait aborder, figure à l'annexe D du présent rapport.
2.3.2 Sondage auprès des intervenants
Un sondage électronique a été élaboré dans le but de recueillir des données auprès des intervenants. Le questionnaire de sondage, qui figure à l'annexe E du présent rapport, renfermait des questions ouvertes et fermées permettant d'aborder les questions soulevées dans le cadre de ce projet. Il a en outre fait l'objet d'évaluations préalables et a été peaufiné au fur et à mesure avant que des répondants éventuels ne soient invités à y participer.
Les invitations à participer au sondage ont été envoyées par courriel à environ 700 personnes, parmi lesquelles 74 (environ 10%), réparties selon les catégories suivantes, se sont livrées au sondage :
- 39 brevetés ou organismes représentant les brevetés;
- 4 organismes de défense des droits des consommateurs et (ou) des patients;
- 7 prestataires des régimes d'assurance-médicaments provinciaux, territoriaux ou fédéraux;
- 8 chercheurs membres de groupes de réflexion, d'universités, et autres;
- 16 autres personnes soi-disant consultants, avocats et pharmaciens.
2.3.3 Examen des documents et analyse documentaire
L'examen des documents effectué pendant l'évaluation a aidé les évaluateurs à acquérir une meilleure connaissance du CEPMB et à aborder un grand nombre de questions d'évaluation. Les documents examinés ont été recueillis auprès du CEPMB, des personnes interrogées de même que d'un ensemble de recherches ciblées dans Internet.
La bibliographie qui figure à l'annexe F du présent rapport fournit une liste de tous les documents examinés dans le cadre de cette étude. Les évaluateurs ont rédigé un document technique et de travail dans lequel des résumés ou des extraits de documents adaptés aux questions précises de l'évaluation ou aux indicateurs de rendement ont été tenus à jour.
2.3.4 Analyse des données sur le rendement du CEPMB
Le CEPMB dispose d'une Stratégie de mesure du rendement (SMR) qui a été mise au point en janvier 2011 et qui a été mise en œuvre, ou est en voie de l'être, par la plupart des directions du CEPMB. Comme la SMR n'a été mise au point que tout récemment, elle n'a entraîné que des données limitées sur la mesure du rendement. Cependant, la SMR a été considérablement appuyée par les données fournies dans les rapports annuels du CEPMB et (ou) dans un large éventail d'autres documents du CEPMB énumérés dans la bibliographie ainsi que par les données tenues à jour et fournies par les différents secteurs d'activité du CEPMB.
2.3.5 Contraintes et limites méthodologiques
Toutes les parties à la présente évaluation ont reconnu dès le début que le nombre de personnes interrogées et de participants au sondage serait trop faible pour établir une validité statistique réelle, que ce soit pour le groupe dans son ensemble ou des catégories qui en font partie. Cela ne rend pas inutile la valeur des renseignements recueillis. L'un des avantages des multiples sources de données est que cela accorde un meilleur niveau de confiance lorsque différentes sources de données produisent des renseignements uniformes et adéquats. Pour la présente étude, on prévoyait que l'ensemble des commentaires provenant des entrevues et des sondages fournirait un degré de confiance raisonnable aux commentaires reçus.
Cette prévision s'est avérée exacte pour le Programme de réglementation. Toutefois, les réponses au sondage provenaient principalement des brevetés, ce qui a ainsi faussé les résultats pour le Programme sur les tendances relatives aux produits pharmaceutiques (Programme sur les TPP) du fait qu'il vise les décideurs du gouvernement et non les brevetés. Étant donné que ces deux groupes (décideurs du gouvernement et brevetés) peuvent avoir des priorités contradictoires, les commentaires globaux du sondage portant sur le Programme sur les TPP doivent être interprétés avec circonspection.
En ce qui concerne les catégories de personnes interrogées et de répondants autres que les brevetés et les représentants des gouvernements FPT, le nombre très faible de réponses pourrait dénoter un manque de rapport entre ces groupes et le CEPMB, peut-être parce que le Programme de réglementation du prix du CEPMB n'influe pas directement sur ces groupes. Cette question sera étudiée à fond dans la mesure du possible et au besoin dans les chapitres qui suivent.
2.4 Le présent rapport
Le reste du rapport est organisé comme indiqué ci-dessous. Dans chacun des chapitres 3, 4, 5 et 6, les constatations pertinentes sont présentées d'abord, puis les conclusions tirées de ces constatations terminent le chapitre.
- Chapitre 3 – Pertinence : Évalue la mesure dans laquelle les deux programmes du CEPMB demeurent pertinents et nécessaires, et la mesure dans laquelle ils cadrent avec les priorités du gouvernement et des organismes de même qu'avec les rôles et responsabilités du gouvernement fédéral.
- Chapitre 4 – Réalisation des résultats ‑ Programme de réglementation : Évalue la mesure dans laquelle le Programme de réglementation a réalisé les résultats escomptés du programme.
- Chapitre 5 – Réalisation des résultats ‑ Programme sur les tendances relatives aux produits pharmaceutiques : Évalue la mesure dans laquelle le Programme sur les TPP a réalisé les résultats escomptés du programme.
- Chapitre 6 – Efficience et économie : Évalue l'efficience et l'économie du rendement des deux programmes.
- Chapitre 7 – Conclusions sommaires : Les réponses sommaires aux principaux enjeux et questions d'évaluation sont présentées. Ce chapitre permet également de déterminer un certain nombre d'enjeux qui pourraient faire l'objet d'un examen par le CEPMB à mesure que ce dernier donne suite au présent rapport d'évaluation.
3. Pertinence
Le présent chapitre porte sur les enjeux et les questions d'évaluation liés au besoin continu du CEPMB et de ses principaux programmes – le Programme de réglementation du prix des médicaments brevetés et le Programme sur les tendances relatives aux produits pharmaceutiques.
3.1 Changements dans l'environnement
L'environnement des produits médicamenteux brevetés est complexe et global, et a évolué rapidement au cours des dernières années. La convergence des données provenant des entrevues menées auprès des intervenants et de l'analyse documentaire ont permis de constater un certain nombre de changements importants qui se sont produits au cours des dernières années, y compris les suivants :
- Fin des médicaments vedettes et émergence des médicaments génériques : Depuis quelques années, les brevets de certains « médicaments vedettes »2 les plus vendus ont commencé d'arriver à échéance, ouvrant la voie à une concurrence intensifiée au chapitre des versions génériques moins coûteuses. Cela a été cité par la plupart des personnes interrogées du CEPMB et par plusieurs autres personnes interrogées comme un important facteur ayant alimenté le changement. Un grand nombre de ces personnes interrogées ont décrit cette chute des brevets comme le facteur ayant déclenché l'émergence des médicaments génériques moins coûteux comme solution de rechange aux médicaments de marque dont les brevets arrivent à échéance.
- Émergence des médicaments pour les marchés à créneaux : On a également constaté récemment une émergence de produits médicamenteux très coûteux de même que des tests et un traitement plus ciblés pour des maladies plus rares. Les produits de marché à créneaux comprennent (sans toutefois s'y limiter) les produits biologiques et les produits à petites molécules, les enzymes, les préparations injectables et les vaccins. Cela a été souligné par la majorité des personnes interrogées au CEPMB, les représentants fédéraux, provinciaux et territoriaux et par plusieurs autres.
- Augmentation du coût des médicaments et réponses des régimes d'assurance-médicaments : Le coût élevé des médicaments dans les marchés à créneaux aggrave les conséquences démographiques décrites dans le rapport intitulé Prix et accès des médicaments génériques au Canada : Quelles sont les répercussions? (2010)3 : « En raison du vieillissement de la population et du nombre grandissant de personnes atteintes de maladies chroniques multiples, beaucoup plus de Canadiens auront besoin de médicaments d'ordonnance à l'avenir. ». Ce changement démographique ainsi que les tendances et les changements relatifs au niveau d'utilisation dans la combinaison thérapeutique comptent probablement parmi les facteurs essentiels découlant de l'augmentation du coût des médicaments, comme l'indique La Stratégie nationale relative aux produits pharmaceutiques : Rapport d'étape (juin 2006)4 : « Exception faite des soins hospitaliers, ce sont les médicaments pour lequel (sic.) le Canada dépense le plus dans le système de santé. Depuis l'an 2000, le total des dépenses publiques et privées pour des médicaments d'ordonnance a progressé d'environ 12 p. cent par année. Cette ascension rapide des coûts des médicaments menace la viabilité même des programmes d'assurance médicaments publics. » Ces constatations de recherche sont également reprises dans le rapport de l'ICIS intitulé Dépenses en médicaments au Canada, de 1985 à 2011 dans lequel on indique que les dépenses en médicaments auraient augmenté, pour passer de 9,5 % en 1985 à 16,2 % en 20105. Cette référence correspond aux commentaires de la majorité des personnes interrogées qui sont des brevetés, qui ont cité les efforts dynamiques déployés à l'égard des formulaires pour limiter les coûts (en particulier en ce qui concerne les médicaments génériques) comme un autre changement important dans l'environnement.
- Mondialisation accrue : Plusieurs brevetés ont également repéré le ralentissement du secteur manufacturier comme un changement important, du fait des fusions ayant donné lieu à un moins grand nombre de fabricants et de brevetés de plus grande taille, dont la plupart sont internationaux. Certains parmi eux ont fait un lien entre cela et l'incidence de la mondialisation accrue, comme le souligne un document de l'OCDE intitulé Les prix des médicaments sur un marché global : politiques et enjeux6, « [l]e marché des produits pharmaceutiques se mondialise de plus en plus, les pratiques commerciales et stratégiques venant compliquer la segmentation et la différenciation des prix selon les pays correspondante, notamment en Europe, où les multinationales ont imposé à leurs filiales de fixer leurs prix dans une fourchette déterminée ».
- Changements dans l'industrie pharmacologique et transparence réduite des prix : Un certain nombre de personnes interrogées ont également cité l'évolution de la façon dont les pharmacies fonctionnent comme un changement important dans l'environnement, et l'un qui a réduit la transparence des prix. Ils faisaient allusion le plus souvent à des ententes de rabais conclues entre des fabricants et des pharmacies, ce qui n'influe aucunement sur les prix inscrits en raison du rabais étant accordé après l'achat. Cela a été souligné par la majorité des enquêtés fédéraux, provinciaux et territoriaux de même que par plusieurs brevetés. Les personnes interrogées ont également constaté l'utilisation accrue d'ententes relatives à l'inscription des produits (EIP) qui se négocient entre les fabricants et les régimes d'assurance-médicaments provinciaux.
3.2 Pertinence du Programme de réglementation
Les conséquences des changements susmentionnés sont bien décrites dans deux extraits probants provenant de l'analyse documentaire :
- « … le Canada est aux prises avec le défi d'optimiser les avantages des médicaments d'ordonnance pour les Canadiennes et Canadiens, tout en composant avec les risques et les complexités associés à ce secteur à évolution rapide. »7
- « L'importance de contenir les coûts des médicaments à long terme ne devrait pas être sous-estimée, vu les prévisions des effets de l'évolution démographique sur la consommation de médicaments. »8
Cela suggère que le Programme de réglementation demeure pertinent. Les réalités des responsabilités fédérales et provinciales en ce qui concerne les soins de santé confirment cette pertinence. Sous le régime du système fédéral des soins de santé, chaque province a sa propre liste de médicaments et chaque régime provincial est libre de négocier les prix directement avec les fabricants de médicaments. Toutefois, le pouvoir de négociation des provinces varie selon leur taille, les grandes provinces étant en meilleure mesure de négocier que les petites provinces. Selon les constatations qui ressortent des entrevues, le CEPMB assume une importante fonction de réglementation à l'égard des petites provinces, même dans le contexte des régimes qui souhaitent négocier les prix des médicaments directement avec les fabricants. En fait, certaines personnes interrogées ont signalé que les prix du CEPMB sont souvent utilisés par les provinces comme point de départ dans le cadre des négociations de leurs ententes relatives à l'inscription des produits (EIP) avec les fabricants.
La majorité des personnes interrogées appuyaient la pertinence du Programme de réglementation, même si une partie de cet appui était mitigée :
- Sur 44 personnes interrogées, 12 ont affirmé leur appui plus ou moins sans réserve envers à la nécessité de maintenir la réglementation au niveau fédéral et de déterminer le caractère approprié de cette réglementation. Cet appui était plus marqué chez les enquêtés des catégories des gouvernements fédéral, provinciaux et territoriaux et des groupes de défense des droits des patients et moins marqué chez les brevetés.
- Quelques personnes interrogées étaient d'avis que le programme est plus pertinent que jamais en raison de l'émergence de produits de marché à créneaux onéreux comme les produits biologiques.
- D'autres croient que la fonction de réglementation est moins pertinente que par le passé en raison de succès qu'ont eu les régimes publics par rapport à la limitation des coûts, mais qu'elle demeure très pertinente pour ceux qui ne sont pas couverts par des régimes publics. Selon le rapport intitulé Incidence de la réglementation fédérale des prix des médicaments brevetés9, il s'agit d'un grand groupe. Il rapporte que :
- 32 % des dépenses totales relatives aux médicaments brevetés sont publiques;
- 56 % sont couvertes par des tiers payeurs et des régimes d'avantages sociaux des employés;
- 12 % sont assumées par des clients qui paient eux-mêmes.
Quelques personnes interrogées, réparties dans toutes les catégories d'intervenants, étaient d'avis que le Programme de réglementation était moins pertinent ou remis en cause par les préoccupations concernant le caractère approprié de l'ensemble des pays de comparaison (dont la fourchette des prix était, selon elles, trop étroite) et l'incidence de la mondialisation. Elles étaient en outre d'avis que les fabricants internationaux tiraient avantage de ces facteurs lors de lancer des médicaments sur le marché. Une étude de l'OCDE10 a fait remarquer qu', « [a]lors que même la mondialisation de leurs marchés réduisait les possibilités […], les fabricants ont apporté une réponse stratégique. Face à l'utilisation de prix de référence externes, ils ont choisi de lancer leurs produits en premier lieu dans des pays où ils sont en mesure d'en fixer les prix librement ou de négocier des prix relativement élevés […], de retarder ces lancements ou d'y renoncer dans les pays où les prix sont plus faibles, et de conserver des prix catalogue artificiellement élevés même lorsqu'ils sont enclins à consentir des ristournes confidentielles ».
Les commentaires des répondants correspondaient sensiblement aux opinions des personnes interrogées. Dans l'ensemble, les répondants croient qu'il est nécessaire d'avoir un programme qui veille à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés ne soient pas excessifs. Toutefois, les opinions provenant, d'un côté, des brevetés (c.-à-d. les personnes réglementées) et d'autres groupes de répondants et, de l'autre côté, d'autres groupes de répondants étaient clairement partagées, indiquant le grand besoin d'un tel programme. Les répondants s'étant identifiés comme appartenant à la catégorie des chercheurs ont indiqué qu'il y existe un « grand besoin » [Traduction] d'un tel programme, tout comme l'ont fait remarquer les représentants de régimes d'assurance-médicaments FPT. La figure 3.1 ci-dessous présente un sommaire des résultats du sondage pour cette question.
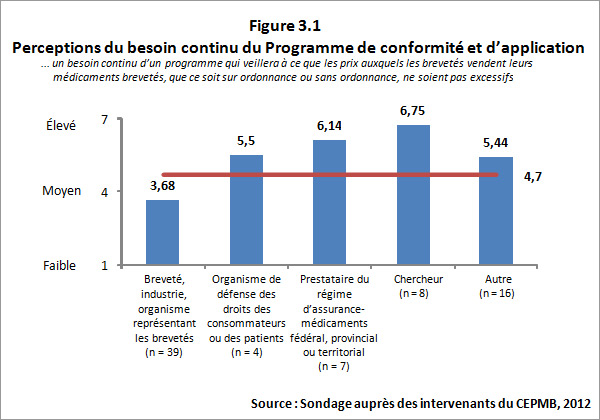
L'analyse documentaire vient appuyer la raison d'être continue du Programme de réglementation, les rapports annuels du CEPMB de 1995 à 2003 indiquant que la valeur des ventes de médicaments brevetés a augmenté de « plus de 10 % par année, alors que les taux moyens de variation des prix n'atteignaient même pas 1 % »11
3.3 Pertinence du Programme sur les tendances relatives aux produits pharmaceutiques
L'analyse documentaire a fourni certains indices quant à la pertinence du Programme sur les tendances relatives aux produits pharmaceutiques (TPP). La citation de statistiques et de renseignements fournis par le CEPMB dans le Rapport Drummond de 2012 de l'Ontario en est le plus récent exemple. Le fait qu'un projet de recherche et d'enquête de première importance comme celui-ci se soit fondé sur des données du CEPMB prouve le bien-fondé de la pertinence programme dont il est responsable.
Les points de vue recueillis lors des entrevues et provenant de deux catégories particulières de personnes interrogées, soit les brevetés et les représentants de régimes d'assurance-médicaments FPT, étaient (comme il fallait s'y attendre) divergents.
Des 14 personnes interrogées des gouvernements FPT, 13 étaient d'avis que les produits d'information du CEPMB étaient pertinents. Soulignons d'autres points de vue fournis par ces mêmes personnes :
- Plus de la moitié de ces personnes ont dit que l'information et les analyses fournies par le CEPMB correspondaient à leurs préoccupations en matière de politique.
- Certaines de ces personnes ont été en mesure de nommer des produits particuliers qu'elles avaient trouvés particulièrement utiles. Quatre d'entre elles ont mentionné le travail accompli au chapitre des prix des médicaments génériques, deux ont parlé du travail accompli au chapitre des facteurs de coût, deux ont indiqué qu'elles avaient trouvé les données du SNIUMP très utiles dans la réalisation d'analyses comparatives, et une seule personne a trouvé très utile le travail du CEPMB concernant les marges bénéficiaires du grossiste.
- Cependant, plus de la moitié de ces personnes qui croyaient que les produits d'information du CEPMB étaient pertinents ont dit qu'ils l'étaient moins en raison du manque de rapidité dans la présentation de l'information. Un certain nombre d'entre elles ont fait remarquer qu'elles doivent souvent prendre des décisions avant que les rapports pertinents du CEPMB soient mis à leur disposition. En conséquence, une recherche parallèle est souvent effectuée par les décideurs, qui par la suite utilisent les rapports du CEPMB pour appuyer les décisions déjà prises plutôt que d'utiliser les recherches du CEPMB pour orienter directement la prise de décisions. Les préoccupations relatives à la présentation en temps opportun (ou au manque de rapidité dans la présentation) des produits d'information ont miné leur valeur et donc réduit leur pertinence.
Contrairement aux représentants des gouvernements FPT, pas un seul des 11 brevetés interrogés n'a affirmé son appui durant son entrevue concernant le Programme sur les tendances relatives aux produits pharmaceutiques du CEPMB, ce qui, comme il a déjà été précisé, vise les décideurs du gouvernement et non les brevetés. Parmi les raisons citées relativement au manque de pertinence perçue, mentionnons le caractère inapproprié perçu de la déclaration des médicaments génériques brevetés et le caractère inapproprié perçu de la définition de R-D conférée par la loi sur laquelle s'appuie le CEPMB. Comme on l'a vu, l'exigence en matière de déclaration des dépenses de R-D et la définition de R-D sont prévus par la Loi sur les brevets et le Règlement sur les médicaments brevetés et ne relève pas du contrôle direct du CEPMB.
Près de la moitié des personnes interrogées dans les autres catégories ont indiqué que les produits d'information du CEPMB sont pertinents. Dans l'ensemble, un peu moins de la moitié de toutes les personnes interrogées croyaient que le Programme sur les TPP était pertinent.
Le portrait qui ressort des résultats du sondage en ligne, lesquels fournissent une répartition plus détaillée des deux catégories de produits d'information, est un peu plus instructif. Ces résultats sont décrits dans les sections qui suivent.
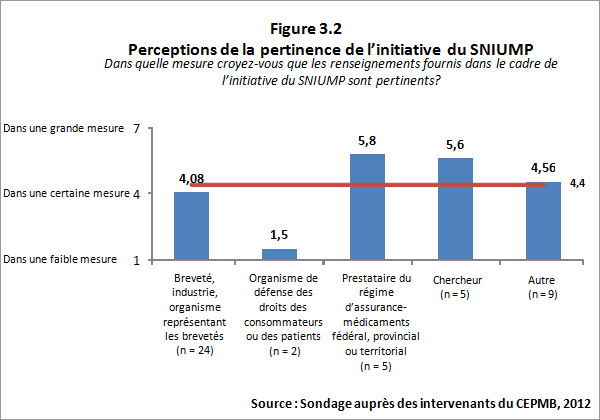
3.3.1 Pertinence perçue du SNIUMP
Des 74 répondants, 45 (ou 61 %) ont indiqué avoir une bonne connaissance des analyses et des recherches réalisées au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP). On a demandé aux répondants d'évaluer la mesure dans laquelle ils trouvaient les renseignements fournis dans le cadre de l'initiative du SNIUMP pertinents. Dans l'ensemble, les répondants ont indiqué qu'ils trouvaient les renseignements pertinents; il y avait toutefois un écart marqué dans les évaluations fournies d'une catégorie de répondant à l'autre. Les répondants représentant les régimes publics d'assurance-médicaments FPT ainsi que les représentants des chercheurs, de l'industrie et des groupes de réflexion ont hautement coté la pertinence des renseignements, alors que les représentants des organismes de défense des droits des consommateurs ou des patients ont coté les renseignements comme ayant peu de pertinence pour eux. Ces résultats peuvent être attribués au fait que le programme du SNIUMP a été créé en vertu d'une entente convenue par les ministres fédéral, provinciaux et territoriaux de la Santé, dans le but de répondre à leurs besoins en matière d'analyses critiques des tendances relatives aux prix, à l'utilisation et aux coûts afin d'orienter l'élaboration de politiques. Le Comité directeur du SNIUMP, dont les membres sont des représentants des régimes publics d'assurance-médicaments FPT, offre des conseils et fournit des directives au CEPMB sur les priorités et les sujets de recherche. Bien que la vaste majorité des rapports du SNIUMP soient publiquement accessibles, ils ne sont pas rédigés pour le grand public. Cela ressort également dans la prise de conscience de l'analyse et de l'établissement de rapports du SNIUMP parmi les intervenants qui se sont livrés au sondage. La figure 3.2 ci-dessous présente un sommaire des résultats du sondage pour cette question.
3.3.2 Pertinence perçue des données sur les dépenses de R-D
Le CEPMB a pour mandat de recueillir des renseignements sur les dépenses de R-D des brevetés dans le but de permettre le suivi du rendement en R-D de l'industrie par rapport à l'engagement initial à l'égard d'un ratio des dépenses de R-D de 10 % pris à la suite de l'adoption des modifications apportées à la Loi en 198712.
Des 74 répondants, 62 (ou 84 %) ont indiqué avoir une bonne connaissance de la déclaration par le CEPMB de renseignements sur les dépenses de R-D par les brevetés. Les brevetés qui ont indiqué avoir une bonne connaissance des données sur les dépenses de R-D ont évalué la pertinence des renseignements comme inférieure à la moyenne, alors que les répondants représentant les groupes de défense des droits des consommateurs et des patients ainsi que les groupes de chercheurs et de l'industrie de même que les groupes de réflexion ont évalué cette pertinence comme supérieure à la moyenne. La figure 3.3 ci-dessous présente un sommaire des résultats du sondage pour cette question.
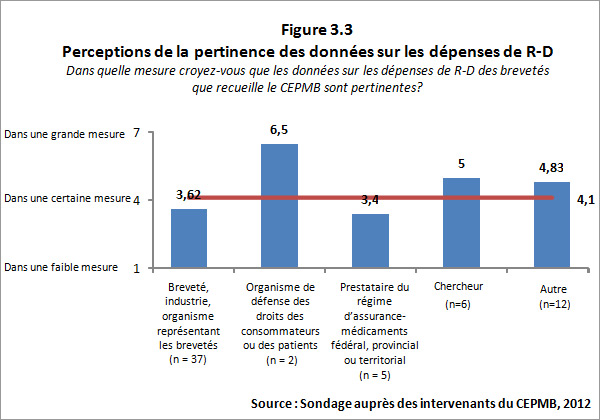
On a demandé aux répondants qui croient que les renseignements du CEPMB sur les dépenses de R-D des brevetés ne sont pas pertinents d'expliquer pourquoi ils étaient de cet avis. L'explication la plus fréquente qu'ils ont fournis porte sur l'avis que la définition actuelle de R-D utilisée par le CEPMB est désuète et (ou) inexacte. La définition utilisée par le CEPMB, comme l'exige le Règlement, est celle qu'a utilisée l'Agence du revenu du Canada à des fins fiscales en 1987. Certains répondants et personnes interrogées ont affirmé que la définition n'est plus pertinente parce que la façon dont fonctionne l'industrie pharmaceutique aujourd'hui est différente de la façon dont elle fonctionnait lorsque la définition actuelle a été établie13. À titre d'exemple, les brevetés entreprennent une recherche fondamentale moins directe, mais assurent un financement de la recherche par d'autres voies telles que les chaires de recherche universitaires, ce qui n'est pas pris en compte dans la définition actuelle de R-D. Cela étant dit, le gouvernement a récemment annoncé, dans le budget de 2012, qu'il a l'intention de passer à une définition plus restrictive de R-D en vertu du programme de la recherche scientifique et du développement expérimental (RS-DE) de l'Agence des douanes et du revenu du Canada dans un avenir prochain.
3.4 Harmonisation avec les priorités et les résultats stratégiques
3.4.1 Harmonisation avec les priorités du gouvernement fédéral
Au cours des dernières années, il y a eu de nombreuses itérations des priorités du gouvernement fédéral liées à la technologie et à l'infrastructure de l'innovation, à la prestation de services de soins de santé en général et aux médicaments d'ordonnance en particulier, ainsi qu'à la diffusion de l'information :
- De la Stratégie nationale relative aux produits pharmaceutiques14:
- « Les premiers ministres conviennent qu'aucun Canadien et aucune Canadienne ne devrait assumer un fardeau financier exagéré pour obtenir les produits pharmaceutiques nécessaires. De plus, l'accès abordable aux médicaments est un élément fondamental permettant des résultats de santé équitables pour tous les citoyens. »
- (La stratégie devrait) « améliorer l'analyse des générateurs de coûts et de la rentabilité, y compris les pratiques exemplaires incluses dans les politiques des régimes d'assurance-médicaments ».
- De la rencontre des premiers ministres sur les soins de santé, Un plan décennal pour consolider les soins de santé15 :
- « L'accès abordable aux médicaments est un élément fondamental permettant des résultats de santé équitables pour tous les citoyens. »
- (Les priorités fédérales comprennent) la « [r]eddition de comptes et transmission d'informations en permanence aux Canadiens et aux Canadiennes afin de les renseigner sur les progrès accomplis » et l'amélioration de « [l']analyse des générateurs de coûts et de la rentabilité […] ».
- Le Discours du Trône de 2007 portait entre autres sur la promotion de l'innovation et de la croissance dans les secteurs essentiels de l'économie et a précisé que le gouvernement aiderait « [l]es chercheurs et les innovateurs à développer et commercialiser leurs idées grâce à la Stratégie canadienne en matière de sciences et de technologie ».
- Du document intitulé Réaliser le potentiel des sciences et de la technologie au profit du Canada – Rapport d'étape 200916 : le « [C]anada s'est efforcé d'améliorer les retombées des investissements fédéraux en S et T. Dans certains cas, il a fait de nouveaux investissements d'intérêt public dans les activités réglementaires, la recherche scientifique et les infrastructures »17.
- Du Discours du Trône de 2010 : « Il veillera à ce que les familles disposent de l'information nécessaire pour faire des choix éclairés, et à ce que ceux qui produisent, importent ou vendent des produits de consommation au Canada répondent de la sécurité des Canadiens ».
- Du Discours du Trône de 2011 :
- « Les Canadiens veulent que, de fait s'attendent à ce que, leur système de santé les aide lorsque leur famille en a le plus besoin. Ils veulent un système plus efficace, et ce, alors que le vieillissement de la population exerce une pression sans précédent sur le bon fonctionnement du système. »
- « Notre gouvernement est résolu à respecter les compétences provinciales et à collaborer avec les provinces et les territoires pour veiller à la viabilité du système de soins de santé et à la reddition de comptes. »
- « Les Canadiens s'attendent à juste titre à ce que toutes les institutions gouvernementales qui les servent agissent équitablement et soient responsables. »
Les commentaires des principales personnes interrogées correspondaient aux indications documentées relatives à l'harmonisation appropriée des deux programmes du CEPMB avec les priorités du gouvernement fédéral. Cela était particulièrement évident chez les représentants des gouvernements FPT, la catégorie de personnes interrogées on estimerait la mieux informée sur les responsabilités fédérales par opposition aux responsabilités provinciales. La plupart de ces personnes interrogées se sont dites à l'aise avec la correspondance entre les programmes du CEPMB et les obligations légales du gouvernement fédéral.
Le CEPMB a été désigné pour contrebalancer la prolongation du pouvoir de la période de protection associée au brevet accordé à l'industrie. La création du Conseil est survenue dans le contexte des cinq piliers en cause à l'époque de la politique sur les brevets pharmaceutiques – propriété intellectuelle, relations avec la politique industrielle, relations multilatérales, protection du consommateur et santé des Canadiens.
3.4.2 Harmonisation avec les résultats stratégiques du CEPMB
Le résultat stratégique à deux volets du CEPMB est le suivant :
- Les intérêts de la population canadienne sont protégés du fait que les produits médicamenteux brevetés ne peuvent être vendus sur un marché canadien à des prix excessifs.
- Les intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques.
Le Programme de réglementation, dont l'objectif est d'examiner les prix des produits médicamenteux brevetés pour s'assurer qu'ils ne sont pas excessifs, correspond à la première composante du résultat stratégique du CEPMB. Le Programme sur les tendances relatives aux produits pharmaceutiques, dont l'objectif est de faire rapport des tendances des prix des produits pharmaceutiques et des dépenses de R-D des brevetés de même que de fournir des analyses critiques sur les tendances relatives au prix, à l'utilisation et aux coûts des médicaments d'ordonnance, correspond à la deuxième composante du résultat stratégique.
Aucune des données de recherche recueillies au moyen de l'analyse documentaire ou de l'examen des documents, des entrevues ou des sondages n'a permis d'annuler cette correspondance très simple entre les programmes du CEPMB et son résultat stratégique.
3.4.3 Relations avec des organismes ayant des mandats connexes
Le CEPMB est un organisme fédéral créé en vertu de la loi et dont les exigences en matière de rapport sont prévues par la loi. À ce titre, son mandat est pancanadien. En revanche, l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) est une collaboration volontaire entre les gouvernements FPT, et l'ICIS est un organisme indépendant (non visé par la loi) financé par le gouvernement fédéral.
On a demandé aux personnes interrogées si elles croyaient que les programmes du CEPMB complétaient ou reproduisaient le travail d'autres organismes ou ordres du gouvernement. Parmi celles qui ont répondu à cette question, une importante majorité a indiqué qu'elle percevait un certain chevauchement, mais aucune reproduction entre les travaux de recherche et de rapports du CEPMB et d'autres groupes comme l'ICIS et l'ACMTS, et les listes provinciales, territoriales et fédérales. Parmi les personnes interrogées, plusieurs ont mentionné la nécessité de continuer et peut-être d'améliorer la collaboration entre le CEPMB et ces autres groupes, en raison de la possibilité, jusqu'à maintenant grandement évitée, de reproduction quant à la fonction de rapport et d'analyse. (Toutes ont convenu que la fonction de réglementation est unique.) Les citations suivantes provenant d'un bon nombre de personnes interrogées du CEPMB expliquent la possibilité de reproduction ou les perceptions à l'égard de la reproduction :
- (Parlant de groupes comme l'ICIS et l'ACMTS et le Programme commun d'évaluation des médicaments [PCEM]) : [Traduction] « Nous examinons les mêmes données, mais d'une différente perspective. »
- [Traduction] « Nous dépendons d'organismes nationaux comme le PCEM et l'ACMTS, et comprenons les subtilités de leurs mandants distincts, mais connexes. Je soupçonne que pour d'autres secteurs comme celui des brevetés, c'est probablement plus déroutant, et que les réponses seront différentes. »
Même si la supposition susmentionnée concernant les perspectives des brevetés était juste, l'étendue de la différence était moins radicale que ce qu'on aurait pu prévoir. La moitié des brevetés partageaient l'avis de la majorité des personnes interrogées qui pensaient qu'il y avait un certain chevauchement, mais aucune reproduction. Une autre répartition des commentaires des personnes interrogées à cet égard est très positive. La plupart des personnes interrogées des gouvernements FPT croyaient qu'il y avait un certain chevauchement, mais aucune redondance.
Lorsqu'elles se sont penchées sur la question de la reproduction perçue ou de la possibilité de reproduction de la fonction de rapport, les personnes interrogées ont nommé l'ICIS et les groupes de recherche sur les listes de médicaments provinciales comme organismes à partir desquelles le travail du CEPMB est le plus susceptible d'être reproduit.
Bien que la plupart des suggestions et des commentaires des personnes interrogées aient porté sur le Programme de réglementation, quelques personnes interrogées ont suggéré que le Programme sur les tendances relatives aux produits pharmaceutiques pourrait être transféré à un autre ministère ou organisme fédéral. Le transfert des activités de recherche du CEPMB à l'Institut canadien d'information sur la santé (ICIS) constituait la solution de rechange la plus fréquemment suggérée. Et bien que certaines personnes interrogées aient fait valoir cette suggestion, d'autres ont précisément souligné que le CEPMB a le mandat de recueillir les renseignements sur les tendances relatives aux dépenses de R-D et sur les prix des produits pharmaceutiques et à en faire rapport, et qu'il est en mesure de mener d'autres activités de recherche liées à l'industrie pharmaceutique.
3.5 Conclusions
3.5.1 Le Programme de réglementation
Selon les constatations de la présente évaluation, des changements dans l'environnement des médicaments brevetés ont eu une incidence sur la mesure dans laquelle le Programme de réglementation demeure pertinent en ce qui a trait à la prévention de prix excessifs des produits médicamenteux brevetés vendus au Canada :
- L'émergence des médicaments génériques et l'application de méthodes dynamiques de limitation des coûts quant aux listes de médicaments publiques semblent avoir réduit la pertinence du Programme de réglementation pour les personnes visées par ces régimes d'assurance-médicaments. Toutefois, seulement 32 % des dépenses en matière de médicaments brevetés étaient couvertes par des régimes publics d'assurance-médicaments, ce qui signifie que l'approche des listes de médicaments publiques n'a PAS réduit la pertinence du Programme de réglementation pour la majorité des dépenses en matière de médicaments brevetés.
- L'émergence de produits extrêmement coûteux dans les marchés à créneaux semble avoir augmenté la nécessité et la pertinence du Programme de réglementation.
Dans l'ensemble, il existe toujours un besoin d'avoir un programme qui puisse empêcher que les prix des médicaments pharmaceutiques au Canada soient excessifs. À cet égard, le Programme de réglementation du CEPMB se cadre aux besoins des Canadiens puisque les données montrent que les prix pourraient être excessifs si ce n'était du CEPMB.
Selon l'examen des constatations de l'évaluation réalisé par les évaluateurs, lesquelles sont décrites dans le présent chapitre, le Programme de réglementation peut être exécuté par un organisme fédéral. Le CEPMB a été désigné pour contrebalancer la prolongation du pouvoir de la période de protection associée au brevet accordé à l'industrie. Il semble que le CEPMB continue de jouer ce rôle, rôle qui ne pourrait être assumé par une entité non fédérale. La présente évaluation n'a révélé aucune preuve de chevauchement des rôles quant à la prévention des prix excessifs des médicaments pharmaceutiques brevetés au Canada.
Le Programme de réglementation cadre bien avec les priorités gouvernementales et le résultat stratégique du CEPMB, comme en témoignent les constatations d'un examen des documents du gouvernement fédéral et du CEPMB. De nombreuses références aux soins de santé, à l'abordabilité et au besoin d'innovation citées dans les Discours du Trône depuis 2007 tiennent compte de l'harmonisation du CEPMB avec les priorités actuelles du gouvernement fédéral. Le Programme de réglementation cadre précisément avec l'un des résultats stratégiques du CEPMB, soit celui énonçant que : « Les intérêts de la population canadienne et leur système de soins de santé sont protégés du fait que les produits médicamenteux brevetés ne peuvent être vendus au Canada à des prix excessifs.»
3.5.2 Le Programme sur les tendances relatives aux produits pharmaceutiques
Selon l'examen des constatations de l'évaluation réalisé par les évaluateurs, lesquelles sont décrites dans le présent chapitre, le Programme sur les TPP demeure pertinent. Cependant, il s'agit d'une prise de position plus mitigée que l'évaluation du Programme de réglementation. Cette évaluation tient compte du fait que le Programme sur les TPP vise dans une grande mesure à répondre aux besoins des intervenants FPT. Parmi les facteurs qui contribuent le plus à la réduction de la pertinence des produits d'information sur les TPP, mentionnons le manque de rapidité dans le développement et la diffusion de l'information et, en ce qui concerne les brevetés, les préoccupations ayant trait au caractère approprié des aspects du programme prescrits par la loi (c.-à-d. les rapports sur les dépenses de R-D). Le CEPMB pourrait accroître la pertinence du Programme sur les TPP en améliorant, dans la mesure du possible, la présentation opportune des renseignements, en particulier à l'égard du SNIUMP.
En vertu de l'article 88 de la Loi, les entreprises pharmaceutiques doivent faire rapport au CEPMB de leurs dépenses de recherche-développement. De plus, l'article 90 de la Loi autorise le ministre de la Santé à demander que d'autres enquêtes soient entreprises par le CEPMB. Étant donné que ces deux articles de la Loi existent toujours, le Programme sur les TPP du CEPMB semble toujours cadrer avec les besoins et priorités du gouvernement fédéral en ce qui concerne la recherche liée aux tendances relatives aux prix des produits pharmaceutiques. En outre, le Comité directeur du SNIUMP compte des représentants des gouvernements fédéral, provinciaux et territoriaux qui fournissent des commentaires sur le choix des sujets de recherche du SNIUMP. Cela sert de lien entre le travail de recherche du SNIUMP et les priorités fédérales liées à la recherche sur les tendances relatives aux prix des produits pharmaceutiques.
Les constatations de l'évaluation dénotent que le Programme sur les TPP cadre bien avec l'un des résultats stratégiques du CEPMB, soit celui énonçant que « [l]es intervenants sont tenus informés des tendances de l'industrie ». Bien qu'il y ait possibilité de reproduction du travail de recherche des organismes étroitement liés comme l'ICIS et l'ACMTS, cette possibilité ne semble pas s'être réalisée. À ce jour, il semble y avoir eu un certain chevauchement, mais peu ou pas de reproduction des efforts du CEPMB et d'autres organismes de recherche fédéraux.
2 Les médicaments vedettes sont habituellement définis comme des médicaments extrêmement populaires qui génèrent des ventes annuelles d'au moins 1 milliard de dollars pour une société. Soulignons à titre d'exemple les médicaments vedettes Vioxx, Lipitor et Zoloft. Les médicaments vedettes servent habituellement à traiter des problèmes médicaux communs comme un taux élevé de cholestérol, le diabète, l'hypertension artérielle, l'asthme et le cancer.
3 BELL, C., D. GRILLER, J. LAWSON et D. LOVREN. Prix et accès des médicaments génériques au Canada : Quelles sont les répercussions?, Toronto, Conseil canadien de la santé, 2010, site Web : www.healthcouncilcanada.ca, page 4.
4 GROUPE DE TRAVAIL MINISTÉRIEL FÉDÉRAL-PROVINCIAL-TERRITORIAL SUR LA STRATÉGIE NATIONALE RELATIVE AUX PRODUITS PHARMACEUTIQUES. Stratégie nationale relative aux produits pharmaceutiques : Rapport d'étape, Publications Santé Canada, extrait de http://www.hc-sc.gc.ca/hcs-sss/alt_formats/hpb-dgps/pdf/pubs/2006-nps-snpp/2006-nps-snpp-fra.pdf, 2006, page 8.
5 INSTITUT CANADIEN D'INFORMATION SUR LA SANTÉ (ICIS). Dépenses en médicaments au Canada, de 1985 à 2011, Ottawa : ICIS, extrait de https://secure.cihi.ca/free_products/DEIC_1985_%202011_FR.pdf, 2012.
6 OCDE. Les prix des médicaments sur un marché global : politiques et enjeux, E. Docteur, V. Paris et P. Moise, 2008, page 11.
7 GROUPE DE TRAVAIL MINISTÉRIEL FÉDÉRAL-PROVINCIAL-TERRITORIAL SUR LA STRATÉGIE NATIONALE RELATIVE AUX PRODUITS PHARMACEUTIQUES. Stratégie nationale relative aux produits pharmaceutiques : Rapport d'étape, Publications Santé Canada, extrait de http://www.hc-sc.gc.ca/hcs-sss/alt_formats/hpb-dgps/pdf/pubs/2006-nps-snpp/2006-nps-snpp-fra.pdf, 2006, page 6.
8 BELL, C., D. GRILLER, J. LAWSON et D. LOVREN. Prix et accès des médicaments génériques au Canada : Quelles sont les répercussions?, Toronto, Conseil canadien de la santé, 2010, site Web : www.healthcouncilcanada.ca, page 4.
9 CONSEIL D'EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS. Incidence de la réglementation fédérale des prix des médicaments brevetés, Ottawa, Conseil d'examen du prix des médicaments brevetés, 1997.
10 OECD. Les prix des médicaments sur un marché global : politiques et enjeux, E. Docteur, V. Paris et P. Moise, 2008, page 18.
11 CONSEIL D'EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS. Rapport annuel 2010, Ottawa, Conseil d'examen du prix des médicaments brevetés, www.pmprb-cepmb.gc.ca, 2011, page 16.
12 Selon le Résumé de l'étude d'impact de la réglementation (RÉIA) du Règlement sur les médicaments brevetés, 1988, publié dans la Partie II de la Gazette du Canada, vol. 122, no 20 – SOR/DORS/88-474.
13 On a souligné dans le Rapport annuel 2010 du CEPMB que ce dernier participait en tant que membre d'un groupe de travail à l'examen des mécanismes de saisie et de déclaration des investissements en recherche-développement de Rx&D et de ses sociétés membres.
14 GROUPE DE TRAVAIL MINISTÉRIEL FÉDÉRAL-PROVINCIAL-TERRITORIAL SUR LA STRATÉGIE NATIONALE RELATIVE AUX PRODUITS PHARMACEUTIQUES. Stratégie nationale relative aux produits pharmaceutiques : Rapport d'étape, Publications Santé Canada, extrait de http://www.hc-sc.gc.ca/hcs-sss/alt_formats/hpb-dgps/pdf/pubs/2006-nps-snpp/2006-nps-snpp-fra.pdf, 2006.
15 SANTÉ CANADA. Système de soins de santé. Rencontre des premiers ministres sur les soins de santé. Un plan décennal pour consolider les soins de santé, extrait de http://www.hc-sc.gc.ca/hcs-sss/delivery-prestation/fptcollab/2004-fmm-rpm/index-fra.php, 2004.
16 TRAVAUX PUBLICS ET SERVICES GOUVERNEMENTAUX CANADA. Réaliser le potentiel des sciences et de la technologie au profit du Canada – Rapport d'étape 2009, Ottawa : Éditions et Services de dépôt, Travaux publics et Services gouvernementaux Canada, [http://ic.gc.ca/fpublications], juin 2009.
17 TRAVAUX PUBLICS ET SERVICES GOUVERNEMENTAUX CANADA. Réaliser le potentiel des sciences et de la technologie au profit du Canada – Rapport d'étape 2009, Ottawa : Éditions et Services de dépôt, Travaux publics et Services gouvernementaux Canada, [http://ic.gc.ca/fpublications].
4. Réalisation des résultats – Programme de réglementation
Le présent chapitre aborde la réalisation des résultats du Programme de réglementation du prix des médicaments brevetés.
4.1 Connaissance et sensibilisation à l'égard des Lignes directrices et des politiques connexes
Le résultat immédiat du Programme de réglementation est que [Traduction] « les brevetés ont accru leur connaissance de la Loi, du Règlement, des politiques et des Lignes directrices de même que des conséquences du non-respect et y sont davantage sensibilisés ». Le niveau de succès atteint par le CEPMB dans la réalisation de ce résultat est examiné ci-dessous.
Les Lignes directrices du Conseil ont été révisées en 2010. Dans le cadre du processus de révision des Lignes directrices, le CEPMB a tenu de longues consultations auprès des intervenants. Il a également déployé des efforts continus en vue de veiller à ce que les brevetés aient une bonne connaissance des Lignes directrices et politiques connexes afin de pouvoir comprendre les exigences juridiques en matière d'établissement de rapports et de respect desdites Lignes directrices et politiques connexes.
Depuis 2007, le CEPMB a organisé ou participé à 13 activités de sensibilisation, dont des séminaires, des séances de liaison et, plus récemment, des webinaires. Ces activités de sensibilisation ont en général été très courues par des brevetés et des consultants qui collaborent avec ces premiers, la participation variant entre 114 brevetés et consultants aux séances de liaison tenues à Toronto et à Montréal en octobre 2009 et 37 participants à un webinaire portant sur la méthodologie de la majoration en avril 2011. Le tableau 4.1 présente le nombre total de consultations tenues auprès des intervenants par le CEPMB au cours des quatre dernières années.
Tableau 4.1 Nombre de consultations auprès des intervenants, de 2008-2009 à 2011-2012
| |
2008-2009 |
2009-2010 |
2010-2011 |
2011-2012 |
| Nombre de consultations tenues auprès des intervenants |
34 |
25 |
5 |
25 |
Source : Données sur la mesure du rendement du CEPMB, 2012.
Dans le cadre de la mise en œuvre de sa nouvelle stratégie de mesure du rendement élaborée en janvier 2010, le CEPMB a récemment créé des formulaires de rétroaction pour les activités de sensibilisation menées auprès des brevetés et des consultants. Jusqu'à maintenant, les formulaires de rétroaction ont été recueillis à la suite de quatre séances de liaison tenues à Montréal et à Toronto en mars 2011 et en février 2012. Pour chacune de ces quatre séances, les commentaires des participants étaient presque entièrement positifs, la grande majorité d'entre eux ayant indiqué que la séance avait répondu à leurs questions sur les Lignes directrices et les sujets connexes.
En plus de présenter des exposés en personne aux brevetés et aux intervenants sur divers aspects des Lignes directrices et politiques connexes, le CEPMB a publié 10 articles dans sa publication La Nouvelle, dans lesquels étaient précisés les Lignes directrices et les processus suivis par le personnel du Conseil au moment d'examiner le prix d'un médicament breveté. On compte parmi les articles visant à préciser les Lignes directrices et les politiques connexes du Conseil les suivants : Clarification du remboursement des recettes excessives (octobre 2010); Section 5 – Vérification des prix des médicaments brevetés pratiqués à l'étranger (janvier 2011); Méthode de décomposition (juillet 2011); Formules de décomposition pour la vérification des prix internationaux (janvier 2012).
Les constatations du sondage indiquent qu'une grande proportion (79 %) des brevetés et des organisations représentant des brevetés sont satisfaits des efforts du CEPMB visant à leur fournir des renseignements sur le cadre législatif ainsi que sur les Lignes directrices et les politiques du Conseil. On a demandé aux répondants qui avaient indiqué qu'ils jugeaient les efforts du CEPMB insuffisants d'expliquer leur point de vue. La plupart ont souligné la nécessité du CEPMB d'accroître la communication. Un de ces répondants a précisé que les Lignes directrices sont complexes et doivent être bien comprises, et qu'il existe de nombreuses zones grises sujettes à interprétation et pour lesquelles des précisions sont nécessaires.
De même, presque tous les brevetés et les organismes représentant des brevetés interrogés dans le cadre de cette évaluation ont indiqué que les efforts du CEPMB ont permis aux brevetés de mieux comprendre leurs obligations prévues par la Loi sur les brevets. En fait, de nombreux brevetés ont constaté que la relation entre les brevetés et le CEPMB s'est beaucoup améliorée au cours de la dernière année ou des deux dernières années, certains décrivant ce qu'ils considéraient comme un « changement de régime » au sein du CEPMB, notamment une communication plus ouverte entre les brevetés et le personnel du CEPMB. Bien que la plupart des brevetés interrogés aient été satisfaits des efforts du CEPMB quant à la communication avec les brevetés, certains d'entre eux ont indiqué être de façon générale insatisfaits, alors que d'autres ont constaté qu'il existe toujours certaines zones grises quant à l'application des Lignes directrices. Une personne interrogée a fait remarquer que le site Web avait été réorganisé trop fréquemment, rendant la recherche difficile.
Bien que l'ensemble des catégories des répondants considèrent que les Lignes directrices et d'autres documents du CEPMB destinés à offrir une orientation sur la Loi, le Règlement et les politiques répondent à leurs besoins, du moins quelque peu, la mesure dans laquelle les répondants croient que ces documents répondent à leurs besoins est variable. Les brevetés, les organisations représentant des brevetés et les répondants de la catégorie « autre » ont tendance à évaluer la mesure dans laquelle les documents fournis par le CEPMB répondent à leurs besoins comme plus faible par rapport aux autres catégories de répondants. La figure 4.1 ci-dessous présente un sommaire des résultats du sondage pour cette question.
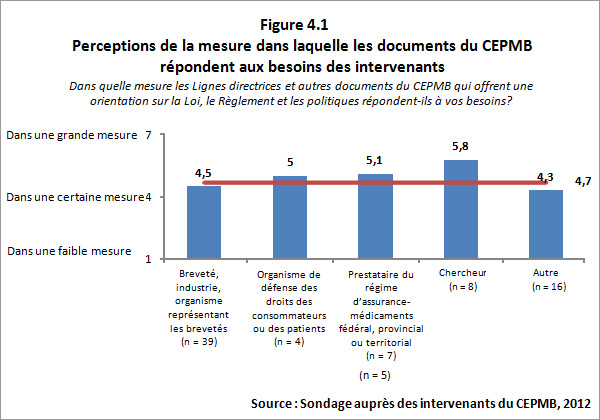
On a demandé aux répondants qui ont indiqué qu'ils ne croyaient pas que les Lignes directrices et les autres documents du CEPMB avaient répondu à leurs besoins d'expliquer leur point de vue. Les réponses obtenues ont porté sur le manque de clarté des Lignes directrices et le besoin relativement à leur interprétation.
Les résultats du sondage indiquent qu'une grande proportion (92 %) des brevetés et des organismes représentant des brevetés pensent qu'ils connaissent assez bien la Loi, le Règlement et les Lignes directrices pour être en mesure de s'y conformer. Les brevetés et les organisations représentant des brevetés interrogés dans le cadre de cette évaluation étaient de même convaincus que l'information et l'orientation du CEPMB répondaient à leurs besoins. Toutefois, les personnes interrogées ont relevé certaines lacunes ou faiblesses. La lacune la plus fréquemment citée concerne la sélection des médicaments de comparaison, en particulier les nouveaux médicaments sans produit comparable évident. Une personne interrogée a fait remarquer l'absence de clarté en ce qui concerne le processus décisionnel du Groupe consultatif sur les médicaments pour usage humain (GCMUH) et un souhait de la part des brevetés quant à l'accès à des rapports plus détaillés de résumés de délibérations ou de décisions (et non seulement en ce qui concerne leurs propres médicaments).
4.2 Respect de la Loi, du Règlement et des Lignes directrices
L'un des résultats intermédiaires du Programme de réglementation est que [Traduction] « les brevetés respectent la Loi, le Règlement et les Lignes directrices ». Le niveau de succès atteint par le CEPMB dans la réalisation de ce résultat est examiné ci-dessous.
4.2.1 Tendances relatives au respect des Lignes directrices
Les brevetés sont tenus par la loi de produire des renseignements relatifs à la vente de leurs produits médicamenteux au Canada. La Loi sur les brevets et le Règlement sur les médicaments brevetés prévoient les exigences en matière de rapport, et le personnel du Conseil examine de façon continue les renseignements sur les prix afin de s'assurer que les prix ne sont pas excessifs. Les brevetés sont tenus de produire les renseignements lors de lancer leur produit sur le marché et deux fois par année par la suite, jusqu'à échéance du brevet.
Le tableau 4.2 ci-dessous présente un sommaire du nombre de médicaments brevetés dont le prix était conforme aux Lignes directrices, du nombre de médicaments brevetés dont le prix n'était pas conforme aux Lignes directrices, et du nombre de médicaments brevetés dont le prix n'était pas conforme aux Lignes directrices, mais qui n'avait pas justifié la tenue d'une enquête.
Tableau 4.2 Nombre de médicaments dont le prix n'est pas conforme aux Lignes directrices, de 2007 à 2011
| |
2007 |
2008 |
2009 |
2010 |
2011 |
| Nombre de médicaments brevetés dont le prix est conforme aux Lignes directrices (prix non excessifs) |
1 022 |
1 092 |
1 053 |
954 |
1 079 |
| Nombre de médicaments brevetés dont le prix n'est pas conforme aux Lignes directrices (mais qui n'a pas justifié pas la tenue d'une enquête)18 |
S.O. |
S.O. |
S.O. |
135 |
134 |
| Nombre de médicaments brevetés dont le prix fait l'objet d'une enquête ou d'une audience19 |
125 |
134 |
93 |
222 |
70 |
Source : Données sur la mesure du rendement du CEPMB, 2012.
La mesure dans laquelle l'information figurant dans le formulaire 2 et le formulaire 3 est complète et exacte et est présentée dans le délai imparti tient compte en partie de la mesure dans laquelle les brevetés connaissent et comprennent leurs obligations prévues aux Lignes directrices et à la Loi.
La soumission des données sur le prix et les ventes (formulaire 2) doit être faite deux fois par année (le 30 janvier et le 30 juin). Lorsque les sociétés omettent de présenter un rapport, le CEPMB envoie une lettre au président de la société, lui accordant un délai supplémentaire de sept jours pour se conformer. Une ordonnance du Conseil est émise aux sociétés qui ne présentent toujours pas leur formulaire 2. Selon les cadres supérieurs du CEPMB, le taux de roulement chez les employés de sociétés pharmaceutiques qui sont responsables de la présentation du formulaire 2 est relativement élevé et ainsi les défauts de présenter les rapports sont attribuables à l'inexpérience du personnel.
Le CEPMB dispose d'un système interne par lequel la présentation du formulaire 2 se fait par voie électronique. La présentation du formulaire 2 se fait au moyen d'un système de vérification électronique qui vérifie si le format des éléments du formulaire 2 est conforme aux exigences. Si le formulaire présenté ne contient aucune erreur, les données sont saisies automatiquement dans la base de données du CEPMB. Si une erreur figure dans le formulaire 2 présenté, un message automatisé est envoyé aux brevetés pour demander des corrections.
Le Conseil n'a pas été appelé à rendre des ordonnances au cours des cinq dernières années pour défaut de présenter le formulaire 2. Le personnel du CEPMB rapporte que le nombre de formulaires 2 ne contenant aucune erreur et présentés depuis 2009 est à la hausse, 67 % des rapports présentés en 2009 et 80 % des rapports présentés en 2011 ne contenant aucune erreur.
En vertu du paragraphe 89(3) de la Loi, le CEPMB doit faire rapport de l'identité des brevetés qui n'ont pas produit les renseignements (au moyen du formulaire 3) sur les recettes qu'ils ont tirées des ventes de médicaments (y compris les recettes tirées des ventes de médicaments non brevetés et les recettes découlant de contrats de licences) ainsi que de leurs dépenses de recherche-développement au Canada se rapportant aux médicaments. En vertu de la Loi, un breveté qui ne présente pas tous les renseignements sera également jugé en « défaut de présenter ses rapports ». Le CEPMB n'a pas signalé d'incident de défaut de présenter ses rapports depuis celui signalé en 2008. Le tableau 4.3 ci-dessous présente un sommaire du nombre d'incidents de défaut de présenter le formulaire 2 et le formulaire 3.
Tableau 4.3 Nombre d'incidents de défaut de présenter ses rapports sur le formulaire 2 et de défauts de présenter ses rapports sur le formulaire 3, de 2008 à 2011
| Année |
Sociétés qui présentent un rapport |
Formulaire 2 – défaut de présenter ses rapports |
Formulaire 3 – défaut de présenter ses rapports |
| 2008 |
82 |
0 |
1 |
| 2009 |
81 |
0 |
0 |
| 2010 |
82 |
0 |
0 |
| 2011 |
79 |
0 |
0 |
Source : Données sur la mesure du rendement du CEPMB, 2012.
Dans l'ensemble, les données appuient fortement l'opinion selon laquelle le niveau de conformité parmi les brevetés est très élevé.
4.2.2 Enquêtes et Engagements de conformité volontaire
Le personnel du Conseil fait l'examen des prix de tous les produits médicamenteux brevetés offerts sur le marché canadien. Lorsque le prix d'un produit semble plus élevé que ne l'autorisent les Lignes directrices et que les circonstances justifient une enquête, le personnel du Conseil mène une enquête aux fins de déterminer si le prix du produit peut en fait être jugé excessif. Ainsi, le nombre d'enquêtes peut être considéré non seulement comme un indicateur de conformité, mais également de connaissance et de sensibilisation – plus le nombre est élevé et plus il est probable qu'il existe des lacunes quant à la connaissance des Lignes directrices; plus le nombre est faible et plus il est probable que les Lignes directrices sont bien comprises. Le nombre d'enquêtes ouvertes et en cours a diminué de façon constante, alors que le nombre d'enquêtes terminées a augmenté depuis 2007. Une augmentation du financement accordé au CEPMB pour réduire les arriérés et sensibiliser davantage les brevetés semble ainsi avoir permis la réalisation des résultats escomptés. Le tableau 4.4 ci-dessous présente un sommaire du nombre d'enquêtes entreprises par le CEPMB depuis 2007.
Tableau 4.4 Nombre d'enquêtes, de 2007 à 2011
| |
2007 |
2008 |
2009 |
2010 |
2011 |
| Ouvertes et en cours |
103 |
125 |
109 |
87 |
68 |
| Terminées |
27 |
36 |
73 |
81 |
90 |
Source : Données sur la mesure du rendement du CEPMB, 2012.
L'Engagement de conformité volontaire est un engagement écrit par lequel le breveté s'engage à prendre des mesures pour se conformer aux Lignes directrices du Conseil, notamment le rajustement du prix de son produit à un niveau non excessif et le remboursement des recettes excessives qu'il a tirées de la vente de son produit à un prix excessif. Les brevetés peuvent soumettre un Engagement de conformité volontaire lorsqu'une enquête menée par le personnel du Conseil détermine que le prix au Canada de leur produit médicamenteux breveté semble plus élevé que ne le permettent les Lignes directrices.
En 2010 et jusqu'au 31 mai 2011, la présidente a approuvé 16 Engagements de conformité volontaire et une modification à un Engagement de conformité volontaire existant. Des 34 brevetés qui ont répondu au sondage, 19 ont indiqué qu'ils avaient participé à des Engagements de conformité volontaire. Dans l'ensemble, les brevetés étaient d'avis qu'ils avaient été traités de façon plutôt équitable dans le cadre du processus d'Engagement de conformité volontaire. On a demandé aux brevetés ayant répondu au sondage qui avaient participé à des Engagements de conformité volontaire d'expliquer si des améliorations, le cas échéant, pouvaient être apportées pour améliorer le processus d'Engagement de conformité volontaire. Voici certains de leurs commentaires :
- le délai est trop court;
- les paiements devraient être versés à des groupes de patients plutôt qu'au gouvernement fédéral;
- les augmentations de prix non concrétisées devraient servir à rembourser les recettes excessives;
- il conviendrait d'établir le délai du prononcé d'une décision après l'audience;
- il conviendrait d'améliorer la souplesse.
En général, les personnes interrogées s'entendent avec les répondants pour dire que le processus d'Engagement de conformité volontaire est équitable. Certains brevetés interrogés ont nuancé leur réponse en précisant que le processus d'Engagement de conformité volontaire est équitable uniquement s'il s'agit véritablement d'une négociation. D'autres ont noté que même s'ils jugent que le processus est équitable, le personnel du CEPMB a généralement tout le pouvoir dans l'élaboration d'un Engagement de conformité volontaire ou les négociations du processus d'Engagement de conformité volontaire.
4.2.3 Audiences
Dans le cas où le prix d'un médicament breveté semble excessif, le Conseil peut tenir une audience publique. Si, durant l'audience, le Conseil juge que le prix du produit médicamenteux est excessif, il peut rendre une ordonnance obligeant le breveté à réduire le prix de son produit et à rembourser la partie excessive des recettes qu'il a tirées de la vente de son produit à un prix excessif. Les brevetés peuvent interjeter appel des décisions du Conseil auprès de la Cour fédérale du Canada.
Depuis sa création, le Conseil a tenu 25 audiences, dont 17 tenues entre 2006 et 2010. Au 31 mai 2011, des décisions sont en instance dans trois affaires.
La direction et les membres du Conseil reconnaissent que les principes d'équité s'appliquent lors des audiences. Le processus est quasi judiciaire et, à ce titre, toutes les parties sont représentées par un conseiller juridique.
Des 34 brevetés qui ont répondu au sondage, six ont indiqué qu'ils avaient participé à des audiences. De ces six brevetés, deux pensaient que les principes d'équité20 n'avaient pas été appliqués, trois pensaient que les principes d'équité avaient été quelque peu appliqués et un pensait que les principes d'équité avaient été appliqués. Bien qu'on leur ait demandé de fournir une explication, seul un breveté qui a été interrogé était en mesure d'en fournir une. Cette personne était d'avis que la présidente avait fait preuve d'une partialité qui a joué au détriment du breveté.
On a demandé aux six brevetés qui ont participé à une audience d'expliquer comment ce processus pourrait être amélioré. Voici quelques suggestions qu'ils ont présentées :
- la présidente du Panel d'audience doit demeurer objective et ne pas formuler de commentaires ni prendre des positions qui indiquent sa partialité en défaveur des fabricants;
- il faut plus de transparence;
- les délais doivent être prorogés pour donner plus de temps pour présenter les renseignements;
- il conviendrait d'établir le délai du prononcé d'une décision.
4.3 Clarté, transparence et prévisibilité
L'un des résultats intermédiaires escomptés du Programme de réglementation est que [Traduction] l'« industrie a un environnement clair, transparent et prévisible de réglementation des prix des médicaments brevetés ». Le niveau de succès atteint par le CEPMB dans la réalisation de ce résultat est examiné ci-dessous.
On a demandé aux participants d'évaluer la clarté (caractère compréhensible) et la transparence procédurale du cadre de réglementation. Dans l'ensemble, les répondants ont indiqué que le cadre de réglementation est clair. On a demandé à ceux qui ont indiqué qu'ils croyaient que le cadre de réglementation manquait de clarté d'expliquer leur point de vue. La plus fréquente explication faisait état du besoin des entreprises pharmaceutiques d'embaucher des consultants externes et des avocats pour les aider à interpréter les Lignes directrices.
Bien que les répondants aient eu tendance à évaluer de façon positive la transparence du cadre de réglementation, les brevetés et les répondants de la catégorie « autre » avaient tendance à l'évaluer de façon plus négative que les autres répondants. Les explications de la raison pour laquelle les répondants croyaient que le cadre de réglementation manquait de transparence comprennent le fait que le CEPMB ne rend pas publiques toutes ses décisions; l'absence de consultation auprès de l'industrie; et la croyance que certaines décisions semblent délibérément vagues et ne fournissent aucune justification.
Les commentaires des personnes interrogées correspondaient quelque peu aux résultats du sondage. [Traduction] « Je crois que les règles du Conseil sont transparentes, et lorsque celui-ci apporte des changements, il le fait de façon ouverte et consultative. » Un certain nombre de personnes interrogées ont indiqué qu'elles étaient sensibles aux récents changements qui ont rendu les Lignes directrices moins complexes. La nature de ce commentaire est bien saisie dans cette citation d'une autre personne interrogée : [Traduction] « La Loi et le Règlement ne sont pas particulièrement clairs; la Loi est délibérément vague. Par contre, les nouvelles Lignes directrices sont soigneusement conçues. Le travail que le Conseil continue de faire auprès de l'industrie les améliorera davantage ».
D'autres personnes interrogées ont reconnu que les nouvelles Lignes directrices ont amélioré la clarté et la transparence du cadre de réglementation, mais ont noté qu'il conviendrait de les simplifier davantage. Le défi inhérent à cette tâche est bien résumé dans les remarques suivantes d'une personne interrogée : [Traduction] « (Le cadre de réglementation est) très clair pour tous ceux qui font partie de l'environnement pharmaceutique, qui sont ceux qui doivent le mieux le comprendre ».
Les répondants ont indiqué dans l'ensemble que le cadre de réglementation est plutôt prévisible. Les chercheurs et les représentants de régimes d'assurance-médicaments FPT pensent que le cadre de réglementation est prévisible, mais d'autres catégories de répondants ne partagent pas cet avis. La figure 4.2 présente un sommaire des résultats du sondage.
On a demandé à ceux qui ont indiqué qu'ils croyaient que le cadre de réglementation manquait de prévisibilité de fournir une explication. Diverses explications ont été fournies, notamment :
- l'absence de prévisibilité en ce qui concerne les facteurs de comparaison qui seront utilisés dans le cadre du processus du GCMUH, ce qui mène à des résultats imprévisibles;
- les Lignes directrices sont appliquées de façon rigoureuse, mais leur interprétation par le personnel du CEPMB est imprévisible;
- des changements continus aux Lignes directrices ont une incidence sur le prix des produits. À court terme, ils sont prévisibles, mais à long terme, les conséquences sont considérées comme imprévisibles et ont des conséquences sur la stratégie à long terme de l'entreprise;
- des préoccupations au sujet du mandat exprimées par certains sont bien résumées dans cette citation : [Traduction] « De récentes décisions judiciaires indiquent qu'une incertitude existe relativement aux frontières du mandat du CEPMB ».
Encore une fois, les commentaires des personnes interrogées correspondaient aux résultats du sondage et les questions liées à la prévisibilité reprenaient celles des répondants. Les facteurs les plus souvent cités par les personnes interrogées qui réduiraient la prévisibilité du cadre de réglementation étaient liés à la méthodologie et au mandat, qui sont tous les deux, en grande partie, établis par la loi.
Il convient de noter le ton des commentaires des personnes interrogées sur la question de la prévisibilité. Bien que la critique dans certains commentaires ait été sincère, un certain nombre de personnes interrogées semblaient se rallier au CEPMB alors qu'il était confronté au défi de tenter de créer un environnement de réglementation prévisible : [Traduction] « Je souhaite la prévisibilité, mais vous devez comprendre qu'il s'agit d'un domaine complexe et qu'il y aura certaines zones d'incertitude, en particulier lorsqu'on a affaire à de nouveaux produits. Nous adoptons ce point de vue : nous devons comprendre les règles et avoir l'expertise technique pour gérer les zones d'incertitude en fonction de la façon dont nous fixons le prix de nos produits. D'autres brevetés veulent uniquement un portrait sans nuance ».
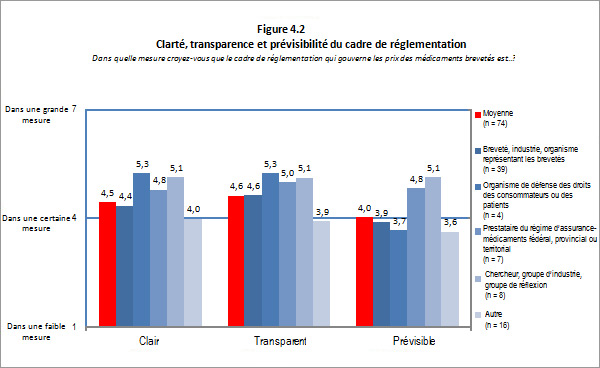
Source : Sondage auprès des intervenants du CEPMB, 2012
4.4 Équilibre entre la prévisibilité et la souplesse
L'un des résultats intermédiaires du Programme de réglementation est que les intervenants considèrent les Lignes directrices comme tenant dûment compte du contexte du cadre législatif et réglementaire du CEPMB. Un aspect important de ce résultat est la perception des intervenants de la capacité des Lignes directrices d'établir un équilibre entre la prévisibilité du processus d'examen des prix et la souplesse requise pour aborder les situations au cas par cas.
On a demandé aux brevetés qui ont été interrogés de formuler des commentaires sur l'équilibre entre la prévisibilité et la souplesse des Lignes directrices du Conseil. Comme on l'a souligné dans la section précédente, les brevetés interrogés croient en général que les Lignes directrices ne sont pas très prévisibles ou souples et qu'elles n'établissent aucun équilibre entre la prévisibilité et la souplesse. Le secteur principal d'imprévisibilité constaté par les brevetés se rapporte à la sélection des médicaments de comparaison. Cette question concerne presque exclusivement les nouveaux médicaments pour lesquels il existe, s'il y en existe, des produits comparables. Comme l'a expliqué un breveté, il existe de l'incertitude quant aux médicaments que le CEPMB utilisera comme produits médicamenteux de comparaison pour établir le prix de nouveaux médicaments, et cela entraîne un risque et de l'incertitude pour les entreprises. Les entreprises peuvent, du fait de cette incertitude, choisir de ne pas lancer un produit d'abord sur un marché canadien. Malgré le fait que la plupart des brevetés estiment que les Lignes directrices manquent de prévisibilité, quelques-uns ont noté qu'il existe une certaine prévisibilité et qu'ils s'attendent à ce que la situation s'améliore grâce aux nouvelles Lignes directrices.
Pour ce qui est de la souplesse, certains brevetés ont indiqué qu'ils s'attendent à ce que le CEPMB applique de façon plus souple les nouvelles Lignes directrices et en fait, quelques-uns ont dit qu'ils ont déjà constaté une plus grande souplesse. Le manque de souplesse a été décrit par les brevetés dans le contexte du Programme d'accès spécial (PAS) et de l'incapacité du personnel de faire des exceptions. Cependant, d'autres brevetés ont noté une certaine souplesse de la part du CEPMB dans l'application des Lignes directrices, indiquant que parfois les brevetés sont en mesure de présenter leur cause devant le personnel.
Dans l'ensemble, les brevetés étaient d'avis que les Lignes directrices n'étaient pas suffisamment souples et prévisibles. Un des problèmes principaux relevés parlait de la complexité des Lignes directrices, ce qui laissait place à leur interprétation et entraînait un manque de prévisibilité. Il y a également des problèmes liés à la sélection des produits de comparaison pour les nouveaux médicaments et à l'approche actuelle, qui manquerait de prévisibilité et de souplesse selon certains brevetés. Quelques brevetés ont noté qu'il est nécessaire de mettre en place une [Traduction] « approche davantage fondée sur le bon sens » et plus simple quant à la façon dont les Lignes directrices sont mises en œuvre.
4.5 Harmonisation des Lignes directrices et du cadre législatif et réglementaire
Comme on l'a déjà souligné, l'un des résultats intermédiaires escomptés du Programme de réglementation est que les intervenants considèrent les Lignes directrices comme tenant dûment compte du contexte du cadre législatif et réglementaire du CEPMB. Les constatations de l'évaluation générale liées à ces résultats sont présentées ci-dessous.
La grande majorité des brevetés interrogés ne croient pas que les Lignes directrices actuelles sont conformes au mandat du CEPMB établi dans la Loi sur les brevets. Les explications fournies portaient sur un mandat perçu ou « glissement de portée », certains brevetés prétendant que le mandat actuel du CEPMB s'étend au-delà de ce que prévoit la Loi sur les brevets. L'argument présenté par ces brevetés stipule que le CEPMB s'affaire à contrôler de plus en plus les prix plutôt que de les examiner, cette dernière fonction étant perçue comme le mandat prévu du CEPMB selon la Loi sur les brevets. Comme un breveté l'a expliqué, [Traduction] « (Le CEPMB) l'examine d'une façon très précise, mais le moral était une moyenne nationale ». Les brevetés représentant les entreprises ou les organisations productrices de médicaments génériques prétendaient qu'il n'était pas prévu que la Loi confère au CEPMB la compétence sur les prix des médicaments génériques brevetés et ainsi le CEPMB n'a pas de mandat relativement aux médicaments génériques brevetés, malgré une récente décision du Conseil qui précise le contraire21.
Cependant, malgré leur opinion selon laquelle les Lignes directrices s'étendent au-delà du mandat du CEPMB, certains brevetés ont fait remarquer que la situation s'était quelque peu améliorée récemment grâce aux nouvelles Lignes directrices et ce qu'ils perçoivent comme un « changement de régime » au CEPMB vu la présence d'une nouvelle présidente et directrice exécutive. Malgré les récents changements apportés aux Lignes directrices et un certain sentiment parmi les brevetés que les nouvelles Lignes directrices représentent une amélioration, la plupart ne croient pas que les Lignes directrices sont raisonnables étant donné le mandat du Conseil et sa loi habilitante. On a cité comme l'une des raisons pour expliquer ce point de vue l'incertitude dans l'application des Lignes directrices, en particulier en ce qui concerne la sélection des médicaments de comparaison; l'absence d'une [Traduction] « approche fondée sur le bon sens » quant à l'application des Lignes directrices; et un accent sur le contrôle des prix plutôt que sur leur examen.
On a demandé à tous les répondants dans quelle mesure ils croyaient que les Lignes directrices du Conseil sont raisonnables dans le contexte du mandat du CEPMB et de sa loi habilitante. Dans l'ensemble, les répondants des catégories autres que celles des brevetés avaient tendance à évaluer le caractère raisonnable des Lignes directrices de façon plus élevée que les brevetés. Les répondants représentant les chercheurs avaient tendance à évaluer le caractère raisonnable des Lignes directrices de façon très élevée. La figure 4.3 ci-dessous présente un sommaire des constatations du sondage.
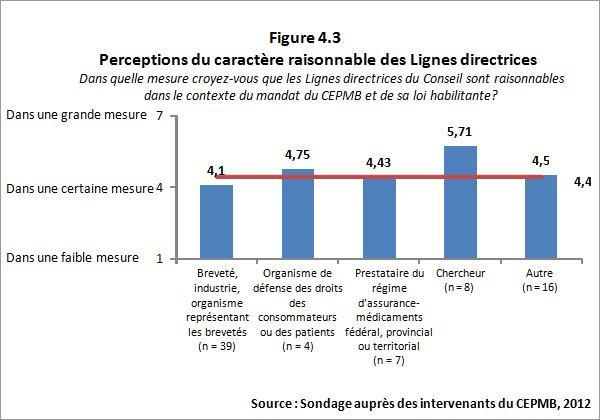
Lorsqu'on leur a demandé d'expliquer pourquoi ils croyaient que les Lignes directrices n'étaient pas raisonnables dans le contexte du mandat du CEPMB et de sa loi habilitante, les répondants ont repris un grand nombre des mêmes préoccupations exprimées par les brevetés interrogés. En particulier, les répondants ont souligné le caractère rigoureux et la complexité des Lignes directrices, un accent perçu sur le contrôle des prix plutôt que de s'assurer que les prix n'étaient pas excessifs, et la perception selon laquelle le Conseil agit comme juge et jury en fonction des recommandations du personnel du CEPMB.
Les répondants de toutes les catégories, à l'exception des brevetés, avaient tendance à évaluer de façon très positive la mesure dans laquelle les Lignes directrices du CEPMB sont conformes au mandat du CEPMB. On a demandé à ceux qui ont indiqué qu'ils ne croyaient pas que les Lignes directrices permettaient de s'assurer que les prix des médicaments brevetés ne sont pas excessifs d'expliquer leur point de vue. Les réponses portaient sur la question du contrôle des prix par opposition à la prévention des prix excessifs, les répondants soutenant que la sélection de médicaments de comparaison et la complexité des Lignes directrices entraînent souvent de faibles prix. La figure 4.4 ci-dessous présente un sommaire des résultats du sondage pour cette question.
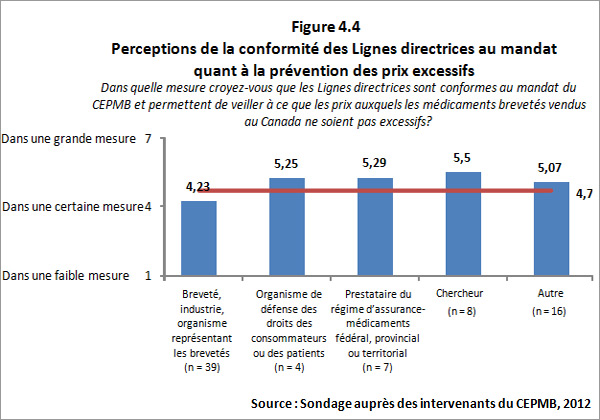
4.6 Mesure dans laquelle les prix ne sont pas excessifs
Le résultat final du Programme de réglementation est que [Traduction] « les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs conformément aux facteurs prévus à la Loi ». Le niveau de succès atteint par le CEPMB dans la réalisation de ce résultat est examiné ci-dessous.
Selon le Rapport annuel du CEPMB de 2010, les ventes de produits médicamenteux brevetés totalisaient 12,9 milliards de dollars en 2010. Le CEPMB utilise l'indice des prix des médicaments brevetés (IPMB) pour surveiller les tendances des prix des produits médicamenteux brevetés vendus au Canada. L'IPMB mesure la variation annuelle moyenne des prix départ-usine à l'aide d'une formule utilisant la moyenne pondérée en fonction des ventes des variations de prix observées au chapitre des produits individuels. Cette méthode est semblable à l'approche utilisée par Statistique Canada pour calculer l'indice des prix à la consommation (IPC). Au fil du temps, la tendance indiquait que les variations de l'IPMB étaient inférieures à l'IPC, ce qui indique que les prix des médicaments brevetés augmentent, en moyenne, à un taux plus faible que l'IPC. Cela indique également que les brevetés n'augmentent pas toujours le prix des médicaments brevetés individuels en fonction de l'IPC, comme le permettent les Lignes directrices. La tendance de l'IPMB par rapport à l'IPC est illustrée à la figure qui suit.
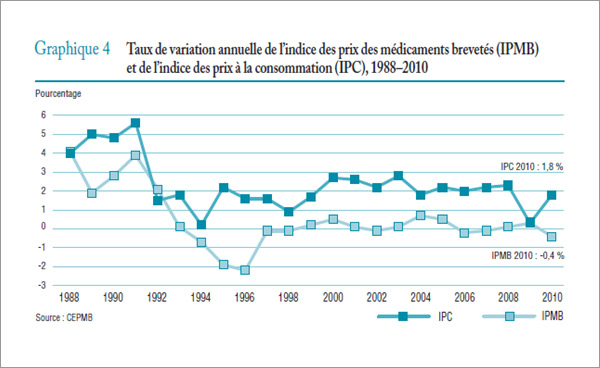
Source : Conseil d'examen du prix des médicaments brevetés (2011). Rapport annuel 2010.
En vertu de la Loi et du Règlement, les brevetés doivent faire rapport au CEPMB des prix départ-usine publiquement accessibles auxquels ils vendent leurs produits médicamenteux brevetés dans les sept pays de comparaison, soit la France, l'Allemagne, l'Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis. Ces renseignements sont utilisés par le CEPMB pour effectuer ses comparaisons des prix internationaux. En général, les prix moyens pratiqués au Canada ont été légèrement inférieurs aux prix moyens pratiqués dans la plupart des pays de comparaison de 2008 à 2010. Les prix pratiqués au Canada sont considérablement inférieurs (en moyenne) aux prix pratiqués aux États-Unis et supérieurs à ceux pratiqués dans la plupart des pays de comparaison européens, à l'exception de l'Allemagne. Les ratios des prix moyens pratiqués dans les pays de comparaison par rapport aux prix moyens pratiqués au Canada de 2008 à 2010 sont illustrés à la figure 4.5 ci-dessous.
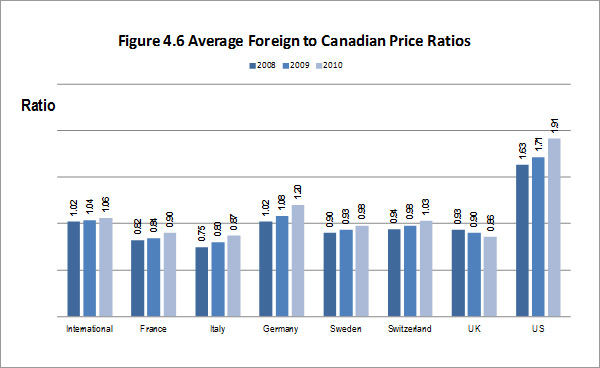
Source : Données sur la mesure du rendement du CEPMB, 2012.
Comme on l'a souligné à la section 4.1, le nombre de médicaments dont le prix est jugé excessif aux termes de la Loi et du Règlement correspondant est demeuré très bas depuis 2007. Pour déterminer si le prix d'un médicament breveté offert sur le marché canadien est excessif, le CEPMB applique les facteurs prévus par la Loi sur les brevets et ses Lignes directrices. En résumé :
- Les prix de la plupart des nouveaux médicaments brevetés sont limités au coût de la pharmacothérapie des médicaments existants vendus au Canada dont l'indication ou l'utilisation approuvée sont les mêmes que le nouveau produit médicamenteux breveté faisant l'objet d'un examen;
- les prix des médicaments constituant une amélioration modeste ou importante, ainsi que les médicaments constituant une découverte, sont assujettis à différents tests;
- les prix des médicaments brevetés existants ne peuvent augmenter davantage que l'indice des prix à la consommation (IPC), au sens de la méthodologie du CEPMB;
- le prix d'un médicament breveté au Canada ne peut sous aucune considération être le plus élevé des prix pratiqués dans les sept pays de comparaison, aux termes du Règlement.
4.7 Résultats inattendus
En ce qui concerne la réglementation, la seule conséquence inattendue fréquemment mentionnée par les personnes interrogées se rapporte au fait que les fabricants peuvent décider de ne pas lancer un médicament sur le marché canadien parce qu'ils ne veulent pas être soumis au processus de réglementation et visés par les résultats du CEPMB. Parmi les personnes interrogées qui ont soulevé ce point comme problème :
- Il y avait une divergence d'opinions sur la question de savoir s'il s'agissait d'un résultat inattendu positif ou négatif, certains indiquant que la disponibilité d'un moins grand nombre de médicaments représentait une conséquence négative parce que cela limitait le choix des consommateurs et pouvait faire en sorte que les médicaments les plus efficaces ne soient pas offerts aux Canadiens. Une personne interrogée a souligné que la présence d'un moins grand nombre de médicaments peut avoir une conséquence positive pour ce qui est de contribuer au maintien de prix peu élevés, selon la méthode adoptée en Nouvelle-Zélande pour empêcher les prix excessifs.
- La plupart ont fait valoir le caractère apocryphe de ce problème, dont ils avaient souvent entendu parler, mais dont ils avaient vu peu de preuve.
Aucune autre conséquence inattendue du Programme de réglementation n'a été aussi souvent mentionnée. Les quelques autres conséquences mentionnées étaient négatives et semblaient spéculatives, dans la mesure où aucune preuve justificative n'a été citée :
- Quelques personnes interrogées croyaient que la réglementation avait entraîné une réduction des dépenses de recherche-développement au Canada. L'une d'elles, qui a soutenu que la participation du Conseil à l'évaluation des produits génériques brevetés n'est pas appropriée, a été plus précise, supposant que les coûts juridiques élevés engagés par les fabricants dans la gestion de la « question des médicaments génériques » pourraient contribuer à la réduction des dépenses de recherche-développement.
- L'approche du CEPMB pourrait dissuader la réduction des prix des anciens produits parce que ce faisant, il est possible que le prix des produits subséquents soit fixé plus bas en raison des produits existants étant utilisés comme produits de comparaison par le CEPMB dans l'établissement des prix.
4.8 Conclusions
Connaissance et sensibilisation
Les constatations de l'évaluation indiquent fortement que le CEPMB a consenti des efforts considérables pour enrichir la connaissance et accroître la sensibilisation des intervenants à l'égard de la Loi, du Règlement, des politiques et des Lignes directrices et des conséquences du non-respect. Ces efforts étaient axés sur la communication de renseignements aux brevetés au moyen de documents et d'activités de sensibilisation ainsi que d'un site Web amélioré. Dans l'ensemble, ces efforts ont porté fruit, les constatations de l'évaluation indiquant qu'une grande proportion de brevetés et d'autres intervenants sont satisfaits des efforts du CEPMB à leur fournir des renseignements sur le cadre législatif ainsi que sur les Lignes directrices et les politiques du Conseil. Les évaluateurs dégagent sans peine que selon les constatations de l'évaluation, les récents efforts du CEPMB ont permis aux brevetés d'enrichir leur connaissance de la Loi, du Règlement, des politiques et des Lignes directrices et de s'y sensibiliser.
Respect du Règlement et des Lignes directrices
Les données tirées de l'évaluation indiquent que les brevetés respectent leur obligation légale de présenter au CEPMB des renseignements sur les ventes. Les données indiquent également une tendance positive quant à la mesure dans laquelle les prix auxquels sont vendus les médicaments brevetés sont conformes aux Lignes directrices, le nombre d'enquêtes entreprises chaque année ayant diminué depuis 2007. La recherche évaluative liée aux audiences est considérée comme trop limitée pour contribuer de façon importante parce que le nombre d'audiences est relativement faible, imprévisible et peut varier considérablement d'une année à l'autre. Selon les données, on peut dégager qu'il existe dans l'ensemble un niveau élevé de respect par les brevetés à l'égard de la Loi, du Règlement et des Lignes directrices.
Clarté, transparence et prévisibilité
Selon les constatations de l'évaluation, le CEPMB a réussi à créer un environnement de réglementation qui est considéré par les intervenants de l'industrie comme clair et transparent. Cependant, bien que l'évaluation des intervenants ait été dans son ensemble positive, leurs commentaires indiquaient que d'autres efforts visant la simplification (et non la précision) seraient appréciés. Autrement dit, les données indiquent que les préoccupations des intervenants sont liées davantage à la complexité inhérente des Lignes directrices, plutôt qu'aux efforts du CEPMB pour les expliquer et les préciser.
Les données suggèrent que cette complexité inhérente semble faire obstacle à la prévisibilité du processus de réglementation, que les intervenants n'ont pas évalué de façon aussi favorable que la clarté et la transparence du processus.
Dans l'ensemble, le CEPMB a réussi à créer un environnement de réglementation qui est clair et transparent. Cependant, davantage d'efforts sont nécessaires pour simplifier les Lignes directrices et ainsi les rendre plus prévisibles (moins susceptibles d'être interprétées ou mal interprétées).
Harmonisation des Lignes directrices et du cadre législatif et réglementaire
Selon les constatations de l'évaluation, la plupart des brevetés ne croient pas que les Lignes directrices actuelles sont conformes au mandat du CEPMB prévu par la Loi sur les brevets ou qu'elles offrent le degré de souplesse et de prévisibilité qu'ils recherchent. Les problèmes les plus souvent mentionnés qui limiteraient le caractère raisonnable, la souplesse et la prévisibilité des Lignes directrices concernaient le mandat et la méthodologie, qui sont tous les deux établis par la loi. Alors que d'autres catégories d'intervenants ont été moins négatives que les brevetés, la perception de l'ensemble des intervenants quant au caractère raisonnable des Lignes directrices se situait uniquement dans les fourchettes inférieures de « plutôt raisonnable », ce qui était appuyé par des raisons semblables à celles exprimées par les brevetés. Certains brevetés ont noté qu'on avait mis un plus gros accent sur le contrôle du prix plutôt que sur l'assurance que les prix ne sont pas excessifs (c.-à-d. ce que certains ont désigné comme un [Traduction] « glissement de mandat ») de la part du CEPMB. Des données probantes pour appuyer ou réfuter cette prétention n'ont pas été relevées au cours de la présente évaluation.
Selon les conclusions de l'évaluation, il semble possible que le CEPMB puisse simplifier davantage les Lignes directrices, mais la majorité des préoccupations exprimées par les intervenants sont liées aux problèmes découlant du mandat législatif du CEPMB. Cependant, il convient également de noter qu'il est dans le plus grand intérêt des brevetés de rechercher des Lignes directrices et un cadre législatif et réglementaire qui soient aussi peu contraignants que possible pour eux et ainsi le CEPMB doit établir l'équilibre entre les besoins des brevetés et ceux du public canadien.
Mesure dans laquelle les prix ne sont pas excessifs
Les critères du cadre pour déterminer si les prix sont excessifs sont les suivants :
- en moyenne, le prix des médicaments brevetés a augmenté à un taux plus faible que l'IPC;
- les prix des médicaments brevetés pratiqués au Canada sont légèrement inférieurs aux prix moyens pratiqués dans la plupart des pays de comparaison;
- le nombre de médicaments dont le prix a été jugé excessif est demeuré très faible durant la période de l'évaluation.
Selon les constatations de l'évaluation et ces critères, on peut dégager que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs.
18 Cette mesure a commencé à faire l'objet d'un suivi dans le cadre des changements apportés aux Lignes directrices en 2010. Avant 2010, les prix de ces médicaments étaient considérés comme conformes aux Lignes directrices. Les critères justifiant la tenue d'une enquête sont les suivants :
- Le prix de transaction moyen national ou le prix de transaction moyen du marché d'un nouveau produit médicamenteux breveté dépasse de plus de 5 % le prix moyen maximal potentiel pour la période de lancement.
- Le prix de transaction moyen national dépasse de plus de 5 % le prix moyen non excessif national.
- Dans le cas d'un produit médicamenteux nouveau ou existant, la valeur des recettes excessives totalise 50 000 $ ou plus.
- Le CEPMB reçoit une plainte selon laquelle le prix du produit médicamenteux est excessif.
19 Cette mesure peut comprendre des enquêtes ou des audiences relatives au prix qui n'étaient pas encore terminées, mais où le produit médicamenteux n'était plus vendu ou breveté au cours de l'année.
20 Les principes d'équité en droit administratif permettent de veiller à ce que les parties comparaissant devant un tribunal reçoivent suffisamment de renseignements de même qu'un avis de l'action envisagée, qu'ils puissent présenter leur cause entièrement et équitablement et que les décisions visant leurs droits et leurs intérêts soient prises dans le cadre d'un processus équitable, impartial et ouvert.
21 Dans l'affaire de la Loi sur les brevets, L.R.C. (1985) ch. P-4, et dans l'affaire de Ratiopharm Inc., Décision : CEPMB-08-D3-ratiopharm – Décision sur le fond, datée du 30 juin 2011, site Web du CEPMB : www.pmprb-cepmb.gc.ca, Audiences et décisions, Liste des décisions du Conseil, Ratiopharm Inc.
5. Réalisation des résultats – Programme sur les tendances relatives aux produits pharmaceutiques
Le présent chapitre porte sur la réalisation des résultats du Programme sur les tendances relatives aux produits pharmaceutiques (TPP). Pour le Programme sur les TPP :
- Le résultat immédiat veut que les intervenants aient accès en temps opportun à des renseignements exhaustifs, pertinents et exacts en ce qui concerne les tendances relatives aux produits pharmaceutiques.
- Le résultat intermédiaire veut que les intervenants connaissent davantage les tendances observées dans le secteur pharmaceutique.
- Le résultat final veut que les intervenants prennent des décisions éclairées.
Les principaux extrants ou produits découlant du Programme sur le TPP sont les suivants :
- analyse des tendances relatives au prix des produits pharmaceutiques au Canada;
- rapport sur les dépenses de recherche-développement au Canada se rapportant aux médicaments;
- rapports sur les tendances relatives aux prix des produits, à leur utilisation et à leur coût au Canada et analyses de ces tendances dans le cadre de l'initiative du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP).
La nature des données de la présente évaluation recueillies permet d'aborder quelques-uns, mais non tous ces résultats en fonction d'un produit. Ainsi, le présent chapitre est organisé selon une combinaison d'intitulés thématiques, certains par résultat et d'autres par produit. La plupart des constatations les plus générales sont présentées en premier, suivies des constatations sur les produits individuels.
5.1 Constatations générales sur l'accessibilité de la recherche du CEPMB
La présente section porte sur l'élément de l'accessibilité du résultat immédiat pour l'ensemble du Programme sur les TPP. Les autres éléments du résultat immédiat (exhaustivité, opportunité et exactitude) sont examinés par produit individuel plus loin dans le présent chapitre.
À leur lancement, les publications sont affichées sur le site Web du CEPMB, une annonce est communiquée sur la page d'accueil du site du CEPMB sous la rubrique « Quoi de neuf @ CEPMB » et un bulletin électronique est envoyé aux abonnés électroniques (environ 900 personnes inscrites à l'heure actuelle). Le CEPMB fait le suivi des statistiques Web depuis août 2011. Le tableau 5.1 présente un sommaire du nombre de pages vues et du nombre de pages vues uniques pour les pages clés du site Web du CEPMB. Toutes les nouvelles publications sont également communiquées dans la publication trimestrielle La Nouvelle du CEPMB. De plus, le rapport annuel du CEPMB et les rapports de recherche clés sont postés aux abonnés (environ 1 000).
Source : Données sur la mesure du rendement du CEPMB, 2012.
Dans le cadre de son plan d'engagement des intervenants de 2012-2013, le personnel du CEPMB prévoit lancer une campagne d'inscription au bulletin électronique visant les groupes de défense des droits des patients, les associations professionnelles de la santé, les universitaires et les tiers payeurs. Les évaluateurs sont d'avis que cela est convenable, étant donné qu'un certain nombre de personnes interrogées dans les catégories de défense des droits des patients et des tiers payeurs ont fait remarquer qu'ils n'étaient pas au courant du type de renseignements ou d'analyses fournis par le CEPMB, et que les connaissances qu'ils ont acquises lors de se préparer pour l'entrevue d'évaluation les ont amenés à souhaiter être mieux informés des efforts du CEPMB. De plus, le CEPMB a récemment lancé un compte Twitter qui vise à s'assurer que le CEPMB demeure ouvert et accessible aux Canadiens et à maximiser l'engagement des intervenants. Le CEPMB a l'intention d'annoncer toutes les publications par Twitter. Tous les exposés présentés par le personnel du CEPMB dans le cadre de conférences et d'activités de sensibilisation comportent un élément concernant les tendances relatives aux produits pharmaceutiques.
Les avis des intervenants interrogés représentant les gouvernements FPT, des utilisateurs de la recherche, des groupes de défense des droits et des tiers payeurs sont partagés quant à la question de savoir si les renseignements sur les tendances relatives aux produits pharmaceutiques sont envoyés aux bonnes personnes. Certains parmi ceux qui croient que les résultats de recherche sont transmis aux bonnes personnes ont nuancé leur réponse en soulignant que dans certains cas les renseignements sont périmés au moment où ils sont publiés. Les membres du Comité directeur du SNIUMP ont indiqué qu'ils reçoivent les rapports avant qu'ils soient publiés. On compte parmi ceux qui ne croient pas que les renseignements sont envoyés aux bonnes personnes les groupes de défense des droits et les tiers payeurs, qui n'étaient pas partie à l'entente originale sur le SNIUMP.
5.2 Constatations générales sur la contribution à la sensibilisation à l'égard des tendances
Le résultat intermédiaire du Programme sur les TPP est que [Traduction] « les intervenants connaissent davantage les tendances observées dans le secteur pharmaceutique ». La mesure dans laquelle le CEPMB a atteint ce résultat est examinée ci-dessous.
Des questions ont été posées aux personnes interrogées sur la portée de leur connaissance des tendances observées dans le secteur pharmaceutique et sur la mesure dans laquelle cette connaissance dépend des renseignements fournis par le CEPMB. L'ensemble des 15 personnes interrogées qui ont répondu à cette question croyaient qu'elles connaissaient très bien les tendances observées dans le secteur, mais seulement trois d'entre elles croyaient que le Conseil avait joué un rôle dans cette sensibilisation. Elles ont toutes indiqué que le rôle joué par le Conseil dans l'accroissement de la sensibilisation était minime ou marginal.
5.3 Constatations générales sur l'utilité de la recherche
La section qui suit décrit les constatations générales liées au résultat final de la [Traduction] « prise de décisions éclairées par les intervenants ». Elle met l'accent sur les perceptions des personnes interrogées. D'autres constatations liées aux produits et fondées sur les données du sondage sont présentées dans les sections relatives aux produits qui suivent.
On a demandé aux personnes interrogées dans quelle mesure les renseignements transmis par le CEPMB ont facilité leur prise de décisions. Parmi elles, un très petit nombre (qui provenaient toutes du secteur FPT, à qui ces renseignements s'adressent) ont dit que les renseignements fournis par le CEPMB ont nettement facilité leur prise de décisions. Dans ce secteur, il y avait une répartition plutôt égale entre celles qui ont dit que les renseignements transmis par le CEPMB ont facilité leur prise de décisions, du moins dans une certaine mesure, et celles qui ont dit qu'ils ont rarement facilité leur prise de décision, voire jamais. Dans les deux groupes, certaines personnes interrogées ont indiqué que leur réponse serait considérablement plus favorable si les renseignements étaient davantage transmis en temps opportun. Cependant, il convient de noter que le rapport annuel du CEPMB ne peut être publié tant qu'il n'a pas été déposé au Parlement, le ministre n'ayant que 15 jours de séance pour déposer le rapport. De plus, le Règlement oblige la présentation des renseignements sur les prix le 30 janvier et des données sur la R-D le 1er mars.
Un certain nombre de personnes interrogées ont été en mesure de donner des exemples de produits d'information qui ont facilité leur prise de décisions. Deux d'entre elles ont mentionné les rapports du SNIUMP sur les prix des médicaments génériques, deux ont noté que les renseignements du SNIUMP avaient servi dans leur prise de décisions et une personne a indiqué que les efforts du CEPMB liés aux marges bénéficiaires du grossiste avaient facilité sa prise de décisions.
On a posé des questions aux personnes interrogées sur les changements constatés dans les tendances relatives à l'utilisation des produits d'information du CEPMB au cours des dernières années. La plupart ont rapporté que leur tendance quant à l'utilisation n'a pas changé.
5.4 SNIUMP
La présente section présente les constatations liées aux résultats immédiats et finaux du Programme sur les TPP qui portent sur la gamme des produits d'information du SNIUMP.
5.4.1 Exhaustivité, opportunité et exactitude
a. Points de vue des personnes interrogées
On a demandé aux intervenants interrogés représentant les régimes d'assurance‑médicaments FPT, les utilisateurs de la recherche, les groupes de défense des droits et les tiers payeurs de formuler des commentaires généraux sur leur satisfaction quant à l'exhaustivité, à l'opportunité et à l'exactitude des renseignements sur les tendances relatives aux produits pharmaceutiques du CEPMB. La majorité des personnes interrogées ont indiqué qu'elles croyaient que les renseignements du CEPMB étaient exhaustifs et exacts. Quelques personnes parmi celles qui trouvaient que la recherche était complète et exacte (en général des membres de la catégorie FPT qui sont membres du Comité directeur du SNIUMP) ont indiqué qu'elles appréciaient la possibilité d'examiner les produits de recherche réalisés dans le cadre de l'initiative du SNIUMP et de formuler des commentaires à leur égard avant qu'ils soient mis au point. D'autres personnes interrogées qui ont exprimé une certaine insatisfaction quant à l'exhaustivité et à l'exactitude des renseignements sur les tendances relatives aux produits pharmaceutiques du CEPMB ont indiqué qu'elles aimeraient que le CEPMB consulte davantage les utilisateurs éventuels.
Depuis 2008-2009, 13 études, qui ont toutes été désignées comme des priorités de recherche par le Comité directeur du SNIUMP, ont été réalisées dans le cadre du Programme sur les tendances relatives aux produits pharmaceutiques. Toutes ces études, à l'exception de deux d'entre elles, devaient être publiées et, à ce jour, 10 des 11 études destinées à la publication l'ont été. Selon les données provenant du Programme sur les tendances relatives aux produits pharmaceutiques, les projets entrepris dans le cadre de l'initiative du SNIUMP s'étendaient sur environ deux exercices22, la durée moyenne étant de huit mois et la proportion de réalisation des études dans les délais établis s'élevant à 70 %.
Les études suivantes ont été achevées depuis l'exercice de 2008‑2009 :
- L'Observateur des médicaments émergents, publiée en juillet 2008
- [Valorisation du régime d'assurance-médicaments du Nouveau-Brunswick],non destinée à la publication
- Effet des baby-boomers sur les dépenses en médicaments d'ordonnance et les demandes de remboursement, publiée en décembre 2010
- Application de la dose quotidienne définie par l'Organisation mondiale de la santé dans les analyses de l'utilisation et des coûts des médicaments au Canada, publiée en décembre 2010
- Médicaments génériques au Canada : Structure de marché – Tendances et répercussions, publiée en décembre 2010
- Médicaments génériques au Canada : Tendances des prix et comparaisons des prix internationaux, 2007, publiée en décembre 2010
- L'Observateur des médicaments émergents, publiée en juillet 2011
- Analyse des facteurs de coût associés aux frais d'exécution d'ordonnance assumés par les régimes publics d'assurance-médicaments de 2001‑2002 à 2007‑2008, publiée en septembre 2011
- Médicaments génériques au Canada : Comparaisons des prix internationaux et économies de coûts potentielles, publiée en septembre 2011
- Incidence de l'arrivée sur le marché des médicaments génériques sur l'utilisation de l'ingrédient, publiée en septembre 2011 (révisée en mai 2012)
- Politiques sur les frais accessoires facturés par les grossistes des régimes publics d'assurance‑médicaments du Canada, publiée en décembre 2011 (révisée en janvier 2012)
- [Brevet : falaise ou pente? Économies du lancement sur le marché passé et futur des médicaments génériques],non destinée à la publication
- [Bandelettes de test glycémiques : Utilisation réelle par opposition aux recommandations], publication à venir.
En général, les personnes interrogées ne trouvent pas que la recherche du CEPMB est suffisamment opportune. Cela s'avère particulièrement vrai pour les représentants des gouvernements FPT. Les personnes interrogées ont indiqué que les renseignements sont souvent périmés au moment où ils sont publiés, ce qui les rend moins utiles aux fins de l'élaboration de politiques et de la planification.
La majorité des personnes interrogées représentant les gouvernements FPT, les utilisateurs de la recherche, les groupes de défense des droits et les tiers payeurs sont satisfaites des instruments de rapport qu'utilise le CEPMB. Certaines de ces personnes ont indiqué qu'elles ont trouvé les notes d'information utiles. Par contre, celles qui ne sont pas entièrement satisfaites des instruments de rapport du CEPMB ont constaté un besoin d'avoir des documents plus courts, moins complexes et qui utilisent un langage clair.
Les avis des intervenants interrogés représentant les gouvernements FPT, les utilisateurs de la recherche, les groupes de défense des droits et les tiers payeurs sont partagés quant à la question de savoir si les extrants et les rapports du Programme sur les tendances relatives aux produits pharmaceutiques sont envoyés aux bonnes personnes. Certains parmi ceux qui croient que les résultats de recherche sont transmis aux bonnes personnes ont nuancé leur réponse en indiquant que dans certains cas les renseignements sont périmés au moment où ils sont publiés. Par exemple, les membres du Comité directeur du SNIUMP ont indiqué qu'ils reçoivent les rapports avant qu'ils ne soient publiés. On compte parmi ceux qui ne croient pas que les renseignements sont envoyés aux bonnes personnes les groupes de défense des droits et les tiers payeurs, qui n'étaient pas partie à l'entente originale sur le SNIUMP. Un membre du personnel du CEPMB rapporte que les membres du Comité directeur du SNIUMP reçoivent des présentations PowerPoint qui résument les principaux résultats dès qu'ils sont disponibles, ce qui précède souvent par de nombreux mois la réception du rapport provisoire du SNIUMP.
b. Points de vue des répondants
Le sondage électronique a fourni davantage de détails sur les produits de recherche du SNIUMP, qui sont présentés ci-dessous. Cependant, en tenant compte de ces renseignements, il conviendrait aux lecteurs de reconnaître que les brevetés représentent le groupe de répondants le plus important, alors que ces produits visent principalement à aborder les priorités de la recherche et les besoins des décideurs FPT et non des brevetés.
On a demandé aux répondants s'ils étaient au courant des renseignements produits dans le cadre de l'initiative du SNIUMP. Dans l'ensemble, 61 % des répondants ont indiqué avoir une bonne connaissance de l'initiative du SNIUMP et de ses produits de recherche. On a en outre demandé à ceux qui ont indiqué en avoir une bonne connaissance d'évaluer la mesure dans laquelle les renseignements produits dans le cadre de l'initiative du SNIUMP sont exhaustifs, exacts et opportuns. Dans l'ensemble, les répondants ont tendance à considérer le travail du SNIUMP comme plutôt exhaustif et opportun et à l'évaluer de façon un peu plus positive sur le plan de l'exactitude. En particulier, les répondants provinciaux et territoriaux, à qui ces produits sont destinés, avaient tendance à évaluer très favorablement l'exactitude des renseignements du SNIUMP. La figure 5.1 qui suit présente un sommaire des résultats par catégorie de répondant.
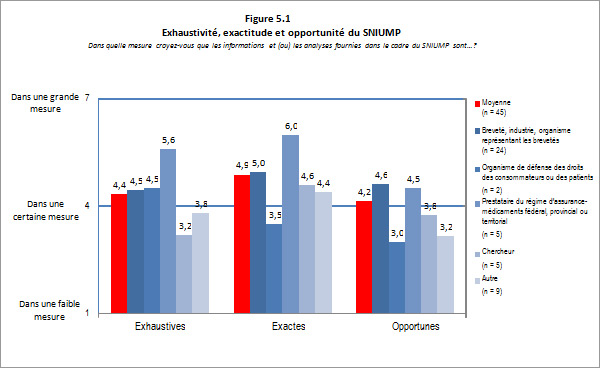
Source : Sondage auprès des intervenants du CEPMB, 2012
On a demandé à ceux qui ont évalué faiblement l'exhaustivité, l'exactitude et l'opportunité des renseignements produits dans le cadre de l'initiative du SNIUMP de fournir une explication. Ceux qui croient que les renseignements relatifs à l'initiative du SNIUMP n'étaient pas exhaustifs ont souligné que ces renseignements ne tiennent pas toujours compte des changements dans le marché pharmaceutique et de du besoin d'obtenir de toutes les provinces un plus grand nombre de données de meilleure qualité. Les répondants qui croient que les renseignements produits dans le cadre de l'initiative du SNIUMP ne sont pas exacts ont indiqué que les données sont souvent périmées, ce qui fait que les rapports sont inexacts. Les répondants qui croient que les rapports du SNIUMP ne sont pas présentés en temps opportun ont expliqué que ces derniers ne sont pas publiés assez rapidement et qu'ils sont ainsi souvent périmés au moment où ils le sont.
On a demandé aux répondants d'évaluer leur satisfaction globale quant aux renseignements produits dans le cadre de l'initiative du SNIUMP selon une échelle de 1 à 7, où 1 représente « dans une faible mesure » et 7 représente « dans une grande mesure ». Les représentants provinciaux et territoriaux à qui sont destinés directement ces produits avaient tendance à dire des renseignements produits dans le cadre de l'initiative du SNIUMP qu'ils étaient de qualité modérée à élevée. Les résultats des autres catégories de répondant indiquaient être peu ou modérément satisfaits.
On a demandé à tous les répondants qui ont dit avoir une connaissance de l'initiative du SNIUMP de quelle façon le CEPMB pourrait améliorer l'établissement de rapports dans le cadre du SNIUMP. On a suggéré les mesures suivantes :
- améliorer la présentation en temps opportun des rapports;
- une meilleure collaboration et un plus grand engagement de la part des intervenants et des décideurs afin de cerner les sujets;
- inclure le Québec23 dans l'analyse;
- effectuer des analyses plus approfondies et nuancées.
5.4.2 Utilité des produits du SNIUMP
Dans l'ensemble, les répondants ont rapporté qu'ils utilisaient très peu ce type de produit d'information. Étant donné que ces renseignements visent davantage les décideurs que les brevetés, il n'est pas surprenant de constater que les chercheurs, les représentants des gouvernements FPT et les groupes de défense des droits des patients les utilisent davantage que les brevetés. Parmi ceux qui ont déclaré utiliser les renseignements et les analyses du SNIUMP, un grand pourcentage d'entre eux (35 %) les utilisait à titre d'information et aux fins d'analyse pour guider la recherche, et 27 % d'entre eux les utilisait pour orienter la planification stratégique et la politique juridictionnelle.
Les résultats du sondage sur l'utilisation des renseignements et des analyses du SNIUMP dans la prise de décisions correspondent aux résultats susmentionnés pour l'utilisation des données. Dans l'ensemble, leur utilisation dans la prise de décision est faible, alors que les représentants des fournisseurs de régimes d'assurance-médicaments FPT et les représentants des groupes de chercheurs, de l'industrie et des groupes de réflexion les utilisent le plus.
On a demandé aux répondants qui ont indiqué avoir une bonne connaissance des renseignements réalisés dans le cadre de l'initiative du SNIUMP si leur utilisation de ce produit du CEPMB avait augmenté, diminué ou était demeurée la même au cours des dernières années. Une majorité (67 %) des répondants ont indiqué que leur utilisation de renseignements fournis dans le cadre du SNIUMP est demeurée la même, mais une importante proportion de représentants de groupes de défense des droits des consommateurs et des patients, de représentants de régimes d'assurance‑médicaments FPT et de représentants des groupes de chercheurs, de l'industrie et des groupes de réflexion ont indiqué que leur utilisation avait augmenté au cours des dernières années.
5.5 Renseignements sur les tendances relatives aux prix
Les sections qui suivent s'appuient sur les commentaires des répondants. Ces réponses proviennent en très grande partie des brevetés, qui ne constituent pas le public à qui les renseignements sur les tendances relatives aux prix sont destinés, lesquels sont ajustés aux besoins des décideurs.
5.5.1 Exhaustivité, opportunité et exactitude
On a demandé aux répondants s'ils avaient connaissance de l'analyse menée par le CEPMB sur les tendances relatives aux prix des produits pharmaceutiques vendus au Canada. Dans l'ensemble, 86 % des répondants ont indiqué en avoir une bonne connaissance. On a en outre demandé à ceux qui ont indiqué en avoir connaissance d'évaluer la mesure dans laquelle la déclaration des tendances par le CEPMB est complète, exacte et opportune. Dans l'ensemble, les répondants avaient tendance à évaluer l'analyse menée par le CEPMB sur les tendances relatives aux prix comme plutôt exhaustive et opportune et de façon légèrement plus positive quant à l'exactitude. La figure 5.2 qui suit présente un sommaire des résultats par catégorie de répondant.
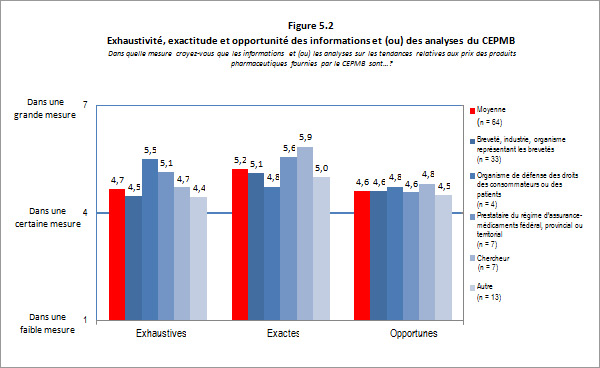
Source : Sondage auprès des intervenants du CEPMB, 2012
On a demandé à ceux qui ont évalué faiblement l'exhaustivité, l'exactitude et l'opportunité de l'analyse menée par le CEPMB sur les tendances relatives aux prix de fournir une explication. Ceux qui pensent que l'analyse des tendances n'était pas complète ont mis l'accent sur le besoin d'obtenir des données plus détaillées ou précises ainsi que des analyses approfondies des tendances relatives aux prix au niveau des prix de détail. Les répondants qui croient que les données sur les tendances ne sont pas exactes ont formulé le commentaire selon lequel les données déclarées par le CEPMB sont inexactes parce qu'elles ne tiennent pas compte des prix réels négociés dans le cadre d'ententes; seuls les prix publiés sont prévus. Les répondants qui croient que l'analyse que mène le CEPMB sur les tendances n'est pas opportune ont expliqué que les données ne leur sont pas transmises dans un délai suffisant à l'élaboration de politiques et (ou) la prise de décisions. Comme un répondant l'a expliqué : [Traduction] « Trop souvent, l'analyse des données est trop périmée pour être utile puisque l'environnement de réglementation a déjà changé. »
On a demandé aux répondants d'évaluer leur satisfaction globale quant à l'analyse menée par le CEPMB sur les tendances relatives aux produits pharmaceutiques selon une échelle de 1 à 7, où 1 représente « dans une faible mesure » et 7 représente « dans une grande mesure ». Les cotes de satisfaction des catégories des répondants à qui ces renseignements sont destinés variaient entre 5 et 5,65 (modérée à très élevée). Comme on le prévoyait, le degré de satisfaction des brevetés était plus faible (4,57), mais même en tenant compte de cela, la cote de satisfaction moyenne globale quant à l'exhaustivité, l'opportunité et l'exactitude se situait à 5,1 sur 7.
On a demandé à tous les répondants qui ont dit avoir une connaissance de l'analyse menée par le CEPMB sur les tendances relatives aux produits pharmaceutiques de quelle façon le CEPMB pourrait améliorer l'analyse. Voici des améliorations suggérées :
- fournir des rapports plus opportuns;
- engager davantage les intervenants, y compris les patients, afin de cerner les besoins;
- inclure les prix payés dans les autres pays;
- permettre le téléchargement de données;
- fournir les tendances relatives aux prix par domaine thérapeutique;
- inclure les commentaires et les données sur les prix et le remboursement relatifs aux régimes d'assurance‑médicaments publics;
- préciser qu'il s'agit de prix départ‑usine et non des prix payés par les consommateurs.
5.5.2 Utilité des renseignements sur les tendances relatives aux prix
Dans l'ensemble, les répondants ont rapporté une faible utilisation de cette information, comprise dans le rapport annuel du CEPMB. Parmi les catégories de répondants au sondage, les chercheurs avaient tendance à démontrer le niveau d'utilisation le plus élevé quant à l'analyse des tendances relatives aux prix. Parmi ceux ayant rapporté qu'ils utilisaient les renseignements et les analyses sur les tendances relatives aux prix, 30 % ont rapporté qu'ils les utilisaient pour élaborer une stratégie de prix et établir des prévisions budgétaires, et 23 % ont rapporté qu'ils les utilisaient à des fins de planification stratégique et d'analyse comparative. D'autres utilisations indiquées comprennent les études de marché, la présentation et l'enseignement et la préparation de rapports et de politiques.
Selon les réponses au sondage, les quatre chercheurs qui ont répondu étaient les plus susceptibles de croire que les renseignements sur les tendances relatives aux prix du CEPMB facilitaient leur prise de décisions. Dans l'ensemble, les répondants croient que l'analyse des tendances relatives aux prix ne contribue pas de façon importante à leur prise de décisions.
Enfin, on a demandé aux répondants qui ont indiqué avoir une bonne connaissance des renseignements sur les tendances relatives aux prix du CEPMB si leur utilisation de ces renseignements avait augmenté, diminué ou était demeurée la même au cours des dernières années. La plupart des groupes de chercheurs, de l'industrie et des groupes de réflexion ont indiqué que leur utilisation avait augmenté au cours des dernières années. Dans l'ensemble, la majorité (69 %) des répondants ont indiqué que leur utilisation des renseignements sur les tendances relatives aux prix est demeurée la même, alors que 19 % ont indiqué que leur utilisation avait augmenté au cours des dernières années.
5.6 Données sur les dépenses de R-D