L'Observateur des médicaments émergents – décembre 2013
ISSN 2292-3144
Numéro de catalogue de la version PDF : H79-5/2014F-PDF
Le CEPMB
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987.
Le CEPMB est investi d'un double rôle : veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs et faire rapport des tendances des prix de vente de tous les médicaments ainsi que des dépenses de recherche et développement (R D) des brevetés.
Le CEPMB rend annuellement compte au Parlement, par l'intermédiaire du ministre de la Santé, de ses activités, des tendances des prix de tous les médicaments et des dépenses de R-D des brevetés.
L'initiative du SNIUMP
Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) fournit des analyses critiques des tendances des prix des médicaments d'ordonnance, de l'utilisation faite de ces médicaments et des coûts en médicaments au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux participants.
L'initiative du SNIUMP est un partenariat entre le CEPMB et l'Institut canadien d'information sur la santé. Elle a vu le jour en 2001 à la suite d'une entente entre les ministres fédéral, provinciaux et territoriaux de la Santé.
Remerciements
Le présent rapport a été rédigé par le Conseil d'examen du prix des médicaments brevetés (CEPMB) au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP).
Le CEPMB tient à remercier les personnes suivantes pour leurs contributions :
- les membres du Comité directeur du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport;
- Greg McComb, économiste principal et membre du SNIUMP, au CEPMB, pour sa contribution au contenu analytique du présent rapport, de même que le groupe scientifique et l'équipe de révision du CEPMB;
- Patricia Carruthers-Czyzewski (B.Sc.[phm.], M.Sc.) de Sintera Inc., pour son expertise pharmaceutique dans le cadre de l'élaboration de la méthodologie et les contributions scientifiques du rapport.
Avis de non-responsabilité
Le SNIUMP est une initiative de recherche qui fonctionne indépendamment des activités de réglementation et de présentation de rapports du CEPMB. Les déclarations et les opinions exprimées dans le présent rapport du SNIUMP ne représentent pas la position officielle du CEPMB.
1. Introduction
Voici la cinquième livraison de L'Observateur des médicaments émergents (OMÉ), une publication qui présente des renseignements sur les médicaments en cours de développement qui peuvent avoir une incidence sur les dépenses des régimes fédéral, provinciaux et territoriaux (F-P-T) d'assurance-médicaments. Chaque rapport comprend une liste de médicaments émergents trouvés dans le cadre d'une recherche dans la base de données BioPharm InsightMD1, une base de données spécialisée qui présente des renseignements sur plus de 21 000 médicaments ayant atteint la phase des essais cliniques. Cette recherche est appuyée par des documents pharmaceutiques publiés, tout particulièrement des études canadiennes.
Seuls les médicaments qui répondent à un ensemble de critères de sélection pourraient intéresser l'OMÉ. Les critères de sélection ont été preparés par Sintera Inc. pour le CEPMB et approuvés par le Comité directeur du SNIUMP en 20061. Cette approche normalisée s'applique de façon uniforme à toutes les livraisons de l'OMÉ. Les critères sont les suivants : la phase du développement, l'indication, le mécanisme d'action et l'incidence sur la pratique clinique. Un algorithme sous forme d'arbre décisionnel a été élaboré afin que les critères soient appliqués de façon uniforme, une étape à la fois. Une fois qu'une liste préliminaire est sélectionnée, on s'emploie à y inclure les médicaments émergents tirés d'un ensemble varié de catégories thérapeutiques dont les médicaments sont admissibles à un remboursement par les régimes publics d'assurance-médicaments. Une attention particulière est accordée aux nouveaux médicaments à coût élevé qui pourraient avoir une incidence financière, aux catégories auxquelles appartiennent ces médicaments ainsi qu'aux catégories comprenant une part élevée de médicaments génériques.
Tout comme les autres livraisons de l'OMÉ, la présente met à jour l'état des médicaments émergents identifiés dans les livraisons précédentes. Certains médicaments ont été retirés de la liste, soit parce qu'ils ont été introduits sur le marché canadien, soit parce que leur fabricant n'effectue plus d'essais cliniques. Réciproquement, les médicaments ont été conservés dans la liste si les essais en cours soutiennent l'évaluation initiale qui a justifié l'ajout à la liste.
La présente livraison comporte six sections. Suivant l'introduction, la section 2 fournit un aperçu des critères utilisés aux fins de sélection des médicaments, tandis que la section 3 décrit l'algorithme qui a servi à appliquer les critères. La section 4 porte sur la recherche dans la base de données BioPharm Insight ainsi que sur l'examen des documents publiés, et elle présente une liste des médicaments identifiés aux fins du présent rapport. La section 5 donne des mises à jour sur les médicaments émergents identifiés dans les rapports précédents, alors que la section 6 présente une liste des références citées dans le rapport.
2. Critères de sélection des médicaments
La présente section décrit brièvement les critères ayant servi à sélectionner les médicaments émergents.
2.1 Phase du développement
L'OMÉ ne traitera que des médicaments ayant atteint la phase III des essais cliniques. La phase III des essais cliniques est la dernière étape avant la soumission réglementaire, et elle met à l'essai l'efficacité et la sécurité d'un nouveau médicament au sein de groupes de patients randomisés de grande taille. Les médicaments qui atteignent ce niveau sont plus susceptibles d'être commercialisés dans un avenir prochain. D'autre part, les médicaments se trouvant à des stades de développement moins avancés ne passent pas nécessairement toute la filière de l'approbation.
2.2 Indication et domaine thérapeutique
Les médicaments sont jugés des candidats potentiels de l'OMÉ s'ils peuvent servir à traiter des affections virtuellement mortelles, des affections pour lesquelles il n'existe aucun traitement, des maladies rares ou, encore, s'ils sont susceptibles de faire changer la pratique clinique à l'intérieur d'un domaine thérapeutique.
2.3 Description du médicament
Parmi les éléments descriptifs des médicaments qui indiquent qu'un nouveau médicament pourrait donner lieu à un changement de la pratique clinique, citons les suivants : premier médicament de sa catégorie, mécanisme d'action différent, technologie nouvelle, thérapie d'appoint, médicament-niche, médicament existant administré pour une indication nouvelle.
2.4 Incidence clinique et autre
Les médicaments doivent être susceptibles d'avoir une incidence clinique importante ou une incidence marquée sur d'autres secteurs du régime de soins de santé. Mentionnons, entre autres, une meilleure efficacité par rapport aux médicaments existants, des bienfaits pour la santé des patients, tels qu'une plus grande espérance de vie ou une meilleure qualité de vie, des résultats nouveaux ou redéfinis et un profil d'innocuité amélioré.
3. Méthode d'application des critères
L'OMÉ tire surtout son information de la base de données BioPharm Insight. Cette base de données fait le suivi des médicaments depuis leur découverte préclinique jusqu'aux données sur leurs ventes, en passant par les essais cliniques et leur commercialisation.
Cette base de données contient de vastes renseignements sur plus de 21 000 médicaments expérimentaux. Son moteur de recherche permet de sélectionner les médicaments selon différents critères, notamment la phase de développement, le domaine thérapeutique, l'indication, le mécanisme du médicament, les médicaments orphelins, la filière d'approbation rapide et le type de molécule.
Vous trouverez dans la figure 1 l'algorithme établi pour faire la sélection des médicaments. Il combine la capacité de recherche de la base de données BioPharm Insight avec le critère clé utilisé pour identifier les médicaments susceptibles d'avoir une grande incidence. Étant donné que les sources d'information de cette base de données sont en large partie américaines, des sources supplémentaires sont utilisées pour vérifier si les nouveaux médicaments sont en développement au Canada.
Figure 1. Algorithme de sélection des médicaments pour L'Observateur des médicaments émergents
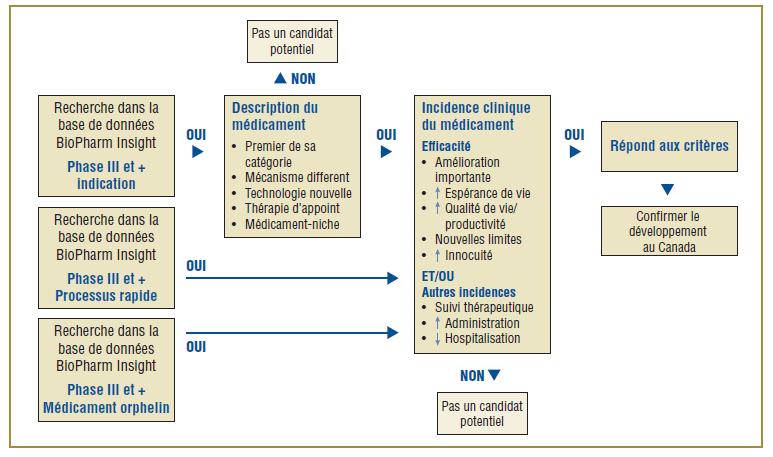
La première étape est l'identification des médicaments auxquels pourrait s'intéresser l'OMÉ. À cette fin, une recherche est faite dans la base de données BioPharm Insight pour trouver les médicaments en phase III du développement. Dans certains cas, les essais de phase III peuvent être à leurs tout débuts et dans d'autres, des résultats seront disponibles. Les médicaments en phase III du développement sont soumis à une procédure de sélection selon le domaine thérapeutique sur lequel agit le médicament et selon l'indication. Un médicament est considéré un candidat potentiel pour l'OMÉ si la US Food and Drug Administration (FDA) l'inscrit comme médicament orphelin, qui traite une maladie rare, si son processus d'approbation est accéléré étant donné qu'il doit traiter une affection grave ou virtuellement mortelle ou, encore, si le médicament semble pouvoir traiter des affections pour lesquelles il n'existe encore aucun médicament.
Pour les médicaments dont le processus de développement n'est pas accéléré ou qui ne sont pas désignés orphelins, la recherche de leur profil est faite à l'aide de mots clés se rapportant à un descripteur précis, comme premier de sa catégorie thérapeutique, mécanisme différent, technologie nouvelle, thérapie d'appoint, médicament-niche, ou médicament existant avec une nouvelle indication. Par la suite, les résultats de la phase III de ces médicaments sont analysés pour valider les caractéristiques du médicament identifiées dans le profil, comme une bien meilleure efficacité ou innocuité. À ce point-ci, les médicaments arrivant au stade des essais cliniques de phase III sont rejetés du fait que l'information n'est pas suffisante pour l'évaluation scientifique.
Ensuite, les sources canadiennes sont consultées pour déterminer si le médicament est en cours de développement au Canada. La principale source d'information est le Pharmacy Practice, qui publie une liste annuelle de nouveaux médicaments prometteurs ayant atteint les derniers stades de développement (phase III ou au-delà) au Canada. On procède ensuite à l'évaluation scientifique des médicaments identifiés. Si les résultats préliminaires de la phase III révèlent une incidence au niveau de l'efficacité ou de l'innocuité, on examine alors la possibilité d'inclure les médicaments dans l'OMÉ. Enfin, pour confirmer l'ajout d'un nouveau médicament à l'OMÉ, on vérifie si le médicament est susceptible d'être inscrit sur la liste des médicaments admissibles à un remboursement par les régimes F-P-T d'assurance-médicaments, à la lumière de l'indication du médicament et de sa forme posologique.
4. Identification des médicaments auxquels pourrait s'intéresser L'Observateur des médicaments émergents
4.1. Recherche dans la base de données BioPharm Insight
La première étape de l'identification des médicaments consistait en une recherche dans la base de données BioPharm Insight. Comme lors des analyses précédentes, seuls les médicaments qui étaient en phase III du développement ou qui faisaient l'objet d'un examen par la FDA (c.-à-d. une présentation de drogue nouvelle [NDA] ou une demande de licence biologique [BLA]) ont été sélectionnés. La recherche de médicaments a été effectuée du 3 au 13 septembre 2013, conformément à l'algorithme décrit dans la section précédente.
La base de données Biopharm Insight est mise à jour régulièrement : certaines données sont mises à jour selon des intervalles de quelques heures, tandis que d'autres sections font l'objet de mises à jour hebdomadaires selon les nouveaux renseignements fournis à la source.1 Peu avant la publication, le statut des médicaments inclus dans l'OMÉ a été vérifié en fonction des renseignements à jour dans la base de données Biopharm Insight.
Le tableau 1 résume les résultats de la recherche par domaine thérapeutique. On a examiné le profil de chacun de ces médicaments dans la base de données, en accordant une attention particulière au champ « drug description » (description du médicament). La recherche a porté sur des mots clés précis comme « premier de sa catégorie » et « mécanisme différent ». Si ces mots clés étaient trouvés, l'étape suivante consistait à déterminer les résultats des essais cliniques de phase III, le cas échéant. Sous le critère « development history » (historique du développement) du profil du médicament, les détails concernant les résultats de la phase III de ces médicaments ont été analysés pour valider de façon plus approfondie les caractéristiques du médicament, p. ex. une meilleure efficacité ou innocuité. Si cette analyse révélait une efficacité insuffisante ou un problème d'innocuité, le médicament était rejeté à la sélection.
Tableau 1. Résultats de la recherche dans BioPharm Insight par domaine thérapeutique
| Domaine thérapeutique |
Nombre de résultats pertinents |
| En phase III |
Présentation NDA/BLA |
| Cancer |
213 |
36 |
| Cardiovasculaire |
58 |
34 |
| Système nerveux central |
64 |
62 |
| Dermatologie |
36 |
9 |
| Yeux et oreilles |
36 |
10 |
| Système gastro-intestinal |
47 |
33 |
| Système génito-urinaire |
34 |
22 |
| Hématologique |
46 |
26 |
| Infections au VIH |
9 |
8 |
| Système hormonal |
76 |
33 |
| Système immunitaire |
77 |
33 |
| Maladies infectieuses |
105 |
69 |
| Système musculosquelettique |
54 |
10 |
| Néphrologie |
10 |
5 |
| Douleur |
54 |
35 |
| Système respiratoire |
31 |
19 |
| Total* |
950 |
444 |
* Le nombre total des résultats pertinents des essais de phase III ne correspond pas forcément au nombre total rapporté; ceci est attribuable au fait que certains médicaments peuvent être classés dans plus d'une catégorie thérapeutique.
Le tableau 2 présente une liste fonctionnelle des médicaments qui ont été sélectionnés aux fins de cette étape. Les médicaments biologiques sont indiqués à part puisqu'il s'agit de médicaments onéreux susceptibles d'avoir une incidence sur les régimes d'assurance-médicaments. Des 199 médicaments sélectionnés, 51 étaient des médicaments biologiques. Dans la plupart des domaines thérapeutiques, on a identifié un ou plusieurs médicaments biologiques, le plus grand nombre de résultats pertinents ayant été rapportés au chapitre des classifications du cancer (24) et du système immunitaire (5).
Tableau 2. Médicaments particuliers sélectionnés par domaine thérapeutique
| Domaine thérapeutique |
Nombre de résultats pertinents |
| En phase III |
Présentation NDA/BLA |
| Chimique |
Biologique |
Chimique |
Biologique |
| Cancer |
41 |
23 |
16 |
1 |
| Cardiovasculaire |
5 |
1 |
5 |
0 |
| Système nerveux central |
5 |
1 |
7 |
0 |
| Dermatologie |
1 |
3 |
2 |
0 |
| Yeux et oreilles |
0 |
0 |
1 |
1 |
| Système gastro-intestinal |
1 |
0 |
4 |
0 |
| Système génito-urinaire |
2 |
0 |
1 |
0 |
| Hématologique |
3 |
2 |
2 |
0 |
| Infections au VIH |
1 |
0 |
1 |
0 |
| Système hormonal |
4 |
3 |
8 |
1 |
| Système immunitaire |
5 |
3 |
2 |
2 |
| Maladies infectieuses |
6 |
3 |
8 |
1 |
| Système musculosquelettique |
5 |
4 |
3 |
0 |
| Néphrologie |
3 |
1 |
0 |
0 |
| Douleur |
0 |
0 |
2 |
0 |
| Système respiratoire |
0 |
1 |
4 |
0 |
| Total : En phase III et présentation NDA/BLA |
82 |
45 |
66 |
6 |
| Total |
199 |
Pour réduire davantage la liste, tous les médicaments sélectionnés ont été vérifiés par rapport à la plus récente liste des médicaments émergents publiée dans Pharmacy Practice3 afin de vérifier s'il s'y trouvait des renseignements relatifs à des développements sur le marché canadien. L'étape suivante consistait en l'évaluation scientifique de cette liste préliminaire. À la suite de l'évaluation, on a passé en revue les détails concernant les résultats de la phase III tirés des profils de médicaments dans la base de données BioPharm Insight, en cherchant tout particulièrement d'importantes améliorations aux résultats en matière d'efficacité et d'innocuité. De plus, on a effectué une recherche dans la base de données MEDLINEMD afin d'avoir une idée de la façon dont le médicament était perçu dans les documents publiés.
À la dernière étape du processus de sélection, on s'est employé à inclure les médicaments émergents tirés d'un ensemble varié de catégories thérapeutiques dont les médicaments sont admissibles à un remboursement par les régimes publics d'assurance-médicaments. On a aussi tenu compte de l'incidence financière potentielle sur les régimes publics d'assurance médicaments. On peut s'attendre à ce que les nouveaux médicaments introduits dans une catégorie à utilisation élevée (p. ex. cardiovasculaire) ou comportant des médicaments coûteux (p. ex. cancer) augmentent l'ensemble des dépenses associées à un régime d'assurance médicaments. La même logique s'applique aux médicaments introduits dans des catégories thérapeutiques comprenant une part élevée de médicaments génériques. Par exemple, bon nombre de médicaments coûteux conçus pour réduire le taux élevé de cholestérol (atorvastatine, simvastatine et pravastatine) se sont récemment vu retirer leur protection associée au brevet et ont été remplacés par des médicaments génériques moins coûteux. Si un nouveau médicament présentant une amélioration thérapeutique importante est lancé sur ce marché, il peut s'avérer un important facteur de coût.
4.2 Médicaments ajoutés à L'Observateur des médicaments émergents
Le tableau 3 présente une liste de nouveaux médicaments ajoutés à l'OMÉ. Chaque médicament a satisfait aux critères de sélection mentionnés à la section 3. La liste comprend le nom de marque du médicament, l'entreprise, le domaine thérapeutique et la justification de son ajout à l'OMÉ.
Tout comme lors des précédentes étapes du processus de sélection, on a identifié les médicaments biologiques; 2 des 12 médicaments ajoutés à la présente livraison de l'OMÉ appartiennent à cette catégorie. Ils sont mis en évidence dans le tableau pour faciliter leur identification.
Tableau 3. Médicaments ajoutés à L'Observateur des médicaments émergents
| Médicament (nom de marque)* – Entreprises** |
Domaine thérapeutique (ATC) – Indication |
Justification de l'ajout à l'OMÉ |
| Cancer |
|
Sotatercept
Acceleron Pharma;
Celgene Corporation
|
Cancer (L01)
Anémie, cancer du sein
|
- Essais de phase III en cours
- Potentiel de stimuler la formation osseuse : besoin médical non satisfait dans le cas du traitement d'une perte osseuse
- Études cliniques en cours pour étudier la possibilité de traiter l'anémie et des pathologies caractérisées par une érythropoïèse inefficace
- Administré par injection sous-cutanée
- Piège à ligand-récepteur d'activine qui renverse la perte osseuse et diminue le degré d'ostéoporose4
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
|
Tavocept
BioNumerik Pharmaceuticals;
Takeda Pharmaceutical Company Limited
|
Cancer (L01)
Thérapie d'appoint pour prévenir une cytotoxicité
|
- Essais de phase III en cours
- La FDA a autorisé la désignation de développement accéléré.
- L'objectif consiste à prévenir des effets secondaires fréquents et graves, notamment des lésions neurologiques et rénales, causés à la suite de traitements avec des médicaments au taxane et de sels de platine, lesquels sont d'usage courant dans le traitement de cancers.
- Thérapie d'appoint par injection intraveineuse : en association avec l'administration du paclitaxel et du cisplatine5
- Agent cytoprotecteur
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
|
Vatalanib
Bayer AG; Novartis AG
|
Cancer (L01)
Cancer colorectal
|
- Essais de phase III en cours
- Potentiellement le premier inhibiteur de la tyrosine kinase administré par voie orale à être utilisé à long terme en association avec une chimiothérapie standard pour le traitement de patients atteints d'un cancer colorectal métastatique
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Cardiovasculaire |
|
LCZ696
Novartis AG
|
Cardiovasculaire (C09)
Hypertension
|
- Essais de phase III en cours pour l'hypertension et essais de phase II pour l'insuffisance cardiaque
- Si les essais de phase III font la démonstration de meilleurs résultats cliniques, il pourrait donner lieu à une nouvelle norme de soins; la norme actuelle en matière de soins dans un cas d'insuffisance cardiaque consiste à administrer des inhibiteurs de l'enzyme de conversion de l'angiotensine (IECA) (p. ex. l'énalapril).
- Médicament à double action administré par voie orale avec un ingrédient premier de sa catégorie : l'inhibiteur des récepteurs de l'angiotensine et de la néprilysine
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
|
Mipomersen(Kynamro)
Genzyme Corporation, a Sanofi Company;
Isis Pharmaceuticals, Inc.
|
Hypolipémiant (C10)
Hypercholestérolémie
|
- Approuvé par la FDA en janvier 2013
- Premier médicament de sa catégorie : un oligonucléotide inhibiteur de la synthèse de l'apolipoprotéine B-100
- Population potentiellement importante : [Traduction] « Bien que l'administration du mipomersen soit restreinte à l'hypercholestérolémie familiale grave comme thérapie supplétive à la LDLaphérèse, il sera probablement prescrit plus fréquemment dans les cas de patients à risque élevé d'affections cardiovasculaires, en particulier chez ceux qui sont résistants ou intolérants à une thérapie de haute intensité par des statines6. »
- [Traduction] « Niveaux de la LDL-C, de l'apolipoprotéine B et de la lipoprotéine A (Lp(a)) sensiblement moindres chez les patients hypercholestérolémiques avec, ou à risque de présenter, une affection cardiovasculaire non maîtrisée par les thérapies actuelles7. »
- Injections sous-cutanées une fois par semaine
- Indiqué comme complément à des hypolipidémiants et à un régime alimentaire pour les patients atteints d'hypercholestérolémie familiale homozygote
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Système nerveux central |
|
Édivoxétine
Eli Lilly and Company
|
Système nerveux central (N06)
Dépression;
trouble d'hyperactivité avec déficit de l'attention (THADA)
|
- Essais de phase III en cours
- Inhibiteur hautement sélectif de recapture des transporteurs de la norépinéphrine, administré par voie orale
- Population importante : Il est étudié comme thérapie d'appoint pour un trouble dépressif majeur et comme monothérapie pour le trouble d'hyperactivité avec déficit de l'attention (THADA) chez l'enfant.
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Yeux et oreilles |
|
Aflibercept (Eylea)
Bayer AG;
Regeneron Pharmaceuticals, Inc.;
Santen Pharmaceutical Co., Ltd.
|
Ophtalmologie (S01)
Dégénérescence maculaire
Médicament biologique
|
- Approuvé par la FD
- Injection intravitréenne
- Inhibiteur du facteur de croissance de l'endothélium vasculaire
- Efficacité comparable au ranibizumab (Lucentis), mais il est administré à des intervalles de huit semaines, ce qui indique le potentiel d'atténuer le risque associé à l'administration une fois par mois d'injections intravitréennes et diminue le fardeau d'un suivi mensuel8.
- Passer à une thérapie avec l'aflibercept est efficace dans le cas de patients avec une vasculopathie polypoïdale choroïdienne qui développent une tachyphylaxie contre le ranibizumab9.
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Système gastro-intestinal |
|
Chlorhydrate de lorcasérine (Belviq)
Arena Pharmaceuticals, Inc.; CY Biotech Company Ltd.; Eisai Co., Ltd.;
Ildong Pharmaceutical Co., Ltd.
|
Système gastro-intestinal (A08)
Obésité
|
- Approuvé par la FDA en juin 2012
- Nouvelle catégorie thérapeutique
- Population importante; forte demande
- Agoniste du récepteur 5-HT2C de la sérotonine (5-hydroxytryptamine, 5-HT) qui régule la prise d'aliments
- [Traduction] « Les données sur les résultats cardiovasculaires seront d'une valeur inestimable pour déterminer l'utilisation éventuelle de la lorcasérine et la place qu'elle occupera en thérapeutique 10. »
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Système génito-urinaire |
|
NX-1207
Nymox Pharmaceutical Corporation;
Recordati S.P.A.
|
Système génito-urinaire (G04)
Hyperplasie bénigne de la prostate
|
- Essais de phase III en cours
- Premier de sa catégorie pour le traitement de l'hyperplasie bénigne de la prostate, une pathologie qui cause des problèmes urinaires associés avec le vieillissement
- Intervention effectuée en cabinet médical au moyen d'une injection intraprostatique par voie transrectale guidée par échographie
- [Traduction] « Dans les quatre essais cliniques effectués à ce jour aux États-Unis sur le NX-1207, on a constaté une atténuation des symptômes passablement plus prononcée qu'avec les médicaments actuellement approuvés pour soigner l'hyperplasie bénigne de la prostate, sans problèmes majeurs liés à l'innocuité11. »
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Hématologique et maladies infectieuses |
|
Alisporivir
Debiopharm Group;
Novartis AG
|
Anti-infectieux (J05)
Sida; hépatite C
|
- Essais de phase III en cours pour le sida et essais de phase II pour l'hépatite C
- Premier antiviral de sa catégorie ciblant les cellules hôtes : inhibiteurs de la cyclophiline
- Sous forme injectable
- Candidat intéressant pour des combinaisons permettant d'éviter l'administration de doses d'interféron12
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
| Système musculosquelettique |
|
Ataluren
Genzyme Corporation, a Sanofi Company;
PTC Therapeutics, Inc.;
Sanofi
|
Thérapie génique
Fibrose kystique
|
- Essais de phase III en cours
- La FDA a autorisé la désignation de processus rapide.
- Médicament administré par voie orale qui permet aux ribosomes de décoder à l'aide des codons d'arrêt prématurés présents dans l'acide ribonucléique messager (ARNm) en vue de produire une protéine fonctionnelle
- [Traduction] « La modification du gène sous-jacent offre la perspective d'une nouvelle thérapie contre la fibrose kystique13. »
|
| Système respiratoire |
|
Lebrikizumab
Chugai Pharmaceutical Co., Ltd;
Genentech, Inc.;
Roche
|
Système respiratoire (R07)
Asthme
Médicament biologique
|
- Essais de phase III en cours
- Injection
- Premier médicament biologique de sa catégorie pour le traitement de l'asthme
- Inhibiteur de l'interleukine 13 (IL-13) qui procure des bienfaits aux patients dont l'asthme est mal maîtrisé
- [Traduction] « Les antagonistes de l'IL-13 peuvent combler d'importants besoins non satisfaits chez les patients dont l'asthme est mal maîtrisé et lorsqu'il y a présence d'indices biologiques d'une activité persistante de l'IL 1314. »
- Thérapie ciblée destinée aux patients dont les niveaux de périostine sérique sont supérieurs, une caractéristique de la fibrose sous-épithéliale, permettant d'envisager la possibilité de modifier, à long terme, la configuration des voies respiratoires15
- Le médicament figure sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
* Si le nom du médicament et le nom de marque sont les mêmes, seulement une entrée figure sur la liste.
** Entreprises qui « développent un médicament » selon la définition de la base de données BioPharm InsightMD. Plus d'une entreprise peut mettre au point un même médicament et le commercialiser, et leur relation peut être définie par voie d'un contrat de licence.
Abréviations : CDK-4, kinase dépendante des cyclines 4; EMA, Agence européenne des médicaments; FDA, Food and Drug Administration.
5. Mises à jour
5.1. Médicaments conservés dans la liste des médicaments émergents
Le tableau 4 présente la liste des médicaments inclus dans les livraisons antérieures de l'OMÉ qui demeurent des candidats aux fins de la liste des médicaments émergents. On y trouve des mises à jour fondées sur les documents scientifiques récemment publiés ainsi que la raison pour laquelle on a conservé les médicaments dans la liste des médicaments émergents.
Tableau 4. Médicaments conservés dans la liste des médicaments émergents
| Médicament (nom de marque) – Entreprises |
Domaine thérapeutique (ATC) – Indication |
Mise à jour et justification de la conservation dans la liste des médicaments émergents |
|
Agomélatine (Valdoxan)
Les Laboratoires Servier;
Novartis AG
|
Antidépresseurs (N06A)
Troubles dépressifs majeurs
|
Description précédente :
- Approuvée par la FDA et l'EMA (BioPharm Insight); non commercialisée aux États-Unis16
- Premier médicament d'ne nouvelle catégorie d'antidépresseurs doté d'un mécanisme d'action unique : un antidépresseur mélatoninergique
Mise à jour :
- [Traduction] « Puisque l'agomélatine comporte un mécanisme d'action qui diffère des autres agents, elle peut représenter une option inestimable comme thérapie supplétive pour les patients qui ne réagissent pas adéquatement aux autres antidépresseurs ou qui ne tolèrent pas leurs effets secondaires17. »
Justification : Les documents publiés continuent d'indiquer que l'agomélatine constitue une nouvelle approche importante en matière de lutte contre la dépression, son efficacité étant à tout le moins comparable, et peut-être supérieure, avec possiblement moins d'effets secondaires.
|
|
Albiglutide (Syncria)
GlaxoSmithKline plc;
Human Genome Sciences, Inc.
|
Diabète (A10) et thérapie cardiaque (C01)
Diabète de type 2 et insuffisance cardiaque
Médicament biologique
|
Description précédente :
- Présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative au diabète de type 2; non commercialisée aux États-Unis16
- Essais de phase II en cours sur l'insuffisance cardiaque (base de données BioPharm Insight)
- Injection sous-cutanée; un agoniste du GLP-1 de longue durée (une injection par semaine)
- Taux global de satisfaction plus élevé à l'égard du traitement chez les patients en raison de la facilité d'emploi et de la possibilité de doses moins fréquentes18
Mise à jour :
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que l'albiglutide est efficace et peut améliorer le respect de la posologie en raison de la facilité d'administration.
|
|
Cetilistat (Cametor)
Norgine BV;
Takeda Pharmaceutical Company Limited
|
Agents antiobésité (A08)
Obésité
|
Description précédente :
- Essais de phase III sur l'obésité terminés aux États-Unis; présentation de drogue nouvelle (NDA) soumise au Japon
- Perte de poids semblable à celle observée avec l'orlistat (Xenical), mais avec jusqu'à 90 % moins d'effets secondaires gastro intestinaux19; pourrait donc s'avérer une meilleure option pour une population importante
Mise à jour :
- Approuvé par la FDA (base de données Biopharm Insight)
- Décrit comme [Traduction] « une thérapie émergente pour l'obésité20»
- Le médicament ne figure plus sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Bien que peu de nouveaux documents aient été publiés sur le médicament, celui-ci peut s'avérer une option mieux tolérée pour le traitement de l'obésité.
|
|
Darapladib
DiaDexus LLC;
GlaxoSmithKline plc;
Human Genome Sciences, Inc.
|
Thérapie cardiaque (C01)
Athérosclérose
|
Description précédente :
- Nouvelle catégorie : inhibiteur de la phospholipase A2 associée aux lipoprotéines (Lp-PLA2)
- Différent mécanisme d'action sur l'athérosclérose comparativement aux statines
- Risque cardiovasculaire réduit; entrave la formation de plaques d'athérosclérose; peut affecter les résultats pour le patient (infarctus du myocarde, accident vasculaire cérébral, décès cardiovasculaire)21
Mise à jour :
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
- Selon les prévisions, les essais de phase III seront terminés en novembre 201422.
Justification : Les documents publiés continuent d'indiquer que le darapladib pourrait s'avérer un important médicament émergent.
|
|
Ecallantide (Kalbitor)
Dyax Corporation;
Sigma-Tau Pharmaceuticals
|
Antihémorragiques (B02)
Angio-œdème héréditaire (AOH)
Médicament biologique
|
Description précédente :
- Besoin médical non satisfait : première thérapie propre aux épisodes aigus – L'AOH est une maladie débilitante et potentiellement fatale.
- Injectable (intraveineuse et sous-cutanée; intravitréenne)
Mise à jour :
- Les données combinées provenant de quatre études cliniques (EDEMA2, EDEMA3, EDEMA4 et DX-88/19) ont démontré que l'ecallantide 30 mg administré par injection sous-cutanée était efficace pour le traitement d'épisodes aigus d'AOH étendu au larynx23; également connu pour son efficacité pour les épisodes d'AOH chez les adolescents24.
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que l'ecallantide satisfait à un besoin médical à l'égard du traitement de l'AOH en phase aiguë.
|
|
Ispronicline
AstraZeneca PLC;
Targacept, Inc.
|
Psycholeptiques (N05) et psychoanaleptiques (N06)
Maladie d'Alzheimer, trouble d'hyperactivité avec déficit de l'attention, troubles dépressifs, stress et anxiété
|
Description précédente :
- Essais de phase II sur la maladie d'Alzheimer et le trouble d'hyperactivité avec déficit de l'attention; essais de phase III sur les troubles dépressifs, le stress et l'anxiété
- Résultats statistiquement significatifs obtenus au chapitre de tous les principaux critères d'évaluation, correspondant à un meilleur rendement cognitif chez les personnes âgées souffrant d'un affaiblissement de la mémoire
Mise à jour :
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que l'ispronicline peut être un traitement efficace contre la maladie d'Alzheimer.
|
|
Istradefylline
Kyowa Hakko Kirin Pharma, Inc;
Valeant Pharmaceuticals International, Inc.
|
Antiparkinsoniens (N04)
Maladie de Parkinson
|
Description précédente :
- Premier médicament d'une nouvelle catégorie thérapeutique : antagoniste sélectif des récepteurs de l'adénosine A2A
- Incidences sur la progression de la maladie plutôt que sur le traitement des symptômes
Mise à jour :
- Approuvé comme thérapie d'appoint au Japon (2013)
- Présentation d'une demande d'approbation réglementaire aux États-Unis (base de données BioPharm Insight)
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que l'istradefylline peut constituer une thérapie non dopaminergique prometteuse pour le traitement de la maladie de Parkinson.
|
|
Laquinimod
Active Biotech AB;
Teva Pharmaceutical Industries Ltd.
|
Immunostimulants (L03) et immunosuppresseurs (L04)
Sclérose en plaques, maladie de Crohn et lupus
Médicament biologique
|
Description précédente :
- Présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative à la sclérose en plaques; essais de phase II en cours sur la maladie de Crohn et le lupus (base de données Biopharm Insight)
- Nouveau composé immunomodulateur administré par voie orale une fois par jour
Mise à jour :
- Les études publiées démontrent les effets bénéfiques qu'a le laquinimod (0,6 mg par jour) sur les marqueurs de substitution cliniques et de neuroimagerie des patients adultes atteints de la sclérose en plaques rémittente et ayant un profil risques-avantages favorable; de façon plus particulière, rien ne démontre l'augmentation des risques d'effets indésirables pour le cœur25.
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que le laquinimod pourrait constituer une thérapie prometteuse pour le traitement de la sclérose en plaques rémittente.
|
|
Macitentan (Opsumit)
Actelion Pharmaceuticals Ltd.
|
Thérapie cardiaque (C01)
Hypertension artérielle pulmonaire et ulcères digitaux
|
Description précédente :
- Essais de phase III en cours sur les ulcères digitaux; approuvé par la FDA pour le traitement de l'hypertension artérielle pulmonaire (HAP)
- Antagoniste double oralement actif des récepteurs de l'endothéline qui améliore l'issue à long terme des affections cardiovasculaires
Mise à jour :
- Dans le cadre d'une étude menée auprès de 250 patients atteints d'une hypertension artérielle pulmonaire symptomatique, le macitentan a considérablement réduit la morbidité et la mortalité des patients atteints d'hypertension artérielle pulmonaire par rapport aux patients qui étaient sous placebo26.
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que le macitentan est un traitement efficacement de l'hypertension artérielle pulmonaire.
|
|
Nintedanib
Boehringer Ingelheim GmbH
|
Cancer (L01)
Cancer à grandes cellules et cancer ovarien
Médicament biologique
|
Description précédente :
- Essais de phase III en cours sur le cancer à grandes cellules et le cancer ovarien (base de données Biopharm Insight)
- Inhibiteur triple de l'angiokinase qui agit au niveau de trois récepteurs de facteurs de croissance : le récepteur du facteur de croissance vasculaire endothéliale, le récepteur du facteur de croissance d'origine plaquettaire et le récepteur du facteur de croissance fibroblastique
Mise à jour :
- Présentation d'une demande d'approbation de la FDA pour l'indication relative au cancer à grandes cellules (base de données Biopharm Insight)
- Peut jouer un rôle dans la fibrose pulmonaire idiopathique, une maladie qui met en danger la vie27
- Le médicament figure toujours sur la liste des médicaments ayant le statut de drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que le nintedanib pourrait jouer un rôle dans le cancer pulmonaire. Il pourrait aussi être utile dans le traitement de la fibrose pulmonaire idiopathique.
|
|
Phénoxodiol
Marshall Edwards, Inc.;
Novogen Limited
|
Cancer (L01)
Cancer ovarien, cancer du col de l'utérus, cancer de la tête et du cou, cancer du rein, leucémie, cancer de la prostate
|
Description précédente :
- La FDA a autorisé le développement rapide du phénoxodiol en tant que radiosensibilisateur destiné aux médicaments aux sels de platine et aux taxanes.
- Taux de survie accru chez les patients atteints d'un cancer difficile à traiter
Mise à jour :
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
- Le médicament figure toujours sur la liste des essais de phase III (base de données Biopharm Insight).
Justification : Bien qu'il existe peu de documents publiés à ce sujet, ce médicament pourrait éventuellement améliorer le taux de survie.
|
|
Ponésimod
Actelion Pharmaceuticals Ltd; Roche
|
Immunostimulants (L03) et immunosuppresseurs (L04)
Sclérose en plaques et psoriasis
Médicament biologique
|
Description précédente :
- Essais de phase III en cours sur le psoriasis; essais de phase III sur la sclérose en plaques (base de données BioPharm Insight)
- Possibilité d'une dose administrée par voie orale une fois par jour pour divers troubles auto-immuns28
Mise à jour :
- Le médicament figure toujours sur la liste des médicaments ayant le statut de drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Bien qu'il existe peu de documents publiés à ce sujet, le ponésimod pourrait constituer une thérapie importante pour le traitement de la sclérose en plaques.
|
|
Rébamipide (Mucosta)
Acucela, Inc.;
Novartis AG;
Otsuka Pharmaceutical Co., Ltd.
|
Préparations ophtalmologiques (S03)
Syndrome de l'œil sec
|
Description précédente :
- Essais cliniques de phase III aux États-Unis (base de données Biopharm Insight); approuvé pour le traitement du syndrome de l'œil sec au Japon
- Besoin d'une thérapie efficace visant le syndrome de l'œil sec qui traite la cause fondamentale du syndrome
- Population importante : 22 millions de patients à l'échelle mondiale consultent un ophtalmologue lorsqu'ils souffrent de symptômes associés au syndrome de l'œil sec.
Mise à jour :
- [Traduction] « L'administration de rébamipide pour traiter le type de syndrome de l'œil sec associé à un court temps de rupture a considérablement accru la qualité optique en raison de l'amélioration de la stabilité lacrymale29. »
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés continuent d'indiquer que le rébamipide est un traitement efficace du syndrome de l'œil sec.
|
|
Safinamide
Meiji Seika Pharma Co., Ltd.;
Merck Serono SA;
Newron Pharmaceuticals;
Zambon Group)
|
Antiparkinsoniens (N04) et antiépileptiques (N03)
Maladie de Parkinson, épilepsie et syndrome des jambes sans repos
|
Description précédente :
- Multiples mécanismes d'action et multiples indications
- Population importante
- Si ce médicament s'avérait plus efficace que les agents existants, il pourrait remplacer des médicaments de rechange peu coûteux comme la quinine pour traiter le syndrome des jambes sans repos.
Mise à jour :
- Présentation d'une demande d'approbation réglementaire pour l'indication relative à la maladie de Parkinson prévue au quatrième trimestre de 2013 (base de données Biopharm Insight)
- Les études portant sur la maladie de Parkinson (MP) sont prometteuses; [Traduction] « Le safinamide pourrait devenir un composé important pour la thérapie de la MP parce que son efficacité symptomatique semble supérieure à celle des inhibiteurs de la monoamine oxydase de type B et des antagonistes des récepteurs du N méthyl D-aspartate qui sont accessibles comme l'amantadine, selon les résultats des essais cliniques disponibles30. »
- Le médicament ne figure plus sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2103)
Justification : Les documents publiés continuent d'indiquer que le safinamide pourrait constituer un traitement efficace de la maladie de Parkinson.
|
|
Satraplatine
Agennix AG;
Celgene Corporation;
GPC Biotech AG;
Spectrum Pharmaceuticals, Inc.
|
Cancer (L01)
Cancer de la prostate et cancer pulmonaire à petites cellules
|
Description précédente :
- Premier composé de platine administré par voie orale
- Désignation de processus rapide aux États Unis à titre de traitement chimiothérapeutique en seconde intervention du cancer de la prostate; présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative au cancer de la prostate; essais de phase III sur le cancer général et de phase II sur le cancer pulmonaire à petites cellules
Mise à jour :
- [Traduction] « Compte tenu de son profil de toxicité favorable et de son administration orale pratique, le développement du satraplatine être justifié lorsque les circonstances empêchent l'utilisation du cisplatine, comme dans les cas de dysfonctionnement rénal sous jacent, d'âge avancé et de faible indice de performance31. »
- Les études de phase II ont été publiées32,33.
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Bien que les documents publiés indiquent que le satraplatine peut ne pas augmenter le taux de survie, s'il est le premier composé de platine administré par voie orale approuvé, il aura une incidence sur la pratique clinique.
|
|
Selexipag
Actelion Pharmaceuticals Ltd;
Nippon Shinyaku Co., Ltd
|
Antihypertenseurs (C02)
Hypertension artérielle pulmonaire
|
Description précédente :
- Agoniste sélectif des récepteurs de la prostacycline à action prolongée, administré par voie orale pour le traitement de l'hypertension artérielle pulmonaire
- Essais de phase III en cours
Mise à jour :
- [Traduction] « L'essai de phase III – GRIPHON – comporte un critère d'évaluation principal de temps, qui est à la fois pertinent sur le plan clinique et hautement robuste, pour les premières occurrences de morbidité ou de mortalité et fournira des renseignements essentiels concernant les effets à long terme qu'a le selexipag sur les patients qui sont atteints d'hypertension artérielle pulmonaire34. »
- Le médicament figure toujours sur la liste des médicaments ayant le statut de drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés indiquent toujours que le Selexipag est un traitement efficacement de l'hypertension artérielle pulmonaire.
|
|
Serelaxin (Relaxin)
Corthera Inc.;
Novartis AG;
Paladin Labs, Inc.
|
Thérapie cardiaque (C01)
Insuffisance cardiaque
Médicament biologique
|
Description précédente :
- Essais de phase III en cours
- Médicament hormonal injectable
- Constitue une importante progression à l'égard de l'insuffisance cardiaque aiguë puisqu'il aborde deux des plus importants aspects du traitement de l'affection, soit l'amélioration hémodynamique et la protection rénale35
Mise à jour :
- Certains résultats ont été publiés : [Traduction] « Le traitement de l'insuffisance cardiaque aiguë par serelaxin a été associé à un soulagement de la dyspnée et à d'autres améliorations des résultats cliniques, mais il n'a eu aucun effet sur les réadmissions à l'hôpital. Le traitement par serelaxin était bien toléré et sans danger, il a été favorisé par la réduction de la mortalité à 180 jours36. »
- Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés indiquent toujours que le serelaxin pourrait constituer un traitement efficace de l'insuffisance cardiaque.
|
|
Tofacitinib (Xeljanz)
Pfizer Inc.;
Takeda Pharmaceutical)
|
Immunosuppresseurs (L04)
Multiples indications : spondylarthrite ankylosante, polyarthrite rhumatoïde, maladie de Crohn, psoriasis, greffes, autres.
|
Description précédente :
- Essais de phase III en cours
- Population importante : polyarthrite rhumatoïde
- Forme posologique orale dans un domaine où les produits injectables sont actuellement la pratique standard
Mise à jour :
- Le médicament figure toujours sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
- [Traduction] « Pour les patients atteints de polyarthrite rhumatoïde (PR) qui reçoivent du méthotrexate, le tofacitinib s'est révélé considérablement supérieur au placebo et a démontré une efficacité similaire à l'adalimumab (Humira)37. »
Justification : Les documents publiés soutiennent toujours que le tofacitinib est un traitement oral efficace des conditions chroniques d'inflammation
|
|
Voclosporin (Luveniq)
SBio Inc.;
Iljin Life Science, Co., Ltd.;
Isotechnika, Inc.;
Lux Biosciences;
Paladin Labs, Inc.;
Roche
|
Préparations ophtalmologiques (S03) et immunosuppresseurs (L04)
Uvéite, greffes de rein et autres greffes, psoriasis
|
Description précédente :
- Essais de phase III sur l'uvéite; présentation d'une demande d'approbation réglementaire de la FDA pour l'indication relative au psoriasis; essais de phase III sur les greffes de rein (base de données Biopharm Insight)
- Une étude canadienne de phase III a révélé une nette amélioration de la qualité de vie chez les patients atteints de psoriasis38.
Mise à jour :
- [Traduction] « Les données limitées disponibles indiquent à tout le moins des résultats comparables à ceux obtenus dans le cadre des thérapies actuelles, ainsi qu'un meilleur profil d'innocuité [dans le cas d'une uvéite]39. »
- Le médicament ne figure plus sur la liste des médicaments ayant le statut de drogue expérimentale au Canada. (Pharmacy Practice, 2013)
Justification : Les documents publiés soutiennent toujours que voclosporin est un traitement oral efficace de l'uvéite.
|
Abréviations : EMA, Agence européenne des médicaments; FDA, Food and Drug Administration.
5.2 Médicaments retirés de la liste des médicaments émergents
Les tableaux 5 et 6 présentent la liste des médicaments inclus dans les livraisons antérieures de l'OMÉ qui ont été retirés de la liste des médicaments émergents. Le médicament présenté dans le tableau 5 a été retiré de la liste parce que son fabricant a été autorisé à le commercialiser sur le marché canadien. Santé Canada accorde cette autorisation dans un avis de conformité (AC). Le tableau 5 présente également des renseignements relatifs aux recommandations faites par le Comité canadien d'expertise sur les médicaments (CCEM), un organe consultatif de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS)40. Le CCEM adresse des recommandations quant au contenu de la liste des médicaments assurés aux régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux.
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) examine les prix des médicaments brevetés pour s'assurer qu'ils ne sont pas excessifs. On a déterminé que le prix du médicament figurant au tableau 5 est conforme aux Lignes directrices.
Le tableau 6 comprend les médicaments qui ont été retirés de la liste des médicaments émergents parce que leur maintien sur cette liste n'est plus soutenu par une évaluation scientifique. Les raisons du retrait comprennent l'insuffisance d'information et des essais cliniques ultérieurs qui ont révélé une insuffisance d'efficacité ou d'innocuité.
Tableau 5. Médicaments retirés de la liste des médicaments émergents :
autorisation de commercialisation accordée par Santé Canada
| Médicament (nom de marque) – Entreprise |
Domaine thérapeutique (ATC) – Indication |
Date de délivrance de l'AC* / Date de la première vente** |
Recommandations de l'ACMTS† |
Examen du CEPMB |
|
Mirabegron (Myrbetriq)
Astellas Pharma Canada Inc.
|
Produits urologiques (G04)
Incontinence, vessie hyperactive
|
AC accordé le 06-03-2013
Commercialisé au Canada à partir du 28-03-201341
|
La période d'embargo sur la recommandation définitive de l'ACMTS a été prolongée jusqu'en novembre 2013. La recommandation a été transmise aux régimes d'assurance médicaments et au fabricant. |
Prix conforme aux Lignes directrices |
* Un avis de conformité est émis par Santé Canada et indique qu'un produit médicamenteux satisfait aux exigences réglementaires relatives à l'usage humain ou vétérinaire et que la vente dudit produit est autorisée au Canada.
** La date de la première vente correspond à la date déclarée au CEPMB. Cette date peut précéder la date d'émission de l'AC par Santé Canada puisqu'un produit peut être vendu en vertu du Programme d'accès spécial ou d'une demande d'essais cliniques, ou parce qu'il s'agit d'une drogue nouvelle de recherche.
† Les recommandations de l'ACMTS sont faites par le Comité canadien d'expertise sur les médicaments (CCEM), un organisme consultatif indépendant formé de spécialistes de la pharmacothérapie et de l'évaluation de médicaments. Les présentations par les fabricants sont déposées volontairement.
Tableau 6. Médicaments retirés de la liste des médicaments émergents : évaluation scientifique
| Médicament (nom de marque) – Entreprise |
Justification du retrait |
|
Sipuleucel-T (Provenge)
Dendreon Corporation
Médicament biologique
|
Bien que le sipuleucel T soit commercialisé aux É.-U., [Traduction] « en raison de son coût, de la complexité du régime de traitement et du nombre élevé de thérapeutiques récemment approuvées et concurrentes qui sont utilisés pour traiter le cancer de la prostate métastatique résistant à la castration, l'utilisation de ce médicament a été moins importante que prévu. De plus, l'augmentation observée de la survie globale en l'absence d'un changement de la survie sans progression ou de la réponse de l'APS pose un défi aux cliniciens. L'utilisation d'indicateurs conventionnels de réaction au traitement du cancer de la prostate métastatique résistant à la castration ne permet pas de démontrer que le sipuleucel-T exerce une activité antitumorale mesurable. L'incidence du sipuleucel-T sur l'évolution naturelle de la maladie est quelque peu déconcertante puisque rien ne permet de démontrer qu'il y a réduction de la charge tumorale après administration de ce traitement à composé immunitaire. Sans ces biomarqueurs d'efficacité, il sera difficile d'intégrer le sipuleucel-T aux protocoles de traitement42. »
Le médicament ne figure pas sur la liste comme drogue expérimentale au Canada. (Pharmacy Practice, 2013)
|
6. Références
1 Base de données BioPharm InsightMD. Sur Internet : http://www.infinata5.com/BioPharm/AccessPoint.aspx?action=Login.ShowLogin&datakey=BioPharm (consulté du 2013-09-03 au 2013-09-13)
2 Dans le cadre de l'élaboration de la méthodologie relative à en 2006, le CEPMB a consulté l'Agence canadienne des médicaments et des technologies de la santé (ACMTS). L'ACMTS effectue actuellement de plus amples évaluations prospectives en collaboration avec le Canadian Network for Environmental Scanning in Health (CNESH). Les travaux de l'ACMTS a une portée plus vaste, notamment les technologies relatives aux soins de santé, les procédures médicales et les médicaments.
3 MURDOCH, L.A. « Under investigation: A summary of drugs in late-stage development in Canada », Pharmacy Practice (le 4 mars 2013). Sur Internet : www.canadianhealthcarenetwork.ca/pharmacists/news/drug-news/under-investigation-19625 (consulté le 2013-09-13)
4 IANCU-RUBIN, C., G. MOSOYAN, J. WANG, et coll. « Stromal cell-mediated inhibition of erythropoiesis can be attenuated by Sotatercept (ACE-011), an activin receptor type II ligand trap », Exp. Hematol., vol. 41, no 2 (2013), p. 155-166.e17.
5 MASUDA, N., S. NEGORO, F. HAUSHEER, et coll. « Phase I and pharmacologic study of BNP7787, a novel chemoprotector in patients with advanced non-small cell lung cancer », Cancer Chemother. Pharmacol., vol. 67, no 3 (mars 2011), p. 533-542.
6 SAHEBKAR, A. et G.F. Watts. « New LDL-Cholesterol lowering therapies: pharmacology, clinical trials, and relevance to acute coronary syndromes », Clin. Ther., vol. 35, no 8 (2013), p.1082-1098.
7 THOMAS, G.S., W.C. CROMWELL, S. ALI, W. CHIN, J.D. FLAIM et M. DAVIDSON. « Mipomersen, an apolipoprotein B synthesis inhibitor, reduces atherogenic lipoproteins in patients with severe hypercholesterolemia at high cardiovascular risk: a randomized, double-blind, placebo-controlled trial », J. Am. Coll. Cardiol. (2013) S0735-1097(13)04044-8.
8 SEMERARO, F., F. MORESCALCHI, S. DUSE, et coll. « Aflibercept in wet AMD: specific role and optimal use », Drug Des. Devel. Ther., vol. 7 (2013) p. 711-722.
9 MIURA, M., T. IWASAKI et H. GOTO. « Intravitreal aflibercept for polypoidal choroidal vasculopathy after developing ranibizumab tachyphylaxis », Clin. Ophthalmol., vol. 7 (2013), p. 1591-1595.
10 BERLIE, H.D. et K.M. HURREN. « Evaluation of lorcaserin for the treatment of obesity », Expert Opin. Drug Metab. Toxicol., vol. 9, no 8 (2013), p. 1053-1059.
11 SHORE, N. et B. COWAN. « The potential for NX-1207 in benign prostatic hyperplasia: an update for clinicians », Ther. Adv. Chronic Dis., vol. 2, no 6 (2011), p.377-383.
12 FLISIAK, R., J. JAROSZEWICZ, I. FLISIAK et T. LAPINSKI. « Update on alisporivir in treatment of viral hepatitis C », Expert Opin. Investig. Drugs, vol. 21, no 3 (2012), p. 375-382.
13 JONES, A.M. et J.M. HELM. « Emerging treatments in cystic fibrosis », Drugs, vol. 69, no 2009(1), p. 1903-1910.
14 CORREN, J. « Role of Interleukin-13 in asthma », Curr. Allergy Asthma Rep., 2013-09-12.
15 THOMSON, N.C., M. PATEL et A.D. SMITH. « Lebrikizumab in the personalized management of asthma », Biologics, vol. 6 (2012), p. 329-335.
16 Site Web des produits médicamenteux approuvés par la US Food and Drug Administration (FDA). Sur Internet : http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=Search.Search_Drug_Name (consulté le 2013-09-13)
17 SMERALDI, E. et D. DELMONTE. « Agomelatine in depression ». Expert Opin. Drug Saf. 2013-09-16.
18 TZEFOS, M., K. HARRIS et A. BRACKETT. « Clinical efficacy and safety of once-weekly glucagon-like peptide-1 agonists in development for treatment of type 2 diabetes mellitus in adults », Ann. Pharmacother., vol. 46, no 1 (2012), p. 68-78.
19 KOPELMAN, P., Gde H. GROOT, A. RISSANEN, et coll. « Weight loss, HbA1c reduction, and tolerability of cetilistat in a randomized, placebo-controlled phase 2 trial in obese diabetics: comparison with orlistat (Xenical) », Obesity (Silver Spring), vol. 18, no 1 (2010), p. 108-115.
20 GEORGE, M., M. RAJARAM et E. SHANMUGAM. « New and emerging drug molecules against obesity », J. Cardiovasc. Pharmacol. Ther. 2013-09-24.
21 WHITE, H. « Editorial: why inhibition of lipoprotein-associated phospholipase A2 has the potential to improve patient outcomes », Curr. Opin. Cardiol., vol. 25, no 4 (2010), p.299-301.
22 NATIONAL INSTITUTE FOR HEALTH RESEARCH, NIHR HORIZON SCANNING CENTRE. « Darapladib for cardiovascular risk reduction in patients with coronary heart disease – add on therapy », NIHR HSC ID : 2237 (mai 2013).
23 SHEFFER, A.L., A.J. MACGINNITIE, M. CAMPION, et coll. « Outcomes after ecallantide treatment of laryngeal hereditary angioedema attacks », Ann. Allergy Asthma Immunol., vol. 110, no 3 (2013), p.184-188.e2.
24 MACGINNITIE, A.J., M. DAVIS-LORTON, L.E. STOLZ et R. TACHDJIAN. « Use of ecallantide in pediatric hereditary angioedema », Pediatrics, vol. 132, no 2 (2013), p. e490-497.
25 THÖNE, J. et G. ELLRICHMANN. « Oral available agents in the treatment of relapsing remitting multiple sclerosis: an overview of merits and culprits », Drug Healthc. Patient Saf., vol. 5 (2013), p. 37-47.
26 PULIDO, T., I. ADZERIKHO, R. CHANNICK, et coll. « Macitentan and morbidity and mortality in pulmonary arterial hypertension », N. Engl. J. Med., vol. 369, no 9 (2013) p. 809-818.
27 WOODCOCK, H.V., P.L. MOLYNEAUX et T.M. MAHER. « Reducing lung function decline in patients with idiopathic pulmonary fibrosis:potential of nintedanib », Drug Des. Devel. Ther., vol. 7 (2013), p. 503-510.
28 BROSSARD, P., H. DERENDORF, J. XU, et coll. « Pharmacokinetics and Pharmacodynamics of Ponesimod, a Selective S1P1 Receptor Modulator, in the First-in-Human Study ». Br. J. Clin. Pharmacol. 2013-04-18. Doi : 10.1111/bcp.12129.
29 KOH, S., Y. INOUE, T. SUGMIMOTO, et coll. « Effect of rebamipide ophthalmic suspension on optical quality in the short break-up time type of dry eye », Cornea, vol. 32, no 9 (2013). p. 1219-1223.
30 MÜLLER, T. « Current status of safinamide for the drug portfolio of Parkinson's disease therapy », Expert Rev. Neurother., vol. 13, no 9 (2013, p. 969-977.
31 DOSHI, G., G. SONPAVDE et C.N. STERNBERG. « Clinical and pharmacokinetic evaluation of satraplatin », Expert Opinion on Drug Metabolism and Toxicology, vol. 8, no 1 (2012), p.103-111.
32 FIGG, W.D., C.H. CHAU, R.A. MADAN, et coll. « Phase II study of satraplatin and prednisone in patients with metastatic castration-resistant prostate cancer: a pharmacogenetic assessment of outcome and toxicity », Clin. Genitourin. Cancer, vol. 11, no 3 (2013). p. 229-237.
33 VAISHAMPAYAN, U.N., J. FONTANA, L.K. HEILBRUN, et coll. « Phase II trial of bevacizumab and satraplatin in docetaxel-pretreated metastatic castrate-resistant prostate cancer ». Urol. Oncol. 2013-02-20. Pii : S1078-1439(12)00423-1.
34 SITBON, O. et N. MORRELL. « Pathways in pulmonary arterial hypertension: the future is here ». Eur. Respir. Rev., vol. 21, no 126 (déc. 2012), p. 321-327.
35 BANI, D. et M. BIGAZZI. « Relaxin as a cardiovascular drug: a promise kept », Curr. Drug Saf., vol.1, no 5 (nov. 2011), p.324-328.
36 TEERLINK, J.R., G. COTTER, B.A. DAVISON, et coll. « Relaxin in acute heart failure (RELAX-AHF) Investigators. Serelaxin, recombinant human relaxin-2, for treatment of acute heart failure (RELAX-AHF): a randomised, placebo-controlled trial ». Lancet, vol. 381, no 9860 (2013), p. 29-39.
37 VAN VOLLENHOVEN, R.F., R. FLEISCHMANN, S. COHEN, et coll. « Tofacitinib or adalimumab versus placebo in rheumatoid arthritis », N. Engl. J. Med., vol. 367, no 6 (2012), p. 508-519.
38 KUNYNETZ, R., W. CAREY, R. THOMAS, et coll. « Quality of life in plaque psoriasis patients treated with voclosporin: a Canadian phase III, randomized, multicenter, double-blind, placebo-controlled study », Eur. J. Dermatol., vol. 21, no 1 (2011), p. 89-94.
39 SCHULTZ, C. « Voclosporin as a treatment for noninfectious uveitis », Ophthalmol. Eye Dis., vol. 5 (2013), p. 5-10.
40 Base de données du Programme commun d'évaluation des médicaments. Sur Internet : http://www.cadth.ca/fr/products/cdr/search (consulté le 2013-11-11) [Seules les informations publiquement accessibles y sont mentionnées]
41 Base de données sur les produits pharmaceutiques. Sur Internet : http://www.hc-sc.gc.ca/dhp-mps/prodpharma/databasdon/index-fra.php (consulté le 2013-09-13)
42 ACAR, O., T. ESEN et N. LACK. « New therapeutics to treat castrate-resistant prostate cancer », Scientific World Journal, no 379641 (2013).