Conseil d’examen du prix des médicaments brevetés
2014-2015
L’honorable Jane Philpott
Ministre de la Santé
Numéro de catalogue : H79-2F-PDF
ISSN : 2368-1071
Table des matières
Message de la présidente
Section I : Vue d’ensemble des dépense de l’organisation
Section II : Analyse des programmes par résultat stratégique
Section III : Renseignements supplémentaires
Section IV : Coordonnées de l’organisation
Annexe : Définitions
Notes de fin de document
Message de la présidente
C’est avec plaisir que je vous présente le Rapport ministériel sur le rendement 2014-2015 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est un organisme de protection des consommateurs qui exerce un double mandat de réglementation et de rapport. Il veille à ce que le prix des médicaments brevetés vendus au Canada ne soit pas excessif et informe les intervenants des dernières tendances relatives aux ventes et aux prix des produits pharmaceutiques ainsi que des dépenses de recherche et développement dans ce domaine au Canada.
En ce qui concerne son mandat de réglementation, en 2014-2015, le CEPMB a établi des engagements de conformité volontaire à l’égard de cinq médicaments brevetés en vertu desquels les titulaires de brevets pharmaceutiques ont versé 2,8 millions de dollars en recettes excédentaires au gouvernement du Canada. Le CEPMB a également entrepris une audience publique sur le prix du médicament breveté Soliris, la première instance de ce genre depuis 2012.
Au cours du dernier exercice financier, le CEPMB a mis l’accent sur ses quatre priorités organisationnelles : l’incidence prévue des changements récents et imminents aux régimes de réglementation étrangers et nationaux; la poursuite de la mise en œuvre du plan d’action de la direction pour l’évaluation des programmes; la réduction du fardeau réglementaire et l’harmonisation des opérations internes avec les exigences des organismes centraux.
À cette fin, nous avons approfondi notre connaissance des enjeux concernant les prix nationaux et internationaux et le remboursement et nous avons continué d’améliorer la production de rapports sur les tendances relatives au prix des médicaments à l’étranger et au Canada. À ce propos, en décembre 2014, le CEPMB a publié Médicaments génériques au Canada, 2013, un rapport fournissant des renseignements sur les rapports entre les prix au Canada et à l’étranger des médicaments génériques vendus au Canada. En mars 2015, le CEPMB a publié le rapport CompasRx du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) qui présente une analyse exhaustive des inducteurs de coûts des dépenses en médicaments d’ordonnance de certains régimes publics d’assurance-médicaments du Canada. Ultérieurement, à l’automne de 2015, nous publierons notre étude de comparaison des prix internationaux pour 2015. L’information contenue dans ces rapports, de même que dans d’autres études du SNIUMP, aidera les payeurs et les décideurs de l’industrie pharmaceutique à prendre des décisions éclairées concernant le remboursement et les politiques.
Grâce à la poursuite de la mise en œuvre du plan d’action de la direction lié à l’évaluation des programmes, nous avons réalisé des progrès en simplifiant les lignes directrices par l’établissement d’une nouvelle méthode de vérification des prix internationaux et un arbre de décision pour fournir aux brevetés une certitude et une transparence accrues dans la détermination des sources acceptables de prix à l’étranger pour le dépôt de formulaires auprès du personnel du CEPMB chargé de la réglementation, en ce qui a trait à la section 5. De même, la publication de notre politique d’interprétation en janvier 2015 reflète notre engagement à mobiliser les intervenants au besoin et à accroître l’utilisation d’un langage clair et simple dans les communications du CEPMB.
Au cours de la dernière année, nous avons continué à rechercher des occasions de dialogue et d’échange de renseignements avec les payeurs des secteurs public et privé pour les aider à faire des choix plus rentables. À la suite de ces efforts, nous avons obtenu le statut d’observateur au sein du Comité consultatif sur les politiques en matière de médicaments (CCPM) et du Comité consultatif sur les médicaments et les thérapeutiques (CCMT) du Programme des services de santé non assurés (SSNA). Ces partenariats permettront au CEPMB d’échanger des connaissances et des pratiques exemplaires et de fournir de l’information sur les marchés encore plus pertinente et opportune.
Enfin, en 2014, nous avons entrepris un processus de planification stratégique sur toute l’année dans le but de tracer une nouvelle voie pour les 25 prochaines années au cours desquelles le CEPMB réaffirmera son engagement à l’égard de son mandat initial de protection du consommateur. Les priorités stratégiques qui sont ressorties de ce processus sont énoncées dans le plan stratégique 2015-2018 du CEPMB. Je suis convaincue que la réalisation attentive de ces priorités au cours des années à venir permettra au CEPMB de s’appuyer sur ses réussites antérieures et de devenir plus fort et plus efficace qu’il ne l’a jamais été, depuis près de trois décennies.
Mary Catherine Lindberg
Section I : Vue d’ensemble des dépense de l’organisation
Profil de l’organisation
Ministre de tutelle : L’honorable Jane Philpott
Premier dirigeant : Mary Catherine Lindberg, Présidente
Portefeuille ministériel : Santé
Instruments habilitants : Loi sur les brevets i et Règlement sur les médicaments brevetés ii
Année d’incorporation ou de création : 1987
Autre : Le ministre de la Santé est responsable de l’application des dispositions pharmaceutiques de la Loi sur les brevets (la Loi) formulées aux articles 79 à 103. Même s’il fait partie du portefeuille de la Santé, le CEPMB, en raison de ses responsabilités quasi judiciaires, exerce son mandat en toute indépendance vis-à-vis de la ministre. Il fonctionne également d’une façon indépendante de Santé Canada, qui approuve l’innocuité, l’efficacité et la qualité des médicaments; d’autres membres du portefeuille de la Santé, comme l’Agence de la santé publique du Canada, les Instituts de recherche en santé du Canada et l’Agence canadienne d’inspection des aliments; des régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments, qui autorisent l’inscription des médicaments sur leurs formulaires de médicaments admissibles à un remboursement et du Programme commun d’examen des médicaments, géré par l’Association canadienne des médicaments et des technologies de la santé (ACMTS), qui évalue l’efficience des médicaments avant leur inscription sur les formulaires des régimes publics d'assurance-médicaments participants.
Contexte organisationnel
Raison d’être
Créé par le Parlement en 1987, le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il est investi d’un double mandat :
- réglementation – veiller à ce que les prix auxquels les titulaires de brevet vendent leurs médicaments au Canada ne soient pas excessifs;
- rapport – faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des brevetés dans la recherche et le développement au Canada.
Dans l’exécution de son mandat, le CEPMB veille à la protection des Canadiens en s’assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs et que les intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques.
Responsabilités
Le CEPMB a été créé à la suite des modifications apportées à la Loi en 1987 (projet de loi C-22) et ses pouvoirs de redressement ont été complétés par d’autres modifications en 1993 (projet de loi C-91). Les révisions s’inscrivaient dans des réformes réglementaires visant à établir un juste équilibre entre les mesures de protection des brevets visant à encourager les efforts de recherche et développement des brevetés pharmaceutiques et la nécessité de protéger les intérêts des consommateurs.
Le CEPMB est investi d'un double mandat :
Réglementation du prix des médicaments brevetés
Il incombe au CEPMB de réglementer le prix départ-usine, notamment les prix plafonds auxquels les brevetés vendent, au Canada, à leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs médicaments brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre, de façon à s’assurer qu’ils ne sont pas excessifs. Le mandat du Conseil couvre également les médicaments distribués au titre du Programme d’accès spécial ou par l’entremise du programme d’essais cliniques de même que les drogues nouvelles de recherche. Les médicaments brevetés en vente libre et les médicaments brevetés à usage vétérinaire sont également réglementés par le Conseil en fonction des plaintes reçues.
Si le personnel du Conseil juge que le prix d’un médicament breveté semble excessif et qu’il ne peut s’entendre avec le breveté pour régler le problème, la présidente peut tenir une audience sur la question si elle est d’avis que cela sert l’intérêt public.
Les fonctions décisionnelles du CEPMB sont exécutées par les membres. Pendant les audiences, un comité d’étude formé de membres du Conseil agit en tant qu’arbitre neutre entre le personnel du Conseil et le breveté. La présidente décide quels membres feront partie du comité. Les ministres de la Santé provinciaux et territoriaux ont le droit accordé par la loi de comparaître devant le comité en tant que parties, et d’autres personnes ou groupes intéressés peuvent demander à participer en tant qu’intervenants.
Lorsqu’un comité conclut que le prix d’un médicament breveté est excessif, il peut ordonner une diminution du prix à un niveau non excessif. Il peut également exiger que le breveté rembourse les recettes excessives qu’il a encaissées et, dans les cas où le comité conclut à la présence d’une politique de prix excessifs, il peut doubler le montant des recettes excessives à rembourser.
Rapport sur les tendances relatives aux produits pharmaceutiques
Chaque année, le CEPMB rend compte au Parlement, par le truchement du ministre de la Santé, de ses activités d’analyse des prix, des prix des médicaments brevetés, des tendances des prix de l’ensemble des médicaments d’ordonnance et des dépenses en recherche et développement (R et D) déclarées par les sociétés pharmaceutiques brevetées. De plus, par suite de l’établissement du Système national d'information sur l’utilisation des médicaments prescrits (SNIUMP) iii par les ministres de la Santé fédéral, provinciaux et territoriaux en septembre 2001, le CEPMB réalise des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts des médicaments brevetés et non brevetés distribués sous ordonnance pour que les principaux participants du système de santé au Canada disposent de renseignements plus complets et plus justes sur la façon dont on utilise les médicaments d’ordonnance et sur les facteurs à l’origine des augmentations de coûts. Cette fonction a pour objet de fournir aux gouvernements FPT et à d’autres parties intéressées une source centralisée d’information crédible sur les tendances dans l’industrie pharmaceutique.
Résultat stratégique et architecture d’alignement des programmes
1. Résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne. La population canadienne est également tenue informée.
1.1 Programme : Le programme de réglementation du prix des médicaments brevetés
1.2 Programme : Le programme sur les tendances relatives aux produits pharmaceutiques
Services internes
Priorités organisationnelles
| Priorité |
Type 1 |
Programme |
| Évaluer l’incidence des changements récents et à venir aux systèmes de réglementation des produits pharmaceutiques étrangers et nationaux sur le travail du CEPMB. |
Priorité nouvelle |
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l’égard de cette priorité?
Examen des tendances liées aux prix à l’étranger par rapport au Canada.
- Le rapport annuel du CEPMB compare les prix des médicaments brevetés au Canada aux prix des médicaments brevetés à l’étranger et fournit des renseignements sur les dépenses en produits médicamenteux au Canada par rapport aux marchés mondiaux.
- Le rapport Médicaments génériques au Canada, 2013 iv, publié en décembre 2014, fournit des renseignements sur les ratios des prix des médicaments brevetés au Canada en comparaison de ceux des médicaments brevetés à l’étranger pour les médicaments génériques vendus au Canada.
- La première édition de sa publication phare, le rapport CompasRx du SNIUMP, a été diffusée en mars 2015.
- En automne 2015, le CEPMB diffusera l’étude Comparaison des prix internationaux, 2015, qui comprendra des renseignements sur la liste de la médiane des prix internationaux comparée aux ratios des prix au Canada pour les médicaments brevetés.
Suivi de l’évolution internationale quant à l’établissement des prix des médicaments et aux régimes de remboursement, ainsi que leurs répercussions pour le Canada.
- On a tenu des séminaires à l’interne sur les changements aux régimes internationaux d’établissement des prix pour le personnel responsable des politiques et des règlements.
- Le CEPMB s’est joint au réseau Pharmaceutical Pricing and Reimbursement Information (PPRI) v et a renforcé des liens et ouvert la communication avec ses homologues internationaux, ce qui signifie, notamment, qu’il a tenu des rencontres en personne avec des délégations australienne et chinoise.
Sensibilisation des autres ministères (c.-à-d. Industrie Canada et Santé Canada) à l’établissement des prix au Canada et à l’étranger et aux tendances de recherche et développement (R et D).
- Les cadres supérieurs d’Industrie Canada et de Santé Canada ont été informés de l’établissement des prix intérieurs et internationaux et des tendances observées sur le plan de la R et D, ainsi que de leurs conséquences pour le régime de réglementation des prix des médicaments au Canada.
- Le CEPMB a obtenu le statut d’observateur auprès du CCPM et du CCMT du SSNA.
Collaboration avec l’industrie, les gestionnaires de régimes de médicaments publics et privés et d’autres intervenants afin de cerner les améliorations qui pourraient être apportées au processus d’examen des prix.
- Le groupe de travail continue son dialogue avec les compagnies de recherche pharmaceutique du Canada afin de dégager des améliorations potentielles au processus d’examen des prix.
- On poursuit les séances d’information avec les représentants de l’industrie et d’autres parties intéressées sur les divers aspects du processus de révision des prix (p. ex. le forum de chercheurs, et la réunion annuelle).
- Les présentations et la participation à divers forums augmentent (p. ex. le CEPMB a été accepté comme membre du PPRI).
- On tient davantage de séances d’information formelles et informelles avec les intervenants du secteur privé tels que l’Association canadienne du médicament générique (ACMG) et l’Association canadienne des compagnies d’assurance de personnes (ACCAP) sur des questions d’intérêt commun.
|
| Priorité |
Type |
Résultat stratégiques [et/ou] programmes |
| Poursuivre la mise en œuvre du plan d’action de la direction donnant suite au Rapport d’évaluation des programmes du CEPMB. |
Priorité déjà établie |
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l’égard de cette priorité?
Accélération des processus du CEPMB.
Simplification des lignes directrices.
Utilisation accrue d’un langage clair et simple dans toutes les communications du CEPMB.
- On a continué d’utiliser la section « En bref » dans le rapport annuel.
- Un « résumé » a été ajouté dans tous les rapports du SNIUMP.
- On a publié la Politique d’interprétation du CEPMB x.
- On a publié le bulletin d’information trimestriel La Nouvelle.
Élargissement du public visé par les efforts de sensibilisation.
- Des séances d’information ont été offertes aux gestionnaires des régimes publics d’assurance médicaments.
- Un nombre accru de demandes de provinces responsables ont été traitées dans le cadre des négociations de l’Alliance pancanadienne pharmaceutique (APP) xi pour obtenir de l’information sur les prix de médicaments brevetés à l’échelle internationale.
- On tient davantage de séances d’informations formelles et informelles avec des représentants du secteur privé (ACMG et ACCAP) sur des questions d’intérêt commun.
- On a amélioré la proactivité de la stratégie de communication.
|
| Priorité |
Genre |
Résultats stratégiques [et/ou] programmes |
| Réduction du fardeau réglementaire et utilisation efficace des ressources du personnel du Conseil. |
Priorité déjà établie |
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l’égard de cette priorité?
Poursuite du travail visant passer à un rapport réglementaire par année (au lieu de deux) sur les prix et les ventes de médicaments brevetés.
- Cette initiative est en cours.
Mise en œuvre de la nouvelle méthodologie de rajustement du prix selon l’indice des prix à la consommation (IPC).
- La méthodologie de rajustement du prix selon l’IPC a été mise en œuvre
- Une aide efficace est apportée en soutenant d’autres gouvernements (c.-à-d. aider le gouvernement de l’Alberta à adopter la méthodologie de rajustement du prix selon l’IPC du CEPMB).
Amélioration de la clarté et de la transparence grâce à une nouvelle politique sous forme d’arbre décisionnel sur les sources des prix internationaux.
|
| Priorité |
Genre |
Résultats stratégiques [et/ou] programmes |
| Harmoniser le cadre opérationnel interne du CEPMB aux exigences des organismes centraux. |
Priorité nouvelle |
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l’égard de cette priorité?
Examen du processus d’établissement des prévisions financières et de ressources humaines du CEPMB pour trouver des moyens d’améliorer l’efficacité des prévisions en vue de la prise de décisions.
- Le CEPMB a élaboré un processus intégré d’établissement des prévisions financières et de ressources humaines qui est soutenu par un plan de dotation et un rapport intégré de ressources humaines et de prévisions salariales.
Évaluation des pratiques et des processus en place pour gérer la sécurité.
- Le plan de sécurité ministériel a été approuvé et sa mise en œuvre a débuté au cours du premier trimestre de 2015-2016.
- Un comité de sécurité ministériel a été créé et se réunit régulièrement.
Élaboration et mise en œuvre d’un système de gestion des dossiers et des données électroniques pour fournir des renseignements pertinents en temps opportun afin d’éclairer la prise de décisions.
- Les Systèmes de gestion de l’information et des dossiers et des données (SGID) ont été mis sur pieds dans toutes les directions et sont largement utilisés par les employés du CEPMB.
- Tous les dossiers sont conservés dans un système de gestion de base de données relationnel.
|
Analyse des risques
Principaux risques
| Risque |
Stratégie d’atténuation du risque |
Lien à l’architecture d’alignement des programmes |
| Inobservation des directives du Conseil |
Le CEPMB a approuvé et publié l’évaluation du PSELD pour l’année 2014.
Le CEPMB communique régulièrement avec les parties concernées par divers moyens pour faciliter l’élaboration de documents d’orientation, et de façon générale, pour s’assurer qu’elles sont au fait des exigences réglementaires auxquelles il faut se conformer, y compris dans le cadre de « séances de sensibilisation » afin de leur donner une orientation et des conseils. Les documents d’orientation et d’autres renseignements pertinents sont accessibles sur le site Web du CEPMB à www.pmprb-cepmb.gc.ca
|
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1. |
| L’évolution rapide de l’environnement pharmaceutique, tant à l’échelle nationale qu’internationale, présente un défi continu à la capacité du CEPMB d’exercer son mandat de manière efficace. |
Le CEPMB s’est engagé à mobiliser les intervenants, lorsque cela est approprié, afin d’élaborer, d’examiner ou de peaufiner les pratiques et le matériel de communication et d’orientation qui visent à assurer la conformité aux règlements et à répondre aux questions. Pour plus d’information sur l’engagement des intervenants, consulter la Politique d’interprétation du CEPMB et la Politique de consultation xii du CEPMB.
Dans sa Politique d’interprétation, le CEPMB s’est engagé à utiliser un langage clair et simple dans toutes ses communications en intégrant de façon régulière, dans le rapport annuel, une section « En bref », en intégrant régulièrement des résumés dans tous les rapports du SNIUMP ainsi qu’en utilisant régulièrement des résumés de recherche pour mettre en évidence les constatations tirées des études analytiques et leurs incidences sur les politiques.
Les fonds du CEPMB continuent d’être engagés dans la tenue de séances de sensibilisation en personne avec les brevetés et d’autres parties concernées, et dans l’amélioration de l’accessibilité et de l’utilité des documents sur le site Web du Conseil.
Le prochain Plan stratégique du CEPMB établit un plan d’action exhaustif pour aborder ce risque.
|
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| Des changements concernant l’établissement des prix et le remboursement des médicaments brevetés dans les sept pays de comparaison nommés dans le Règlement peuvent faire en sorte que le CEPMB doive rajuster la façon dont les prix de référence internationaux sont appliqués. |
Le CEPMB a établi une méthodologie de vérification des prix internationaux xiii, à l’aide de renseignements publics, en vue de valider les prix étrangers présentés par les brevetés pour chacun des sept pays de comparaison nommés dans le Règlement xiv.
Dans le cas où un prix départ-usine ne figure pas dans les sources reconnues xv du CEPMB, le Conseil adoptera une approche cohérente pour déterminer si une autre source est acceptable. Un arbre décisionnel xvi a été mis au point par le personnel du Conseil afin d’offrir davantage de certitude et de transparence aux brevetés au sujet de ces évaluations se rapportant à un cas particulier.
De vastes travaux analytiques sur les rajustements possibles et sur leur incidence ont été effectués.
Le prochain Plan stratégique du CEPMB établit un plan d’action exhaustif pour aborder ce risque.
|
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| L’utilisation d’ententes relatives à l’inscription des produits par les payeurs publics et éventuellement, par les payeurs privés, remet en question la capacité du CEPMB à vérifier le véritable prix d’un médicament lorsqu’il est utilisé à des fins de référence. |
Comme cela a été annoncé dans l’édition de janvier 2015 de La Nouvelle du CEPMB, le Conseil transférera sa source de prix reconnue pour l’Allemagnexvii de Rote Liste à Lauer-Taxe à partir de janvier 2016. À la suite d’un examen interne des sources de prix actuelles, le CEPMB a conclu que Lauer-Taxe est une meilleure source en raison de sa fiabilité supérieure, du fait qu’elle est accessible au public et parce qu’elle comprend une liste exhaustive des prix départ-usine en Allemagne.
En septembre 2014, le CEPMB a organisé un webinaire sur le SNIUMP pour les administrations participantes afin de leur présenter les points saillants du Rapport annuel de 2013 du CEPMB et les détails du modèle des facteurs de coûts du SNIUMP utilisé pour calculer les dépenses en médicaments sur ordonnance.
En 2014, le CEPMB a été accepté à titre de membre de l’Organisation mondiale de la santé (OMS) pour le PPRI, et s’emploie activement à l’échange d’information et à la diffusion de pratiques exemplaires avec ses homologues internationaux sur des questions liées à la transparence des prix.
Le prochain Plan stratégique du CEPMB établit un plan d’action exhaustif pour aborder ce risque.
|
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
| Changements à la politique canadienne de la propriété intellectuelle, à la suite de négociations sur le commerce international, de traités, de la baisse des activités de R et D. |
Le CEPMB consulte les intervenants sur les conséquences de ces changements.
La Loi sur les brevets prévoit que le CEPMB surveille les dépenses en R et D pharmaceutique et qu’il en rende compte. Le Rapport annuel du CEPMB contient des renseignements sur les dépenses en R et D d’un breveté.
Le prochain Plan stratégique du CEPMB établit un plan d’action exhaustif pour aborder ce risque.
|
Le CEPMB n’a qu’un résultat stratégique. Ainsi, toutes les priorités se rapportent à ce résultat. Cette priorité est liée aux programmes 1.1 et 1.2. |
Le CEPMB communique régulièrement avec ses intervenants par l’entremise de divers moyens afin de faciliter l’élaboration de documents d’orientation, et de favoriser de façon plus générale la conformité aux Lignes directrices sur les prix excessifs. Le personnel du CEPMB a organisé des séances de liaison auprès des brevetés à Montréal et à Toronto en juin et en décembre 2014 sur le dépôt en ligne du formulaire 2 et sur les derniers renseignements quant aux Lignes directrices et aux tendances pharmaceutiques. De plus, le personnel du CEPMB a offert cinq séances d’introduction individuelles à divers brevetés afin de leur présenter des renseignements sur son cadre de réglementation en matière de prix. Enfin, le CEPMB a affiché sur son site Web une vidéo éducative intitulée Acquisition de DIN(s) d’un ancien breveté 2, laquelle explique la manière de remplir un formulaire 1 lorsqu’un breveté acquiert un produit médicamenteux breveté d’un autre breveté.
En janvier 2015, pour faire suite à son engagement de promouvoir l’utilisation d’un langage clair dans tous ses documents accessibles au public, le CEPMB a publié sa Politique d’interprétation. Le CEPMB poursuit son engagement consistant à inclure une section « Résumé » dans le rapport annuel, les résumés exécutifs dans tous les rapports du SNIUMP, et à élaborer des résumés analytiques soulignant les principales constatations et répercussions stratégiques des études analytiques.
Au Canada, comme dans de nombreux pays, les coûts des soins de santé augmentent, et les tiers payeurs de partout sont confrontés à la difficulté de concilier des budgets de médicaments limités et l’accès des patients à de nouvelles technologies dans le domaine de la santé, qui sont prometteuses mais dispendieuses. Uniquement de 2010 à 2012, 23 pays européens ont commencé à planifier ou ont mené d’importantes réformes de leur cadre de réglementation des prix des produits pharmaceutiques pour réaliser davantage d’économies.
Au moment où ces réformes ont été mises en œuvre en Europe, les prix des médicaments brevetés au Canada ont augmenté plus rapidement que dans les autres pays européens faisant partie des sept pays de comparaison du CEPMB.
Le prochain Plan stratégique du CEPMB propose un plan d’action exhaustif pour aborder ces évolutions. Ce dernier comprend notamment la production de rapports davantage axés sur le consommateur et la modernisation du cadre et de la réglementation.
Dépenses réelles
Ressources financières budgétaires (en dollars)
Budget principal des
dépenses 2014-2015 |
Dépenses prévues
2014-2015 |
Autorisations totales
pouvant être utilisées
2014-2015 |
Dépenses réelles
(autorisations utilisées)
2014-2015 |
Écart (dépenses
réelles moins
dépenses prévues) |
| 10 927 030 |
10 927 030 |
11 197 168 |
7 930 280 |
(2 996 750) |
Ressources humaines (équivalents temps plein - ETP)
Prévues
2014-2015 |
Résultats réel
2014-2015 |
Écart (réel moins prévu)
2014-2015 |
| 73,0 |
56,2 |
(16,8) |
Sommaire du rendement budgétaire pour les résultats stratégiques et les programmes (en dollars)
| Résultats stratégiques, programmes et Services internes |
Budget principal des dépenses 2014-2015 |
Dépenses prévues 2014–2015 |
Dépenses prévues 2015–2016 |
Dépenses prévues 2016–2017 |
Autorisations totales pouvant être utilisées 2014-2015 |
Dépenses réelles (autorisations utilisées) 2014-2015 |
Dépenses réelles (autorisations utilisées) 2013-2014 |
Dépenses réelles (autorisations utilisées) 2012-2013 |
| Résultat stratégique : 1. Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs afin de protéger les intérêts de la population canadienne. La population canadienne est également tenue informée. |
| Programme de réglementation du prix des médicaments brevetés |
6 827 010 |
6 827 010 |
6 834 096 |
6 834 096 |
7 004 647 |
3 543 891 |
6 395 602 |
3 888 795 |
| Programme sur les tendances relatives aux produits pharmaceutiques |
1 267 557 |
1 267 557 |
1 506 994 |
1 506 994 |
1 292 325 |
1 301 871 |
1 146 790 |
983 279 |
| Total partiel |
8 094 567 |
8 094 567 |
8 341 090 |
8 341 090 |
8 296 972 |
4 845 762 |
7 542 392 |
4 872 074 |
| Services internes
Total partiel
|
2 832 463 |
2 832 463 |
2 604 091 |
2 604 091 |
2 900 196 |
3 084 518 |
2 998 175 |
3 184 729 |
| Total |
10 927 030 |
10 927 030 |
10 945 181 |
10 945 181 |
11 197 168 |
7 930 280 |
10 540 567 |
8 056 803 |
Le Budget principal des dépenses 2014-2015 et ceux des exercices suivants comprennent le financement d’une affectation à but spécial (ABS) d’un montant de 2 470 000 $. L’ABS ne peut être utilisée que pour couvrir les coûts associés aux audiences publiques, comme le recours à des conseillers juridiques externes, à des témoins experts, entre autres. Les dépenses prévues de 2014-2015 à 2016-2017 supposent que le CEPMB dépensera la totalité des fonds de l’ABS. La raison en est que ces dépenses dépendent du nombre d’audiences, de la durée et de la complexité des audiences qui se dérouleront, des éléments qui sont difficiles à prévoir.
Le fait que les dépenses réelles de 2013-2014 soient nettement supérieures à celles de 2012-2013 est en grande partie imputable à une décision rendue par la Cour fédérale, qui a ordonné qu’un revenu excédentaire de 2 801 285 $ soit remboursé par le CEPMB au breveté, avec l’intérêt approprié et les frais déterminés.
Harmonisation des dépenses avec le cadre pangouvernemental
Harmonisation des dépenses réelles pour 2014-2015 avec le cadre pangouvernemental xviii (en dollars)
| Résultat stratégique |
Programme |
Secteur de dépenses |
Résultat du gouvernement du Canada |
Dépenses réelles 2014–2015 |
| Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs afin de protéger les intérêts de la population canadienne. La population canadienne est également tenue informée. |
Programme de réglementation du prix des médicaments brevetés |
Affaires sociales |
Des Canadiens en santé |
3 543 891 |
| Programme sur les tendances relatives aux produits pharmaceutiques |
Affaires sociales |
Des Canadiens en santé |
1 301 871 |
Total des dépenses par secteur de dépenses (en dollars)
| Secteur de dépenses |
Total des dépenses prévues |
Total des dépenses réelles |
| Affaires économiques |
|
|
| Affaires sociales |
8 094 567 |
4 845 762 |
| Affaires internationales |
|
|
| Affaires gouvernementales |
|
|
Tendances relatives aux dépenses du ministère
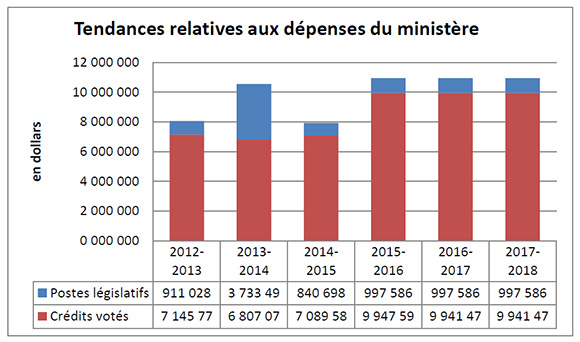
Description de la figure
Le graphique illustre la tendance des dépenses du CEPMB. Il présente les dépenses législatives pour les exercices 2012-2013, 2013-2014, and 2014-2015, ainsi que les dépenses votées pour les exercices 2015-2016, 2016-2017 et 2017-2018.
L’écart entre les dépenses législatives (postes législatifs) de 2012-2013 et celles de 2013-2014, qui leur sont nettement supérieures, est en grande partie imputable au financement supplémentaire reçu au moyen d’un mandat de rajustement pour couvrir le montant que la Cour fédérale a ordonné de rembourser à un breveté. La Cour fédérale a annulé une ordonnance du Conseil et ordonné dans sa décision qu’un revenu excédentaire de 2 801 285 $ soit remboursé par le CEPMB au breveté, avec l’intérêt approprié et les frais déterminés.
Dépenses réparties par crédit
Pour obtenir davantage d’information sur les dépenses organisationnelles votées et législatives du CEPMB, consulter les Comptes publics du Canada 2015 xix, accessibles sur le site Web de Travaux publics et Services gouvernementaux Canada xx
Section II : Analyse des programmes par résultat stratégique
Résultat stratégique :
Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs afin de protéger les intérêts de la population canadienne. La population canadienne est également tenue informée.
Programme 1.1 : Le Programme de réglementation du prix des médicaments brevetés
Description
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires et qui est responsable de s’assurer que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs en vertu des facteurs d’examen du prix prévus à la Loi. Pour décider si un prix est excessif, le Conseil doit tenir compte des facteurs suivants : les prix de vente du médicament et des autres médicaments de la même catégorie thérapeutique au Canada et dans chacun des sept pays mis en comparaison nommés dans le Règlement sur les médicaments brevetés (le Règlement); les variations de l’IPC; et, conformément à la Loi, tous les autres facteurs précisés par les règlements d’application visant l’examen du prix xxi. En vertu de la Loi et du Règlement, les brevetés sont tenus de faire rapport des renseignements sur les prix et les ventes pour chaque médicament breveté vendu au Canada, jusqu’à échéance du brevet ou des brevets. Le personnel du Conseil examine les renseignements soumis par les brevetés au lancement et à chaque période de rapport, et ce, pour tous les médicaments brevetés vendus au Canada. S’il conclut que le prix d’un médicament breveté semble excessif, le personnel du Conseil mène une enquête sur le prix. Une enquête peut se solder par un des résultats suivants : la fermeture de l’enquête lorsqu’il apparaît que le prix n’est pas excessif; un engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son produit et à rembourser les recettes excessives qu’il en a tirées au moyen d’un paiement et (ou) d’une réduction du prix d’un autre produit médicamenteux breveté; ou une audience publique dont l’objet est de déterminer si le prix du produit médicamenteux est ou non excessif, y compris une ordonnance corrective rendue par le Conseil. Si le panel d’audience du Conseil conclut, à l’issue d’une audience publique, qu’un prix est ou était excessif, il peut ordonner au breveté de réduire le prix de son produit et de prendre des mesures qui lui sont dictées pour rembourser les recettes excessives tirées de ce produit. Ce programme assure la protection des Canadiens et de leur système des soins de santé en effectuant l’examen des prix auxquels les brevetés vendent leurs médicaments brevetés au Canada afin d’éviter les prix excessifs.
Ressources financières budgétaires (en dollars)
| Budget principal des dépenses 2014-2015 |
Dépenses prévues 2014-2015 |
Autorisations totales pouvant être utilisées 2014-2015 |
Dépenses réelles (autorisations utilisées) 2014-2015 |
Écart (dépenses réelles moins dépenses prévues) 2014-2015 |
| 6 827 010 |
6 827 010 |
7 004 647 |
3 543 891 |
(3 283 119) |
Ressources humaines (équivalents temps plein - ETP)
| Prévues 2014-2015 |
Résultats réel 2014-2015 |
Écart (réel moins prévu) 2014-2015 |
| 44,0 |
24,7 |
(19,3) |
Résultats liés au rendement
| Résultats attendus |
Indicateurs de rendement |
Cibles |
Résultats réels |
| La conformité des brevetés à la Loi sur les brevets, à la réglementation et aux Lignes directrices sur les prix excessifs (les Lignes directrices) |
Pourcentage de médicaments brevetés dont les prix sont fixés en conséquence de la conformité volontaire, suivant les Lignes directrices, ou ne justifient pas la tenue d’une enquête |
95 % |
95,3 % xxii |
| Taux de conformité aux ordonnances du Conseil relatives au prix ou à la compétence et aux engagements de conformité volontaire |
100 % |
100 % |
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette des prix pratiqués dans les sept pays de comparaison nommés dans le Règlement |
Les prix canadiens des nouveaux médicaments brevetés correspondent à la moyenne du prix médian international ou se trouvent en dessous de la médiane |
100 % |
Comme par les années passées, les prix canadiens se situent généralement dans la fourchette de prix observés dans les pays de comparaison. |
| Les prix canadiens des médicaments brevetés existants correspondent à la moyenne du prix médian international ou se trouvent en dessous de la médiane |
100 % |
Comme par les années passées, les prix canadiens se situent généralement dans la fourchette de prix observés dans les pays de comparaison, malgré le fait qu’ils augmentent de façon stable par rapport à ceux pratiqués dans ces pays depuis 2005. |
Analyse du rendement et leçons retenues
De plus amples renseignements sur les résultats des examens des prix pour 2014 se trouvent dans le Rapport annuel 2014 du CEPMB dans la section « Réglementation des prix des médicaments brevetés ».
Avant la mise sur pied du CEPMB, les prix des médicaments brevetés au Canada augmentaient plus rapidement que le taux d’inflation général, selon la mesure de l’IPC, et ils excédaient de 23 % la médiane des prix à l’étranger; le Canada se classait au deuxième rang, derrière les États Unis, parmi les sept pays de comparaison du CEPMB. Depuis ce temps, l’augmentation des prix annuelle est demeurée bien en deçà de l’IPC dans presque tous les cas, tandis que les prix globaux ont été équivalents ou inférieurs à la médiane internationale après les importantes révisions apportées aux lignes directrices du CEPMB en 1994 xxiii.
Cependant, plus récemment, les prix des médicaments brevetés au Canada ont augmenté de façon constante par rapport aux prix observés dans les sept pays de comparaison du CEPMB. En 2005, le Canada figurait au troisième rang des prix les plus faibles au sein des sept pays, tandis qu’en 2013, il était au troisième rang des prix les plus élevés, presque à égalité avec l’Allemagne, mais bien en deçà des États-Unis. Le CEPMB, s’il veut continuer à respecter son mandat initial, doit moderniser son cadre de réglementation et adopter une approche davantage axée sur le consommateur relativement à la façon dont il assume ses fonctions en matière de réglementation et de rapport.
De plus amples renseignements sur les prix canadiens des médicaments par rapport à ceux des pays de comparaison pour 2014 se trouvent dans le Rapport annuel 2014 du CEPMB dans la section « Principales tendances relatives aux produits pharmaceutiques : Les ventes de médicaments sont à la hausse ».
Programme 1.2 : Le programme sur les tendances relatives aux produits pharmaceutiques
Description
Chaque année, le CEPMB rend compte au Parlement, par le truchement du ministre de la Santé, de ses activités d’analyse des prix, des prix des médicaments brevetés, des tendances des prix de l’ensemble des médicaments d’ordonnance et des dépenses en recherche et développement (R et D) déclarées par les sociétés pharmaceutiques brevetées. À l’appui de cette exigence en matière de rapport, le Programme sur les tendances relatives aux produits pharmaceutiques fournit des renseignements complets et précis sur les tendances relatives aux prix auxquels les fabricants vendent leurs médicaments brevetés au Canada et sur les dépenses de recherche développement des brevetés aux intervenants intéressés, notamment l’industrie (c.-à-d. de médicaments de marque, issus de la biotechnologie et génériques); les gouvernements fédéral, provinciaux et territoriaux; les groupes de défense des droits des consommateurs et des patients; les tiers payants; et autres. Ces renseignements permettent également de rassurer les Canadiens en leur démontrant que les prix des médicaments brevetés ne sont pas excessifs. De plus, suivant l’établissement du SNIUMP par les ministres de la Santé fédéral, provinciaux et territoriaux, la ministre fédérale de la Santé a demandé au CEPMB d’effectuer des analyses des tendances relatives au prix, à l’utilisation et aux coûts des médicaments d’ordonnance brevetés et non brevetés afin de s’assurer que le système canadien de soins de santé possède des renseignements plus exhaustifs et précis sur l’utilisation de tout médicament d’ordonnance et sur les facteurs à l’origine des augmentations de coûts. Cette fonction vise à fournir aux gouvernements fédéral, provinciaux et territoriaux ainsi, qu’aux autres intervenants intéressés, une source d’information centrale et fiable concernant les prix de tout médicament d’ordonnance.
Ressources financières budgétaires (en dollars)
| Budget principal des dépenses 2014-2015 |
Dépenses prévues 2014-2015 |
Autorisations totales pouvant être utilisées 2014-2015 |
Dépenses réelles (autorisations utilisées) 2014-2015 |
Écart (dépenses réelles moins dépenses prévues) 2014-2015 |
| 1 267 557 |
1 267 557 |
1 292 325 |
1 301 871 |
34 314 |
Ressources humaines (équivalents temps plein - ETP)
| Prévues 2014-2015 |
Résultats réels 2014-2015 |
Écart (réel moins prévu) 2014–2015 |
| 10,0 |
9,2 |
(0,8) |
Résultats liés au rendement
| Résultats attendus |
Indicateurs de rendement |
Cibles |
Résultats réels |
| Information sur les tendances pharmaceutiques et les facteurs à l’origine des coûts offerte aux intervenants |
Nombre de nouveaux rapports/nouvelles études sur le site Web du CEPMB |
12 rapports et études |
15 rapports et études |
| Nombre de présentations du CEPMB à un public externe |
10 séances d’information |
25 séances d’information |
Analyse du rendement et leçons retenues
En 2014-2015, en plus de son rapport annuel, le CEPMB a publié les études et les rapports suivants :
Méthodologie de vérification des prix internationaux
Arbre décisionnel pour la détermination des sources de prix étrangers
CompasRx du SNIUMP, 1ère édition, mars 2015
Résumé analytique : CompasRx du SNIUMP, 1ère édition, mars 2015
L’Observateur des médicaments émergents, 6e livraison, décembre 2014
Médicaments génériques au Canada, 2013, décembre 2014
L’utilisation d’opioïdes sur ordonnance dans les régimes publics d’assurance-médicaments du Canada, de 2006-2007 à 2012-2013, avril 2014
Affiches, Centre for Health Services and Policy Research (CHSPR) Health Policy Conference de 2015, mars 2015
Médicaments génériques au Canada, 2013
Les inducteurs de coût des régimes privés d’assurance-médicaments au Canada, 2012-2013
Les inducteurs de coût des régimes publics d’assurance-médicaments au Canada, 2012-2013
L’utilisation de la gabapentine dans les régimes publics d’assurance-médicaments
L’observation des nouveaux médicaments au Canada : une stratégie à facettes multiples
Médicaments génériques dans les régimes privés canadiens, 2005-2013
Affiches, Conférence de l’Association canadienne pour la recherche sur les services et les politiques de la santé (ACRSPS) de 2014, mai 2014
Les régimes privés d’assurance-médicaments au Canada
L’Observateur des médicaments émergents
Le CEPMB a pendant longtemps soutenu les efforts déployés en vertu du Processus compétitif d’appel d’offres visant les médicaments génériques (maintenant l’Alliance pharmaceutique pancanadienne (APP)) en vue d’obtenir une diminution importante du prix des médicaments génériques. Pendant plusieurs années, cette tâche consistait principalement à fournir des données comparatives sur les prix des médicaments génériques au Canada par rapport aux prix à l’échelle internationale. Récemment, le CEPMB a toutefois traité un nombre accru de demandes de provinces responsables dans le cadre des négociations de l’APP pour obtenir de l’information sur les prix de médicaments de marque brevetés à l’échelle internationale. L’adoption récente par l’Alberta de la méthode liée à l’IPC du CEPMB en tant que manière de réglementer l’augmentation des prix des médicaments brevetés et non brevetés dans cette province reflète le partenariat étroit entre le gouvernement fédéral et la province, et il pourrait y avoir d’autres collaborations de ce type. Des possibilités semblables existent dans le marché privé, car il n’y a pas d’organisme gouvernemental indépendant qui examine les questions liées au remboursement et à l’achat propres aux assureurs privés et aux particuliers et qui en fait rapport.
Le CEPMB doit accroître la sensibilisation à son mandat de protection des consommateurs et s’appuyer sur sa réputation de courtier honnête auprès des intervenants et du public en général en renforçant son partenariat avec les tiers payeurs publics pour fournir en temps opportun encore plus de renseignements pertinents sur le marché; en accroissant la portée des sujets de nature pharmaceutique sur lesquels il fait rapport pour fournir aux tiers payeurs privés et aux consommateurs des renseignements afin de les aider à faire de meilleurs choix plus rentables; en collaborant étroitement avec ses homologues internationaux afin d’assurer le partage des connaissances et des pratiques exemplaires et en adoptant une approche plus proactive concernant la communication de ses réalisations en matière de réglementation et de rapport aux intervenants et au public.
Services internes
Description
Les services internes sont des groupes d’activités et de ressources connexes qui sont gérés de façon à répondre aux besoins des programmes et des autres obligations générales d’une organisation. Ces groupes sont les suivants : services de gestion et de surveillance, services des communications, services juridiques, services de gestion des ressources humaines, services de gestion des finances, services de gestion de l’information, services des technologies de l’information, services de gestion des biens immobiliers, services de gestion du matériel, services de gestion des acquisitions et services de gestion des voyages et autres services administratifs. Les services internes comprennent seulement les activités et les ressources qui visent l’ensemble d’une organisation et non pas celles qui visent un programme particulier.
Ressources financières budgétaires (en dollars)
| Budget principal des dépenses 2014-2015 |
Dépenses prévues 2014-2015 |
Autorisations totales pouvant être utilisées 2014-2015 |
Dépenses réelles (autorisations utilisées) 2014-2015 |
Écart (dépenses réelles moins dépenses prévu) 2014-2015 |
| 2 832 463 |
2 832 463 |
2 900 196 |
3 084 518 |
252 055 |
Ressources humaines (ETP)
| Prévues 2014-2015 |
Résultats réels 2014-2015 |
Écart (réel moins prévu) 2014-2015 |
| 19,0 |
22,3 |
3,3 |
Analyse du rendement et leçons retenue
En 2014-2015, le CEPMB a mis sur pied un processus intégré pour l’établissement des besoins et des stratégies actuels et futurs en matière de dotation et de budget. Le Comité de gestion, en collaboration avec le chef, Services financiers et le chef, Services en ressources humaines, examine régulièrement les besoins en matière de budget et de dotation de l’ensemble de l’organisation, et chaque directeur doit gérer les risques associés au budget des services votés affecté à sa direction générale.
L’élaboration et la mise en œuvre du système de gestion des documents électroniques, le SGID, sont terminées. Les employés de toutes les directions générales sont maintenant formés et ils utilisent le SGID.
Au cours de la dernière année, le CEPMB a mis en place un plan de sécurité ministériel approuvé et un plan d’action pour la mise en œuvre de ce dernier. En outre, le CEPMB a entrepris une campagne de bulletins d’information sur la sécurité et créé un comité de sécurité ministériel qui se réunit régulièrement pour discuter de questions touchant la sécurité.
Section III : Renseignements supplémentaires
Faits saillants des états financiers
État condensé des opérations
(non audité)
Pour l’exercice se terminant le 31 mars 2015
(dollars)
| Information financière |
Résultats attendus 2014-2015* |
Résultats réels 2014-2015 |
Résultats réels 2013-2014 |
Écart (résultats réels 2014-2015 moins résultats attendus 2014-2015) |
Écart (résultats réels 2014-2015 moins résultats réels 2013-2014) |
| Total des dépenses |
12 515 942 |
8 806 161 |
8 749 006 |
(3 709 781) |
57 155 |
| Total des revenus |
- |
114 |
213 |
114 |
(99) |
| Coût de fonctionnement net avant le financement du gouvernement et les transferts |
12 515 942 |
8 806 047 |
8 748 793 |
(3 709 895) |
57 254 |
* Les dépenses prévues en 2014-2015 sont fondées sur l’hypothèse que le CEPMB dépensera la totalité des 2 470 000 $ conservés dans l’ABS et réservés pour la tenue d’audiences publiques. La raison en est que ces dépenses dépendent du nombre d’audiences, de la durée et de la complexité des audiences qui se dérouleront, qui sont difficiles à prévoir.
** Les revenus qui sont non disponibles ne peuvent être utilisés par le Conseil pour s’acquitter de ses obligations. Les revenus non disponibles sont gagnés au nom du gouvernement du Canada. Le CEPMB recueille des revenus non disponibles par suite de paiements effectués par les brevetés au gouvernement du Canada au titre d’engagements de conformité volontaire ou d’ordonnances du Conseil pour compenser les revenus excédentaires. En 2014-2015, le CEPMB a recueilli des revenus non disponibles d’un montant de 2 731 123 $. En 2013-2014, les revenus non disponibles étaient de 10 605 109 $. |
État condensé de la situation financière (non audité)
Au 31 mars 2015
(dollars)
| Information financière |
2014–2015 |
2013–2014 |
Écart (2014-2015 moins 2013-2014) |
| Total des passifs nets |
1 510 991 |
1 112 115 |
398 876 |
| Total des actifs financiers nets |
851 654 |
571 604 |
280 050 |
| Dette nette du Ministère |
659 337 |
540 511 |
118 826 |
| Total des actifs non financiers |
165 738 |
73 343 |
92 395 |
| Situation financière nette du Ministère |
(493 599) |
(467 168) |
(26 431) |
Total des passifs
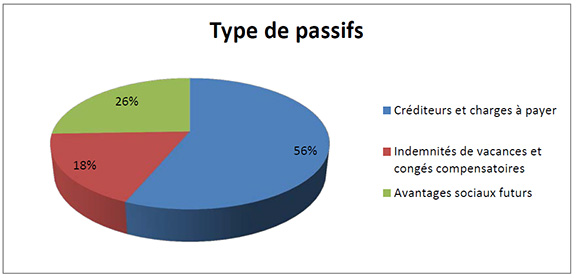
Description de la figure
Le total des passifs nets était de 1 510 991 $ à la fin de 2014-2015, soit une augmentation de 398 876 $ par rapport à l’exercice précédent. L’augmentation comportait principalement ce qui suit :
- Une augmentation de 280 467 $ au titre des créditeurs et charges à payer
- Une augmentation de 20 634 $ au titre des indemnités de vacances et congés compensatoires.
- Une augmentation de 97 775 $ au titre des avantages sociaux futurs.
Total des passifs
Le total des passifs nets était de 1 510 991 $ à la fin de 2014-2015, soit une augmentation de 398 876 $ par rapport à l’exercice précédent. L’augmentation comportait principalement ce qui suit :
- Une augmentation de 280 467 $ au titre des créditeurs et charges à payer
- Une augmentation de 20 634 $ au titre des indemnités de vacances et congés compensatoires.
- Une augmentation de 97 775 $ au titre des avantages sociaux futurs.
Total des actifs
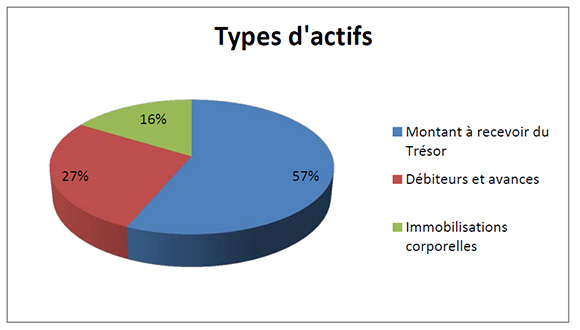
Description de la figure
Le total des actifs était de 1 017 392 $ à la fin de 2014-2015, une augmentation de 372 445 $ par rapport à l’exercice précédent. Les écarts dans les actifs comportaient principalement ce qui suit :
- Une augmentation de 191 691 $ au titre du montant à recevoir du Trésor.
- Une augmentation de 88 359 $ au titre des débiteurs et avances.
- Une augmentation de 92 395 $ au titre des immobilisations corporelles.
Total des actifs
Le total des actifs était de 1 017 392 $ à la fin de 2014-2015, une augmentation de 372 445 $ par rapport à l’exercice précédent. Les écarts dans les actifs comportaient principalement ce qui suit :
- Une augmentation de 191 691 $ au titre du montant à recevoir du Trésor.
- Une augmentation de 88 359 $ au titre des débiteurs et avances.
- Une augmentation de 92 395 $ au titre des immobilisations corporelles.
États financiers
Les principales données financières présentées dans le Rapport ministériel sur le rendement visent à donner une vue d’ensemble de la situation financière et des activités du Commissariat. Les États financiers du CEPMB xxiv sont accessibles sur son site Web.
Tableaux de renseignements supplémentaires
Les tableaux de renseignements supplémentaires énumérés dans le Rapport ministériel sur le rendement 2014–2015 se trouvent sur le site Web du CEPMB.
Dépenses fiscales et évaluations
Il est possible de recourir au régime fiscal pour atteindre des objectifs de la politique publique en appliquant des mesures spéciales, comme de faibles taux d’impôt, des exemptions, des déductions, des reports et des crédits. Le ministère des Finances du Canada publie annuellement des estimations et des projections du coût de ces mesures dans une publication intitulée Dépenses fiscales et évaluations xxvii. Les mesures fiscales présentées dans ladite publication relèvent de la responsabilité du ministre des Finances.
Section IV : Coordonnées de l’organisation
Conseil d’examen du prix des médicaments brevetés
Case L40
Centre Standard Life
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 613-952-7360
Sans frais : 1-877-861-2350
Télécopieur : 613-952-7626
ATS : 613-957-4373
Courriel : pmprb@pmprb-cepmb.gc.ca
Site Web : http://www.pmprb-cepmb.gc.ca/fr/accueil
Annexe : Définitions
architecture d’alignement des programmes (program alignment architecture) : Répertoire structuré de tous les programmes d’un ministère ou organisme qui décrit les liens hiérarchiques entre les programmes et les liens aux résultats stratégiques auxquels ils contribuent.
cadre pangouvernemental (whole-of-government framework) : Schéma représentant la contribution financière des organisations fédérales qui dépendent de crédits parlementaires en harmonisant leurs programmes avec un ensemble de 16 secteurs de résultat pangouvernementaux de haut niveau regroupés sous 4 secteurs de dépenses.
cible (target) : Niveau mesurable du rendement ou du succès qu’une organisation, un programme ou une initiative prévoit atteindre dans un délai précis. Une cible peut être quantitative ou qualitative.
crédits (appropriation) : Autorisation donnée par le Parlement d’effectuer des paiements sur le Trésor.
dépenses budgétaires (budgetary expenditures) : Les dépenses budgétaires comprennent les dépenses de fonctionnement et en capital; les paiements de transfert à d’autres ordres de gouvernement, à des organisations ou à des particuliers; et les paiements à des sociétés d’État.
dépenses non budgétaires (Non-budgetary expenditures) : Recettes et décaissements nets au titre de prêts, de placements et d’avances, qui modifient la composition des actifs financiers du gouvernement du Canada.
dépenses législatives (statutory expenditures) : Dépenses approuvées par le Parlement à la suite de l’adoption d’une loi autre qu’une loi de crédits. La loi précise les fins auxquelles peuvent servir les dépenses et les conditions dans lesquelles elles peuvent être effectuées.
dépenses prévues (planned spending) : En ce qui a trait aux RPP et aux RMR, les dépenses prévues s’entendent des montants approuvés par le Conseil du Trésor au plus tard le 1er février. Elles peuvent donc comprendre des montants qui s’ajoutent aux dépenses prévues indiquées dans le budget principal des dépenses.
Un ministère est censé être au courant des autorisations qu’il a demandées et obtenues. La détermination des dépenses prévues relève du ministère, et ce dernier doit être en mesure de justifier les dépenses et les augmentations présentées dans son RPP et son RMR.
dépenses votées (voted expenditures) : Dépenses approuvées annuellement par le Parlement à la suite de l’adoption d’une loi de crédits. Le libellé du crédit régit les conditions dans lesquelles ces dépenses peuvent être effectuées.
équivalent temps plein (full-time equivalent) : Mesure utilisée pour déterminer dans quelle mesure un employé représente une année-personne complète dans le budget ministériel. L’équivalent temps plein est calculé en fonction du coefficient des heures de travail assignées et des heures normales de travail. Les heures normales de travail sont établies dans les conventions collectives.
indicateur de rendement (Performance indicator) : Moyen qualitatif ou quantitatif de mesurer un extrant ou un résultat en vue de déterminer le rendement d’une organisation, d’un programme, d’une politique ou d’une initiative par rapport aux résultats attendus.
plan (plan) : Exposé des choix stratégiques qui montre comment une organisation entend réaliser ses priorités et obtenir les résultats connexes. De façon générale, un plan explique la logique qui sous-tend les stratégies retenues et tend à mettre l’accent sur des mesures qui se traduisent par des résultats attend.
priorité (priority) : Plan ou projet qu’une organisation a choisi de cibler et dont elle rendra compte au cours de la période de planification. Il s’agit de ce qui importe le plus ou qui doit être fait en premier pour appuyer la réalisation du ou des résultats stratégiques souhaités.
production de rapports sur le rendement (performance reporting) : Processus de communication d’information sur le rendement fondée sur des éléments probants. La production de rapports sur le rendement appuie la prise de décisions, la responsabilisation et la transparence.
programme (program) : Groupe d’intrants constitué de ressources et d’activités connexes qui est géré pour répondre à des besoins précis et pour obtenir les résultats visés, et qui est traité comme une unité budgétaire.
programme temporisé (sunset program) : Programme ayant une durée fixe et dont le financement et l’autorisation politique ne sont pas permanents. Lorsqu’un tel programme arrive à échéance, une décision doit être prise quant à son maintien. Dans le cas d’un renouvellement, la décision précise la portée, le niveau de financement et la durée.
rapports ministériels sur le rendement (departmental performance report) : Rapport traitant des réalisations concrètes d’une organisation qui dépend de crédits parlementaires au regard des plans, des priorités et des résultats attendus exposés dans le rapport sur les plans et les priorités correspondant. Ce rapport est déposé au Parlement à l’automne.
rapport sur les plans et les priorités (Report on Plans and Priorities) : Rapport fournissant des renseignements au sujet des plans et du rendement prévu sur trois ans d’une organisation qui dépend de crédits parlementaires. Ces rapports sont déposés au Parlement chaque printemps.
rendement (Performance) : Utilisation qu’une organisation a faite de ses ressources en vue d’obtenir ses résultats, mesure dans laquelle ces résultats se comparent à ceux que l’organisation souhaitait obtenir, et mesure dans laquelle les leçons apprises ont été cernées
résultat (result) : Conséquence externe attribuable en partie aux activités d’une organisation, d’une politique, d’un programme ou d’une initiative. Les résultats ne relèvent pas d’une organisation, d’une politique, d’un programme ou d’une initiative unique, mais ils s’inscrivent dans la sphère d’influence de l’organisation.
résultat stratégique (performance) : Avantage durable et à long terme pour les Canadiens qui est rattaché au mandat, à la vision et aux fonctions de base d’une organisation.
résultats du gouvernement du Canada (Government of Canada outcomes) : Ensemble de 16 objectifs de haut niveau établis pour l’ensemble du gouvernement et regroupés selon 4 secteurs de dépenses : affaires économiques, affaires sociales, affaires internationales et affaires gouvernementales.
structure de la gestion, des ressources et des résultats (Management, Resources and Results Structure) : Cadre exhaustif comprenant l’inventaire des programmes, des ressources, des résultats, des indicateurs de rendement et de l’information de gouvernance d’une organisation. Les programmes et les résultats sont présentés d’après le lien hiérarchique qui les unit, et les résultats stratégiques auxquels ils contribuent. La Structure de la gestion, des ressources et des résultats découle de l’architecture d’alignement des programmes.
Notes de fin de document
i. Loi sur les brevets, http://www.laws-lois.justice.gc.ca/fra/lois/P-4/
ii. Règlement sur les médicaments brevetés, http://laws-lois.justice.gc.ca/fra/reglements/DORS-94-688/index.html
iii. Des renseignements supplémentaires sur le Système national d’information sur l’utilisation des médicaments prescrits sont disponibles sur le site Web du CEPMB à l’adresse, http://www.pmprb-cepmb.gc.ca/fr/sniump/à-propos-du-sniump
iv. Médicaments génériques au Canada, 2013, décembre 2014, disponible sur le site Web du CEPMB à l’adresse http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1122&lang=fr
v. Pharmaceutical Pricing and Reimbursement Information (PPRI) est une initiative de réseautage et de partage d’information sur des questions pressantes de politiques pharmaceutiques du point de vue de la santé publique. Cette initiative rassemble environ 70 établissements (principalement des autorités compétentes et des tiers payants) des 28 États membres de l'Union européenne en plus de dix autres pays (principalement européens).
vi. La norme de service pour l’examen scientifique des nouveaux produits médicamenteux brevetés et les résultats de 2014 sont accessibles sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=499&lang=fr
vii. La norme de service pour l’examen du prix des nouveaux produits médicamenteux brevetés et les résultats de 2014 sont accessibles sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=500&lang=fr
viii. La norme de service pour l’examen du prix des produits médicamenteux brevetés existants et les résultats de 2014 sont accessibles sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=501&lang=fr
ix. Le Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices (PSELD 2014) est accessible sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1141&lang=fr
x. La Politique d’interprétation du CEPMB est accessible sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1128&lang=fr
xi. En 2010, par suite d’un effort commun des provinces et des territoires pour mettre au point des stratégies de prix de gros et d’achat en masse, le Conseil de la fédération a créé l’Alliance pancanadienne pharmaceutique (APP). L’APP mène des négociations provinciales/territoriales communes sur les médicaments de marque et les médicaments génériques afin d’accroître la valeur des programmes de médicaments financés par l’État.
xii. La Politique de consultation est accessible sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1028&lang=fr
xiii. Des renseignements sur les Formules de décomposition pour la vérification des prix internationaux sont accessibles sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=504&lang=fr
xiv. France, Royaume-Uni, Suède, Suisse, Allemagne, États-Unis, Italie
xv. Les sources reconnues du CEPMB sont accessibles sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=502&lang=fr
xvi. L’arbre décisionnel est accessible sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=502&lang=fr
xvii. L’édition de janvier 2015 de La Nouvelle du CEPMB est accessible sur le site Web du CEPMB, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1145&lang=fr
xviii. Cadre pangouvernemental, http://publiservice.tbs-sct.gc.ca/ppg-cpr/frame-cadre-fra.aspx
xix. Comptes publics du Canada 2015, http://www.tpsgc-pwgsc.gc.ca/recgen/cpc-pac/index-fra.html
xx. Site Web de Travaux publics et Services gouvernementaux Canada, http://www.tpsgc-pwgsc.gc.ca/recgen/cpc-pac/index-fra.html
xxi. Si, compte tenu des facteurs précisés, le Conseil n’est pas en mesure de décider si le médicament est ou a été vendu à un prix excessif, il peut également tenir compte du coût de fabrication et de commercialisation du médicament et de tout autre facteur qu’il juge pertinent dans les circonstances.
xxii. Ce pourcentage, fondé sur le nombre d’examen des prix effectués en date du 31 mars 2015, est calculé comme suit : la somme du nombre d’examens des prix dont les résultats respectent les Lignes directrices, plus le nombre d’examens des prix qui n’ont pas donné lieu à une enquête, plus le nombre d’engagements de conformité volontaire; divisé par le nombre total de produits pharmaceutiques breveté en date du 31 mars 2015 moins le nombre de produits pharmaceutiques qui faisaient encore l’objet d’un examen.
xxiii. Conseil d’examen du prix des médicaments brevetés, Bulletin, no 12, septembre 1993
xxiv. Les États financiers du CEPMB sont accessibles sur le site Web du CEPMB : http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1223&lang=fr
xxv. Audits internes et évaluations, http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1222&lang=fr
xxvi. Stratégie ministérielle de développement durable http://www.pmprb-cepmb.gc.ca/view.asp?ccid=1220&lang=fr
xxvii. Dépenses fiscales du gouvernement du Canada, http://www.fin.gc.ca/purl/taxexp-fra.asp