
ISSN : 1495-057X
No cat. : H78F-PDF
La version PDF (2.69 MB)
Aperçu statistique de 2014
Mandat de réglementation
- 1 363 produits médicamenteux brevetés pour usage humain ont fait l’objet d’un rapport au CEPMB, dont 103 nouveaux produits médicamenteux brevetés.
En date du 31 mai 2015 :
- 5 engagements de conformité volontaire ont été acceptés.
- Des recettes excessives totalisant 2,79 millions de dollars ont été remboursées au moyen de paiements au gouvernement du Canada, en plus de réductions de prix.
- 1 avis d’audience a été émis dans l’affaire du prix du Soliris.
Mandat de rapport
Tendances observées au niveau des ventes :
- Les ventes de produits médicamenteux brevetés au Canada ont atteint 13,7 milliards de dollars en 2014, soit une augmentation de 3,1 % par rapport à 2013.
- Les produits médicamenteux brevetés ont accaparé 59,6 % du total des ventes de médicaments au Canada, soit une diminution par rapport à 60,7 % en 2013.
Tendances observées au niveau des prix :
- Les prix des produits médicamenteux brevetés sont demeurés stables, alors que l’Indice des prix à la consommation a augmenté de 2,0 %.
- Les prix au Canada se situaient au 3e rang des prix les plus élevés par rapport aux sept pays de comparaison du CEPMB, étant inférieurs aux prix en Allemagne et aux États-Unis.
Recherche et développement (R-D) :
- Les brevetés ont fait rapport de dépenses de R-D totalisant 739,2 millions de dollars, soit une diminution de 1,8 % par rapport à 2013.
- Les brevetés membres de Rx&D ont fait rapport de dépenses de R-D totalisant 658,7 millions de dollars, soit une augmentation de 1,0 % par rapport à 2013.
Les ratios des dépenses de R-D par rapport aux recettes tirées des ventes ont enregistré un recul en 2014 :
- 4,4 % chez tous les brevetés, une diminution par rapport à 4,5 % en 2013
- 5,0 % chez les brevetés membres de Rx&D, une diminution par rapport à 5,4 % en 2013
Lettre à la Ministre
Le 16 novembre 2015
L’honorable Jane Philpott, députée
Ministre de la Santé
Chambre des communes
Ottawa (Ontario)
K1A 0A6
Madame la ministre,
J’ai le plaisir de vous présenter, conformément aux articles 89 et 100 de la Loi sur les brevets, le Rapport annuel du Conseil d’examen du prix des médicaments brevetés pour l’exercice terminé le 31 décembre 2014.
Croyant le tout conforme, je vous prie d’agréer, Madame la ministre, l’assurance de mes sentiments distingués.
Mary Catherine Lindberg
Présidente
Message de la Présidente
Je suis heureuse de présenter le Rapport annuel 2014 du CEPMB. Cette année, nous avons mis à jour le format du rapport afin d’adopter un concept plus convivial qui met en évidence les activités du CEPMB et souligne les tendances importantes.
En tant que Canadiens, nous sommes actuellement confrontés à des questions complexes quant à la meilleure façon d’assurer l’accès continu aux médicaments et ce, de manière rentable. Alors que notre population vieillit, une vague de nouveaux médicaments prometteurs, mais onéreux, font leur entrée sur le marché. Ce phénomène augmente la tension qui se fait déjà ressentir au niveau des budgets en matière de soins de santé et, par conséquent, les payeurs sont forcés à prendre des décisions de plus en plus difficiles.
Le Conseil d’examen du prix des médicaments brevetés (CEPMB), une agence de protection des consommateurs avec un double mandat de réglementation et de rapport, a un rôle unique à jouer dans ce paysage en constante évolution. Le mandat de réglementation du CEPMB vise à s’assurer que les prix auxquels les médicaments brevetés sont vendus au Canada ne sont pas excessifs. Son mandat de rapport consiste à fournir aux intervenants des renseignements sur les dernières tendances relatives aux ventes et aux prix des produits pharmaceutiques et aux dépenses de recherche-développement (R-D) pharmaceutique au Canada.
En ce qui concerne son mandat de réglementation, au cours de la période de rapport de 2014, le CEPMB a conclu des engagements de conformité volontaire suite à des enquêtes sur les prix de cinq médicaments brevetés. Par conséquent, des brevetés pharmaceutiques ont remboursé des recettes excessives totalisant 2,8 millions de dollars au gouvernement du Canada. En 2014, le CEPMB a aussi entamé une audience relative au prix du médicament breveté Soliris, soit la première telle instance depuis 2012.
En ce qui a trait à son mandat de rapport, outre la publication de son rapport annuel, le CEPMB a publié la première édition du rapport annuel CompasRx du SNIUMP. Ce rapport phare est le premier de son genre qui cerne les principaux moteurs à l’origine des changements observés en matière de dépenses en médicaments d’ordonnance au sein des régimes publics d’assurance-médicaments au Canada. Les renseignements présentés dans ce rapport et dans les autres études du SNIUMP visent à appuyer les payeurs et les décideurs de l’industrie pharmaceutique dans la prise de décisions éclairées en matière de remboursement et d’établissement de prix. Par l’entremise de ses rapports impartiaux, le CEPMB contribue à la discussion générale au sein de la société, et prépare les Canadiens, que ce soit les gestionnaires de régimes d’assurance-médicaments ou les consommateurs, en vue des décisions importantes dans l’horizon.
Le Canada et l’Union européenne se sont entendus sur le texte complet de l’Accord économique et commercial global (AECG). La mise en oeuvre de ce dernier exigera des modifications à la Loi sur les brevets afin d’accorder aux brevetés pharmaceutiques une prolongation de la période d’exclusivité commerciale d’au plus deux années supplémentaires. Ce changement coïnciderait avec des prix élevés de médicaments et une faiblesse record des niveaux de R-D, ce qui porte certains à remettre en question l’efficacité du CEPMB et à se demander si l’équilibre stratégique conçue il y a plus de vingt-cinq ans peut continuer de répondre à l’objectif visé. À la lumière de telles questions, le Conseil a amorcé un processus de planification stratégique tout au long de l’année 2014, en vue d’établir un nouveau plan pour les vingt-cinq prochaines années qui permettra au CEPMB de se réapproprier ses origines en matière de protection des consommateurs. Les priorités stratégiques qui ont résulté de ce processus sont décrites dans le prochain Plan stratégique du CEPMB. Alors que j’entame ma cinquième et dernière année à titre de présidente du CEPMB, et ma dixième année en tant que membre du Conseil, j’ai bonne confiance que l’exécution minutieuse de ces priorités au courant des prochaines années permettra au CEPMB de faire fond sur ses réussites antérieures et de sortir de cette période avec une plus grande vigueur et une meilleure efficacité que jamais dans son histoire qui remonte à presque trois décennies.
Mary Catherine Lindberg
Le Conseil d’examen du prix des médicaments brevetés : Agir dans l’intérêt des canadiens
Le CEPMB a été établi en 1987 en tant que « pilier » de la protection du consommateur du projet de loi C-22, mesure législative qui visait également à renforcer les droits de brevet des fabricants de produits pharmaceutiques afin de stimuler l’investissement dans la recherche et développement (R-D) au Canada.
Le CEPMB est chargé de protéger les consommateurs en réglementant le prix des médicaments brevetés au niveau départ usine, et de suivre attentivement les tendances dans l’établissement des prix et la R-D au sein de l’industrie. Dans le cadre de sa fonction de rapport, il agit en tant que source d’information objective et centralisée sur les tendances pharmaceutiques pour les décideurs, les sociétés pharmaceutiques, les assureurs privés et d’autres intervenants.
Nous sommes un organisme indépendant
chargé d’administrer les dispositions de la Loi sur les brevets du Canada relatives aux médicaments brevetés. En tant que membre du portefeuille de la Santé, il contribue à un système de soins de santé durable pour l’ensemble de la population canadienne.
1 363 Produits médicamenteux brevetés
1 363 Produits médicamenteux brevetés ont fait l’objet d’un rapport au CEPMB en 2014.
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi).
Le CEPMB est un organisme de protection des consommateurs qui exécute un double mandat de réglementation et de production de rapports. Dans le cadre de son mandat de réglementation, il s’assure que les produits médicamenteux brevetés ne sont pas vendus au Canada à des prix excessifs. Le Conseil fait également le point sur les tendances observées au niveau des ventes de produits pharmaceutiques et de l’établissement des prix pour tous les médicaments, ainsi que les dépenses de recherche-développement (R-D) des brevetés. Notamment, par l’entremise de l’initiative du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), le CEPMB fournit aux payeurs de produits pharmaceutiques et aux décideurs les renseignements nécessaires pour prendre des décisions rationnelles et fondées sur des données probantes en ce qui a trait au remboursement et à l’établissement des prix.
La protection des consommateurs dans un marché complexe
Description de la figure
Les consommateurs canadiens sont représentés de façon symbolique par des images génériques d’un homme et d’une femme au centre d’un cercle divisé en segments. Chaque segment du cercle représente une organisation ou une catégorie d’organisations faisant partie de l’environnement pharmaceutique canadien : Régimes publics d’assurance-médicaments; ICIS; Régimes privés d’assurance-médicaments; Associations de l’industrie; Santé Canada; Brevetés; CEPMB; ACMTS.
Le CEPMB fait partie du portefeuille de la Santé, qui est également constitué de Santé Canada, de l’Agence de la santé publique du Canada, des Instituts de recherche en santé du Canada et de l’Agence canadienne d’inspection des aliments. Le portefeuille de la Santé aide le ministre de la Santé à maintenir et à améliorer la santé des Canadiens.
Même s’il fait partie du portefeuille de la Santé, le CEPMB, en raison de ses responsabilités quasi judiciaires, exerce son mandat en toute indépendance vis-à-vis du ministre de la Santé, qui est responsable de l’application des dispositions de la Loi se rapportant au Conseil. Il fonctionne également d’une façon indépendante des autres organismes, à savoir Santé Canada, qui autorise la vente des médicaments au Canada après avoir vérifié leur innocuité, leur efficacité et leur qualité; les régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments qui autorisent l’inscription des médicaments sur leurs formulaires de médicaments admissibles à un remboursement; et le Programme commun d’examen des médicaments, géré par l’Association canadienne des médicaments et des technologies de la santé, qui présente des recommandations quant aux médicaments admissibles au remboursement par les régimes publics d’assurance-médicaments participants.
Le CEPMB se compose du personnel du Conseil, soit des fonctionnaires responsables des activités quotidiennes de l’organisme, et de membres du Conseil nommés par le gouverneur en conseil, qui agiront en cas de conflit entre le personnel du Conseil et un breveté au sujet du prix d’un médicament breveté.
Compétence
Réglementation
Le CEPMB réglemente les prix « départ usine » de tous les produits médicamenteux brevetés au Canada, soit le prix auquel les brevetés (entreprises) vendent leurs produits aux grossistes, aux hôpitaux, aux pharmacies et aux autres grands distributeurs. Le CEPMB n’a aucun droit de regard sur les prix pratiqués dans le reste de la chaîne d’approvisionnement, par exemple les prix de gros ou de détail pratiqués par les pharmacies, et n’est pas habileté à réglementer les prix des médicaments non brevetés.
La compétence du Conseil ne s’applique pas exclusivement aux produits médicamenteux dont le brevet porte sur l’ingrédient actif, mais aussi aux médicaments auxquels un brevet est lié, que ce soit au niveau de son procédé de fabrication, de son mode d’administration, de sa forme posologique, de l’indication/utilisation, de la préparation ou autre.
En vertu de la Loi, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté. Les brevetés doivent présenter des renseignements relatifs au prix et à la vente après l’introduction de leur produit et après que tous les brevets sont expirés. Même s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour s’assurer que les prix auxquels ils vendent leurs produits médicamenteux au Canada ne sont pas excessifs.
Le personnel du Conseil examine les prix demandés par les brevetés pour chaque concentration et forme d’un médicament breveté. S’il détermine qu’un prix est excessif, le personnel tâchera d’abord de trouver un consensus avec le breveté. À défaut d’y parvenir, le président peut tenir une audience. Lors de cette dernière, un panel, se composant des membres du Conseil, agira à titre d’arbitre neutre entre le personnel du Conseil et le breveté. Si ce panel conclut que le prix du médicament breveté est excessif, il peut rendre une ordonnance demandant la réduction du prix. Il peut également exiger que le breveté rembourse les recettes excessives qu’il a encaissées et, dans les cas où le panel conclut à la présence d’une politique de prix excessifs, il peut doubler le montant des recettes excessives à rembourser.
Rapport
Chaque année, le CEPMB rend compte au Parlement, par le truchement du ministre de la Santé, de ses activités d’examen des prix et des prix des médicaments brevetés, présente une analyse des tendances des prix de tous les médicaments sur ordonnance et fait rapport des dépenses de R-D déclarées par les brevetés, comme l’exige la Loi.
Au moyen de l’initiative du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), établie par les ministres fédéral, provinciaux et territoriaux (FPT) de la Santé en 2001, le CEPMB effectue des analyses critiques des tendances des prix des produits médicamenteux d’ordonnance, de l’utilisation faite de ces produits et des coûts en produits médicamenteux. Cette initiative permet aux gouvernements FPT et aux autres intervenants intéressés d’accéder à une source centrale et fiable de renseignements sur les tendances concernant les produits pharmaceutiques.
Gouvernance
Le Conseil est composé d’au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Tous les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi, le président du Conseil assume également les fonctions de chef de la direction et, en cette qualité, est chargé de la gouverne et de la supervision des activités du CEPMB.
Les membres du Conseil, y compris le président, sont collectivement responsables de la mise en œuvre des dispositions applicables de la Loi. Ensemble, ils établissent les lignes directrices, les règles, les règlements administratifs et les autres politiques du Conseil, comme le prévoit la Loi et consultent au besoin des intervenants, y compris les ministres provinciaux et territoriaux de la Santé et les représentants de groupes de consommateurs et de l’industrie pharmaceutique.
Membres du Conseil
Présidente
Mary Catherine Lindberg, B. Sc. Pharm.

Mary Catherine Lindberg a d’abord été nommée membre et vice-présidente du Conseil d’examen du prix des médicaments brevetés en juin 2006. Le 19 mai 2010, Mme Lindberg assumait les fonctions de la présidence pendant la vacance du poste. Elle a été officiellement nommée présidente du Conseil le 3 mars 2011.
Mme Lindberg a occupé de 2002 à 2009 le poste de directrice exécutive du Ontario Council of Academic Hospitals, un regroupement de 25 hôpitaux universitaires affiliés à une université et à sa faculté de médecine. Avant d’occuper ce poste, Mme Lindberg était sous-ministre adjointe des Services de santé, au ministère de la Santé et des Soins de longue durée de l’Ontario. Elle s’occupait entre autres du Régime d’assurance-maladie de l’Ontario et des Programmes de médicaments.
Mme Lindberg a fait ses études en pharmacie à l’Université de la Saskatchewan et a son permis de pratique en Saskatchewan et en Ontario.
Vice-président
Mitchell Levine, B. Sc., M. Sc., M. D., FRCPC, FISPE, FACP

Le Dr Mitchell Levine a été nommé membre et vice-président du Conseille 3 mars 2011.
Le Dr Levine est professeur au sein des départements de médecine et d’épidémiologie clinique et biostatistiques, à la division de pharmacologie clinique de la faculté des sciences de la santé de l’Université McMaster à Hamilton, en Ontario. Il est également directeur du Centre for Evaluation of Medicines à St. Joseph’s Healthcare, à Hamilton.
Le Dr Levine a obtenu son diplôme en médecine à l’Université de Calgary et a fait des études supérieures en médecine interne et en pharmacologie clinique à l’Université de Toronto. Il a obtenu un diplôme de maîtrise ès sciences en épidémiologie clinique de l’Université McMaster. Il est également un médecin consultant à Hamilton, en Ontario.
Avant sa nomination au Conseil, le Dr Levine était membre du Groupe consultatif sur les médicaments pour usage humain du CEPMB. Il agit actuellement comme consultant spécial en pharmacologie clinique au ministère de la Santé et des Soins de longue durée de l’Ontario. De plus, il est rédacteur en chef du Journal de la thérapeutique des populations et de la pharmacologie clinique et est corédacteur de l’ACP Journal Club : Evidence-Based Medicine.
Membres
Normand Tremblay, ASC, M.Sc., Adm.A., CMC

Normand Tremblay a été nommé Membre du Conseil le 31 mai 2012.
M. Tremblay enseigne à l’Université du Québec dans le domaine de la gestion, de la gestion de projet et de l’innovation. Il apporte une vaste expérience et expertise dans le développement stratégique et organisationnel au sein du Conseil. M. Tremblay a été actif pendant plus de 20 ans dans le domaine des affaires dans différents secteurs d’activités, et ce sur l’échiquier national et international. Il a aussi siégé sur des comités d’investissements et plusieurs conseils d’administration, dont celui du Conseil National de la recherche du Canada de 2007 à 2010.
M. Tremblay est titulaire d’une maitrise en gestion de projet (M. Sc.) spécialisée dans les meilleures pratiques de développement de produit de l’Université du Québec à Trois-Rivières, d’un certificat en gouvernance de sociétés de l’Université Laval (2009) et est conseiller en management certifié. Il est aussi membre de l’Ordre des Administrateurs du Québec.
Richard Bogoroch, LL.B.

Richard Bogoroch a été nommé membre du Conseil le 13 décembre 2012.
M. Bogoroch est le fondateur et directeur associé de Bogoroch & Associates LLP, le successeur de Bogoroch and Associates, un cabinet d’avocats spécialisé en litige civil établi à Toronto en novembre 1999. Bogoroch &
Associates LLP exerce principalement en litige lié aux blessures personnelles graves, à la mort dommageable, à la faute médicale, à la responsabilité des produits et aux réclamations d’invalidité.
M. Bogoroch a obtenu un B. C.L. en 1978 et un LL. B en 1979 de l’Université McGill. Il a été reçu au Barreau de l’Alberta en 1980 et appelé au Barreau de l’Ontario en 1983. Richard a complété son stage à Thomson Rogers et, suite à son appel au Barreau en 1983, s’est joint au cabinet. En 1993, il a été certifié en tant que spécialiste en contentieux civil par le Barreau du Haut-Canada. Il a agi à titre d’associé au cabinet Thomson Rogers de 1987 à 1999. M. Bogoroch est ancien directeur de l’Ontario Centre for Advocacy Training et de l’Advocates’ Society. Il est également ancien président de l’Association du Barreau canadien – comité provincial de l’Ontario sur le pouvoir judiciaire. M. Bogoroch a donné de nombreux exposés et écrit bon nombre de documents sur les diverses facettes du contentieux du dommage corporel dans le cadre des programmes de formation juridique permanente offerts par l’Advocates’ Society, le Barreau du Haut-Canada, l’Association du Barreau de l’Ontario, l’Ontario Trial Lawyers Association, l’Institut canadien, l’Osgoode Hall Law School, Insight, et autres. Depuis 1999, il est professeur invité dans le cadre de l’atelier intensif en techniques de plaidoirie à la Osgoode Hall Law School. De 2011 à 2014, il a présidé ou co-présidé le programme annuel du programme de formation permanente d’Osgoode sur le droit de préjudice personnel. Depuis 2011, il co-préside le programme « Tricks of the Trade » de l’Advocates’ Society, son programme annuel de formation juridique permanente sur le droit de préjudice personnel.
M. Bogoroch a été reconnu par LEXPERT en tant qu’avocat de premier rang en droit du préjudice personnel et a été nommé parmi les « meilleurs avocats » en litige en matière de préjudice personnel.
Carolyn Kobernick, LL. L., LL. B.

Carolyn Kobernick a été nommée membre du Conseil le 13 juin 2014.
Mme Kobernick est avocate et ancienne fonctionnaire. Avant sa retraite en 2013, elle occupait le poste de sousministre adjointe du droit public au sein du ministère de la Justice depuis 2006. En tant qu’avocate principale du ministre de la Justice et du procureur général du Canada, Mme Kobernick a joué un rôle clé dans l’élaboration et la mise en œuvre de politiques du secteur du droit public. En plus de cerner les grandes questions stratégiques, juridiques et opérationnelles, elle s’est attaquée à des questions intersectorielles nationales à titre d’agente de liaison entre le ministère de la Justice et les autres organismes gouvernementaux.
Mme Kobernick s’est jointe au ministère de la Justice en 1980, où elle a pratiqué le droit litigieux et fiscal dans le bureau régional de Toronto. En 1991, elle a été nommée avocate générale principale et chef adjointe du portefeuille du droit des affaires et du droit réglementaire après avoir travaillé pendant plus de dix ans au sein de l’unité des services juridiques de Service correctionnel du Canada. En tant qu’avocate principale générale, Mme Kobernick a participé à des dossiers stratégiques et opérationnels complexes touchant le gouvernement du Canada, comme les projets de pipeline de l’Alaska et de pipeline de la vallée du Mackenzie ainsi que le dossier des commandites.
Pendant sa carrière au sein de la fonction publique, Mme Kobernick a activement participé à de nombreuses initiatives de haut niveau. Elle a été présidente du Comité national de conseils juridiques et championne ministérielle des Autochtones et de l’égalité entre les sexes. Elle a également été nommée conseillère juridique principale du gouvernement du Canada dans le cadre de l’enquête de la commission Gomery de 2004.
Mme Kobernick possède un B.C.L. et un LL.B. de l’Université McGill et a été reçue au barreau de l’Ontario. En 2012, elle a obtenu un certificat en arbitrage auprès des conseils d’administration et des tribunaux de l’Osgoode Hall Law School et de la Society of Adjudicators and Regulators.
Structure organisationnelle et personnel
Organigramme du CEPMB
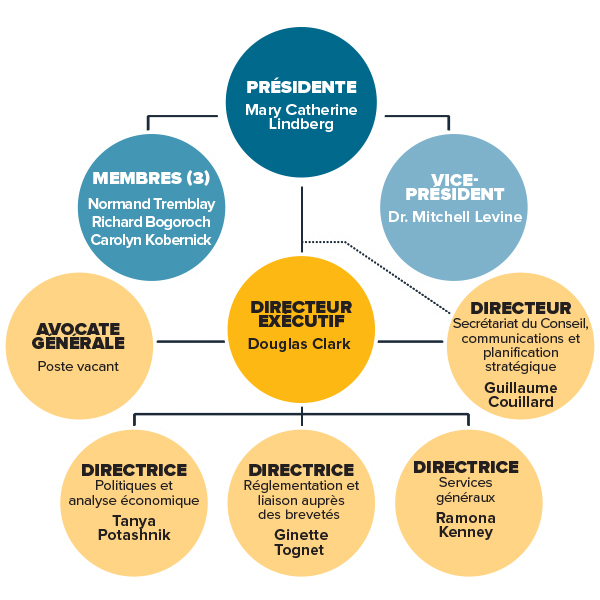
Description de la figure
L’organigramme illustre la structure hiérarchique de haut niveau au sein du CEPMB, et nomme les membres actuels du Conseil et de la haute direction. Conseil : Présidente—Mary Catherine Lindberg; Vice-président—Dr. Mitchell Levine; Membres—Normand Tremblay, Richard Bogoroch et Carolyn Kobernick. Haute direction : Directeur exécutif—Douglas Clark; Avocate générale—Poste vacant; Directeur, Secrétariat du Conseil, communications et planification stratégique—Guillaume Couillard; Directrice, Politiques et analyse économique—Tanya Potashnik; Directrice, Réglementation et liaison auprès des brevetés—Ginette Tognet; Directrice, Services généraux —Ramona Kenney.
Directeur exécutif
Le directeur exécutif avise le Conseil, supervise le travail du personnel et en assume le leadership.
Réglementation et liaison auprès des brevetés
La Direction de la réglementation et de la liaison auprès des brevetés fait l’examen des prix des produits médicamenteux brevetés vendus au Canada pour s’assurer qu’ils ne sont pas excessifs. De plus, elle encourage les brevetés à se conformer volontairement aux Lignes directrices du Conseil, veille à la bonne application des politiques de conformité et fait enquête sur les plaintes reçues concernant les prix de certains produits médicamenteux brevetés. De plus, la Direction sensibilise les brevetés sur les Lignes directrices du Conseil et les informe de leurs obligations en matière de présentation de rapports.
Politiques et analyse économique
La Direction des politiques et de l’analyse économique formule lorsqu’il y a lieu des conseils stratégiques concernant les changements qui pourraient être apportés aux Lignes directrices et à d’autres politiques du Conseil. Elle effectue des recherches, ainsi que des analyses des tendances des prix des produits médicamenteux, et présente des renseignements à l’appui de la conformité et de l’application de la loi. Par l’entremise de l’initiative du SNIUMP, elle fournit des analyses ciblées des tendances des prix, de l’utilisation et des coûts des médicaments afin d’appuyer les gestionnaires de régimes publics d’assurance médicaments et les autres décideurs au Canada.
Services généraux
La Direction des services généraux offre conseils et services en matière de gestion des ressources humaines, des installations, de la santé et sécurité au travail, de la technologie et de la gestion de l’information. Elle s’occupe également de la planification stratégique et financière de même que des rapports, des vérifications, de l’évaluation et de la liaison auprès des agences centrales fédérales compétentes relativement à ces questions.
Secrétariat du Conseil, communications et planification stratégique
La Direction du Secrétariat du Conseil, communications et planification stratégique planifie et orchestre le programme des communications du CEPMB, les relations avec les médias, le suivi aux demandes de renseignements du grand public et le processus relatif aux plaintes officielles. Elle gère les réunions et les audiences du Conseil, dont les dossiers de procédure. Elle coordonne les activités du Conseil relatives à l’application de la Loi sur l’accès à l’information et de la Loi sur la protection des renseignements personnels. Finalement, elle est responsable du processus de planification stratégique et de production de rapports.
Avocate générale
L’avocate générale fournit des opinions juridiques au CEPMB et dirige l’équipe de la poursuite dans les audiences du Conseil.
Budget
En 2014-2015, le Conseil disposait d’un budget de 10,927 millions de dollars et d’un effectif approuvé de 73 équivalents temps plein (ETP).
Tableau 1. Budget et effectif
|
2013-2014 |
2014-2015 |
2015-2016 |
| Budget |
10,944 M$ |
10,927 M$ |
10,945 M$ |
| Salaires |
6,920 M$ |
6,903 M$ |
6,937 M$ |
| Opérations |
1,554 M$ |
1,554 M$ |
1,538 M$ |
| Affectation à but spécial* |
2,470 M$ |
2,470 M$ |
2,470 M$ |
| Équivalents temps plein (ETP) |
74 |
73 |
71 |
* L’affectation à but spécial est réservée aux coûts externes liés à la tenue d’audiences publiques (conseillers juridiques, témoins experts, etc.). Les fonds non dépensés sont retournés au Trésor.
Communications et liaison aupres des brevetes
Le programme des communications est responsable de la planification et de la gestion des activités de communication externes et internes du CEPMB. L’un de ses objectifs est d’engendrer un dialogue de qualité entre le gouvernement, les intervenants de l’industrie, les consommateurs canadiens et les médias quant aux questions pharmaceutiques, afin de renforcer les relations qu’entretient le CEPMB avec ces différents groupes.
À cette fin, le programme des communications adopte une approche plus proactive relativement à sa présence dans les médias. Au cours de la dernière année, le CEPMB a notamment publié un plus grand nombre de communiqués de presse et a généralement accru son engagement auprès des médias. De plus, le CEPMB a entièrement revu son site Web, augmenté son utilisation des médias sociaux et créé de nouveaux produits ciblant un plus large public. Il continue de répondre aux demandes du public et d’informer ce dernier en publiant des mises à jour sur les délibérations et les décisions du Conseil ainsi que les résultats de recherche.
Le CEPMB s’est engagé à veiller à ce que les intervenants de l’industrie soient consultés et avisés de tout changement apporté à l’environnement opérationnel et informés rapidement de toute mise à jour du processus réglementaire. Au cours de la dernière année, la Direction générale des affaires réglementaires et de la liaison auprès des brevetés a continué d’offrir des séances de liaison régulières aux brevetés, réorganisé les pages de son site Web visant les brevetés et créé sa première vidéo éducative.
Publications
Le CEPMB est une source fiable, impartiale et exhaustive de renseignements sur les prix et les tendances des médicaments. En plus de ses publications régulières, comme le Rapport annuel et La Nouvelle trimestrielle, le Conseil publie les résultats d’études analytiques, y compris les rapports de recherche du SNIUMP.
Cette année, le CEPMB s’est engagé à publier un résumé analytique en même temps que la diffusion de chaque nouveau rapport du SNIUMP afin de présenter les constatations principales de l’étude à un plus vaste public. Le CEPMB a également organisé un forum de chercheurs avec des universitaires et des experts en matière de politiques afin de discuter de la recherche actuelle relativement à l’utilisation de produits pharmaceutiques au Canada et de domaines émergents pour des études futures.
Réglementation des prix des médicaments brevetés : Une vigilance continue nécessaire
Avec une population qui vieillit et qui utilise davantage de médicaments sur ordonnance (et parfois certains types de médicaments plus dispendieux), les dépenses du Canada en produits pharmaceutiques devraient augmenter considérablement au cours des prochaines années. Certaines avancées médicales ont permis d’offrir sur le marché canadien de nombreux nouveaux médicaments novateurs plus efficaces pour remplacer les traitements existants et traiter des conditions qui étaient jadis considérées intraitables. Ces nouveaux médicaments incluent les médicaments orphelins à coût élevé, les produits biologiques et les médicaments contre le cancer. Le CEPMB joue un rôle important en réglementant les prix des produits médicamenteux brevetés nouveaux et existants, afin d’assurer la viabilité du système de santé canadien.
2 % des nouveaux médicaments considères comme des découvertes
Depuis 2010, environ 2 % des nouveaux médicaments déclarés au CEPMB étaient considérés comme des découvertes.
Un produit pharmaceutique constituant une découverte s’entend d’un premier produit pharmaceutique autorisé sur le marché Canadien qui permet de traiter efficacement une maladie particulière ou une indication particulière.
61 Enquêtes
En 2014, 61 enquêtes ont été réalisées relativement aux prix excessifs de médicaments.
Suite aux enquêtes du CEPMB, cinq engagements de conformité volontaire ont été acceptés (en date du 31 mai 2015), et des recettes excessives de plus de 2,7 :millions de dollars ont été remboursées au moyen de paiements au gouvernement du Canada.
Avis d'audience
En attente de l’audience sur le médicament breveté Soliris.
En janvier 2015, un avis d’audience a été émis en vue de déterminer si le médicament breveté Soliris, médicament « orphelin » à coût élevé, est vendu à un prix excessif au Canada. Les procédures sont en cours.
Le CEPMB protège les intérêts des consommateurs canadiens en s’assurant que les produits médicamenteux brevetés ne sont pas vendus au Canada à des prix excessifs. Il le fait en examinant les prix auxquels les brevetés vendent chaque produit médicamenteux breveté aux grossistes, aux hôpitaux et aux pharmacies et en prenant des mesures à l’encontre des brevetés afin qu’ils réduisent leurs prix ou remboursent leurs recettes excessives, le cas échéant.
Exigences en matière de rapport
Les brevetés sont tenus par la loi de produire des renseignements relatifs à la vente de leurs produits médicamenteux au Canada. La Loi sur les brevets (la Loi) et le Règlement sur les médicaments brevetés (le Règlement) dictent les rapports que doivent soumettre les brevetés, et le personnel du Conseil examine de façon continue les renseignements sur les prix afin de s’assurer que les prix ne sont pas excessifs, et ce, jusqu’à échéance de tous les brevets applicables.
Il existe divers facteurs servant à déterminer si le prix d’un produit médicamenteux est excessif, comme l’énonce l’article 85 de la Loi. Le Compendium des politiques, des Lignes directrices et des procédures (les Lignes directrices) fournit des renseignements sur les tests appliqués aux prix par le personnel du Conseil pour décider si le prix auquel un breveté vend son produit est inférieur au prix maximal permis. Les Lignes directrices ont été élaborées en collaboration avec les intervenants, dont les ministres de la Santé provinciaux et territoriaux, les associations de consommateurs et l’industrie pharmaceutique. Lorsque, à l’issue d’une enquête, on juge qu’il y a un problème relativement au prix d’un produit médicamenteux breveté, on offre au breveté la possibilité de réduire volontairement son prix et (ou) de rembourser ses recettes excessives aux termes des modalités d’un engagement de conformité volontaire. Si le breveté ne souscrit pas aux résultats de l’enquête et choisit de ne pas présenter un tel engagement, la présidente du Conseil peut émettre un avis d’audience. Après l’audition de la preuve, si le Conseil conclut que le prix est excessif, il peut rendre une ordonnance obligeant le breveté à réduire le prix de son produit et (ou) à rembourser les recettes excessives. Le breveté peut également soumettre un engagement de conformité volontaire après l’émission d’un avis d’audience afin de résoudre l’affaire. Des copies de la Loi, du Règlement, des Lignes directrices et du Guide du breveté sont affichées sur le site Web du CEPMB.
Défaut de présenter ses rapports
Le CEPMB compte sur la ponctualité des brevetés en ce qui a trait à la présentation de leurs rapports sur tous les produits médicamenteux brevetés qu’ils vendent au Canada auxquels un brevet s’applique. En 2014, neuf produits médicamenteux ont été déclarés au CEPMB pour la première fois, même s’ils avaient été brevetés et vendus avant 2014. Le tableau 2 présente les produits médicamenteux qui étaient brevetés et vendus au Canada avant de faire l’objet d’un rapport au CEPMB.
Tableau 2. Défaut de présenter ses rapports sur les ventes de produits médicamenteux brevetés
| Actuellement vendu par |
Nom de marque |
Nom générique |
Année où le médicament est devenu
assujetti à la compétence du conseil |
| Sigma-Tau Pharmaceuticals Inc. |
Carnitor IV |
Levocarnitine |
2001 |
| Pfizer Canada Inc. |
Cytosar (3 DINs) |
Cytarabine |
2003 |
| Paladin Labs Inc. |
Metadol (3 DINs) |
Chlorhydrate de méthadone |
2010 |
| Otuska Canada Pharmaceutical Inc. |
Samsca (2 DINs) |
Tolvaptan |
2011 |
Défaut de présenter les données sur les prix et sur les ventes (formulaire 2)
Le défaut de présenter ses rapports fait référence au défaut partiel ou complet d’un breveté de soumettre les rapports qu’il est tenu de présenter en vertu de la Loi et du Règlement. Le Conseil n’a pas été appelé à rendre des ordonnances pour défaut de présenter ses rapports en 2014.
Examen scientifique
Groupe consultatif sur les médicaments pour usage humain
Tous les nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB sont soumis à une évaluation scientifique dans le cadre du processus d’examen du prix. Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) a été créé par le Conseil dans le but d’offrir une expertise et des conseils indépendants au personnel du Conseil. Le GCMUH entreprend un examen lorsqu’un breveté présente une demande relative à l’amélioration thérapeutique. De plus, les membres du groupe examinent et évaluent les renseignements scientifiques pertinents et disponibles, notamment toute preuve présentée par le breveté quant au niveau d’amélioration thérapeutique proposé, le choix de produits médicamenteux aux fins de comparaison et les posologies comparables.
Examen du prix
Le CEPMB examine le prix moyen de chaque concentration et de chaque forme posologique d’un médicament breveté. Dans la plupart des cas, cette unité est conforme au numéro d’identification du médicament (DIN) attribué par Santé Canada au moment où la vente au Canada du médicament est approuvée.
Nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB en 2014
Aux fins du présent rapport, tout produit médicamenteux breveté lancé ou vendu sur le marché canadien avant l’attribution de son premier brevet entre le 1er décembre 2013 et le 30 novembre 2014 est réputé avoir été breveté en 2014.
Il y a eu 103 nouveaux produits médicamenteux brevetés pour usage humain ayant été rapportés comme vendus en 2014. Certains constituent une ou plusieurs concentrations d’une nouvelle substance active et d’autres, de nouvelles présentations de médicaments existants. Quatre (3,9 %) des 103 nouveaux produits médicamenteux brevetés ont été commercialisés au Canada avant d’avoir obtenu le brevet canadien qui les a assujettis à la compétence du CEPMB. Le tableau qui suit indique l’année de la première commercialisation de ces produits médicamenteux.
Tableau 3. Nombre de nouveaux produits médicamenteux brevetés pour usage humain en 2014 selon l’année de leur première vente
| Année de la première vente |
Nombre de produits médicamenteux |
| 2014 |
99 |
| 2013 |
1 |
| 2011 |
1 |
| 2008 |
1 |
| 2006 |
1 |
| Total |
103 |
La liste des nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB est affichée sur le site Web sous la rubrique « Réglementation des prix ». Cette liste présente de l’information sur l’état d’avancement de l’examen (p. ex. la question de savoir si le prix du médicament est sous examen, conforme aux Lignes directrices, sous enquête ou assujetti à un engagement de conformité volontaire ou à un avis d’audience).
La figure 1 illustre le nombre de nouveaux produits médicamenteux brevetés pour usage humain ayant fait l’objet d’un rapport au CEPMB de 1989 à 2014.
Figure 1. Nouveaux produits médicamenteux brevetés pour usage humain
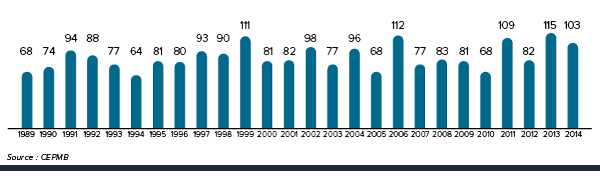
Description de la figure
Il s’agit d’un diagramme à barres présentant le nombre de nouveaux produits médicamenteux brevetés à usage humain déclarés au CEPMB selon l'année. En 1989, 68 produits médicamenteux brevetés à usage humain ont été déclarés au CEPMB.
1990 : 74; 1991 : 94; 1992 : 88; 1993 : 77; 1994 : 64; 1995 : 81; 1996 : 80; 1997 : 93; 1998 : 90; 1999 : 111; 2000 : 81; 2001 : 82; 2002 : 98; 2003 : 77; 2004 : 96; 2005 : 68; 2006 : 112; 2007 : 77; 2008 : 83; 2009 : 81; 2010 : 68; 2011 : 109; 2012 : 82; 2013 : 115; 2014 : 103.
Des 103 nouveaux produits médicamenteux brevetés :
- les prix de 77 produits médicamenteux brevetés avaient été soumis à un examen en date du 31 mars 2015 :
- les prix de 68 produits médicamenteux brevetés ont été jugés conformes aux Lignes directrices;
- le prix de 1 produit médicamenteux breveté semblait excessif aux termes des Lignes directrices d’un montant ne justifiant pas d’enquête;
- les prix de 8 produits médicamenteux brevetés semblaient excessifs aux termes des Lignes directrices; ainsi, des enquêtes ont été lancées.
Pour la liste complète des 103 nouveaux produits médicamenteux brevetés, y compris l’état d’avancement de l’examen de leur prix, veuillez consulter l’Annexe 2.
Examen des prix des produits médicamenteux brevetés existants pour usage humain en 2014
Aux fins du présent rapport, l’expression « produits médicamenteux brevetés existants » désigne tous les produits médicamenteux brevetés vendus sur le marché canadien et ayant fait l’objet d’un rapport au CEPMB avant le 1er décembre 2013.
Au moment de la rédaction du présent rapport, il y avait 1 260 produits médicamenteux brevetés existants :
- les prix de 970 produits médicamenteux brevetés étaient conformes aux Lignes directrices;
- les prix de 226 produits médicamenteux brevetés étaient excessifs aux termes des Lignes directrices d’un montant ne justifiant pas d’enquête;
- les prix de 53 produits médicamenteux brevetés existants faisaient l’objet d’une enquête :
- 6 enquêtes provoquées par le prix de lancement en 2012;
- 7 enquêtes provoquées par le prix de lancement en 2013;
- 40 enquêtes lancées en fonction des prix annuels.
- les prix de 8 produits médicamenteux étaient sous enquête;
- les prix de 2 produits médicamenteux étaient visés par un engagement de conformité volontaire;
- un produit médicamenteux fait l’objet d’une audience;
- un autre produit médicamenteux fait toujours l’objet d’une audience, même s’il n’était plus breveté en 2014.
Un aperçu de l’état d’avancement de l’examen du prix des produits médicamenteux brevetés pour usage humain nouveaux et existants en 2014 est présenté au tableau 4.
Tableau 4. Produits médicamenteux brevetés pour usage humain vendus en 2014 – État d’avancement de l’examen du prix au 31 mars 2015
|
Nouveaux produits médicamenteux lancés sur le marché en 2014 |
Produits médicamenteux existants |
Total |
| Total |
103 |
1 260 |
1 363 |
| Conformes aux Lignes directrices |
68 |
970 |
1 038 |
| Sous examen |
26 |
8 |
34 |
| Ne justifient pas d’enquête |
1 |
226 |
227 |
| Sous enquête |
8 |
53 |
61 |
| Engagements de conformité volontaire |
0 |
2 |
2 |
| Audiences sur le prix |
0 |
1 |
1 |
Mise à jour du rapport annuel 2013
- L’examen de l’ensemble des produits médicamenteux pour usage humain ayant fait l’objet d’un rapport « sous examen » dans le rapport annuel de 2013 est terminé.
- Des 66 enquêtes mentionnées dans le rapport annuel de 2013, 44 d’entre elles se sont soldées par les résultats suivants :
- la fermeture de l’enquête lorsqu’il apparaît que le prix est conforme aux Lignes directrices;
- un engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son produit et à rembourser les recettes excessives au moyen d’un paiement et (ou) d’une réduction du prix d’un autre produit médicamenteux breveté (voir la section « Engagements de conformité volontaire »);
- une audience publique dont l’objet est de déterminer si le prix du produit médicamenteux est ou non excessif, y compris une ordonnance corrective rendue par le Conseil (voir la section « Audiences »).
Produits médicamenteux brevetés en vente libre et produits médicamenteux brevetés pour usage vétérinaire
Le personnel du Conseil fait l’examen des prix des produits médicamenteux brevetés en vente libre et des produits médicamenteux brevetés pour usage vétérinaire à la suite de la réception d’une plainte. Aucune plainte n’a été reçue en 2014.
Demandes de renseignements et plaintes officielles
En 2014, le CEPMB a reçu plusieurs demandes de renseignements concernant ses activités de réglementation et le statut de conformité de différents produits médicamenteux brevetés et non brevetés. Le personnel du Conseil était en mesure de confirmer que les prix des médicaments brevetés en question étaient conformes aux Lignes directrices. Si le prix d’un produit médicamenteux breveté avait été excessif aux termes des Lignes directrices, le personnel du Conseil aurait entamé une enquête.
Si l’on conclut que le prix d’un produit médicamenteux est excessif en vertu des Lignes directrices, le breveté peut soumettre un engagement de conformité volontaire aux fins d’approbation de la présidente du Conseil. La présidente peut aussi juger que l’intérêt public justifie la tenue d’une audience publique. Dans les deux cas, la décision et les résultats sont affichés sur le site Web du CEPMB.
Engagements de conformité volontaire et Audiences
Engagements de conformité volontaire
L’engagement de conformité volontaire est un engagement écrit par lequel le breveté s’engage à rendre le prix de son produit médicamenteux conforme aux Lignes directrices du Conseil. En vertu des Lignes directrices, les brevetés peuvent soumettre un engagement de conformité volontaire lorsque le personnel du Conseil détermine, à la suite d’une enquête, que le prix auquel le produit médicamenteux breveté est vendu par le breveté au Canada semble excessif aux termes des Lignes directrices. Le breveté peut également soumettre un engagement de conformité volontaire après l’émission d’un avis d’audience.
En 2014, quatre engagements de conformité volontaire ont été acceptés. En plus de la réduction du prix de certains produits médicamenteux, des recettes excessives totalisant 2 728 804,38 $ ont été remboursées au moyen de paiements versés au gouvernement du Canada.
En 2015, à ce jour, la présidente a accepté un engagement de conformité volontaire dans l’affaire Crixivan.
Les brevetés doivent s’assurer que les prix de leurs produits médicamenteux brevetés sont conformes aux Lignes directrices du Conseil, et ce, au cours de toutes les périodes où les produits médicamenteux relèvent de la compétence du CEPMB.
Tableau 5. Engagements de conformité volontaire en 2014 jusqu’au 31 mai 2015
| Médicament breveté |
Usage thérapeutique |
Breveté |
Date d’approbation |
Réduction de prix |
Paiement au gouvernement |
| Engagements de conformité volontaire en 2014 |
| Gonal F (3 produits médicamenteux) |
Stimulation d’un développement folliculaire multiple chez les patientes subissant des traitements de reproduction assistée. |
EMD Inc. |
Juin |
blank |
1 667 002,48 $ |
| Lamisil (1 produit médicamenteux) |
Traitement des infections fongiques de la peau et des ongles |
Novartis Pharmaceuticals Canada Inc. |
Juin |
blank |
425 034,25 $ |
| Lodalis (1 produit médicamenteux) |
Réduction du taux de cholestérol sanguin |
Valeant Canada LP |
Septembre |
blank |
63 119,56 $ |
| Gelnique (1 produit médicamenteux) |
Traitement de la vessie hyperactive |
Actavis Specialty Pharmaceutical Co. |
Novembre |
✔ |
573 648,09 $ |
| Total |
|
|
|
|
2 728 804,38 $ |
| Engagements de conformité volontaire en 2015, jusqu’au 31 mai |
| Crixivan (1 produit médicamenteux) |
Traitement de l’infection à VIH |
Merck Canada Inc. |
Avril |
blank |
58 917,68 $ |
| Grand total |
|
|
|
|
2 787 722,06 $ |
Audiences
Lorsque le prix d’un médicament breveté semble excessif, le Conseil peut tenir une audience publique et, s’il est démontré que le prix du produit médicamenteux est excessif, rendre une ordonnance obligeant le breveté à réduire le prix de son produit et à rembourser les recettes excessives qu’il a tirées de la vente de son produit à un prix excessif. Les décisions du Conseil peuvent être assujetties à une révision judiciaire devant la Cour fédérale du Canada.
En janvier 2015, le Conseil d’examen du prix des médicaments brevetés a annoncé qu’il tiendrait une audience publique dans l’affaire du prix du médicament breveté Soliris et d’Alexion Pharmaceuticals Inc., la société pharmaceutique qui détient le brevet de Soliris et qui vend ce médicament au Canada. Soliris est le premier et le seul traitement pour l’hémoglobinurie paroxystique nocturne – une affection sanguine rare et potentiellement mortelle. Le but de cette audience sera de déterminer si le médicament a été ou est vendu sur le marché canadien à un prix qui, de l’avis du Conseil, est ou était excessif et, le cas échéant, de déterminer l’ordonnance qui doit être délivrée, s’il le faut, pour corriger le prix excessif.
Le Conseil compte deux autres affaires dans son calendrier d’audiences : Apotex Inc. et Apo-Salvent exempt de CFC. Les résultats de ces affaires seront examinés à la lumière des décisions de la Cour fédérale dans trois autres affaires : ratio-Salbutamol HFA, ratiopharm et Sandoz, sur des questions relatives à la compétence du Conseil. La Cour d’appel fédérale étudie présentement ces décisions.
Tableau 6. État d’avancement des audiences devant le Conseil en 2014 jusqu’au 31 mai 2015
| Produit médicamenteux breveté |
Usage thérapeutique |
Breveté |
Date de l'avis d'audience |
État d’avancement |
| Apo-Salvent exempt de CFC |
Asthme |
Apotex Inc. |
8 juillet 2008 |
En cours |
| ratio-Salbutamol HFA |
Asthme |
ratiopharm Inc.
(actuellement Teva Canada) |
18 juillet 2008 |
Révision judiciaire entendue par la Cour fédérale du 4 au 6 nov. 2013; décision rendue le 27 mai 2014
Avis d’appel déposé à la Cour d’appel fédérale le 25 juin 2014 |
| Soliris |
Hémoglobinurie paroxystique nocturne
Syndrome hémolytique et urémique atypique |
Alexion Pharmaceuticals Inc. |
20 janvier 2015 |
En cours
Avis d’audience délivré le 22 janvier 2015 |
Blank
| Breveté |
Objet de l’audience |
Date de l’avis de demande |
État d’avancement |
| Apotex Inc. |
Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) |
3 mars 2008 |
En cours |
ratiopharm Inc.
(actuellement Teva Canada) |
Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) |
28 août 2008 |
Révision judiciaire entendue par la Cour fédérale du 4 au 6 nov. 2013; décision rendue le 27 mai 2014
Avis d’appel déposé à la Cour d’appel fédérale le 25 juin 2014 |
| Sandoz Canada Inc. |
Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) |
8 mars 2010 |
Révision judiciaire entendue par la Cour fédérale les 19 et 20 novembre 2013; décision rendue le 27 mai 2014
Avis d’appel déposé à la Cour d’appel fédérale le 25 juin 2014 |
Sommaire
En 2014 et jusqu’au 31 mai 2015, des recettes excessives totalisant 2 787 722,06 $ ont été remboursées au moyen de paiements versés au gouvernement du Canada en vertu d’engagements de conformité volontaire et d’ordonnances du Conseil.
Depuis 1993, 100 engagements de conformité volontaire ont été approuvés et 27 audiences publiques ont été entamées. Ces mesures ont donné lieu à des réductions de prix et au remboursement des recettes excessives au moyen de réductions supplémentaires de prix ou de paiements versés au gouvernement du Canada. Plus de 149 millions de dollars ont été recueillis en vertu d’engagements de conformité volontaire et d’ordonnances du Conseil par l’entremise de paiements versés au gouvernement du Canada et (ou) aux clients, dont les hôpitaux et les cliniques médicales.
Affaires interjetées auprès de la cour d’appel fédérale
Trois décisions du Conseil ont fait l’objet de révisions judiciaires devant la Cour fédérale : ratio-Salbutamol HFA (T-1058-11; T-1825-11); ratiopharm Inc. (actuellement Teva Canada) (T-1252-11); Sandoz Canada Inc. (T-1616-12). Les audiences devant la Cour ont été tenues en novembre 2013, et la Cour a rendu ses décisions le 27 mai 2014. La Cour fédérale a fait droit aux demandes de révision judiciaire et a renvoyé les affaires au Conseil avec une directive de statuer que ratiopharm Inc. et Sandoz Canada Inc. ne sont pas des brevetés. Des avis d’appel concernant ces décisions (ratiopharm Inc. – actuellement Teva Canada – (A-303-14) et Sandoz (A-302-14)) ont été déposés devant la Cour d’appel fédérale par le procureur général le 25 juin 2014.
Principales tendances relatives aux produits pharmaceutiques : Les ventes de médicaments sont à la hausse
De nombreux facteurs influent sur les dépenses totales en produits pharmaceutiques, notamment les prix, l’utilisation, l’arrivée sur le marché de nouveaux médicaments plus couteux, et la « substitution générique » d’anciens médicaments. En 2014, les ventes de médicaments brevetés avaient augmenté de 3,1 %, et les prix au Canada sont demeurés au troisième rang parmi tous les pays de comparaison du CEPMB (CEPMB7).
3e Rang parmi les prix les plus élevés des médicaments brevetés
Les prix des médicaments brevetés au canada demeurent au troisième rang parmi les pays de comparaison.
Pour la deuxième année consécutive, les prix au Canada sont plus élevés que ceux en France, au Royaume-Uni, en Italie, en Suède et en Suisse.
L’augmentation moyenne des prix des médicaments brevetés était inférieure à l’IPC
En 2014, l’augmentation des prix des médicaments brevetés était inférieure au taux d’inflation, tel que mesuré par l’Indice des prix à la consommation (IPC) et, par conséquent, n’a pas contribué à la croissance des ventes.
30,8 % des ventes en 2014
Les agents antinéoplasiques et immunomodulateurs ont eu la plus grande incidence sur la croissance des ventes en 2014.
Les médicaments de chimiothérapie et les médicaments agissant sur le système immunitaire comptaient pour 30,8 % des ventes en 2014, soit une augmentation de 7,4 % par rapport à l’année précédente.
Prix 6 % plus élevés
Les prix des médicaments brevetés au canada sont 6 % plus élevés par rapport à la médiane internationale lorsqu’on exclut les prix aux états-unis.
Les prix des médicaments brevetés au Canada se situent en deçà du prix médian international des pays de comparaison du CEPMB; mais si l’on exclut les États-Unis de la moyenne internationale, les prix canadiens sont, en moyenne, 6 % plus élevés.
Augmentation des dépenses totales en médicaments de 184,43 %
Depuis 2000, l’augmentation des dépenses en médicaments au canada a dépassé celle dans tous les pays de comparaison.
De 2000 à 2012, les dépenses canadiennes consacrées aux médicaments ont augmenté de 184,43 %. Ce taux de croissance est supérieur à celui de tous les pays de comparaison du CEPMB – même celui des États-Unis.
Le CEPMB fait rapport des tendances observées au chapitre des ventes de produits pharmaceutiques et des prix de tous les médicaments, ainsi que des dépenses de recherche-développement des brevetés. De plus, il dirige des études et mène des analyses portant sur diverses questions relatives aux prix et aux coûts des produits pharmaceutiques.
Tendances relatives aux ventes de produits médicamenteux brevetés
En vertu du Règlement sur les médicaments brevetés (le Règlement), les brevetés doivent faire rapport en détail de leurs ventes de produits médicamenteux brevetés, à savoir les quantités vendues et les recettes nettes tirées des ventes de chaque produit médicamenteux, par catégorie de clients et par province ou territoire. Le CEPMB utilise ces éléments d’information dans ses analyses des tendances aux niveaux des ventes, des prix et de l’utilisation faite des produits médicamenteux brevetésNote de bas de page 1. La présente section donne les résultats statistiques clés de cette analyse.
Ventes et prix
La population canadienne consacre aujourd’hui une partie beaucoup plus grande de son budget à l’achat de produits médicamenteux brevetés qu’elle ne le faisait il y a une dizaine d’années; toutefois, il est important de préciser qu’une augmentation des dépenses en produits médicamenteux n’est pas nécessairement attribuable à une augmentation des prix. Par exemple, selon les rapports annuels du CEPMB des années 1995 à 2003, la valeur des ventes de produits médicamenteux brevetés a augmenté de plus de 10 % par année, alors que les taux moyens de variation des prix n’atteignaient même pas 1 %. Dans ces cas, ce sont le volume et la composition de l’utilisation faite des produits médicamenteux qui sont à l’origine de la croissance de la valeur des ventes.
Différents facteurs peuvent être à l’origine de tels changements, dont les suivants :
- augmentation de la population totale;
- variations de la composition démographique de la population (p. ex. vieillissement de la population et une plus grande incidence de problèmes de santé chez les personnes âgées);
- augmentation de l’incidence des problèmes de santé nécessitant une pharmacothérapie;
- nouvelles pratiques d’ordonnance des médecins (p. ex. tendance à prescrire des nouveaux produits médicamenteux plus onéreux pour traiter une condition qui était jusque-là traitée avec des produits existants souvent vendus à moindre prix, ou ordonnance de concentrations plus fortes ou plus fréquentes);
- recours plus régulier à des pharmacothérapies en remplacement d’autres formes de traitement;
- recours à de nouveaux produits médicamenteux pour traiter des conditions pour lesquelles il n’existait pas encore un traitement efficace.
Tendances observées au niveau des ventes
Le tableau 7 présente la valeur des ventes totales par les brevetés au Canada des produits médicamenteux brevetés pour les années 1990 à 2014. En 2014, les ventes de produits médicamenteux brevetés ont augmenté à 13,7 milliards de dollars par rapport à 13,3 milliards de dollars en 2013, ce qui représente une hausse de 3,1 %. En guise de comparaison, la croissance annuelle des ventes était de 27,0 % en 1999 et s’est maintenue dans les deux chiffres jusqu’en 2003.
La dernière colonne du tableau 7 présente la valeur des ventes des produits médicamenteux brevetés exprimée en pourcentage de la valeur des ventes de tous les produits médicamenteux. Entre 1990 et 2003, le pourcentage de la valeur des ventes est passé respectivement de 43,2 % à un sommet de 72,7 %. Ce pourcentage a reculé entre 2003 et 2009, mais est relativement stable depuis. Cela signifie que les ventes des produits médicamenteux de marque non brevetés et des produits médicamenteux génériques ont en général augmenté au même rythme dans les dernières années que celles de produits médicamenteux brevetés.
Tableau 7. Ventes de produits médicamenteux brevetés, 1990-2014
| Année |
Produits médicamenteux brevetés :
Ventes (en milliards de $) |
Produits médicamenteux brevetés :
Variation (en %) |
Ventes de produits médicamenteux brevetés par rapport à la valeur des ventes de tous les médicaments (en %)* |
| 2014 |
13,7 |
3,1 |
59,6 |
| 2013 |
13,3 |
4,1 |
60,7 |
| 2012 |
12,8 |
-0,1 |
59,3 |
| 2011 |
12,8 |
3,1 |
58,6 |
| 2010 |
12,4 |
-4,3 |
56,0 |
| 2009 |
12,9 |
2,4 |
59,2 |
| 2008 |
12,6 |
2,4 |
61,7 |
| 2007 |
12,3 |
3,4 |
63,2 |
| 2006 |
11,9 |
3,5 |
67,8 |
| 2005 |
11,5 |
4,5 |
70,6 |
| 2004 |
11,0 |
7,8 |
72,2 |
| 2003 |
10,2 |
14,3 |
72,7 |
| 2002 |
8,9 |
17,5 |
67,4 |
| 2001 |
7,6 |
18,9 |
65,0 |
| 2000 |
6,3 |
16,7 |
63,0 |
| 1999 |
5,4 |
27,0 |
61,0 |
| 1998 |
4,3 |
18,9 |
55,1 |
| 1997 |
3,7 |
22,6 |
52,3 |
| 1996 |
3,0 |
12,8 |
45,0 |
| 1995 |
2,6 |
10,8 |
43,9 |
| 1994 |
2,4 |
-2,1 |
40,7 |
| 1993 |
2,4 |
9,4 |
44,4 |
| 1992 |
2,2 |
14,0 |
43,8 |
| 1991 |
2,0 |
13,1 |
43,2 |
| 1990 |
1,7 |
– |
43,2 |
* Le dénominateur dans ce ratio comprend la valeur des ventes des produits médicamenteux de marque brevetés, des produits médicamenteux de marque non brevetés et des produits médicamenteux génériques. L’estimation de la valeur totale des ventes utilisée pour calculer le ratio à compter de 2005 se fonde sur les données tirées de la base de données MIDASMC d’IMS AG. Pour les années antérieures, les données d’IMS Health n’ont été utilisées que pour calculer la valeur des ventes des produits médicamenteux génériques. Quant à la valeur des ventes des produits médicamenteux de marque non brevetés, elle était alors estimée à l’aide des données fournies par les brevetés. Pour mettre un terme aux anomalies attribuables aux variations annuelles de la liste des sociétés faisant rapport au CEPMB, le CEPMB n’utilise plus cette approche. Les ratios rapportés pour les années avant 2005 gonflaient probablement la part des produits médicamenteux brevetés, mais seulement dans une faible proportion. Ce léger écart n’invalide toutefois pas la forte tendance à la hausse observée pour les années 1990 à 2003.
Sources : CEPMB; Base de données MIDASMC, 2005-2014, IMS AG. Tous droits réservés.Note de bas de page 2
Facteurs à la source de la croissance des ventes
Le tableau 8 décompose en différents éléments la croissance des ventes enregistrée entre 2013 et 2014. Ces éléments sont les suivants :
- produits médicamenteux auparavant brevetés dont le brevet est arrivé à échéance ou qui ont quitté le marché canadien (« effet du retrait du médicament »);
- produits médicamenteux brevetés lancés sur le marché canadien en 2014 (« effet du nouveau médicament »);
- variations des prix des produits médicamenteux brevetés vendus au Canada en 2013 et en 2014 (« effet du prix »);
- écarts de quantités vendues de ces produits médicamenteux en 2013 et en 2014 (« effet du volume »);
- interactions des variations de prix et de quantité (« effet croisé »).
La première rangée du tableau 8 présente les incidences d’après leur valeur monétaire et la deuxième rangée les présente au moyen de la variation des ventes entre 2013 et 2014. Pour des fins de comparaison, la troisième rangée présente les incidences avec les taux moyens annuels de variation des ventes pour la période de 2010 à 2014.Note de bas de page 3
Les résultats de ce tableau révèlent que l’augmentation des ventes totales survenue entre 2013 et 2014 découlait de deux facteurs : augmentations de la quantité de produits médicamenteux vendus et ventes importantes de nouveaux produits médicamenteux, ce qui vient compenser un effet du retrait du médicament relativement important.
Tableau 8. Décomposition des variations au chapitre des ventes de produits médicamenteux brevetés
|
Variation totale |
Effet du retrait du médicament |
Effet du nouveau médicament |
Effet du prix |
Effet du volume |
Effet croisé |
Incidence sur les ventes, 2014/2013
(en M$) |
381,78 |
-344,14 |
351,61 |
-0,60 |
389,19 |
-14,32 |
Proportion de la variation totale
2014/2013 (%) |
100,00 |
-90,14 |
92,09 |
-0,15 |
101,94 |
-3,75 |
Proportion moyenne de la variation totale,
2010–2013 (en %) |
100,00 |
-165,33 |
215,80 |
34,67 |
30,79 |
-15,93 |
Source : CEPMB
La figure 2 présente pour 2014 une ventilation des ventes de produits médicamenteux brevetés selon l’année de leur première vente au Canada. Au cours de la dernière partie des années 1990 et du début des années 2000, la croissance des ventes a été grandement associée à une succession de nouveaux médicaments « vedettes » qui ont donné lieu à des volumes de ventes très élevés. Malgré l’expiration récente des brevets (« chute des brevets »), ces produits représentent toujours un pourcentage considérable des ventes en 2014. Depuis le milieu des années 2000, les changements observés dans l’environnement pharmaceutique canadien ainsi que la diminution du taux de mise en marché de nouveaux produits médicamenteux de grande vente ont ralenti la croissance.
Figure 2. Pourcentage des ventes de produits médicamenteux brevetés selon l’année de lancement, 2014
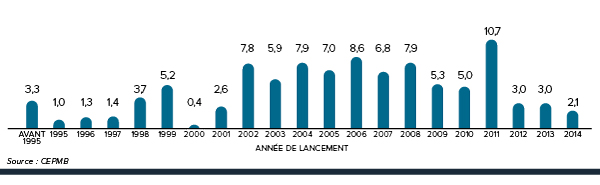
Description de la figure
Il s’agit d’un diagramme à barres présentant le pourcentage des ventes, en 2014, de produits médicamenteux brevetés en fonction de leur année de lancement au Canada. Les produits médicamenteux commercialisés avant 1995 représentaient 3,3 % des parts de marché en 2014.
1995 : 1,0; 1996 : 1,3; 1997 : 1,4; 1998 : 3,7; 1999 : 5,2; 2000 : 0,4; 2001 : 2,6; 2002 : 7,8; 2003 : 5,9; 2004 : 7,9; 2005 : 7,0; 2006 : 8,6; 2007 : 6,8; 2008 : 7,9; 2009 : 5,3; 2010 : 5,0; 2011 : 10,7; 2012 : 3,0; 2013 : 3,0; 2014 : 2,1
Ventes selon le groupe thérapeutique
Pour ses analyses de prix au niveau du groupe thérapeutique, le CEPMB classe généralement les produits médicamenteux à l’aide du Système de classification anatomique, thérapeutique, chimique (ATC) de l’Organisation mondiale de la Santé (OMS). Ce système hiérarchique classe les produits médicamenteux selon leur utilisation thérapeutique principale et leur composition chimique. Au premier niveau de ce système, à savoir au niveau 1, le système ATC classe les produits médicamenteux selon la partie de l’anatomie à laquelle ils sont principalement associés.
Le tableau 9 ventile les ventes des produits médicamenteux brevetés effectuées au Canada en 2014 selon le groupe thérapeutique principal, à savoir le premier niveau de la classification ATC. Il présente les ventes effectuées en 2014 dans les différents groupes de produits médicamenteux, leur part de l’ensemble des ventes ainsi que le taux d’augmentation de la valeur de leurs ventes par rapport à 2013. Les valeurs présentées dans la dernière colonne correspondent à la composante de la croissance de l’ensemble des ventes attribuables aux produits médicamenteux du groupe correspondantNote de bas de page 4. La mesure ainsi obtenue permet de dégager que ce sont les agents antinéoplasiques et immunomodulateurs qui ont le plus contribué à la croissance de la valeur des ventes. Il convient de noter que le recul des ventes à la fois d’antiinfectieux généraux pour usage systémique, de produits antiparasitaires et de médicaments agissant sur le système nerveux a aussi eu un impact important sur les dépenses globales.
Tableau 9. Ventes des produits médicamenteux brevetés selon leur groupe thérapeutique principal, 2014
| Groupe thérapeutique |
Ventes en 2014 (en M$) |
Part de ventes en 2014 (en %) |
Croissance : 2014/2013 (en M$) |
Croissance : 2014/2013 (en %) |
Incidence sur la variation des dépenses (en %) |
| A : Tube digestif et métabolisme |
1 505.5 |
11,0 |
116,2 |
8,4 |
28,5 |
| B : Sang et organes sanguinoformateurs |
784,9 |
5,7 |
4,2 |
0,5 |
1,0 |
| C : Système cardiovasculaire |
911,6 |
6,6 |
-37,1 |
-3,9 |
-9,1 |
| D : Produits dermatologiques |
109,7 |
0,8 |
-20,3 |
-15,6 |
-5,0 |
| G : Système génito-urinaire et hormones sexuelles |
506,1 |
3,7 |
-8,3 |
-1,6 |
-2,0 |
| H : Préparations hormonales systémiques |
62,4 |
0,5 |
-0,8 |
-1,2 |
-0,2 |
J : Antiinfectieux généraux pour usage systémique
P : Produits antiparasitaires* |
1 256,8 |
9,1 |
-160,2 |
-11,3 |
-39,2 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
4 225,8 |
30,8 |
290,6 |
7,4 |
71,2 |
| M : Système musculo-squelettaire |
452,1 |
3,3 |
28,1 |
6,6 |
6,9 |
| N : Système nerveux |
1 694,1 |
12,3 |
-141,7 |
-7,7 |
-34,7 |
| R : Système respiratoire |
1 164,5 |
8,5 |
-10,1 |
-0,9 |
-2,5 |
| S : Organes sensoriels |
723,1 |
5,3 |
79,3 |
12,3 |
19,4 |
| V : Divers |
343,3 |
2,5 |
268,2 |
357,1 |
65,7 |
| Tous les groupes thérapeutiques |
13 739,8 |
100,0† |
408,2 |
3,1 |
100,0† |
* Pour des raisons de confidentialité, les données sur ces deux groupes ont été combinées.
† Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Tendances observées au niveau des prix
Le CEPMB utilise l’indice des prix des médicaments brevetés (IPMB) pour faire le suivi des tendances des prix des produits médicamenteux brevetés. L’IPMB mesure la variation moyenne des prix auxquels les brevetés vendent leurs produits médicamenteux brevetés sur le marché canadien (prix départ usine) par rapport à l’année précédente. L’indice est calculé à l’aide de la formule qui correspond à la moyenne de la variation des prix au niveau du produit médicamenteux pondérée en fonction des ventesNote de bas de page 5. La méthodologie utilisée rappelle celle qu’utilise Statistique Canada pour compiler l’indice des prix à la consommation (IPC). L’IPMB est fondé sur l’information sur les prix moyens par transaction et sur les ventes pour une période de six mois, dont les brevetés font rapport au Conseil.
Il est important de bien comprendre la relation théorique qui existe entre l’IPMB et les coûts des produits médicamenteux. L’IPMB ne mesure pas les effets des changements de l’utilisation faite des produits médicamenteux brevetés. Cette mesure est prise par un autre indice appelé l’indice du volume des ventes de médicaments brevetés – l’IVVMB (voir la section « Utilisation faite des produits médicamenteux brevetés »). L’IPMB ne mesure pas non plus l’incidence sur les coûts des nouvelles habitudes d’ordonnance des médecins ou de l’arrivée sur le marché de nouveaux produits médicamenteux. L’IPMB est conçu pour isoler la composante de variation des ventes attribuable aux variations des prix.
La figure 3 présente le taux annuel de variation de l’IPMB pour les années 1988 à 2014. Selon la mesure prise par l’IPMB, les prix des produits médicamenteux brevetés n’ont pratiquement pas changé entre 2013 et 2014.
Figure 3. Taux annuel de variation (%) de l’indice des prix des médicaments brevetés (IPMB), 1988-2014
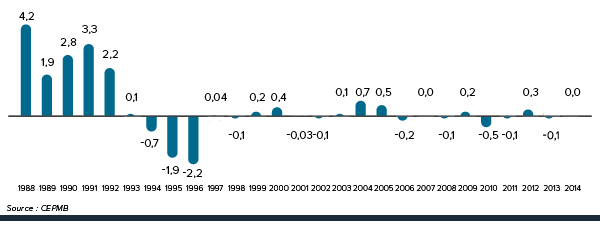
Description de la figure
Il s’agit d’un diagramme à barres présentant les taux annuels de variation, en pourcentage, de l’Indice des prix des médicaments brevetés (IPMB), de 1988 à 2014. En 1988, le taux de variation de l’IPMB était de 4,2 %.
1989 : 1,9; 1990 : 2,8; 1991 : 3,3; 1992 : 2,2; 1993 : 0,1; 1994 : -0,7; 1995 : -1,9; 1996 : -2,2; 1997 : 0,04; 1998 : -0,1; 1999 : 0,2; 2000 : 0,4; 2001 : -0,03; 2002 : -0,1; 2003 : 0,1; 2004 : 0,7; 2005 : 0,5; 2006 : -0,2; 2007 : 0,0; 2008 : -0,1; 2009 : 0,2; 2010 : -0,5; 2011 : -0,1; 2012 : 0,3; 2013 : -0,1; 2014 : 0,0.
La Loi sur les brevets prévoit que le CEPMB doit tenir compte des variations de l’IPC, entre autres facteurs, lorsqu’il est appelé à déterminer si le prix d’un médicament breveté est ou non excessif. La figure 4 présente les variations annuelles de l’IPMB par rapport aux variations de l’IPC pour les mêmes années. L’inflation générale des prix, mesurée au moyen de l’IPC, a été supérieure à l’augmentation moyenne des prix des produits médicamenteux brevetés presque chaque année depuis 1988. En 2014, l’IPC a augmenté de 2,0 %, alors que l’IPMB n’a pas changé en moyenne entre 2013 et 2014 (0,0 %).
Figure 4 Taux annuel de variation de l’indice des prix des médicaments brevetés (IPMB) et de l’indice des prix à la consommation (IPC), 1988-2014
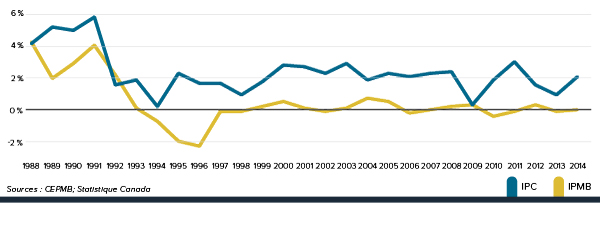
Description de la figure
Il s’agit d’un diagramme linéaire présentant, en pourcentage, le taux annuel de variation de l’Indice des prix des médicaments brevetés (IPMB) par rapport aux variations correspondantes de l’Indice des prix à la consommation (IPC). En 1988, le taux de variation de l’IPMB était de 0,041 %. Le taux de variation de l’IPC était de 0,04 % pour la même année.
1989 : IPMB 0,019, IPC 0,05; 1990 : IPMB 0,028, IPC 0,048; 1991 : IPMB 0,039, IPC 0,056; 1992 : IPMB, 0,021, IPC 0,015; 1993 : IPMB 0,001, IPC 0,018; 1994 : IPMB -0,007, IPC 0,002; 1995 : IPMB -0,019, IPC 0,022; 1996 : IPMB -0,022, IPC 0,015; 1997 : IPMB -0,001, IPC 0,017; 1998 : IPMB -0,001, IPC 0,009; 1999 : IPMB 0,002, IPC 0,017; 2000 : IPMB 0,005, IPC 0,027; 2001 : IPMB 0,1, IPC 2,6; 2002 : IPMB -0,012, IPC 0,023; 2003 : IPMB 0,001, IPC 0,028; 2004 : IPMB 0,007, IPC 0,018; 2005 : IPMB 0,005, IPC 0,022; 2006 : IPMB -0,002, IPC 0,020; 2007 : IPMB 0,000, IPC 0,022; 2008 : IPMB 0,002, IPC 0,023; 2009 : IPMB 0,003, IPC 0,003; 2010 : IPMB -0,004, IPC 0,018; 2011 : IPMB -0,001, IPC 0,029; 2012 : IPMB 0,003, IPC 0,015; 2013 : IPMB -0,001, IPC 0,009; 2014 : IPMB 0,000, IPC 0,020.
Il n’est pas surprenant que l’IPMB ait rarement augmenté au même rythme que l’IPC. Les Lignes directrices du CEPMB prévoient en effet que les prix des produits médicamenteux brevetés ne peuvent augmenter davantage que le taux moyen d’augmentation de l’IPC calculé sur une période de trois ans. (Les Lignes directrices limitent également les augmentations annuelles de prix à une fois et demie le taux d’inflation calculé à l’aide de l’IPC.) Cette exigence a pour effet de limiter les augmentations des prix des produits à celles de l’IPC sur une période de trois annéesNote de bas de page 6. En pratique, les variations de l’IPC n’atteignent jamais cette limite étant donné qu’un grand nombre de brevetés n’augmentent pas les prix de leurs médicaments dans toute la mesure autorisée par les Lignes directrices ou décident même de les réduire.
Variation du prix selon le groupe thérapeutique
Le tableau 10 présente les taux moyens de variation des prix des produits médicamenteux brevetés au niveau de leur groupe thérapeutique principal. Ce tableau a été établi en appliquant la méthode de calcul de l’IPMB aux données sur les prix des différents produits médicamenteux brevetés ventilées selon le niveau 1 de la classification ATC. La dernière colonne du tableau présente le résultat de la décomposition de la variation globale de l’IPMB où chaque entrée représente la composante attribuable aux produits médicamenteux du groupe thérapeutique correspondant. Selon cette mesure, l’IPMB inchangé (0,0 %) indique que les prix des produits médicamenteux des différents groupes thérapeutiques sont relativement stables. Veuillez noter que tous les groupes thérapeutiques ont affiché, en moyenne, un taux de variation des prix inférieur au taux d’inflation de l’IPC.Note de bas de page 7
Tableau 10. Variation de l’indice des prix des médicaments brevetés (IPMB) selon le groupe thérapeutique principal, 2014
| Groupe thérapeutique |
Pourcentage des ventes en 2014 (en %) |
Variation des prix de 2013 à 2014 (en %) |
Contribution : Variation de l'IPMB (en %) |
| A : Tube digestif et métabolisme |
11,0 |
-0,9 |
-0,1 |
| B : Sang et organes sanguinoformateurs |
5,7 |
-1,9 |
-0,1 |
| C : Système cardiovasculaire |
6,6 |
0,1 |
0,0 |
| D : Produits dermatologiques |
0,8 |
-0,3 |
0,0 |
| G : Système génito-urinaire et hormones sexuelles |
3,7 |
1,1 |
0,0 |
| H : Préparations hormonales systémiques |
0,5 |
0,6 |
0,0 |
J : Antiinfectieux généraux pour usage systémique
P : Produits antiparasitaires* |
9,1 |
1,0 |
0,1 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
30,8 |
0,3 |
0,1 |
| M : Système musculo-squelettaire |
3,3 |
0,6 |
0,0 |
| N : Système nerveux |
12,3 |
-0,1 |
0,0 |
| R : Système respiratoire |
8,5 |
0,0 |
0,0 |
| S : Organes sensoriels |
5,3 |
-0,2 |
0,0 |
| V : Divers |
2,5 |
-3,1 |
-0,1 |
| Tous les groupes thérapeutiques |
100,0† |
0,0 |
0,0 |
* Pour des raisons de confidentialité, les données sur ces deux groupes ont été combinées.
† Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Variation des prix selon la catégorie de clients
La figure 5 présente les taux moyens de variation des prix selon la catégorie de clientsNote de bas de page 8. Ces taux ont été obtenus en appliquant séparément la méthodologie de l’IPMB aux données sur les ventes faites aux hôpitaux, aux pharmacies et aux grossistesNote de bas de page 9. Pour 2014, les taux de variation des prix étaient de -0,4 %, de -0,8 % et de 0,1 % respectivement.
Figure 5. Taux annuel de variation (%) de l’indice des prix des médicaments brevetés (IPMB) selon la catégorie de clients, 2011-2014
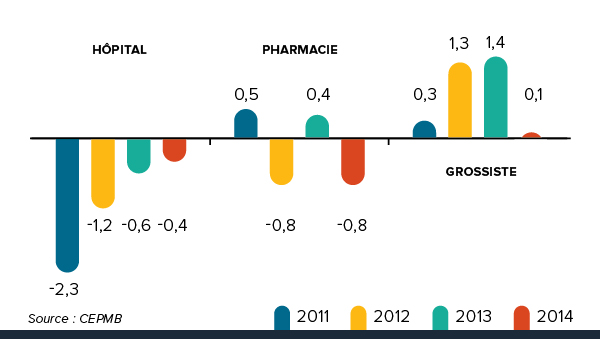
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, le taux moyen de variation des prix par catégorie de clients. En 2011, le taux moyen de variation de prix était de -2,3 % pour la catégorie hôpital, de 0,5 % pour la catégorie pharmacie et de 0,3 % pour la catégorie grossiste.
2012 : hôpital -1,2, pharmacie -0,8, grossiste 1,3; 2013 : hôpital -0,6, pharmacie 0,4, grossiste 1,4; 2014 : hôpital -0,4, pharmacie -0,8, grossiste 0,1.
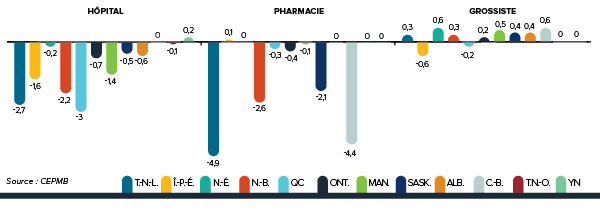
Variation des prix selon la province ou le territoire
La figure 6 présente les taux moyens annuels de variation des prix selon la province ou le territoire. Ces taux ont été obtenus en appliquant la méthodologie du calcul de l’IPMB aux données sur les ventes ventilées selon la province ou le territoire dans lequel les ventes ont été effectuées. Ces résultats révèlent que, entre 2013 et 2014, les prix des produits médicamenteux brevetés à l’Î.-P.-É. ont reculé, en moyenne. La Nouvelle-Écosse a connu la plus importante augmentation moyenne des prix (0,4 %).
Figure 6. Taux annuel de variation des prix, par province ou territoire*, par catégorie de clients†, 2014
* Les valeurs pour le Nunavut sont comprises dans celles des Territoires du Nord-Ouest (T.N.-O.).
†Les résultats pour la catégorie « Tous » dans la figure 6 ne comprennent pas ceux de la catégorie « Autre ».
Description de la figure
Il s’agit d’un diagramme à barres présentant le taux annuel moyen de variation des prix, par province ou territoire et par catégorie de clients entre 2013 et 2014. Pour la catégorie hôpital :
- Terre-Neuve-et-Labrador (T.-N.-L.), -2,7
- Île-du-Prince-Édouard, -1,6
- Nouvelle-Écosse, -0,2
- Nouveau-Brunswick, -2,2
- Québec, -3,0
- Ontario, -0,7
- Manitoba, -1,4
- Saskatchewan, -0,5
- Alberta, -0,6
- Colombie-Britannique, 0,0
- Territoires du Nord-Ouest, -0,1
- Yukon, 0,2
Pour la catégorie pharmacie :
- Terre-Neuve-et-Labrador, -4,9
- Île-du-Prince-Édouard, 0,1
- Nouvelle-Écosse, 0,0
- Nouveau-Brunswick, -2,6
- Québec, -0,3
- Ontario, -0,4
- Manitoba, -0,1
- Saskatchewan, -2,1
- Alberta, 0,0
- Colombie-Britannique, -4,4
- Territoires du Nord-Ouest, 0,0
- Yukon, 0,0
Pour la catégorie grossiste :
- Terre-Neuve-et-Labrador, 0,3
- Île-du-Prince-Édouard, -0,6
- Nouvelle-Écosse, 0,6
- Nouveau-Brunswick, 0,3
- Québec, -0,2
- Ontario, 0,2
- Manitoba, 0,5
- Saskatchewan, 0,4
- Alberta, 0,4
- Colombie-Britannique, 0,6
- Territoires du Nord-Ouest, 0,0
- Yukon, 0,0
Variation du prix d’un produit médicamenteux breveté dans les années qui suivent son lancement sur le marché canadien
Le prix du produit médicamenteux breveté type varie-t-il beaucoup au cours des années qui suivent son lancement sur le marché canadien? La figure 7 répond à cette question en présentant le ratio moyen des prix de vente des produits médicamenteux en 2014 par rapport aux prix auxquels ils ont été offerts au moment de leur lancement sur le marché canadien.
Figure 7. Ratio moyen du prix de 2014 par rapport au prix de lancement, par année de lancement
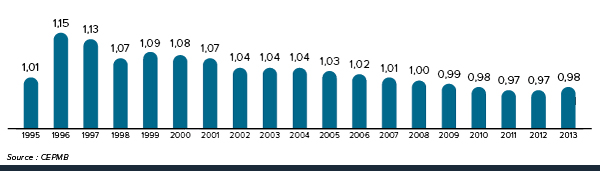
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix de 2014 par rapport au prix de lancement d’un médicament breveté type (prix de vente du médicament au cours de son année de lancement sur le marché canadien).
Pour 1995, le ratio moyen entre le prix de vente de 2014 et le prix de lancement est de 1,01 %. 1996, 1,15; 1997, 1,13; 1998, 1,07; 1999, 1,09; 2000, 1,08; 2001, 1,07; 2002, 1,04; 2003, 1,04; 2004, 1,04; 2005, 1,03; 2006, 1,02; 2007, 1,01; 2008, 1,00; 2009, 0,99; 2010, 0,98; 2011, 0,97; 2012, 0,97; 2013, 0,98.
Les résultats présentés à la figure 7 ne révèlent pas une tendance à la hausse ou à la baisse des prix après la période de lancement des produits médicamenteux sur le marché canadien. En 2014, le prix moyen d’un produit médicamenteux breveté type se situait dans une marge de quelques points de son prix de lancementNote de bas de page 10. Par exemple, les prix des produits lancés il y a une décennie sont seulement 4 % plus élevés en 2014.
Variation des prix selon le pays
La Loi et son Règlement obligent les brevetés à faire rapport des prix de leurs produits médicamenteux brevetés accessibles au public qu’ils pratiquent dans les sept pays de comparaison nommés dans le Règlement (« CEPMB7 »). Ces pays sont la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
Le CEPMB utilise ces données aux fins suivantes :
- pour effectuer ses comparaisons des prix internationaux prévues dans les Lignes directrices;
- pour comparer les prix des produits médicamenteux brevetés pratiqués au Canada avec les prix pratiqués dans d’autres pays.
La figure 8 présente les taux moyens annuels de variation des prix pour le Canada et pour les sept pays de comparaison. Ces valeurs ont été obtenues en appliquant la méthodologie de l’IPMB (avec pondération pour tenir compte des tendances des ventes au Canada) aux données sur les prix pratiqués dans les différents pays de comparaison soumises par les brevetés au CEPMB. À titre d’information, les résultats pour les États-Unis sont fondés sur des prix qui tiennent compte des prix de la Classification fédérale des approvisionnements (US Federal Supply Schedule ou FSS)Note de bas de page 11.
Figure 8. Taux moyens annuels de variation des prix pratiqués au Canada et dans les pays de comparaison, 2014
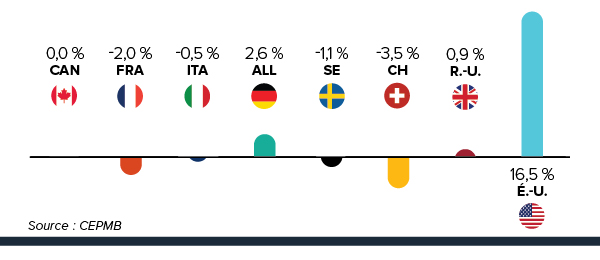
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, les taux moyens annuels de variation des prix au Canada et dans chacun des sept pays de comparaison. Au Canada, le taux moyen annuel de variation des prix était de 0,0. France, -2,0; Italie, -0,5; Allemagne, 2,6; Suède, -1,1; Suisse, -3,5; Royaume-Uni, 0,9; États-Unis, 16,5.
Les résultats présentés à la figure 8 indiquent que, en 2014, les États-Unis ont connu une hausse moyenne des prix se chiffrant à 16,5 %. Le Royaume-Uni et l’Allemagne ont connu des hausses moyennes des prix plus modestes, tandis que les prix en France, en Italie, en Suisse et en Suède ont baissé.
Les résultats s’appliquant au marché étranger se basent sur des données relatives au prix départ usine accessibles au public (habituellement dans la catégorie des clients de la vente au détail) qui sont soumises par les brevetés au CEPMB. Toutefois, pour le Canada, le taux de variation se fonde sur les prix moyens réels par transaction et ne tient pas compte des remises et des rabais accordés par les fabricants directement à leurs clients.
Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger
Les tableaux 11 et 12 présentent des statistiques détaillées qui permettent de comparer les prix des produits médicamenteux brevetés pratiqués à l’étranger avec ceux pratiqués au Canada. Chaque tableau présente deux séries de ratios de prix moyens. Les tableaux sont différents l’un de l’autre selon la méthode de conversion en équivalents dollars canadiens des prix exprimés dans la devise des différents pays. Les deux tableaux présentent également le nombre de produits médicamenteux (DIN) et le volume des ventes couverts par chaque ratio de prix.Note de bas de page 12
Les ratios de prix moyens donnés dans les tableaux 11 et 12 sont des moyennes arithmétiques pondérées de ratios de prix obtenues pour des produits médicamenteux individuels, dont la pondération est fondée sur les tendances des ventes au Canada. Les ratios moyens de prix interprétés de cette façon donnent des réponses exactes aux questions comme celle-ci :
« Combien les Canadiens auraient-ils payé, en plus ou en moins, leurs produits médicamenteux brevetés en 2014 s’ils les avaient achetés aux prix pratiqués dans le pays X? »
Par exemple, on peut voir dans le tableau 11 que le ratio du prix moyen en France par rapport au prix moyen au Canada calculé avec la moyenne arithmétique est de 0,75 pour 2014. Ce ratio signifie que les Canadiens auraient payé leurs médicaments brevetés 25 % de moins en 2014 s’ils avaient pu les acheter aux prix pratiqués en France.
Pendant bon nombre d’années, le CEPMB a fait rapport des ratios des prix moyens pratiqués dans les pays de comparaison par rapport aux prix moyens pratiqués au Canada après avoir converti les prix pratiqués dans les pays de comparaison en équivalents dollars canadiens à l’aide des moyennes des taux de change (ou, plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois que le CEPMB utilise généralement lorsqu’il applique ses Lignes directrices). Le tableau 11 compare également les ratios des prix dans les pays de comparaison par rapport à leurs prix au Canada, après avoir converti la devise à l’aide de la parité des pouvoirs d’achat. Le taux de parité des pouvoirs d’achat représente le coût de la vie relatif dans ces deux pays exprimé dans leurs devises respectives. En pratique, le coût de la vie est calculé à l’aide d’un « panier » de produits et de services aux prix courants dans chaque pays.
Étant donné que les taux de parité des pouvoirs d’achat représentent le coût relatif de la vie dans chacun des pays, ils constituent un moyen simple de rajuster les prix pour tenir compte des différences de prix, de revenus et d’autres valeurs monétaires dans la comparaison des prix pratiqués dans les différents pays. Appliqués au calcul des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d’achat fournissent des statistiques qui nous permettent de répondre à des questions comme celle-ci :
« Dans quelle mesure les Canadiens auraient-ils dû sabrer dans leur consommation de biens et de services pour acheter des produits médicamenteux brevetés si, en 2014, ils avaient vécu dans le pays X? »
On ne peut répondre à une telle question en limitant la comparaison aux prix des produits médicamenteux. Il faut plutôt calculer ce que chaque prix représente en termes de biens et de services sacrifiés. C’est précisément ce que permettent de faire les parités des pouvoirs d’achat.
Comparaisons bilatérales des prix
Le tableau 11 compare les prix pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. D’après les résultats de la conversion des différentes devises aux taux de change du marché, il semble que, comme dans les années antérieures, les prix pratiqués au Canada se situaient en général dans la gamme des prix observés parmi les pays de comparaison. Les prix en France, en Italie, au Royaume-Uni, en Suède et en Suisse étaient beaucoup moins élevés qu’au Canada, alors que ceux en Allemagne étaient plus élevés. Comme dans les années antérieures, les prix déclarés étaient beaucoup plus élevés aux États-Unis qu’au Canada et que dans tous les autres pays de comparaison.
Tableau 11. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, comparaisons bilatérales, 2014
Taux de change du marché
|
Canada |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume
Uni |
États-
Uni |
| Ratio moyen des prix en 2014 |
1,00 |
0,75 |
0,87 |
1,14 |
0,96 |
0,97 |
0,86 |
2,47 |
| Ratio moyen des prix en 2013 |
1,00 |
0,72 |
0,79 |
1,04 |
0,90 |
0,95 |
0,77 |
2,07 |
Parités des pouvoirs d’achat
|
Canada |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume
Uni |
États-
Uni |
| Ratio moyen des prix en 2014 |
1,00 |
0,82 |
1,05 |
1,32 |
0,88 |
0,80 |
0,93 |
2,97 |
| Ratio moyen des prix en 2013 |
1,00 |
0,78 |
0,97 |
1,23 |
0,85 |
0,78 |
0,86 |
2,53 |
| Nombre de produits médicamenteux brevetés en 2014 |
1 345 |
772 |
849 |
974 |
940 |
900 |
946 |
1 100 |
| Ventes (en M$) |
13 739,82 |
10 009,96 |
10 949,53 |
11 992,04 |
11 606,85 |
11 500,61 |
11 637,63 |
12 763,82 |
Source : CEPMB
Il importe de prendre note qu’il n’est pas toujours possible de trouver un prix correspondant dans chaque pays de comparaison pour chacun des produits médicamenteux brevetés vendus au Canada. Le tableau 11 illustre la fréquence de disponibilité d’un prix de comparaison pratiqué dans chacun des pays de comparaison. Par exemple, parmi les 1 345 produits médicamenteux brevetés assujettis à la compétence du CEPMB en 2014, un prix départ usine publiquement disponible n’était disponible pour la France que dans 58 % des cas, alors que le même chiffre pour les États-Unis s’élevait à 82 %, de loin le taux le plus élevé. Vu le caractère intégré de la chaîne d’approvisionnement du Canada et des États-Unis, il arrive souvent que les États-Unis constituent le seul autre pays pour lequel un prix de comparaison est disponible relativement à un produit vendu au Canada. Dans un tel cas, ce prix est considéré comme étant le prix international médian pour les fins de la méthodologie du CEPMB.
Les ratios moyens de prix obtenus à la suite de la conversion des devises aux taux de parité des pouvoirs d’achat permettent de tirer les mêmes conclusions. Si l’on tient compte des différences du coût de la vie dans les pays de comparaison, le Canada se présente comme le pays où les coûts de consommation pour les produits médicamenteux brevetés étaient les plus élevés en 2014. En effet, ces coûts donnent à penser que les Canadiens ont dépensé davantage que les consommateurs des pays de comparaison, exclusion faite des consommateurs de l’Italie, de l’Allemagne et des États-Unis.
La figure 9 présente ces résultats dans une perspective historique. En 2005, les prix au Canada étaient généralement égaux ou inférieurs aux prix correspondants pratiqués dans tous les pays de comparaison, sauf en Italie. En 2014, les prix au Canada étaient résolument plus élevés que ceux pratiqués au Royaume-Uni, en France et en Italie et un peu plus élevés que ceux pratiqués en Suède et en Suisse.
Figure 9. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada : 2005, 2014
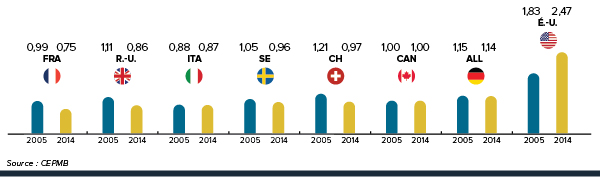
Description de la figure
Il s’agit d’un diagramme à barres présentant les ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada en 2005 et en 2014.
- France — 2005: 0,99, 2014: 0,75
- Royaume-Uni — 2005: 1,11, 2014: 0,86
- Italie — 2005: 0,88, 2014: 0,87
- Suède — 2005: 1,05, 2014: 0,96
- Suisse — 2005: 1,21, 2014: 0,97
- Canada — 2005: 1,00, 2014: 1,00
- Allemagne — 2005: 1,15, 2014: 1,14
- États-Unis — 2005: 1,83, 2014: 2,47
Si le médicament breveté est vendu dans un ou plusieurs des pays de comparaison (CEPMB7), le breveté doit soumettre les prix départ usine accessibles au public au CEPMB pour chaque catégorie de clientsNote de bas de page 13. Pour pouvoir évaluer comment se situe le Canada par rapport à un ensemble de pays plus large que le CEPMB7, la figure 10 utilise les prix pratiqués au Canada et à l’étranger consignés dans la base de données MIDASMC d’IMS AG au niveau du prix du fabricant départ usine de manière à tenir compte de toutes les ventes dans les secteurs des pharmacies et des hôpitaux.
Les comparaisons de prix étrangers consignées à la figure 10 permettent de faire une comparaison bilatérale des prix en se servant de tous les pays de l’Organisation de coopération et de développement économiques (OCDE) qui se trouvent dans MIDASMC. Les ratios moyens du prix international par rapport aux prix canadiens sont calculés en se servant exactement de la même approche que celle utilisée pour produire les ratios présentés à la figure 9. Il s’agit de moyennes arithmétiques, pondérées en fonction des ventes canadiennes, pour les ratios du prix international correspondant par rapport au prix canadien pour des médicaments pris individuellementNote de bas de page 14. Comme l’indique la figure qui suit, les prix canadiens sont en moyenne environ 26 % supérieurs à la médiane de l’OCDE et se situent au quatrième rang sur les 31 pays.
Figure 10. Ratio moyen du prix international pratiqué par rapport au prix pratiqué au Canada, OCDE, 2014
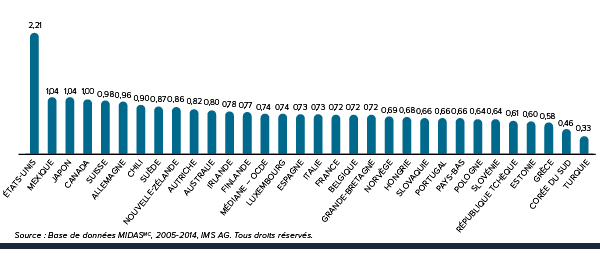
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix des produits médicamenteux brevetés dans les pays de l’OCDE par rapport au prix du Canada en 2014. La comparaison a été réalisée au moyen du prix canadien et du prix international au départ de l’usine figurant dans la base de données MIDASMC d’IMS AG, de manière à tenir compte de toutes les ventes dans les secteurs des pharmacies et des hôpitaux 2014. États-Unis : 2,21; Mexique : 1,04; Japon : 1,04; Canada : 1,00; Suisse : 0,98; Allemagne : 0,96; Chili : 0,90; Suède : 0,87; Nouvelle-Zélande : 0,86; Autriche : 0,82; Australie : 0,80; Irlande : 0,78; Finlande : 0,77; OCDE : 0,74; Luxembourg : 0,74; Espagne : 0,73; Italie : 0,73, France : 0,72; Belgique : 0,72; Grande-Bretagne : 0,72; Norvège : 0,69; Hongrie : 0,68; Slovaquie : 0,66; Portugal : 0,66; Pays-Bas : 0,66; Pologne : 0,64; Slovénie : 0.64; République tchèque : 0,61; Estonie : 0,60; Grèce : 0,58; Corée du Sud : 0,46; Turquie : 0,33.
Comparaisons multilatérales des prix
Le tableau 12 présente les ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, et ce, pour plusieurs mesures multilatérales des prix pratiqués dans les pays de comparaison. Le « prix international médian » correspond à la médiane des prix observés dans les sept pays de comparaison. D’autres ratios de prix multilatéraux comparent la moyenne minimale, maximale et simple des prix pratiqués dans les pays de comparaison par rapport aux prix au Canada.
Tableau 12. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, comparaisons multilatérales, 2014
|
Médiane |
Minimum |
Maximum |
Moyenne |
| Ratio moyen des prix aux taux de change du marché |
1,13 |
0,82 |
2,48 |
1,31 |
| Ratio moyen des prix aux parités de pouvoir d’achat |
1,19 |
0,93 |
2,95 |
1,45 |
| Nombre de produits médicamenteux brevetés |
1 262 |
1 262 |
1 ,262 |
1 262 |
| Ventes (en millions de $) |
13 448,29 |
13 448,29 |
13 448,29 |
13 448,29 |
Source : CEPMB
Une fois de plus sous l’angle des résultats obtenus avec les taux de change du marché, le ratio du prix international médian par rapport aux prix pratiqués au Canada s’est maintenu à 1,13 en 2014 (la valeur correspondante pour 2013 était de 1,06). Il convient de noter que la moyenne des prix pratiqués dans les pays de comparaison semble produire des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada plus élevés que les prix internationaux médians. Cette situation s’explique par l’influence des prix pratiqués aux États-Unis où les prix sont habituellement beaucoup plus élevés que dans tous les autres pays. Même si les prix pratiqués aux États-Unis sont presque toujours pris en compte dans la détermination du prix moyen pratiqué dans les pays de comparaison, ce n’est pas toujours le cas en ce qui concerne les prix internationaux médians. Néanmoins, les États-Unis exercent une influence notable sur le ratio moyen des prix internationaux médians par rapport aux prix pratiqués au Canada en raison du phénomène récurrent mentionné à la section précédente, où les États-Unis constituent le seul pays pour lequel un prix départ usine est disponible relativement à un produit médicamenteux breveté vendu au Canada.
La figure 11 replace ces résultats dans leur contexte historique en présentant l’historique des ratios moyens des prix internationaux médians par rapport aux prix pratiqués au Canada de 2001 à 2014. Même si le ratio a beaucoup changé au cours de cette période, il est demeuré au-dessus de la parité.
Figure 11. Ratio moyen du prix international médian par rapport aux prix PTM pratiqués au Canada, aux taux de change du marché, 2001-2014
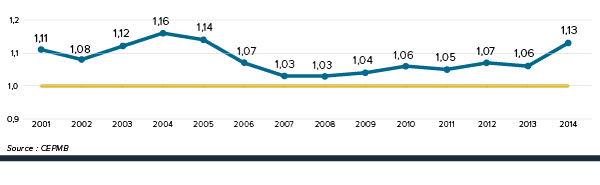
Description de la figure
Il s’agit d’un diagramme linéaire présentant l’historique des ratios moyens du prix international médian par rapport aux prix pratiqués au Canada de 2001 à 2014. En 2001, le ratio moyen du prix international médian (PIM) par rapport au prix de transaction moyen au Canada, aux taux de change du marché, était de 1,11. En 2002 : 1,08; 2003 : 1,12; 2004 : 1,16; 2005 : 1,14; 2006 : 1,07; 2007 : 1,03; 2008 : 1,03; 2009 : 1,04; 2010 : 1,06; 2011 : 1,05; 2012 : 1,07; 2013 : 1,06; 2014 : 1,13.
La figure 12 présente d’autres résultats concernant le ratio moyen du prix international médian par rapport aux prix canadiens aux taux de change du marché en 2014. Afin de se pencher sur la question soulevée précédemment selon laquelle les prix canadiens sont des prix de vente moyens nationaux tandis que les prix étrangers sont des prix courants, on calcule un ratio prix courant-prix courant. Suivant cette méthode, le ratio moyen diminue de 1,13 à 1,02. Il importe de garder à l’esprit que les remises opaques accordées directement aux payeurs ne sont présentement pas consignées dans les données.
Afin de tenir compte de la grande incidence des prix américains au niveau de l’établissement du prix étranger moyen, on fournit aussi à la figure 12 un ratio qui exclut les États-Unis et un ratio qui inclut au moins cinq pays dans le calcul de la valeur médiane. En tenant compte de ces restrictions, le ratio moyen du prix international médian par rapport aux prix canadiens diminue à 0,85 et à 0,86, respectivement, ce qui donne à penser que les prix courants canadiens sont en moyenne 14 % ou 15 % supérieurs aux prix courants étrangers médians. Dans bon nombre des pays de comparaison, des rabais sur les prix courants sont offerts à tous les payeurs publics et privés. En revanche, une grande proportion du marché canadien (plus de 60 %) paie en fait le prix courant.
Figure 12. Ratio moyen du prix international médian par rapport aux prix pratiqués au Canada, aux taux de change du marché, 2014
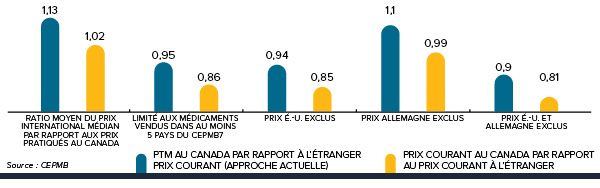
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix international médian (PIM) par rapport au prix pratiqué au Canada, aux taux de change du marché, selon les données de 2014.
|
Canada au PTM-N |
Canada au prix marqué |
| Prix international médian pour CEPMB7 |
1,13 |
1,02 |
| Sans l’Allemagne |
1,10 |
0,99 |
| Sans les États-Unis |
0,94 |
0,85 |
| Sans l’Allemagne et les États-Unis |
0,90 |
0,81 |
| Prix médian limité aux médicaments vendus dans au moins 5 pays du CEPMB7 |
0,95 |
0,86 |
La figure 13 présente avec encore plus de détails les ratios des prix internationaux médians par rapport aux prix pratiqués au Canada au niveau des produits, ventilés selon les moyennes présentées dans le tableau 12. Cette figure ventile les ventes de chaque médicament breveté effectuées en 2014 selon le ratio des prix internationaux médians par rapport aux prix canadiens (ou, pour être plus précis, selon la fourchette dans laquelle s’inscrit le ratio)Note de bas de page 15. Ces résultats révèlent une dispersion importante des ratios de prix au niveau du produit. Alors que les produits dont les ratios du prix international médian par rapport au prix au Canada se situent entre 0,90 et 1,10 accaparaient 25,9 % des ventes, ceux dont les ratios se situent sous 0,90 en accaparaient 45,6 % et ceux dont les ratios dépassaient 1,10 en accaparaient 28,5 %.
Figure 13. Distribution d’intervalle des ventes, selon le ratio du prix international médian par rapport aux prix canadiens, 2014
Description de la figure
Il s’agit d’un diagramme à barres présentant la distribution d’intervalle des ventes en 2014 pour chaque produit médicamenteux breveté, selon le ratio du prix international médian par rapport aux prix canadiens (plus exactement, selon l’intervalle dans lequel se trouve le ratio).
‹ 0,50 : 3,6; de 0,50 à 0,55 : 1,3; de 0,55 à 0,60 : 4,2; de 0,60 à 0,65 : 4,8; de 0,65 à 0,70 : 3,1; de 0,70 à 0,75 : 2,4; de 0,75 à 0,80 : 3,5; de 0,80 à 0,85 : 12,0; de 0,85 à 0,90 : 10,7; de 0,90 à 0,95 : 8,2; de 0,95 à 100 : 3,5; de 1,00 à 1,05 : 6,6; de 1,05 à 1,10 : 7,6; de 1,10 à 1,15 : 3,5; de 1,15 à 1,20 : 5,4; de 1,20 à 1,25 : 1,5; de 1,25 à 1,30 : 1,2; de 1,30 à 1,35 : 1,6; de 1,35 à 1,40 : 0,6; de 1,40 à 1,45 : 0,9; de 1,45 à 1,50 : 1,8; › 1,50 : 12,2.
Utilisation faite des produits médicamenteux brevetés
Les données sur les prix et sur la valeur des ventes utilisées pour calculer l’IPMB servent également à déterminer les tendances dans les quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule à cette fin l’indice du volume des ventes de médicaments brevetés (IVVMB). La figure 14 présente pour les années 1988 à 2014 les taux moyens de croissance de l’utilisation des produits médicamenteux brevetés, mesurée à l’aide de l’IVVMB. Les résultats obtenus confirment que, dans les dernières années, la croissance de l’utilisation faite des produits médicamenteux brevetés est le principal facteur d’augmentation de la valeur des ventes. Les taux de croissance de l’utilisation talonnent en effet de près les taux de croissance de la valeur des ventes. Cette tendance de suivi s’est maintenue en 2014, le taux d’utilisation des produits médicamenteux brevetés ayant augmenté, en moyenne, de 3,6 % entre 2013 et 2014 et les ventes ayant augmenté de 3,1 %.
Figure 14. Taux annuel de variation (%) de l’indice du volume des ventes de médicaments brevetés (IVVMB), 1988-2014
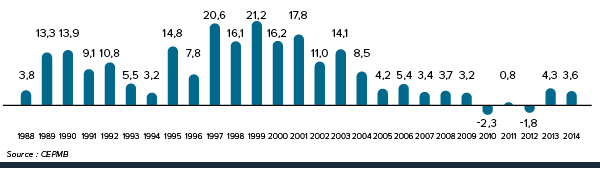
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, les taux moyens de croissance de l’utilisation des produits médicamenteux brevetés, mesurés par l’indice de volume des ventes de médicaments brevetés (IVVMB), de 1998 à 2014.
1988 : 3,8; 1989 : 13,3; 1990 : 13,9; 1991 : 9,1; 1992 : 10,8; 1993 : 5,5; 1994 : 3,2; 1995 : 14,8; 1996 : 7,8; 1997 : 20,6; 1998 : 16,1; 1999 : 21,2; 2000 : 16,2; 2001 : 17,8; 2002 : 11,0; 2003 : 14,1; 2004 : 8,5; 2005 : 4,2; 2006 : 5,4; 2007 : 3,4; 2008 : 3,7; 2009 : 3,2; 2010 : -2,3; 2011 : 0,8; 2012 : -1,8; 2013 : 4,3; 2014 : 3,6.
Croissance de l’utilisation faite des produits médicamenteux brevetés selon le groupe thérapeutique
Le tableau 13 présente les taux moyens de croissance de l’utilisation faite des produits médicamenteux brevetés. Ces taux sont ventilés selon les groupes thérapeutiques principaux. Les résultats présentés dans ce tableau ont été obtenus en appliquant la méthodologie de l’ aux données du niveau 1 de la classification ATC. Comme dans le tableau 13, la dernière colonne donne un aperçu de la contribution des différents groupes thérapeutiques à la variation de l’IVVMB global.
En 2014, les niveaux d’utilisation ont augmenté dans huit groupes thérapeutiques. La croissance modérée de l’utilisation des produits agissant sur le tube digestif et le métabolisme, sur les agents antinéoplasiques et immunomodulateurs ainsi que sur les organes sensoriels représente la plus grande partie de la croissance de l’utilisation faite de l’ensemble des produits. Quant aux produits médicamenteux agissant sur le système cardiovasculaire, sur le sang et les organes sanguinoformateurs et sur le système nerveux, leur taux d’utilisation a reculé.
Tableau 13. Variation de l’indice du volume des ventes de médicaments brevetés (IVVMB) selon le groupe thérapeutique principal, 2014
| Groupe thérapeutique |
Pourcentage des ventes en 2014 (%) |
Variation du volume de 2013 à 2014 (%) |
Contribution : variation de l’IVVMB (%) |
| A : Tube digestif et métabolisme |
11,0 |
10,2 |
1,1 |
| B : Sang et organes sanguinoformateurs |
5,7 |
-5,6 |
-0,3 |
| C : Système cardiovasculaire |
6,6 |
-4,2 |
-0,3 |
| D : Produits dermatologiques |
0,8 |
-4,8 |
0,0 |
| G : Système génito-urinaire et hormones sexuelles |
3,7 |
-0,6 |
0,0 |
| H : Préparations hormonales systémiques |
0,5 |
2,1 |
0,0 |
J : Antiinfectieux généraux pour usage systémique
P : Produits antiparasitaires* |
9,1 |
-1,9 |
-0,2 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
30,8 |
8,7 |
2,7 |
| M : Système musculo-squelettaire |
3,3 |
5,8 |
0,2 |
| N : Système nerveux |
12,3 |
-6,1 |
-0,8 |
| R : Système respiratoire |
8,5 |
0,7 |
0,1 |
| S : Organes sensoriels |
5,3 |
12,6 |
0,7 |
| V : Divers |
2,5 |
7,8 |
0,2 |
| Tous les groupes thérapeutiques |
100,0† |
3,6 |
3,6 |
* Pour des raisons de confidentialité, les données sur ces groupes ont été combinées.
† Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Dépenses en produits médicamenteux au Canada par rapport aux marchés mondiaux
IMS HealthNote de bas de page 16 fait régulièrement rapport des ventes de médicaments dans un grand nombre de pays. Selon les données sur les ventes provenant de cette source, la figure 15 illustre la répartition de ces ventes entre le Canada et les sept pays que le CEPMB utilise dans ses examens de prix (CEPMB7)Note de bas de page 17. En 2014, le marché canadien a représenté 2,2 % du marché mondial.
Figure 15. Distribution des ventes de produits médicamenteux entre les grands marchés nationaux, 2014
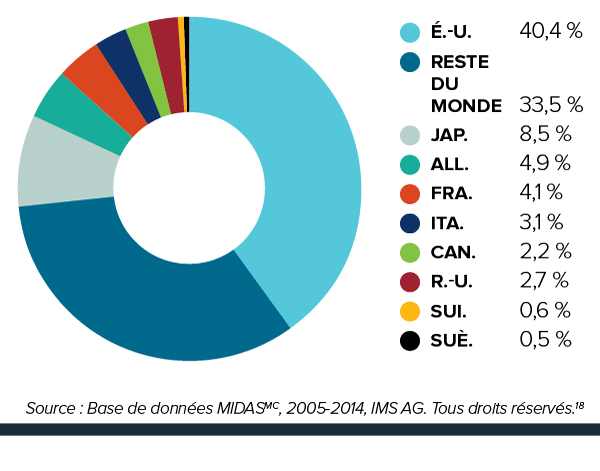
Description de la figure
Il s’agit d’un diagramme en secteurs présentant la distribution des ventes des médicaments parmi les principaux marchés mondiaux en 2014.
Le marché des É.-U. comptait pour 40,4 % du marché mondial 2014. Japon : 8,5. Allemagne : 4,9. France : 4,1. Italie : 3,1. Canada : 2,2. Royaume-Uni : 2,7. Suisse : 0,6. Suède : 0,5; reste du monde : 33,5.
La figure 16 présente la part des ventes du Canada sur les principaux marchés mondiaux de 2005 à 2014. Pendant toutes ces années, la part des ventes du Canada s’est maintenue entre 2,2 % et 2,7 %.
Figure 16. Pourcentage des ventes de produits médicamenteux du Canada, 2005-2014
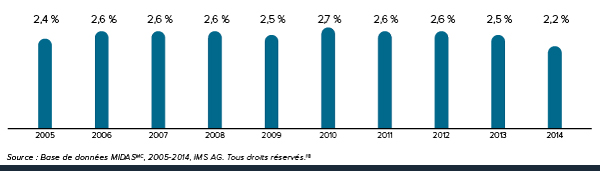
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, la part des ventes du Canada sur les marchés mondiaux, de 2005 à 2014.
2005 : 2,4; 2006 : 2,6; 2007 : 2,6; 2008 : 2,6; 2009 : 2,5; 2010 : 2,7; 2011 : 2,6; 2012 : 2,6; 2013 : 2,5; 2014 : 2,2.
La figure 17 compare la croissance annuelle des ventes de produits médicamenteux au Canada à celle des sept pays de comparaison, ensemble et séparément (CEPMB7). Entre 2005 et 2014, les ventes de produits médicamenteux au Canada ont augmenté à un taux annuel moyen de près de 3,9 %. Ce taux est inférieur au taux moyen de croissance des ventes dans les sept pays de comparaison pour la même période.
Figure 17. Taux moyen de croissance (%) des ventes de produits médicamenteux aux taux de change constants du marché de 2014, par pays, 2005-2014
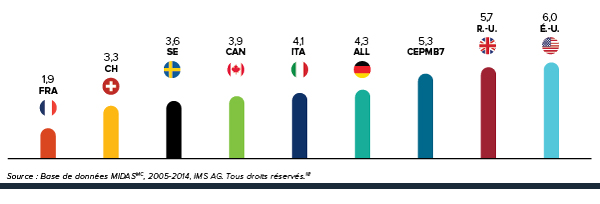
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, la croissance moyenne annuelle des ventes totales de produits médicamenteux pour le Canada et les sept autres pays de comparaison, individuellement et collectivement, de 2005 à 2014.
France : 1,9; Suisse : 3,3; Suède : 3,6; Canada : 3,9; Italie : 4,1; Allemagne : 4,3; CEPMB7 : 5,3; Royaume-Uni : 5,7; États-Unis : 6,0.
La figure 18 compare les taux annuels de croissance des ventes de produits médicamenteux au Canada et dans l’ensemble des pays de comparaison (CEPMB7). En 2014, pour la cinquième année consécutive, les ventes ont augmenté à un taux plus lent au Canada que dans les pays de comparaison.
Figure 18. Taux moyen annuel de variation des ventes de produits médicamenteux aux taux de change constants du marché de 2014, au Canada et dans les pays de comparaison, 2006-2014
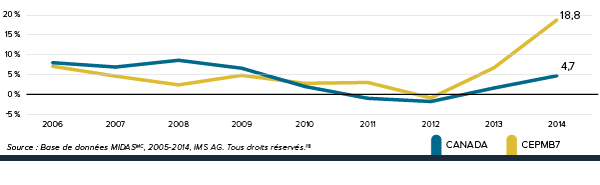
Description de la figure
Il s’agit d’un diagramme linéaire comparant le taux moyen annuel de croissance des ventes de produits médicamenteux, aux taux de change constants du marché de 2014, au Canada et dans les pays de comparaison (CEPMB7), de 2006 à 2014.
2006 : Canada 8,0, pays de comparaison 7,1; 2007 : Canada 6,9, pays de comparaison 4,6; 2008 : Canada 8,6, pays de comparaison 2,4; 2009 : Canada 6,6, pays de comparaison 4,8; 2010 : Canada 2,0, pays de comparaison 2,8; 2011 : Canada 1,0, pays de comparaison 3,0; 2012 : Canada -1,8, pays de comparaison -0,9; 2013 : Canada 1,6, pays de comparaison 6,7; 2014 : Canada 4,7, pays de comparaison 18,8
La comparaison des dépenses en produits médicamenteux entre les pays peut aussi être faite à l’aide de la proportion du revenu national consacrée à l’achat de médicamentsNote de bas de page 19. La figure 19 présente les dépenses en produits médicamenteux exprimées en pourcentage du produit intérieur brut (PIB) du Canada et des sept pays de comparaison (selon des données de 2012). Dans les sept pays de comparaison, les dépenses en produits médicamenteux ont accaparé entre 1,0 % et 2,0 % du PIB. Sur cette échelle, la valeur du Canada (2,0 %) s’inscrit près de la limite supérieure tout comme celle des États-Unis.
Figure 19. Dépenses en produits médicamenteux, exprimées en pourcentage du PIB, 2012
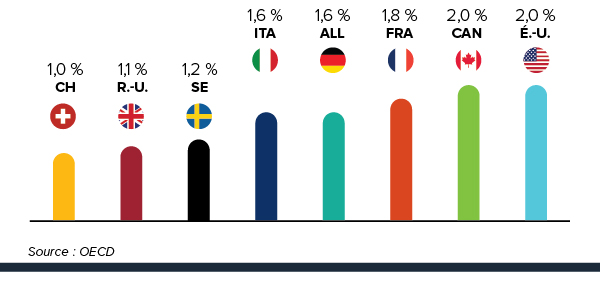
Description de la figure
Il s’agit d’un diagramme à barres présentant les dépenses en produits médicamenteux en pourcentage du produit intérieur brut (PIB) pour le Canada et les sept pays de comparaison, selon les données de 2012.
Suisse : 1,0; Royaume-Uni : 1,1; Suède : 1,2; Italie : 1,6; Allemagne : 1,6; France : 1,8; Canada : 2,0; États-Unis : 2,0.
Le tableau 14 présente le ratio des dépenses par rapport au PIB dans son contexte historique. Entre 2000 et 2012, les dépenses en produits médicamenteux au Canada ont augmenté plus rapidement qu’aux États-Unis, soit presque le double du taux de croissance du PIB.
Le tableau 15 présente la distribution des ventes par les brevetés selon le groupe thérapeutique au Canada, dans chaque pays de comparaison ainsi que dans l’ensemble des pays de comparaison (CEPMB7)Note de bas de page 20. Les résultats font ressortir un degré d’uniformité remarquable entre les différents pays.
Tableau 14. Dépenses en produits médicamenteux, exprimées en pourcentage du PIB, 2012Note de bas de page 21
|
Part des dépenses en produits médicamenteux, 2012
(% du PIB) |
Part des dépenses en produits médicamenteux, 2000
(% du PIB) |
Croissance des dépenses en produits médicamenteux, 2000-2012
(%) |
Croissance du PIB, 2000-2012
(%) |
| Canada |
1,96 |
1,42 |
184,43 |
105,86 |
| France |
1,83 |
1,81 |
89,61 |
87,25 |
| Allemagne |
1,63 |
1,43 |
112,95 |
87,14 |
| Italie |
1,55 |
1,74 |
75,84 |
96,78 |
| Suède |
1,18 |
1,18 |
74,27 |
74,15 |
| Suisse |
1,05 |
1,11 |
75,94 |
86,21 |
| Royaume-Uni |
1,14 |
1,14 |
66,18 |
65,61 |
| États-Unis |
2,03 |
1,46 |
129,98 |
65,57 |
Source : OCDE
Tableau 15. Distribution des ventes de produits médicamenteux (en %) selon le groupe thérapeutique principal, au Canada et dans les pays de comparaison, 2014
| Groupe thérapeutique |
Canada |
CEPMB7 |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| A : Tube digestif et métabolisme |
12,4 |
12,9 |
10,0 |
11,3 |
11,0 |
9,0 |
11,3 |
10,8 |
13,7 |
| B : Sang et organes sanguinoformateurs |
4,3 |
5,1 |
7,4 |
8,5 |
6,5 |
7,4 |
5,6 |
4,7 |
4,4 |
| C : Système cardiovasculaire |
10,8 |
8,6 |
10,6 |
12,0 |
7,9 |
4,8 |
10,4 |
7,1 |
8,3 |
| D : Produits dermatologiques |
3,2 |
2,9 |
2,4 |
2,2 |
2,7 |
2,5 |
3,7 |
3,0 |
3,1 |
| G : Système génito-urinaire et hormones sexuelles |
5,2 |
4,7 |
3,1 |
3,9 |
3,3 |
4,2 |
4,6 |
3,9 |
5,1 |
| H : Préparations hormonales systémiques |
1,2 |
2,2 |
2,1 |
2,0 |
2,0 |
2,3 |
1,6 |
2,7 |
2,2 |
| J : Antiinfectieux généraux pour usage systémique |
8,0 |
12,4 |
13,9 |
12,8 |
10,8 |
10,6 |
10,9 |
10,5 |
12,5 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
18,3 |
18,3 |
18,9 |
18,2 |
22,7 |
25,5 |
19,5 |
19,3 |
17,5 |
| M : Système musculo-squelettaire |
3,6 |
3,2 |
3,3 |
3,7 |
3,7 |
3,1 |
5,3 |
2,5 |
3,1 |
| N : Système nerveux |
17,6 |
16,4 |
13,8 |
11,6 |
14,3 |
16,5 |
15,3 |
18,0 |
17,2 |
| P : Produits antiparasitaires |
0,2 |
0,2 |
0,2 |
0,0 |
0,1 |
0,2 |
0,2 |
0,2 |
0,2 |
| R : Système respiratoire |
7,3 |
6,9 |
5,9 |
5,7 |
6,5 |
8,1 |
6,1 |
9,2 |
7,0 |
| S : Organes sensoriels |
4,0 |
2,7 |
3,2 |
2,2 |
2,8 |
2,7 |
3,9 |
4,1 |
2,5 |
| V : Divers |
3,9 |
3,5 |
5,2 |
6,1 |
5,6 |
3,0 |
1,6 |
3,9 |
2,9 |
| Tous les groupes thérapeutiques* |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
* Il se peut que les valeurs ne totalisent pas 100,0 en raison de l’arrondissement.
Source : Base de données MIDASMC, 2005-2014, IMS AG. Tous droits réservés.Note de bas de page 18
Le Système national d’information sur l’utilisation des médicaments prescrits : À l’appui des décisions relatives aux soins de Santé au Canada
La façon dont les médicaments sont utilisés — où, par qui et dans quel but — influe sur les dépenses canadiennes en matière de médicaments. Le CEPMB permet au Canada de mieux comprendre les tendances par le biais du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), qui produit des renseignements complets et exacts permettant d’orienter le processus décisionnel et de favoriser la viabilité soutenue de notre système pharmaceutique.
Le CEPMB collabore avec les provinces et les territoires
Les rapports du CEPMB ont servi au Conseil de la fédération dans le cadre des efforts de l’Alliance pancanadienne pharmaceutique visant à réduire les prix des médicaments de marque et génériques.
Les publications du SNIUMP
Les publications du SNIUMP du CEPMB informent les canadiens
Le SNIUMP fournit des renseignements objectifs et actuels sur une grande variété de sujets, y compris l’utilisation et les coûts des médicaments génériques, les nouveaux médicaments en voie de commercialisation, l’utilisation d’opioïdes et les principaux facteurs de coût dans les régimes d’assurance-médicaments.
Contexte
Le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) est une initiative de recherche établie en septembre 2001 par les ministres fédéral, provinciaux et territoriaux de la Santé. Il s’agit d’un partenariat entre le CEPMB et l’Institut canadien d’information sur la santé (ICIS).
Il vise à fournir aux décideurs et aux gestionnaires des régimes publics d’assurance-médicaments des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts des médicaments, afin de s’assurer que le système canadien des soins de santé a accès à des renseignements exhaustifs et précis sur l’utilisation des médicaments d’ordonnance et sur les facteurs à l’origine des augmentations des coûts.
Le Comité consultatif du SNIUMP, constitué de représentants des régimes publics d’assurance-médicaments de la Colombie-Britannique, de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du-Prince-Édouard, de Terre- Neuve-et-Labrador, du Yukon et de Santé Canada, conseille le CEPMB sur son programme de recherche et lui suggère des sujets d’étude. Le Comité comprend également des observateurs de l’ICIS et de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS).
Faits saillants
En 2014-2015, le CEPMB a publié quatre études analytiques au titre du SNIUMP :
- CompasRx : Rapport annuel sur les dépenses des régimes publics d’assurance-médicaments, 1ère édition
- Médicaments génériques au Canada, 2013
- L’Observateur des médicaments émergents, 6e édition
- L’utilisation d’opioïdes sur ordonnance dans les régimes publics d’assurance-médicaments du Canada, de 2006-2007 à 2012-2013
Le résumé des deux plus récents rapports est présenté ci-après.
CompasRx : Rapport annuel sur les dépenses des régimes publics d’assurance-médicaments, 1ère édition
CompasRx est un rapport annuel phare et le premier du genre à cerner les principaux facteurs ayant une incidence sur les dépenses en médicaments d’ordonnance au sein des régimes publics d’assurance-médicaments au Canada. Ces facteurs constituent un élément important qui permet aux décideurs et aux chercheurs de mieux comprendre les tendances actuelles et d’anticiper les tensions futures sur les coûts et les niveaux de dépenses. Ce rapport est un outil essentiel pour tous ceux qui s’intéressent à une analyse approfondie des dépenses en médicaments. La première édition porte sur les dépenses des régimes publics d’assurance-médicaments en 2012-2013.
Principales constatations
- En 2012-2013, les dépenses en médicaments d’ordonnance des régimes publics d’assurance médicaments choisis ont totalisé 7,7 milliards de dollars, montant constitué des coûts des médicaments (74,4 %), des frais d’exécution des pharmacies (21,4 %) et de leur marge bénéficiaire (4,2 %).
Dépenses en médicaments d’ordonnance, régimes publics d’assurance-médicaments choisis (2012-2013) : 7,7 milliards de dollars
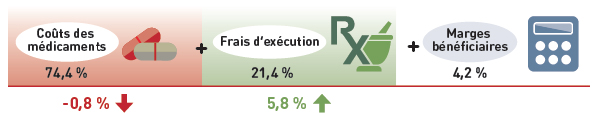
Source des données : Base de données du Système national d’information sur l’utilisation des médicaments prescrits, Institut canadien d’information sur la santé (ICIS)
Les résultats portent sur certains coûts des régimes publics d’assurance-médicaments pour lesquels des données sont disponibles, soit ceux de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du-Prince-Édouard et du régime d’assurance-médicaments des services de santé non assurés de Santé Canada.
Description de la figure
L’image décompose les éléments composants des dépenses en médicaments d’ordonnance totalisant 7,7 milliards de dollars pour les régimes publics d’assurance-médicaments choisis en 2012-2013. Les coûts des médicaments représentaient 74,4 % des dépenses totales, soit une diminution de 0,8 % par rapport à l’année précédente. Les frais d’exécution représentaient 21,4 % des dépenses totales, une augmentation de 5,8 % par rapport à l’année précédente. Les marges bénéficiaires représentaient 4,2 % des dépenses totales en 2012-2013.
- Les régimes publics d’assurance médicaments choisis ont payé 82,0 % du total des dépenses en médicaments prescrits tandis que les bénéficiaires des régimes ont payé le reste soit directement, soit par l’intermédiaire d’un assureur privé tiers.
- Les taux de variation de l’élément coût des médicaments des dépenses en médicaments prescrits dans les régimes publics d’assurance-médicaments reculent régulièrement depuis quelques années, tombant de 0,8 % en 2012-2013 comparativement à 2011-2012.
- Le faible taux de variation nette découle d’effets de « poussée » (à la hausse) et de « traction » (à la baisse) qui s’opposent et se sont presque annulés mutuellement.
- Les effets « démographie », « volume » et « combinaison des médicaments » ont exercé un important effet de « poussée » et sans les économies permises par les médicaments génériques, ces facteurs auraient propulsé le niveau des coûts des médicaments de 8,5 % en 2012-2013.
- La variation moyenne des prix des médicaments génériques et les répercussions des substitutions ont exercé un important effet de « traction » et sans les autres pressions qui ont agi sur les coûts, ces facteurs auraient fait baisser les niveaux des coûts des médicaments de 9,2 % en 2012-2013.
Inducteurs des coûts des médicaments en 2012-2013
Nota : Les valeurs peuvent ne pas correspondre aux totaux parce qu’elles ont été arrondies et en raison des effets croisés.
Source des données : Base de données du Système national d’information sur l’utilisation des médicaments prescrits, Institut canadien d’information sur la santé (ICIS).
Les résultats portent sur les coûts des régimes publics d’assurance-médicaments choisis pour lesquels des données sont disponibles, soit ceux de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du-Prince-Édouard et du régime d’assurance-médicaments des services de santé non assurés de Santé Canada.
Description de la figure
Le diagramme illustre les inducteurs de coût des médicaments de 2012-2013, et les divise en effets de poussée (augmentation) ou de traction (réduction). Il fait état des totaux pour les régimes publics d’assurance-médicaments choisis au Canada.
La variation nette globale des coûts des médicaments entre 2011-2012 et 2012-2013 était de -0,8 %.
L’effet de poussée total était de 8,5 % et comprenait les principaux effets suivants :
- L’effet « combinaison de médicaments » (4,1 %) dû au recours accru aux médicaments plus coûteux :
- Le taux de croissance du coût des médicaments biologiques était de 19,6 %.
- Le nombre de bénéficiaires actifs avec des coûts d’ordonnance annuels de 10 000 $ ou plus has est à la hausse, représentant 1,3 % des bénéficiaires et 20,6 % des dépenses.
- Les coûts moyens annuels des aînés ont diminué, alors que les coûts moyens annuels des non-aînés ont augmenté considérablement dans plusieurs provinces.
- L’effet « volume » (1,7 %) dû à l’utilisation accrue de médicaments.
- L’effet « démographie » (2,7 %) dû à l’augmentation de la population de bénéficiaires actifs.
L’effet de traction total était de -9,2 % et comprenait les principaux effets suivants :
- L’effet « substitution de médicaments génériques » (- 7,2 %) dû au passage des produits de marque plus coûteux aux médicaments génériques moins coûteux :
- La part du marché des médicaments génériques a augmenté dans tous les plans, représentant 62,3 % des ordonnances en 2012-2013.
- Les cinq principaux nouveaux médicaments génériques ont à eux seuls généré des économies de 3,0 % en 2012-2013.
- L’effet « variation de prix » (- 2,0 %) dû à une réduction des prix des médicaments :
- Plusieurs provinces ont mis en œuvre des politiques relatives aux prix des médicaments génériques en 2012-2013.
- En 2012-2013, les réductions des prix des médicaments génériques allaient de 38 % à 16 %, selon la province.
Un effet croisé a résulté de l’interaction entre les effets individuels. Aucune valeur n’est accordée à l’effet croisé.
Médicaments génériques au Canada, 2013
Le rapport Médicaments génériques au Canada, 2013 compte parmi les rapports produits par le CEPMB au cours des dernières années qui comparent le prix des médicaments génériques au Canada à ceux des autres pays industrialisés. Il fait état des prix des médicaments génériques en 2013 et présente les changements relatifs à l’établissement des prix des médicaments génériques qui se sont produits depuis 2011. Le prix des médicaments génériques au Canada est une question cruciale pour les gestionnaires des régimes d’assurance-médicaments, les décideurs et les consommateurs.
Principales constatations
- Dans le cas des médicaments génériques, les prix du fabricant canadiens ont diminué considérablement par rapport à ceux des produits de marque correspondants au cours des dernières années : les réductions des niveaux des prix relatifs ont varié de 56 % du prix des médicaments de marque au cours du premier trimestre de 2011 à 31 % au deuxième trimestre de 2013, selon les données de l’Ontario.
- Malgré une importante diminution des prix des médicaments génériques canadiens au cours des dernières années, ceux-ci demeurent considérablement plus élevés que ceux des autres pays. En 2011, les prix internationaux génériques étaient, en moyenne, inférieurs de 35 % au prix au Canada. Ce taux était de 32 % en 2013.
- Les résultats se fondant sur les prix disponibles du Programme de médicaments de l’Ontario pour le deuxième trimestre de 2013, qui sont susceptibles de mieux refléter la diminution des prix découlant des premières étapes de l’Initiative pour des médicaments génériques à prix concurrentiel, réduisent l’écart des prix et constituent une amélioration marquée.
- L’écart entre les prix génériques étrangers et canadiens était le plus marqué (38 %-39 %) pour les médicaments auxquels étaient associés un plus grand nombre de fournisseurs se faisant concurrence sur le marché canadien (six fournisseurs ou plus) et pour les médicaments dont les ventes étaient les plus élevées (10 millions de dollars ou plus).
Prix moyens des médicaments génériques par rapport aux prix de marque, Canada
Description de la figure
Le diagramme à bandes met en comparaison les prix moyens des médicaments génériques au Canada et en Ontario par rapport aux prix des médicaments de marque. Au Canada : les prix des médicaments génériques au T1-2011 représentaient 0,56 des prix de marque; au T1-2012 0,46; au T1-2013 0,39. En Ontario : T2-2013 0,31.
Prix moyens étrangers* des médicaments génériques par rapport aux prix en Ontario, T2-2013
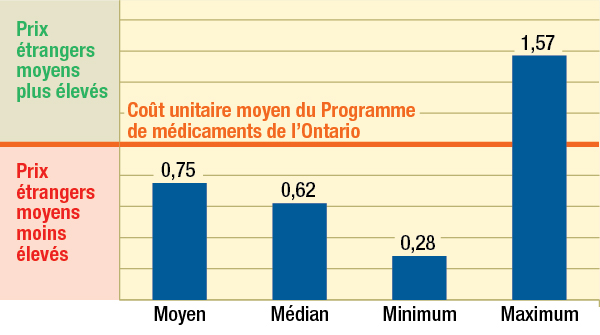
*France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis
Source : MIDASMC, janvier-mars 2011 et janvier-mars 2013, IMS AG Tous droits réservés.
Programme de médicaments de l’Ontario, Base de données du Système national d’information sur l’utilisation des médicaments prescrits, Institut canadien d’information sur la santé, d’avril à juin 2013.
Description de la figure
Le diagramme à bandes met en comparaison les prix internationaux moyens des médicaments génériques par rapport aux prix en Ontario au T2-2013. Prix internationaux : moyenne – 0,75; médiane – 0,62; minimum – 0,28; maximum – 1,57.
Programme de recherche
Le programme de recherche du SNIUMP pour les deux prochains exercices financiers comprend les études analytiques suivantes :
- Les régimes privés d’assurance-médicaments au Canada : Marché des médicaments génériques, 2013
- Résumé analytique – Comparaison des marges de détail des prix internationaux, 2013
- CompasRx du SNIUMP, 2e édition
- Les régimes privés d’assurance-médicaments au Canada : Analyse des facteurs de coûts, 2013
- L’Observateur des médicaments émergents, 7e édition
- L’Observateur des nouveaux médicaments lancés sur le marché
- L’Observateur des médicaments orphelins lancés sur le marché
- L’utilisation et les coûts des médicaments biologiques, de 2005-2006 à 2012-2013
- Les régimes privés d’assurance-médicaments au Canada : Médicaments onéreux, 2013
Analyse des dépenses de recherche-développement : Les investissements en R-D tombent en deçà de la cible
L’innovation est cruciale pour la promotion des soins de santé. La Loi sur les brevets du Canada vise, en partie, à créer un climat d’investissement propice à la recherche et au développement (R-D) dans le domaine pharmaceutique au Canada. Toutefois, le pourcentage de dépenses effectuées en R-D par rapport aux ventes chez les titulaires de brevets pharmaceutiques au Canada diminue depuis la fin des années 1990 et se situe sous l’objectif convenu de 10 % depuis 2003. En 2014, ce pourcentage équivalait à 4,4 % chez tous les titulaires de brevets, et à 5,0 % chez les membres de l’Association des compagnies de recherche pharmaceutique du Canada (Rx&D), soit le point le plus bas depuis que le CEPMB a commencé à produire des rapports sur la R-D en 1988.
Parmi les 10 premiers marchés dans le monde
Le Canada est un marché important pour les produits pharmaceutiques
Le Canada figure constamment parmi les 10 premiers marchés dans le monde pour les produits pharmaceutiques. Malgré cela, les ratios moyens de R-D par rapport aux ventes sont 3 fois plus élevés parmi les pays de comparaison du CEPMB, alors que les prix dans la plupart de ces pays sont moins élevés.
Ratio des dépenses de R-D de 4,4 %
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes chez tous les brevetés est tombé à 4,4 %
Cela représente une diminution de 166 % par rapport au sommet de 11,7 % en 1995.
Analyse des dépenses de recherche-développement
La Loi sur les brevets (la Loi) confère au CEPMB le mandat de faire le suivi des dépenses des brevetés en recherche-développement (R-D) et de faire rapport des tendances observées (la Loi ne confère toutefois pas au CEPMB un droit de regard sur le montant des dépenses des brevetés dans la recherche-développement ni sur le type de recherche-développement). Le présent chapitre fournit des statistiques clés sur la situation actuelle des investissements dans la recherche pharmaceutique au Canada.
Sources des données
Les résultats statistiques présentés dans le présent rapport ont été entièrement tirés des données que les brevetés ont soumises au CEPMB.
La Loi oblige les brevetés à faire rapport au CEPMB des recettes brutes totales qu’ils tirent des ventes de tous leurs produits médicamenteux pour usage humain et pour usage vétérinaire (y compris les recettes tirées des ventes de produits médicamenteux non brevetés et les recettes découlant d’ententes de production sous licence) ainsi que de leurs dépenses de R-D au Canada pour leurs différents produits médicamenteux (brevetés et non brevetés, pour usage humain et pour usage vétérinaire). Les brevetés transmettent ces renseignements au CEPMB au moyen de son Formulaire 3 (Recettes et dépenses en recherche et développement fournies en application du paragraphe 88(1) de la Loi sur les brevets).
Le Règlement sur les médicaments brevetés (le Règlement) exige que chaque Formulaire 3 déposé soit accompagné d’un document certifiant l’exactitude et la conformité des données fournies. Le CEPMB ne vérifie pas systématiquement l’information qui lui est présentée sur le Formulaire 3, mais cherche plutôt les anomalies et les contradictions et, lorsqu’il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour garantir la juste interprétation des données de la part du personnel du CEPMB, chaque breveté est invité à vérifier et à confirmer, avant la publication du ratio, l’exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes.
Défaut de soumettre son rapport sur ses dépenses de R-D
Les brevetés sont tenus de soumettre un Formulaire 3 complet et exact dans les délais mentionnés dans le Règlement. Si un breveté omet de respecter les exigences en matière de présentation de rapport, le Conseil peut rendre une ordonnance exigeant le respect de ces exigences. Le Conseil n’a pas été appelé à rendre des ordonnances pour la période de déclaration de 2014.
Couverture
Notons que les sociétés pharmaceutiques qui n’ont fait aucune vente de médicaments brevetés ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D au CEPMB. Cela a deux conséquences.
D’abord, les résultats statistiques indiqués ici ne devraient pas être utilisés afin de couvrir toute la recherche pharmaceutique réalisée au Canada. Par exemple, une société peut vendre uniquement des produits médicamenteux non brevetés, mais effectuer quand même beaucoup de recherche au Canada. De même, une société peut effectuer de la recherche et ne vendre aucun produitNote de bas de page 22. Les résultats présentés ci-dessous ne tiendront pas compte des dépenses de R-D des entreprises dans l’une ou l’autre de ces situations.
Ensuite, comme de nouveaux produits médicamenteux brevetés sont entrés dans le marché canadien et que des brevets existants expirent, le nombre et l’identité des sociétés pharmaceutiques ayant soumis un rapport sur leurs activités de R-D peuvent varier d’année en année. Au total, 75 sociétés ont déclaré leurs activités de R-D en 2014. Parmi celles-ci, 35 étaient membres des Compagnies de recherche pharmaceutique du Canada (Rx&D).
Définition de recettes tirées des ventes
Aux fins du présent rapport, les recettes tirées des ventes s’entendent du produit brut total des ventes au Canada de tous les produits médicamenteux ainsi que des recettes découlant d’ententes de vente sous licence (p. ex. redevances et droits versés au breveté liés aux ventes effectuées au Canada par des titulaires de licence).
Définition de dépenses de R-D
En vertu de l’article 6 du Règlement, les brevetés doivent inclure dans leurs rapports leurs dépenses de R-D qui auraient été admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental (RS-DE) aux termes de la Loi de l’impôt sur le revenu, dans sa version qui est entrée en vigueur le 1er décembre 1987Note de bas de page 23. Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d’immobilisation et l’amortissement autorisé. Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données de routine n’étant pas admissibles au crédit d’impôt à l’investissement, ils ne doivent pas figurer dans les dépenses de R-D déclarées par les brevetés.
Recettes tirées des ventes et dépenses de R-D totales
Le tableau 16 donne un aperçu des recettes tirées des ventes et des dépenses de R-D déclarées au cours de la période de 1988 à 2014.
La valeur des recettes totales déclarées par les brevetés a totalisé 16,8 milliards de dollars en 2014, ce qui représente une augmentation de 0,1 % par rapport à 2013. Les recettes tirées des ventes déclarées par les brevetés membres de Rx&D ont totalisé 13,2 milliards de dollars, soit 78,7 % de l’ensemble des recettes. (De ce montant, moins de 1 % des recettes découlent d’ententes de vente sous licence.)
Les dépenses de R-D déclarées par les brevetés ont totalisé 739,2 millions de dollars en 2014, ce qui représente un recul de 1,8 % par rapport à 2013. Les dépenses de R-D déclarées par les brevetés membres de Rx&D ont totalisé 658,7 millions de dollars en 2014, soit une hausse 1,0 % par rapport à l’année précédente. Les brevetés membres de Rx&D ont effectué 89,1 % de toutes les dépenses de R-D déclarées pour 2014.
Ratios des dépenses de R-D par rapport aux recettes tirées des ventes
Le tableau 16 et la figure 20 présentent également les ratios des dépenses de R-D par rapport aux recettes tirées des ventes. Il convient de noter que, dans ce contexte, en contrepartie de l’adoption des modifications apportées à la Loi en 1987, Rx&D s’était engagé publiquement à augmenter ses dépenses annuelles de R-D pour qu’elles totalisent en 1996 10 % des recettes tirées des ventesNote de bas de page 24. Ce niveau de dépenses de R-D a été atteint en 1993, le taux ayant même dépassé 10 % certaines années. Toutefois, depuis 2003, le ratio des dépenses de R-D par rapport aux recettes tirées des ventes de tous les brevetés et des membres de Rx&D a diminué.
Figure 20. Ratio des dépenses de R-D par rapport aux recettes tirées des ventes chez les brevetés de produits pharmaceutiques, 1988-2014
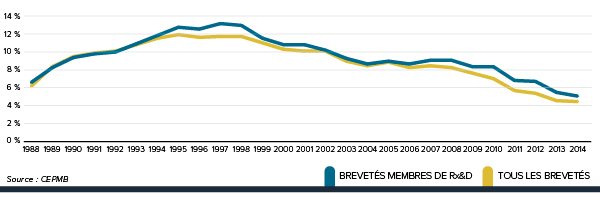
Description de la figure
Il s’agit d’un diagramme linéaire comparant le ratio des dépenses de R-D par rapport aux recettes tirées des ventes parmi tous les brevetés et les brevetés membres de Rx&D, compte tenu des données recueillies entre 1998 et 2014.
Brevetés membres de Rx&D : 1988, 6,5; 1989, 8,1; 1990, 9,2; 1991, 9,6; 1992, 9,8; 1993, 10,7; 1994, 11,6; 1995, 12,5; 1996, 12,3; 1997, 12,9; 1998, 12,7; 1999, 11,3; 2000, 10,6; 2001, 10,6; 2002, 10; 2003, 9,1; 2004, 8,5; 2005, 8,8; 2006, 8,5; 2007, 8,9; 2008, 8,9; 2009, 8,2; 2010, 8,2; 2011, 6,7; 2012, 6,6; 2013, 5,4; 2014, 5.
Tous les brevetés : 1988, 6,1; 1989, 8,2; 1990, 9,3; 1991, 9,7; 1992, 9,9; 1993, 10,6; 1994, 11,3; 1995, 11,7; 1996, 11,4; 1997, 11,5; 1998, 11,5; 1999, 10,8; 2000, 10,1; 2001, 9,9; 2002, 9,9; 2003, 8,8; 2004, 8,3; 2005, 8,7; 2006, 8,1; 2007, 8,3; 2008, 8,1; 2009, 7,5; 2010, 6,9; 2011, 5,6; 2012, 5,3; 2013, 4,5; 2014, 4,4.
Le ratio de 2014 des dépenses de R-D par rapport aux recettes tirées des ventes parmi les brevetés était de 4,4 %, un recul par rapport au ratio de 4,5 % en 2013. Ces valeurs sont inférieures aux données observées en 1988. Le ratio global des dépenses de R-D par rapport aux recettes tirées des ventes a été inférieur à 10 % pendant les 14 dernières années consécutives.
Le ratio correspondant des dépenses de R-D par rapport aux recettes tirées des ventes des brevetés membres de Rx&D était de 5,0 % en 2014, un recul par rapport au ratio de 5,4 % en 2013Note de bas de page 25. Ces valeurs se situent également près des données observées en 1988. Le ratio des brevetés membres de Rx&D a été inférieur à 10 % pendant les 12 dernières années consécutives.
Le tableau 21 à l’Annexe 3 présente en détail la fourchette des ratios des dépenses de R-D par rapport aux recettes tirées des ventes de 2014. Des 75 sociétés ayant présenté des rapports en 2014, 89,3 % ont présenté un ratio de R-D par rapport aux recettes tirées des ventes de moins de 10 %.
Tableau 16. Dépenses totales de R-D et ratios des dépenses de R-D par rapport aux recettes tirées des ventes des sociétés faisant rapport, 1988-2014
| Année |
Tous les brevetés |
Rx&D |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes : Tous les brevetés (%) |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes : Brevetés membres de Rx&D (%) |
| Nbre de brevetés |
Dépenses de R-D de tous les brevetés (millions $) |
Variation par rapport à l’année précédente (%) |
Recettes tirées des ventes (millions $) |
Variation par rapport à l’année précédente (%) |
Dépenses de R-D de tous les brevetés membres de Rx&D (millions $) |
Variation par rapport à l’année précédente (%) |
Recettes tirées des ventes des brevetés membres de Rx&D (millions $) |
Variation par rapport à l’année précédente (%) |
| Source : CEPMB |
| 2014 |
75 |
739,2 |
-1,8 |
16 842,2 |
0,1 |
658,7 |
1,0 |
13 248,2 |
8,9 |
4,4 |
5,0 |
| 2013 |
81 |
752,8 |
-15,9 |
16 817,9 |
0,4 |
652,0 |
-16,7 |
12 167,6 |
2,3 |
4,5 |
5,4 |
| 2012 |
85 |
894,8 |
-9,8 |
16 754,4 |
-5,8 |
782,8 |
-13,1 |
11 896,1 |
-11,5 |
5,3 |
6,6 |
| 2011 |
79 |
991,7 |
-15,8 |
17 798,8 |
4,7 |
901,2 |
-9,9 |
13 446,1 |
10,7 |
5,6 |
6,7 |
| 2010 |
82 |
1 178,2 |
-7,4 |
17 000,0 |
-0,3 |
1 000,2 |
-11,7 |
12 149,0 |
-11,8 |
6,9 |
8,2 |
| 2009 |
81 |
1 272,0 |
-2,9 |
17 051,9 |
4,5 |
1 132,9 |
-3,4 |
13 780,0 |
4,6 |
7,5 |
8,2 |
| 2008 |
82 |
1 310,7 |
-1,1 |
16 316,7 |
2,0 |
1 172,2 |
-1,0 |
13 178,2 |
-1,4 |
8,1 |
8,9 |
| 2007 |
82 |
1 325,0 |
9,5 |
15 991,0 |
7,3 |
1 184,4 |
24,8 |
13 359,8 |
20,0 |
8,3 |
8,9 |
| 2006 |
72 |
1 210,0 |
-1,9 |
14 902,0 |
4,7 |
949,0 |
-8,8 |
11 131,2 |
-5,8 |
8,1 |
8,5 |
| 2005 |
80 |
1 234,3 |
5,5 |
14 231,3 |
0,5 |
1 040,1 |
3,9 |
11 821,4 |
0,0 |
8,7 |
8,8 |
| 2004 |
84 |
1 170,0 |
-2,0 |
14 168,3 |
4,0 |
1 000,8 |
0,8 |
11 819,0 |
8,8 |
8,3 |
8,5 |
| 2003 |
83 |
1 194,3 |
-0,4 |
13 631,1 |
12,8 |
992,9 |
-3,6 |
10 865,7 |
5,2 |
8,8 |
9,1 |
| 2002 |
79 |
1 198,7 |
13,0 |
12 081,2 |
12,5 |
1 029,6 |
10,1 |
10 323,8 |
16,8 |
9,9 |
10,0 |
| 2001 |
74 |
1 060,1 |
12,6 |
10 732,1 |
15,3 |
935,2 |
14,7 |
8 835,4 |
14,3 |
9,9 |
10,6 |
| 2000 |
79 |
941,8 |
5,3 |
9 309,6 |
12,0 |
815,5 |
4,0 |
7 728,8 |
11,6 |
10,1 |
10,6 |
| 1999 |
78 |
894,6 |
12,0 |
8 315,5 |
19,2 |
784,3 |
9,9 |
6 923,4 |
22,8 |
10,8 |
11,3 |
| 1998 |
74 |
798,9 |
10,2 |
6 975,2 |
10,9 |
713,7 |
8,6 |
5 640,2 |
10,6 |
11,5 |
12,7 |
| 1997 |
75 |
725,1 |
9,0 |
6 288,4 |
7,4 |
657,4 |
10,3 |
5 098,2 |
4,9 |
11,5 |
12,9 |
| 1996 |
72 |
665,3 |
6,4 |
5 857,4 |
9,9 |
595,8 |
6,5 |
4 859,5 |
8,7 |
11,4 |
12,3 |
| 1995 |
71 |
625,5 |
11,5 |
5 330,2 |
7,5 |
559,5 |
9,8 |
4 468,8 |
1,4 |
11,7 |
12,5 |
| 1994 |
73 |
561,1 |
11,4 |
4 957,4 |
4,4 |
509,5 |
10,4 |
4 407,2 |
2,0 |
11,3 |
11,6 |
| 1993 |
70 |
503,5 |
22,1 |
4 747,6 |
14,0 |
461,4 |
24,0 |
4 321,4 |
14,4 |
10,6 |
10,7 |
| 1992 |
71 |
412,4 |
9,6 |
4 164,4 |
6,9 |
372,1 |
9,0 |
3 778,4 |
6,5 |
9,9 |
9,8 |
| 1991 |
65 |
376,4 |
23,2 |
3 894,8 |
18,1 |
341,4 |
24,7 |
3 546,9 |
19,5 |
9,7 |
9,6 |
| 1990 |
65 |
305,5 |
24,8 |
3 298,8 |
11,0 |
273,8 |
25,8 |
2 967,9 |
10,5 |
9,3 |
9,2 |
| 1989 |
66 |
244,8 |
47,4 |
2 973,0 |
9,4 |
217,6 |
34,7 |
2 685,5 |
7,3 |
8,2 |
8,1 |
| 1988 |
66 |
165,7 |
— |
2 718,0 |
— |
161,5 |
— |
2 502,3 |
— |
6,1 |
6,5 |
Dépenses courantes selon le type de recherche
Le tableau 17 et la figure 21 (ainsi que la figure 23 à l’Annexe 3) présentent des données sur la ventilation des dépensesNote de bas de page 26 courantes de R-D engagées en 2014 selon le type de recherche, à savoir la recherche fondamentale, la recherche appliquée et autres types de R-D admissiblesNote de bas de page 27. Pour 2014, les brevetés ont fait état de dépenses de recherche fondamentale totalisant 81,8 millions de dollars ou 11,5 % du total des dépenses courantes de R-D, soit une hausse de 21,0 % par rapport à l’année antérieure. Les brevetés ont déclaré des dépenses de recherche appliquée totalisant 456,1 millions de dollars, ou, encore, 63,9 % des dépenses courantes de R-D. Les essais cliniques ont accaparé 69,7 % des dépenses de recherche appliquée.
Tableau 17. Dépenses courantes de R-D selon le type de recherche, 2014 et 2013
| Type de recherche |
Dépenses en 2014
(en M$) |
Part en 2014
(en %) |
Dépenses en 2013
(en M$) |
Part en 2013
(en %) |
Variation annuelle des dépenses
(en %)
|
| Recherche fondamentale |
81,8 |
11,5 |
67,6 |
9,3 |
21,0 |
| Chimique |
52,6 |
7,4 |
39,2 |
5,4 |
34,2 |
| Biologique |
29,2 |
4,1 |
28,4 |
3,9 |
2,8 |
| Recherche appliquée |
456,1 |
63,9 |
487,8 |
66,9 |
-6,5 |
| Processus de fabrication |
51,4 |
7,2 |
70,5 |
9,7 |
-27,1 |
| Essais précliniques I |
48,9 |
6,8 |
40,0 |
5,5 |
22,3 |
| Essais précliniques II |
38,0 |
5,3 |
42,9 |
5,9 |
-11,4 |
| Essais cliniques de phase I |
25,4 |
3,6 |
35,8 |
4,9 |
-29,1 |
| Essais cliniques de phase II |
61,2 |
8,6 |
70,1 |
9,6 |
-12,7 |
| Essais cliniques de phase III |
231,2 |
32,4 |
228,5 |
31,3 |
1,2 |
| Autre R-D admissible |
176,1 |
24,7 |
173,9 |
23,8 |
1,3 |
| Total |
714,0 |
100,0* |
729,3 |
100,0* |
-2,1 |
* Il se peut que les valeurs dans cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Figure 21. Dépenses courantes de R-D (%) selon le type de recherche, 1988-2014
Description de la figure
Il s’agit d’un diagramme à colonnes empilées présentant les dépenses courantes de R-D par type de recherche, selon les données recueillies de 1998 à 2014. En 1998, la recherche fondamentale comptait pour 19,1 % des dépenses de R-D, la recherche appliquée, pour 67,2 %, et les travaux regroupés dans la catégorie autre R-D admissible, pour 13,7 %.
- 1989 : fondamentale 23,4, appliquée 62,7, autre R-D admissible 13,9;
- 1990 : fondamentale 27,2, appliquée 58,0 autre R-D admissible 14,8;
- 1991 : fondamentale 26,5, appliquée 57,3, autre R-D admissible 16,2;
- 1992 : fondamentale 26,4, appliquée 57,1, autre R-D admissible 16,5;
- 1993 : fondamentale 25,3, appliquée 60,3, autre R-D admissible 14,4;
- 1994 : fondamentale 21,9, appliquée 62,7, autre R-D admissible 15,4;
- 1995 : fondamentale 22,1, appliquée 61,8, autre R-D admissible 16,1;
- 1996 : fondamentale 21,7, appliquée 62,9, autre R-D admissible 15,4;
- 1997 : fondamentale 20,7, appliquée 62,0 autre R-D admissible 17,3;
- 1998 : fondamentale 19,6, appliquée 61,1, autre R-D admissible 19,4;
- 1999 : fondamentale 18,4, appliquée 63,3, autre R-D admissible 18,3;
- 2000 : fondamentale 17,8, appliquée 61,3, autre R-D admissible 20,9;
- 2001 : fondamentale 16,1, appliquée 59,9, autre R-D admissible 24,0;
- 2002 : fondamentale 17,4, appliquée 55,8, autre R-D admissible 26,6;
- 2003 : fondamentale 15,8, appliquée 55,2, autre R-D admissible 29,1;
- 2004 : fondamentale 19,7, appliquée 58,3, autre R-D admissible 21,7;
- 2005 : fondamentale 18,2, appliquée 62,4, autre R-D admissible 19,5;
- 2006 : fondamentale 20,0, appliquée 59,5, autre R-D admissible 20,5;
- 2007 : fondamentale 20,3, appliquée 54,4, autre R-D admissible 25,6;
- 2008 : fondamentale 15,9, appliquée 57,3, autre R-D admissible 26,8;
- 2009 : fondamentale 19,4, appliquée 56,2, autre R-D admissible 24,3;
- 2010 : fondamentale 21,1, appliquée 54,8, autre R-D admissible 24,2;
- 2011 : fondamentale 17,3, appliquée 55,0, autre R-D admissible 27,8;
- 2012 : fondamentale 13,2, appliquée 60,2, autre R-D admissible 26,6;
- 2013 : fondamentale 9,3, appliquée 66,9, autre R-D admissible 23,8;
- 2014 : fondamentale 11,5, appliquée 63,9, autre R-D admissible 24,7
Dépenses courantes de R-D selon le milieu de recherche
Les brevetés peuvent inclure dans leurs dépenses de R-D la recherche qu’ils effectuent eux-mêmes à l’interne ainsi que la recherche qu’ils font faire à l’externe, notamment par des universités, des hôpitaux et d’autres fabricants. Le tableau 18 révèle que, en 2014, 48,9 % des dépenses courantes de recherche ont été effectuées à l’interne. La proportion de la R-D effectuée par d’autres sociétés pour le compte des brevetés a représenté 25,0 % de l’ensemble des dépenses courantes. Quant à la recherche effectuée par les universités et par les hôpitaux, sa valeur a représenté 15,0 % des dépenses courantes.
Tableau 18. Dépenses courantes de R-D selon le milieu de recherche, 2014 et 2013
| Milieu de recherche |
Dépenses en 2014 (en M$) |
Part en 2014 (en %) |
Dépenses en 2013 (en M$) |
Part en 2013 (en %) |
Variation annuelle des dépenses (en %) |
* Il se peut que les valeurs dans cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB |
| À l’interne |
| Brevetés |
349,5 |
48,9 |
364,9 |
50,0 |
-4,2 |
| À l’externe |
| Universités et hôpitaux |
107,1 |
15,0 |
94,7 |
13,0 |
13,0 |
| Autres sociétés |
178,2 |
25,0 |
187,4 |
25,7 |
-3,8 |
| Autres |
79,2 |
11,1 |
82,3 |
11,3 |
-4,9 |
| Total |
714,0 |
100,0* |
729,3 |
100,0* |
-2,1 |
Dépenses courantes De R-D selon la provenance des fonds
Le tableau 19 présente des renseignements sur la prov- enance des fonds que les brevetés ont investis pour financer leurs activités de R-D. En 2014, les brevetés ont financé à même leurs propres fonds la majeure partie de leur R-D (87,9 % des dépenses courantes). Les fonds provenant du gouvernement ont servi à financer 1,3 % des dépenses courantes.
Tableau 19. Ensemble des dépenses de R-D selon la provenance des fonds, 2014 et 2013
| Provenance des fonds |
Dépenses en 2014 (en M$) |
Part en 2014 (en %) |
Dépenses en 2013 (en m$) |
Part en 2013 (en %) |
Variation annuelle des dépenses (en %) |
| Brevetés |
649,8 |
87,9 |
660,5 |
87,7 |
-1,6 |
| Gouvernements fédéral et provinciaux |
9,8 |
1,3 |
10,8 |
1,4 |
-9,1 |
| Autres |
79,6 |
10,8 |
81,5 |
10,8 |
-2,4 |
| Total |
739,2 |
100,0* |
752,8 |
100,0* |
-1,8 |
* Il se peut que les valeurs dans cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Dépenses courantes de R-D selon la région géographique
Le tableau 20 (ainsi que le tableau 23 et le tableau 24 de l’Annexe 3) ventile les dépenses courantes de R-D selon la région géographique dans laquelle elles ont été engagées. Cette année encore, les dépenses ont été surtout engagées en Ontario et au Québec, qui ont accaparé 81,2 % de la valeur totale des dépenses courantes de R-D. La valeur des dépenses courantes de R-D a augmenté d’un taux annuel de 21,5 % dans l’Ouest du pays, mais elle n’a augmenté que de 6,7 % en Ontario et a diminué de 19,1 % au Québec.
Tableau 20. Dépenses courantes de R-D selon la région géographique, 2014 et 2013
| Région |
Dépenses en 2014 (en M$) |
Part en 2014 (en %) |
Dépenses en 2013 (en M$) |
Part en 2013 (en %) |
Variation annuelle des dépenses (en %) |
| Provinces de l’Atlantique |
18.6 |
2.6 |
20.1 |
2.8 |
-7.7 |
| Québec |
236.2 |
33.1 |
292.0 |
40.0 |
-19.1 |
| Ontario |
343.6 |
48.1 |
322.0 |
44.1 |
6.7 |
| Provinces de l’Ouest |
115.7 |
16.2 |
95.2 |
13.1 |
21.5 |
| Territoires |
0.0 |
0.0 |
0.0 |
0.0 |
0.0 |
| Total |
714.0 |
100.0* |
729.3 |
100.0* |
-2.1 |
* Il se peut que les valeurs dans cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Contexte mondial
La figure 22 compare pour les années 2000 et 2012 les ratios des dépenses de R-D pharmaceutiques par rapport aux recettes tirées des ventes du Canada aux mêmes ratios des sept pays de comparaison du CEPMBNote de bas de page 28. Le ratio du Canada était de 10,1 % en 2000. Cette année-là, seule l’Italie présentait un ratio plus bas (6,2 %), tandis que la Suisse présentait le ratio le plus élevé (102,5 %).
En 2012, le Canada présentait le ratio le moins élevé (5,3 %) suivi de l’Italie (6,1 %). Le ratio de tous les autres pays de comparaison est demeuré bien supérieur à celui du Canada. Le ratio obtenu avec l’ensemble des dépenses de R-D et des ventes de tous les pays de comparaison était de 21,8 %, soit trois fois et demie celui du Canada.
Figure 22. Ratios des dépenses de R-D par rapport aux recettes tirées des ventes, au Canada et dans les pays de comparaison
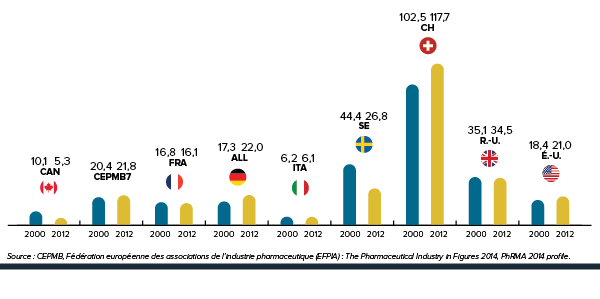
Description de la figure
Il s’agit d’un diagramme à barres présentant les ratios des dépenses de R-D par rapport aux recettes tirées des ventes, au Canada et dans les pays de comparaison, en 2000 et en 2012.
2000 : Canada, 10,1; tous les pays de comparaison, 20,4; France, 16,8; Allemagne, 17,3; Italie, 6,2; Suède, 44,4; Suisse, 102,5; Royaume-Uni, 35,1; États-Unis, 18,4
2012 : Canada, 5,3; tous les pays de comparaison, 21,8; France, 16,1; Allemagne, 22,0; Italie, 6,1; Suède, 26,8; Suisse, 117,7; Royaume-Uni, 34,5; États-Unis, 21,0
On peut comparer les ratios des dépenses de R-D par rapport aux recettes tirées des ventes présentés à la figure 22 avec les ratios des prix moyens bilatéraux mentionnés au tableau 11 (voir la section « Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger »). Plusieurs pays de comparaison, dont les prix des produits médicamenteux brevetés sont, en moyenne, beaucoup moins élevés qu’au Canada, ont obtenu des ratios des dépenses de R-D par rapport aux recettes tirées des ventes bien supérieurs à ceux au Canada.
Tel que mentionné dans le rapport de l’an dernier, la région géographique où se produit la R-D pharmaceutique dépend de plusieurs facteurs. Parmi les facteurs dont tiennent compte les entreprises, mentionnons notamment la présence, la qualité et la rentabilité des meilleures institutions scientifiques et l’accès aisé à une infrastructure de haute qualité pour les essais cliniques. Bien qu’on cite souvent les niveaux de prix comme importants leviers politiques pour attirer la R-D, les données n’appuient pas une telle corrélation au niveau national ou international.
Annexe 1: Glossaire
Pour de plus amples explications et définitions, veuillez consulter la Loi sur les brevets, le Règlement sur les médicaments brevetés, le Compendium des politiques, des Lignes directrices et des procédures du CEPMB et le Règlement sur les aliments et drogues ou, encore, communiquer avec le CEPMB.
ATC :
Système de classification anatomique, thérapeutique, chimique (ATC) conçu et tenu à jour par le Centre collaborateur de l’OMS pour la méthodologie sur l’établissement des statistiques concernant les produits médicamenteux de l’Organisation mondiale de la Santé (OMS). Ce système distingue les médicaments selon leur site d’action et leurs caractéristiques thérapeutiques et chimiques. Le CEPMB utilise ce système pour sélectionner les médicaments qui seront utilisés dans les comparaisons des prix.
Avis de conformité :
Avis donné en vertu de l’article C.08.004.01 ou C.08.004.01 du Règlement sur les aliments et drogues. Cet avis confirme que le produit médicamenteux respecte les normes prescrites par Santé Canada pour une administration à des humains ou à des animaux, selon le cas, et que sa vente est autorisée au Canada.
Brevet :
Instrument émis par le Commissaire aux brevets sous forme de lettres patentes. Le brevet confère à son titulaire un monopole d’une durée limitée pour les allégations formulées. Le brevet confère également à son titulaire et à ses représentants légaux le droit exclusif de fabriquer, de construire, d’exploiter ou de vendre son invention.
Brevet en instance :
Demande pour un brevet qui n’a pas encore été attribué.
Breveté :
Aux termes du paragraphe 79(1) de la Loi sur les brevets, le mot « breveté » désigne « la personne ayant droit aux retombées d’un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d’un brevet pour une telle invention ou qui exerce ou a exercé les droits d’un titulaire dans un cadre autre qu’une licence prorogée en vertu du paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets ».
Certificat de décision préalable :
Certificat non contraignant délivré à la demande du breveté en vertu du paragraphe 98(4) de la Loi sur les brevets lorsque le Conseil estime que le prix pratiqué ou proposé du produit médicamenteux ne dépasse pas le prix maximal non excessif qu’autorisent ses Lignes directrices.
Cession de brevet :
Avis donné par le breveté au Commissaire aux brevets l’informant qu’il renonce irrévocablement à ses droits de propriété à l’égard du brevet en cause et qu’il les cède au domaine public. Note : Depuis le 30 janvier 1995, le Conseil ne reconnaît pas la cession d’un brevet lorsque le breveté utilise cette mesure pour se soustraire à sa compétence en matière d’examen du prix.
Défaut de présenter ses rapports :
Défaut complet d’un breveté de déclarer un produit médicamenteux breveté vendu conformément aux exigences réglementaires en matière de présentation de rapport prévues à la Loi sur les brevets et au Règlement sur les médicaments brevetés.
Défaut de soumettre ses rapports :
Défaut partiel ou complet d’un breveté de respecter les exigences réglementaires en matière de soumission de rapport prévues à la Loi sur les brevets et au Règlement sur les médicaments brevetés.
Dépenses courantes de recherche-développement :
Désignent les dépenses autres qu’en capital directement liées à la recherche, dont : (a) salaires; (b) matériel direct; (c) entrepreneurs et sous-traitants; (d) autres coûts directs tels que les frais généraux de production; (e) paiements aux institutions désignées; (f) paiements aux organismes subventionnaires; (g) paiements aux autres organismes. Ces éléments sont décrits plus amplement dans le Formulaire 3 présenté dans le Guide du breveté qui se trouve dans le site Web du CEPMB sous « Rapports réglementaires ».
Dépenses de recherche-développement :
Aux termes du Règlement sur les médicaments brevetés, et plus particulièrement de ses articles 5 et 6, la recherche-développement s’entend des activités qui auraient été considérées admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental en vertu de la Loi de l’impôt sur le revenu dans sa version du 1er décembre 1987.
Engagement de conformité volontaire :
Engagement écrit pris par le breveté de rajuster le prix de son produit médicamenteux pour le rendre conforme aux Lignes directrices du Conseil. La présidente du Conseil peut, en lieu d’un avis d’audience, accepter un engagement de conformité volontaire si celui-ci sert les meilleurs intérêts du grand public. La politique du Conseil sur la conformité et l’application autorise le breveté à soumettre un engagement de conformité volontaire même si un avis d’audience a été émis. Toutefois, l’engagement soumis à ce point doit être approuvé par le panel d’audience. Le Conseil publie tous les engagements acceptés par la présidente ou le Conseil.
Indice des prix des médicaments brevetés (IPMB) :
Indice établi par le CEPMB pour mesurer la variation annuelle des prix de transaction des médicaments brevetés vendus au Canada. Cet indice est établi à partir des données sur les prix et sur les ventes déclarées par les brevetés.
Licence volontaire :
Engagement contractuel entre un breveté et un titulaire de licence permettant à ce dernier de bénéficier des retombées d’un brevet ou d’exercer des droits à l’égard de celui-ci moyennant une contrepartie financière (comme des redevances sous forme de pourcentage des recettes tirées des ventes).
Médicament :
Toute substance ou tout mélange de substances produites biologiquement, chimiquement ou autrement qui est appliqué ou administré in vivo pour faciliter le diagnostic, le traitement, l’atténuation ou la prévention d’une maladie, de symptômes, de troubles ou d’états physiques anormaux ou, encore, pour modifier des fonctions organiques chez les humains ou chez les animaux. Cette définition comprend les vaccins, les préparations topiques, les anesthésiques et les produits de diagnostic in vivo quel que soit le mode d’administration (p. ex. préparations transdermiques, gélules, solutions injectables, solutions pour inhalation, etc.). Cette définition exclut les appareils médicaux, les produits de diagnostic in vitro et les désinfectants qui ne sont pas utilisés in vivo.
Numéro d’identification du médicament (DIN) :
Numéro d’identification que la Direction générale des produits de santé et des aliments de Santé Canada attribue à chaque produit médicamenteux vendu sous ordonnance ou en vente libre et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN est assigné en tenant compte des éléments suivants : le fabricant du produit, le ou les ingrédients actifs, la concentration du ou des ingrédients actifs, la forme posologique, le nom de marque du produit et son mode d’administration.
Produit générique :
Produit médicamenteux contenant le même ingrédient actif, la même concentration et la même forme posologique que son équivalent de marque.
Produit médicamenteux :
Présentation d’un médicament qui se distingue par sa forme pharmaceutique et la concentration de son ingrédient actif.
Programme d’accès spécial :
Programme en vertu duquel Santé Canada permet à des praticiens d’avoir accès à des produits médicamenteux n’ayant pas encore été approuvés ou qui ne seraient autrement pas disponibles sur le marché canadien.
Recherche et développement (R-D) :
Recherche fondamentale ou appliquée visant à créer de nouveaux matériaux, dispositifs, produits ou procédés ou à améliorer ceux qui existent (p. ex. procédés de fabrication).
Recherche et développement — autre R-D Admissible :
Comprend les dépenses de recherche-développement admissibles qui ne correspondent à aucune des catégories de R-D susmentionnées. Elle comprend les présentations sur la réglementation des produits médicamenteux, les études de biodisponibilité ainsi que les essais cliniques de phase IV.
Recherche et développement — recherche appliquée :
Activité de recherche et développement entreprise avec une application pratique précise en vue, notamment la recherche visant à améliorer les procédés de fabrication ainsi que les études précliniques et cliniques.
Substance active :
Substance chimique ou biologique responsable de l’effet pharmacologique d’un produit médicamenteux.
Annexe 2 : Produits médicamenteux brevetés ayant fait l’objet d’un premier rapport au CEPMB en 2014
blank
|
Marque de commerce |
Société |
DIN |
Statut |
Niveau d’amélioration thérapeutique/catégorie* |
| 1 |
CREON MINIMICROSPHÈRES –
6 000 unités/capsule |
Abbott Laboratories Limited |
02415194 |
Conforme aux Lignes directrices |
MN |
| 2 |
CONSTELLA - 145 mcg/capsule |
Actavis Specialty Pharmaceuticals Co. |
02417162 |
Conforme aux Lignes directrices |
MN |
| 3 |
CONSTELLA - 290 mcg/capsule |
Actavis Specialty Pharmaceuticals Co. |
02417170 |
Sous examen |
blank |
| 4 |
FIBRISTAL – 5 mg/comprimé |
Actavis Specialty Pharmaceuticals Co. |
02408163 |
Sous examen |
blank |
| 5 |
LOLO 1/0,1 |
Actavis Specialty Pharmaceuticals Co. |
02417456 |
Conforme aux Lignes directrices |
MN |
| 6 |
CARIPUL – 0,5 mg/fiole |
Actelion Pharmaceuticals Canada Inc. |
02397447 |
Sous examen |
blank |
| 7 |
CARIPUL – 1,5 mg/fiole |
Actelion Pharmaceuticals Canada Inc. |
02397455 |
Sous examen |
blank |
| 8 |
OPSUMIT – 10 mg/comprimé |
Actelion Pharmaceuticals Canada Inc. |
02415690 |
Conforme aux Lignes directrices |
MN |
| 9 |
XIAFLEX – 0,9 mg/fiole |
Actelion Pharmaceuticals Canada Inc. |
02388316 |
Conforme aux Lignes directrices |
D |
| 10 |
JUXTAPID – 5 mg/capsule |
Aegerion Pharmaceuticals (Canada) Ltd. |
02420341 |
Conforme aux Lignes directrices |
AM-P |
| 11 |
JUXTAPID - 10 mg/capsule |
Aegerion Pharmaceuticals (Canada) Ltd. |
02420376 |
Conforme aux Lignes directrices |
AM-P |
| 12 |
JUXTAPID - 20 mg/capsule |
Aegerion Pharmaceuticals (Canada) Ltd. |
02420384 |
Conforme aux Lignes directrices |
AM-P |
| 13 |
ILEVRO - 3 mg/mL |
Alcon Canada Inc. |
02411393 |
Conforme aux Lignes directrices |
MN |
| 14 |
FLUMIST QUADRIVALENT – 0,2 unité/dose |
AstraZeneca Canada Inc. |
02426544 |
Sous examen |
blank |
| 15 |
EYLEA - 40 mg/mL |
Bayer Inc. |
02415992 |
Conforme aux Lignes directrices |
AM-S |
| 16 |
XOFIGO - 1000 kBq/mL |
Bayer Inc. |
blank |
Sous examen |
blank |
| 17 |
TECFIDERA - 240 mg/capsule |
Biogen Idec Canada Inc. |
02420201 |
Sous enquête |
MN |
| 18 |
GIOTRIF – 20 mg/comprimé |
Boehringer Ingelheim (Canada) Ltd. |
02415666 |
Conforme aux Lignes directrices |
MN |
| 19 |
GIOTRIF – 30 mg/comprimé |
Boehringer Ingelheim (Canada) Ltd. |
02415674 |
Conforme aux Lignes directrices |
MN |
| 20 |
GIOTRIF – 40 mg/comprimé |
Boehringer Ingelheim (Canada) Ltd. |
02415682 |
Conforme aux Lignes directrices |
MN |
| 21 |
ISTODAX – 10 mg/fiole |
Celgene Inc. |
02414295 |
Conforme aux Lignes directrices |
MN |
| 22 |
POMALYST - 1 mg/capsule |
Celgene Inc. |
02419580 |
Conforme aux Lignes directrices |
AI |
| 23 |
POMALYST - 2 mg/capsule |
Celgene Inc. |
02419599 |
Conforme aux Lignes directrices |
AI |
| 24 |
POMALYST - 3 mg/capsule |
Celgene Inc. |
02419602 |
Conforme aux Lignes directrices |
AI |
| 25 |
POMALYST - 4 mg/capsule |
Celgene Inc. |
02419610 |
Conforme aux Lignes directrices |
AI |
| 26 |
NOCDURNA – 50 mcg/comprimé |
Ferring Pharmaceuticals Inc. |
02431076 |
Conforme aux Lignes directrices |
MN |
| 27 |
ONRELTEA – 5 mg/gramme |
Galderma Canada Inc. |
02421208 |
Sous enquête |
MN |
| 28 |
GD-AZITHROMYCIN - 20 mg/mL |
GenMed |
02274566 |
Conforme aux Lignes directrices |
MN |
| 29 |
GD-AZITHROMYCIN - 40 mg/mL |
GenMed |
02274574 |
Conforme aux Lignes directrices |
MN |
| 30 |
GD-CELECOXIB - 100 mg/capsule |
GenMed |
02291975 |
Conforme aux Lignes directrices |
MN |
| 31 |
GD-CELECOXIB - 200 mg/capsule |
GenMed |
02291983 |
Conforme aux Lignes directrices |
MN |
| 32 |
GD-QUINAPRIL – 5 mg/comprimé |
GenMed |
02290987 |
Conforme aux Lignes directrices |
MN |
| 33 |
GD-QUINAPRIL – 10 mg/comprimé |
GenMed |
02290995 |
Conforme aux Lignes directrices |
MN |
| 34 |
GD-QUINAPRIL – 20 mg/comprimé |
GenMed |
02291002 |
Conforme aux Lignes directrices |
MN |
| 35 |
GD-QUINAPRIL – 40 mg/comprimé |
GenMed |
02291010 |
Conforme aux Lignes directrices |
MN |
| 36 |
HARVONI 90/400 |
Gilead Sciences Inc. |
02432226 |
Conforme aux Lignes directrices |
MN |
| 37 |
SOVALDI – 400 mg/comprimé |
Gilead Sciences Inc. |
02418355 |
Conforme aux Lignes directrices |
AI |
| 38 |
ANORO ELLIPTA 62,5/25 |
GlaxoSmithKline Inc. |
02418401 |
Conforme aux Lignes directrices |
MN |
| 39 |
ROTARIX |
GlaxoSmithKline Inc. |
02300591 |
Conforme aux Lignes directrices |
3 |
| 40 |
ACTEMRA – 162 mg/seringue |
Hoffmann-La Roche Limited, Canada |
02424770 |
Conforme aux Lignes directrices |
AM-S |
| 41 |
GAZYVA - 25 mg/mL |
Hoffmann-La Roche Limited, Canada |
02434806 |
Sous examen |
blank |
| 42 |
IMBRUVICA - 140 mg/capsule |
Janssen Inc. |
02434407 |
Sous examen |
blank |
| 43 |
INVOKANA – 100 mg/comprimé |
Janssen Inc. |
02425483 |
Sous examen |
blank |
| 44 |
INVOKANA – 300 mg/comprimé |
Janssen Inc. |
02425491 |
Conforme aux Lignes directrices |
MN |
| 45 |
NUCYNTA XR – 50 mg/comprimé |
Janssen Inc. |
02415577 |
Conforme aux Lignes directrices |
MN |
| 46 |
NUCYNTA XR – 100 mg/comprimé |
Janssen Inc. |
02415585 |
Conforme aux Lignes directrices |
MN |
| 47 |
NUCYNTA XR – 150 mg/comprimé |
Janssen Inc. |
02415593 |
Conforme aux Lignes directrices |
MN |
| 48 |
NUCYNTA XR – 200 mg/comprimé |
Janssen Inc. |
02415607 |
Conforme aux Lignes directrices |
MN |
| 49 |
NUCYNTA XR – 250 mg/comprimé |
Janssen Inc. |
02415615 |
Conforme aux Lignes directrices |
MN |
| 50 |
PREZCOBIX 800/150 |
Janssen Inc. |
02426501 |
Conforme aux Lignes directrices |
MN |
| 51 |
SIMPONI – 50 mg/fiole |
Janssen Inc. |
02417472 |
Conforme aux Lignes directrices |
MN |
| 52 |
TRINTELLIX – 5 mg/comprimé |
Lundbeck Canada Inc. |
02432919 |
Sous examen |
blank |
| 53 |
TRINTELLIX – 10 mg/comprimé |
Lundbeck Canada Inc. |
02432927 |
Sous examen |
blank |
| 54 |
TRINTELLIX – 20 mg/comprimé |
Lundbeck Canada Inc. |
02432943 |
Sous examen |
blank |
| 55 |
GRASTEK – 2 800 unités/comprimé |
Merck Canada Inc. |
02418394 |
Conforme aux Lignes directrices |
MN |
| 56 |
JANUMET XR 50/1000 |
Merck Canada Inc. |
02416784 |
Sous enquête |
MN |
| 57 |
POSANOL – 100 mg/comprimé |
Merck Canada Inc. |
02424622 |
Ne justifie pas une enquête |
MN |
| 58 |
POSANOL – 100 mg/comprimé |
Merck Canada Inc. |
02432676 |
Sous examen |
blank |
| 59 |
RAGWITEK – 12 unités/comprimé |
Merck Canada Inc. |
02423723 |
Conforme aux Lignes directrices |
AM-S |
| 60 |
AFINITOR DISPERZ – 2 mg/comprimé |
Novartis Pharmaceuticals Canada Inc. |
02425645 |
Conforme aux Lignes directrices |
MN |
| 61 |
AFINITOR DISPERZ – 3 mg/comprimé |
Novartis Pharmaceuticals Canada Inc. |
02425653 |
Conforme aux Lignes directrices |
MN |
| 62 |
AFINITOR DISPERZ – 5 mg/comprimé |
Novartis Pharmaceuticals Canada Inc. |
02425661 |
Conforme aux Lignes directrices |
MN |
| 63 |
BEXSERO |
Novartis Pharmaceuticals Canada Inc. |
02417030 |
Sous enquête |
D |
| 64 |
LUCENTIS – 0,5 mg/dose |
Novartis Pharmaceuticals Canada Inc. |
02425629 |
Sous examen |
blank |
| 65 |
ULTIBRO BREEZHALER 110/50 |
Novartis Pharmaceuticals Canada Inc. |
02418282 |
Conforme aux Lignes directrices |
MN |
| 66 |
NORDITROPIN NORDIFLEX – 5 mg/stylo |
Novo Nordisk Canada Inc. |
02334852 |
Sous examen |
blank |
| 67 |
NORDITROPIN NORDIFLEX – 10 mg/stylo |
Novo Nordisk Canada Inc. |
02334860 |
Sous examen |
blank |
| 68 |
NORDITROPIN NORDIFLEX – 15 mg/stylo |
Novo Nordisk Canada Inc. |
02334879 |
Sous examen |
blank |
| 69 |
ABILIFY MAINTENA – 300 mg/fiole |
Otsuka Canada |
02320864 |
Conforme aux Lignes directrices |
MN |
| 70 |
ABILIFY MAINTENA – 400 mg/fiole |
Otsuka Canada |
02420872 |
Conforme aux Lignes directrices |
MN |
| 71 |
ANTIZOL - 1 g/mL |
Paladin Labs Inc. |
02242980 |
Sous examen |
blank |
| 72 |
VEREGEN – 100 mg/gramme |
Paladin Labs Inc. |
02411849 |
Sous examen |
blank |
| 73 |
BOSULIF – 100 mg/comprimé |
Pfizer Canada Inc. |
02419149 |
Conforme aux Lignes directrices |
MN |
| 74 |
BOSULIF – 500 mg/comprimé |
Pfizer Canada Inc. |
02419157 |
Conforme aux Lignes directrices |
MN |
| 75 |
CYTARABINE - 20 mg/mL |
Pfizer Canada Inc. |
02406764 |
Conforme aux Lignes directrices |
MN |
| 76 |
CYTARABINE - 100 mg/mL |
Pfizer Canada Inc. |
02406772 |
Conforme aux Lignes directrices |
MN |
| 77 |
ELELYSO – 200 unités/fiole |
Pfizer Canada Inc. |
02425637 |
Conforme aux Lignes directrices |
MN |
| 78 |
IRINOTECAN - 20 mg/mL |
Pfizer Canada Inc. |
02410419 |
Sous enquête |
MN |
| 79 |
XELJANZ – 5 mg/comprimé |
Pfizer Canada Inc. |
02423898 |
Sous examen |
blank |
| 80 |
ZALTRAP – 100 mg/fiole |
sanofi-aventis Canada Inc. |
02421070 |
Conforme aux Lignes directrices |
MN |
| 81 |
ZALTRAP – 200 mg/fiole |
sanofi-aventis Canada Inc. |
02421089 |
Conforme aux Lignes directrices |
MN |
| 82 |
APTIOM – 200 mg/comprimé |
Sunovion Pharmaceuticals Canada Inc. |
02426862 |
Sous examen |
blank |
| 83 |
APTIOM – 400 mg/comprimé |
Sunovion Pharmaceuticals Canada Inc. |
02426870 |
Sous examen |
blank |
| 84 |
APTIOM – 600 mg/comprimé |
Sunovion Pharmaceuticals Canada Inc. |
02426889 |
Sous examen |
blank |
| 85 |
APTIOM – 800 mg/comprimé |
Sunovion Pharmaceuticals Canada Inc. |
02426897 |
Sous examen |
blank |
| 86 |
LATUDA – 20 mg/comprimé |
Sunovion Pharmaceuticals Canada Inc. |
02422050 |
Conforme aux Lignes directrices |
MN |
| 87 |
LATUDA – 60 mg/comprimé |
Sunovion Pharmaceuticals Canada Inc. |
02413361 |
Conforme aux Lignes directrices |
MN |
| 88 |
KAZANO 12,5/500 |
Takeda Canada Inc. |
02417219 |
Conforme aux Lignes directrices |
MN |
| 89 |
KAZANO 12,5/850 |
Takeda Canada Inc. |
02417227 |
Sous enquête |
MN |
| 90 |
KAZANO 12,5/1000 |
Takeda Canada Inc. |
02417235 |
Conforme aux Lignes directrices |
MN |
| 91 |
NESINA – 6,25 mg/comprimé |
Takeda Canada Inc. |
02417189 |
Sous enquête |
MN |
| 92 |
NESINA – 12,5 mg/comprimé |
Takeda Canada Inc. |
02417197 |
Sous enquête |
MN |
| 93 |
NESINA – 25 mg/comprimé |
Takeda Canada Inc. |
02417200 |
Conforme aux Lignes directrices |
MN |
| 94 |
FENTORA – 100 mcg/comprimé |
Teva Canada Innovation |
02408007 |
Conforme aux Lignes directrices |
MN |
| 95 |
FENTORA – 200 mcg/comprimé |
Teva Canada Innovation |
02408015 |
Conforme aux Lignes directrices |
MN |
| 96 |
FENTORA – 400 mcg/comprimé |
Teva Canada Innovation |
02408023 |
Conforme aux Lignes directrices |
MN |
| 97 |
FENTORA – 600 mcg/comprimé |
Teva Canada Innovation |
02408031 |
Conforme aux Lignes directrices |
MN |
| 98 |
FENTORA – 800 mcg/comprimé |
Teva Canada Innovation |
02408058 |
Conforme aux Lignes directrices |
MN |
| 99 |
NEUPRO – 1 mg/timbre |
UCB Canada Inc. |
02403897 |
Conforme aux Lignes directrices |
MN |
| 100 |
NEUPRO – 3 mg/timbre |
UCB Canada Inc. |
02403919 |
Conforme aux Lignes directrices |
MN |
| 101 |
JUBLIA – 10 mg/gramme |
Valeant Canada LP |
02413388 |
Sous examen |
blank |
| 102 |
VYLOMA – 250 mg/sachet |
Valeant Canada LP |
02356661 |
Conforme aux Lignes directrices |
MN |
| 103 |
TRIUMEQ 50/600/300 |
Viiv Healthcare ULC |
02430932 |
Sous examen |
blank |
* Vendu après l’entrée en vigueur des nouvelles Lignes directrices en 2010 :
- MN Amélioration minime ou nulle
- AM-S Amélioration modeste – facteurs secondaires
- AM-P Amélioration modeste – facteurs principaux
- AI Amélioration importante
- D Découverte
Vendu avant l’entrée en vigueur des nouvelles Lignes directrices en 2010 :
Catégorie 1 Une forme posologique existante ou comparable d’un médicament existant.
Catégorie 2 Une forme posologique non comparable d’un médicament existant, ou le premier DIN d’une nouvelle entité chimique constituant une découverte, sinon une amélioration importante par rapport aux DIN existants comparables.
Catégorie 3 Une forme posologique non comparable d’un médicament existant ou le premier DIN d’une nouvelle entité chimique offrant une amélioration modeste, voire même aucune amélioration par rapport aux DIN existants comparables.
Annexe 3 : Recherche et développement
Tableau 21. Intervalle des ratios des dépenses de R-D par rapport aux recettes tirées des ventes, selon le nombre de sociétés ayant présenté des rapports et la valeur des recettes totales tirées des ventes
| Intervalle du ratio des dépenses de R-D par rapport aux recettes tirées des ventes |
Nombre de sociétés ayant présenté un rapport en 2014 |
Recettes tirées des ventes en 2014 (en M$) |
Part en 2014 (en %) |
Nombre de sociétés ayant présenté un rapport en 2013 |
Recettes tirées des ventes en 2013 (en M$) |
Part en 2013 (en %) |
| 0 % |
28 |
2 008,8 |
11,9 |
33 |
2 744,5 |
16,3 |
| ≤10 % |
39 |
14 028,0 |
83 2 |
37 |
13 210,3 |
78,5 |
| >10 % |
8 |
805,4 |
4,8 |
11 |
863,1 |
5,1 |
| Total |
75 |
16 842,2 |
100,0* |
81 |
16 817,9 |
100,0* |
* Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Figure 23. Dépenses courantes de R-D (en M$) selon le type de recherche, 1988-2014
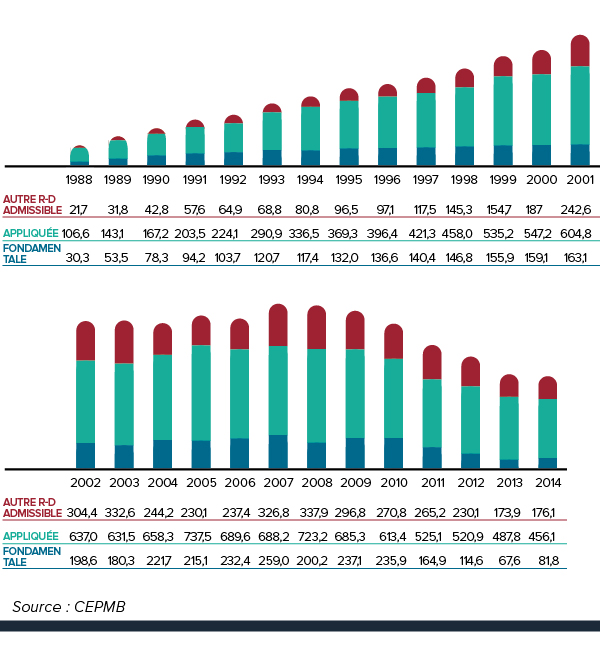
Description de la figure
Il s’agit d’un diagramme à colonnes empilées présentant les dépenses courantes de R-D, en millions de dollars, par type de recherche, en fonction des données recueillies de 1998 à 2014.
| Année |
Fondamentale |
Appliquée |
Autre R-D admissible |
| 1988 |
30,3 |
106,6 |
21,7 |
| 1989 |
53,5 |
143,1 |
31,8 |
| 1990 |
78,3 |
167,2 |
42,8 |
| 1991 |
94,2 |
203,5 |
57,6 |
| 1992 |
103,7 |
224,1 |
64,9 |
| 1993 |
120,7 |
290,9 |
68,8 |
| 1994 |
117,4 |
336,5 |
80,8 |
| 1995 |
132,0 |
369,3 |
96,5 |
| 1996 |
136,6 |
396,4 |
97,1 |
| 1997 |
140,4 |
421,3 |
117,5 |
| 1998 |
146,8 |
458,0 |
145,3 |
| 1999 |
155,9 |
535,2 |
154,7 |
| 2000 |
159,1 |
547,2 |
187,0 |
| 2001 |
163,1 |
604,8 |
242,6 |
| 2002 |
198,6 |
637 |
304,4 |
| 2003 |
180,3 |
631,5 |
332,6 |
| 2004 |
221,7 |
658,3 |
244,2 |
| 2005 |
215,1 |
737,5 |
230,1 |
| 2006 |
232,4 |
689,6 |
237,4 |
| 2007 |
259,0 |
688,2 |
326,8 |
| 2008 |
200,2 |
723,2 |
337,9 |
| 2009 |
237,1 |
685,3 |
296,8 |
| 2010 |
235,9 |
613,4 |
270,8 |
| 2011 |
164,9 |
525,1 |
265,2 |
| 2012 |
114,6 |
520,9 |
230,1 |
| 2013 |
67,6 |
487,8 |
173,9 |
| 2014 |
81,8 |
456,1 |
176,1 |
Tableau 22. Ratios des dépenses de R-D par rapport aux recettes tirées des ventes selon les brevetés1 qui ont présenté un rapport, 2014 et 2013
| Société |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes (en %) 2014 |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes (en %) 2013 |
| Abbott Laboratories, Ltd.2 |
0,0 |
0,0 |
| AbbVie Corporation2, 3, 4 |
2,2 |
2,2 |
| Actavis Specialty Pharmaceuticals Co. (Watson Pharma Co.) |
0,1 |
0,0 |
| Actelion Pharmaceutiques Canada Inc.2, 3, 4 |
4,2 |
— |
| Aegerion Pharma Canada Ltd.3, 5 |
1,9 |
— |
| Alcon Canada Inc. |
0,1 |
0,1 |
| Alexion Pharmaceuticals Inc.3 |
0,0 |
0,0 |
| Allergan Inc. |
5,0 |
3,8 |
| Almirall Limited2 |
0,0 |
59,2 |
| Alveda Pharmaceuticals Inc. |
0,0 |
0,0 |
| Amgen Canada Inc.2, 3 |
6,0 |
7,0 |
| Aspri Pharma Canada Inc.5 |
0,0 |
— |
| Astellas Pharma Canada Inc.2, 6 |
2,0 |
3,3 |
| AstraZeneca Canada Inc.2, 3 |
3,0 |
1,8 |
| Baxter Corporation |
0,3 |
0,4 |
| Bayer Inc.2 |
5,2 |
4,3 |
| Biogen Idec Canada Inc.3 |
10,2 |
10,3 |
| BioMarin Canada Inc.3 |
42,5 |
19,2 |
| Biovitrum AB |
0,0 |
0,0 |
| Boehringer Ingelheim (Canada) Ltd.2 |
4,5 |
5,8 |
| Bracco Diagnostics Canada Inc. |
0,0 |
0,0 |
| Bristol-Myers Squibb Canada2, 3 |
9,7 |
12,0 |
| Celgene Inc.3 |
2,0 |
1,2 |
| Correvio (UK) Ltd. (Iroko International LP) |
0,0 |
0,0 |
| CSL Behring Canada Inc. |
0,5 |
0,8 |
| Cubist Pharmaceuticals Canada, Inc. (Optimer Pharmaceuticals Canada Inc.) |
0,0 |
0,0 |
| Duchesnay Inc. |
12,5 |
9,4 |
| Eisai Limited2, 3 |
0,9 |
12,3 |
| Eli Lilly Canada Inc. (dont la Provel Animal Health Division)2, 3 |
4,3 |
9,6 |
| EMD Serono Canada Inc.2 |
5,8 |
5,9 |
| Ferring Produits Pharmaceutiques Inc.2 |
0,0 |
0,0 |
| Galderma Canada Inc. |
0,0 |
0,0 |
| Gilead Sciences Canada, Inc.2 |
22,6 |
19,5 |
| GlaxoSmithKline Inc.2 |
8,5 |
9,7 |
| Grifols Canada Ltd. (Talecris Biotherapeutics Ltd.)3 |
0,0 |
0,0 |
| Hoffmann-La Roche Ltd. Canada2 |
4,9 |
4,7 |
| Hospira Healthcare Corp. |
0,0 |
0,0 |
| Janssen Inc.2, 3 |
3,3 |
3,1 |
| Johnson & Johnson Inc. |
0,0 |
0,0 |
| Produits médicaux Johnson & Johnson |
1,7 |
0,0 |
| Lantheus MI Canada Inc. |
0,0 |
0,0 |
| LEO Pharma Inc.2 |
1,2 |
0,9 |
| Lundbeck Canada Inc.2 |
0,8 |
0,3 |
| McNeil Consumer Healthcare Canada |
3,8 |
2,9 |
| Meda Valeant Pharma Canada Ltd. |
0,0 |
0,0 |
| Medical Futures Inc. |
0,0 |
0,0 |
| Merck Canada Inc.2, 3 |
2,4 |
1,7 |
| Merus Labs |
0,0 |
0,0 |
| Merz Pharma Canada Ltd. |
5,8 |
6,6 |
| Novartis Pharmaceuticals Canada Inc.2, 3 |
6,4 |
9,4 |
| Novo Nordisk Canada Inc.2, 3 |
2,9 |
1,3 |
| Orion Corporation.5 |
0,0 |
- |
| Otsuka Canada Pharmaceutical Inc. (OCPI)2 |
48,0 |
39,1 |
| Paladin Labs Inc.2 |
0,0 |
0,0 |
| Pfizer Canada Inc.2, 3 |
1,2 |
1,7 |
| Purdue Pharma2 |
4,6 |
4,9 |
| Ranbaxy Pharmaceuticals Canada Inc. |
0,0 |
0,0 |
| Salix Pharmaceuticals Inc. |
45,9 |
130,7 |
| Sanofi Canada Inc.2, 8 |
2,4 |
3,7 |
| Sanofi Pasteur Ltd.2, 3, 7 |
67,1 |
69,7 |
| Seattle Genetics Inc. |
5,2 |
6,6 |
| Servier Canada Inc.2 |
4,7 |
4,6 |
| Shire Canada Inc.2, 3 |
0,2 |
0,2 |
| Shire Human Genetic Therapies2, 3 |
1,6 |
1,2 |
| Sigma Tau Pharmaceuticals Inc. |
0,0 |
0,0 |
| Sunovion Pharmaceuticals Canada Inc.2 |
0,0 |
0,0 |
| Takeda Canada Inc.2, 3 |
0,0 |
0,0 |
| Teva Canada Innovation3 |
0,7 |
0,9 |
| Tribute Pharma Canada Inc. |
0,0 |
0,0 |
| Tyco Healthcare Group Canada Inc. (Mallinckrodt Pharmaceuticals, LLC) |
0,0 |
0,0 |
| UCB Canada Inc.3 |
1,7 |
7,9 |
| Valeant Canada Ltd.3, 9 |
0,0 |
0,0 |
| Vertex Pharma Canada Inc. |
66,5 |
21,3 |
| Vetoquinol Canada Inc. |
1,9 |
2,8 |
| VIIV Soins de santé ULC.2 |
0,0 |
0,0 |
1 Pour éviter la double comptabilisation des recettes tirées des ventes, les recettes tirées des redevances sont incluses dans le calcul du ratio de chaque société mais non dans le calcul du ratio à l’échelle de l’industrie. Les subventions des gouvernements fédéral et provinciaux ne sont pas comptabilisées dans les dépenses utilisées pour le calcul des ratios des dépenses de R-D de chaque société, mais elles le sont dans les statistiques pour l’ensemble de l’industrie. La liste des sociétés ayant soumis un rapport sur les prix n’est pas identique à celle des sociétés ayant soumis un rapport sur leurs activités de R-D en raison des différences des modalités de rapport entre les brevetés et leurs sociétés affiliées ou les détenteurs d’une licence d’exploitation. Il convient également de noter que certains titulaires d’un brevet pour un médicament vétérinaire (soit les brevetés qui ne tirent aucun revenu de la vente de produits pour un usage humain) sont tenus de présenter un rapport sur leurs dépenses de R-D, mais pas nécessairement sur les prix qu’ils pratiquent et sur la valeur de leurs ventes.
2 Membre de Rx&D.
3 Membre de BIOTECanada.
4 Société détachée de la division des produits de marque déposée d’Abbott en entité juridique distincte depuis le 31 octobre 2012.
5 N’était pas un breveté en 2013.
6 Anciennement connu sous le nom Fujisawa Canada Inc.
7 Anciennement connu sous le nom Aventis Pasteur Ltd.
8 Anciennement connu sous le nom Aventis Pharma Inc.
9 Anciennement connu sous le nom ICN Canada Ltd.
Tableau 23. Dépenses courantes de R-D selon la province ou le territoire, 2014
| Province |
Dépenses par tous les brevetés (000 $) |
Part régionale (%) |
Dépenses par tous les brevetés membres de Rx&D (000 $) |
Part régionale (%) |
| Terre-Neuve |
3 257,85 |
0,456 |
2 915,79 |
0,459 |
| Île-du-Prince-Édouard |
2,07 |
0,000 |
2,07 |
0,000 |
| Nouvelle-Écosse |
13 492,91 |
1,890 |
12 209,82 |
1,922 |
| Nouveau-Brunswick |
1 811,68 |
0,254 |
1 457,57 |
0,229 |
| Québec |
236 197,38 |
33,080 |
203 269,39 |
31,991 |
| Ontario |
343 568,69 |
48,118 |
311 605,53 |
49,042 |
| Manitoba |
4 734,09 |
0,663 |
4 101,09 |
0,645 |
| Saskatchewan |
1 586,18 |
0,222 |
1 092,00 |
0,172 |
| Alberta |
76 177,32 |
10,669 |
70 018,22 |
11,020 |
| Colombie-Britannique |
33 187,85 |
4,648 |
28 714,54 |
4,519 |
| Territoires |
0 |
0,000 |
0 |
0,000 |
| Canada |
714 016,02 |
100,0* |
635 386,02 |
100,0* |
* Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Tableau 24. Dépenses courantes de R-D selon le milieu de recherche et la province ou le territoire, 2014
| Province |
blank |
Brevetés |
Autres Sociétés |
Université |
hôpitaux |
Autres |
| Terre-Neuve |
000 $ |
661,62 |
1 258,67 |
599,90 |
142,36 |
595,30 |
| blank |
% |
20,3 |
38,6 |
18,4 |
4,4 |
18,3 |
| Île-du-Prince-Édouard |
000 $ |
0,00 |
0,00 |
0,00 |
2,07 |
0,00 |
| blank |
% |
0,0 |
0,0 |
0,0 |
100,0 |
0,0 |
| Nouvelle-Écosse |
000 $ |
1 096,22 |
2 851,22 |
5 356,77 |
2 375,28 |
1 813,41 |
| blank |
% |
8,1 |
21,1 |
39,7 |
17,6 |
13,4 |
| Nouveau-Brunswick |
000 $ |
122,06 |
776,47 |
0,17 |
558,59 |
354,39 |
| blank |
% |
6,7 |
42,9 |
0,01 |
30,8 |
19,6 |
| Québec |
000 $ |
92 343,03 |
82 861,12 |
9 669,42 |
16 514,58 |
34 809,23 |
| blank |
% |
39,1 |
35,1 |
4,1 |
7,0 |
14,7 |
| Ontario |
000 $ |
185 955,44 |
72 319,00 |
19 762,42 |
34 625,46 |
30 906,37 |
| blank |
% |
54,1 |
21,0 |
5,6 |
10,1 |
9,0 |
| Manitoba |
000 $ |
745,59 |
1 483,84 |
513,10 |
1 084,57 |
906,99 |
| blank |
% |
15,7 |
31,3 |
10,8 |
22,9 |
19,2 |
| Saskatchewan |
000 $ |
277,27 |
840,32 |
279,75 |
130,99 |
57,85 |
| blank |
% |
17,5 |
52,9 |
17,6 |
8,3 |
3,6 |
| Alberta |
000 $ |
55 162,62 |
6 553,60 |
7 433,41 |
2 993,73 |
4 033,95 |
| blank |
% |
72,4 |
8,6 |
9,7 |
3,4 |
5,3 |
| Colombie-Britannique |
000 $ |
13 184,99 |
9 236,55 |
2 161,37 |
2 849,56 |
5 755,38 |
| blank |
% |
39,7 |
27,8 |
6,5 |
8,6 |
17,3 |
| Territoires |
000 $ |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
| blank |
% |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
| Canada |
000 $ |
349 548,85 |
178 180,78 |
45 776,31 |
61 277,21 |
79 232,87 |
| blank |
% |
49,0 |
25,0 |
6,4 |
8,6 |
11,1 |
Remarques :
- Le pourcentage figurant sous chaque catégorie de R-D correspond au pourcentage de toutes les dépenses engagées dans cette catégorie dans la province.
- Les dépenses présentées sous forme de pourcentage du total correspondent au pourcentage des dépenses de R-D dans cette province par rapport à l’ensemble des dépenses de R-D faites au Canada.
- Le total des colonnes et des rangs ne correspond pas nécessairement, car certains chiffres ont été arrondis.
- Dépenses courantes plus dépenses en immobilisations (équipement + amortissement) = total des dépenses de R-D.
Source : CEPMB