Rapport annuel 2003
Rapport annuel (PDF)
Retour aux rapports annuels
Table des matières
- Communiqué de presse
- Faits saillants de l'exercice 2003
- Lettre au ministre
- Message du président
- Le Conseil d'examen du prix des médicaments brevetés : Mandat et compétences
- Réglementation : prix des médicaments brevetés
- Ventes de médicaments au Canada
- Conformité et lignes directrices sur les prix excessifs
- Certificat de décision préalable
- Engagements de conformité volontaire
- Activités quasi-judiciaires
- Information sur les principales tendances
- Valeur des ventes au prix départ-usine au canada et dans d'autres pay
- Le contexte mondial
- Tendances des prix des médicaments et des dépenses
- Système national d'information sur l'utilisation des médicaments prescrits
- Analyse des dépenses de recherche-développement
- Initiatives de politique et de recherche
- Programme de recherche
- Approche de réglementation des prix des médicaments pour usage vétérinaire : les prochaines étapes
- Projet d'examen des échéanciers
- Communications
- Gouvernance
- Membres du Conseil et cadres supérieurs
- Budget
- Publications
- Glossaire
- Acronymes
- Annexe 1
- Annexe 2
- Annexe 3
- Tableaux 8 - 9
- Tableaux 10 - 13
- Tableau 14
- Médicaments brevetés pour usage humain et titulaires des brevets au Canada
- Notes
Communiqué
Rapport annuel du CEPMB pour l´exercice 2003
OTTAWA, le 6 octobre 2004 : Le ministre de la Santé, l´honorable Ujjal Dosanjh, a déposé hier au Parlement le rapport annuel du Conseil d´examen du prix des médicaments brevetés pour l´exercice 2003.
La valeur totale au Canada des ventes au prix départ-usine de tous les médicaments pour usage humain a augmenté de 14,5 % en 2003 par rapport à 2002 pour se situer à 15,0 milliards de dollars. Quant à la valeur des ventes de médicaments brevetés, elle a augmenté de 14,8 % pour se situer à 10,1 milliards de dollars. Les médicaments brevetés ont, comme l´année précédente, accaparé 67,4 % de l´ensemble des ventes de médicaments.
Le président du CEPMB, le Dr Robert G. Elgie, a fait valoir que les prix des médicaments brevetés existants, qui sont assujettis aux Lignes directrices du CEPMB, ont diminué de 1,1 % en 2003 par rapport à l´exercice précédent. Il a ajouté que les prix des médicaments brevetés pratiqués au Canada étaient à environ 5 % sous la médiane des prix pratiqués dans les sept pays de comparaison. Sauf en 2002, les prix canadiens se situent, en moyenne, entre 5 et 12 % sous la médiane des prix étrangers depuis 1995.
Soixante dix nouveaux produits médicamenteux brevetés pour usage humain ont fait l´objet d´un rapport au CEPMB, dont 18 nouvelles substances actives. Toutefois, en date du dépôt du rapport annuel on comptait au total 71 nouveaux produits sous la régie du CEPMB en 2003. Les prix de 70 de ces produits avaient été examinés, dont 58 étaient conformes aux Lignes directrices alors que 12 faisaient l´objet d´une enquête. Dans la foulée de son initiative visant à améliorer la transparence de ses activités, les rapports sommaires des résultats des examens des nouvelles substances actives sont affichés sur le site Internet du CEPMB, sous la rubrique Médicaments brevetés, et publiés dans son feuillet trimestriel La Nouvelle.
Le Conseil fait état des activités d´application conclues par des engagements de conformité volontaire soumis par les titulaires de brevets, assurant ainsi que les prix des médicaments brevetés sont conformes aux Lignes directrices. En plus des engagements acceptés par le Conseil pour les médicaments Remicade, Aromasin et Dostinex, on note également les engagements acceptés pour le One-Alpha et le Fasturtec.
Les brevetés ont déclaré des dépenses dans la R-D totalisant 1,19 milliard de dollars en 2003, soit une diminution de 0,5 % par rapport aux 1,2 milliard de dollars déclarés pour 2002. Le ratio de dépenses de R-D par rapport aux recettes tirées des ventes pour l´ensemble des brevetés a diminué, passant de 9,9 % en 2002 à 8,8 % en 2003, tout comme le ratio des brevetés membres de Rx&D qui est passé de 10,0 % à 9,1 % au cours de la même période. Les dépenses de recherche fondamentale ont diminué de 9,3 % en 2003 pour totaliser 180 millions de dollars et représenter 15,7 % des dépenses courantes de R-D.
Le CEPMB contribue aux soins de santé de la population canadienne en s´assurant que le prix des médicaments brevetés n´est pas excessif et en analysant les tendances des prix de tous les médicaments ainsi que la recherche-développement effectuée par les brevetés, et en faisant rapport de ses conclusions à la population canadienne au moyen de son rapport annuel.
Le rapport annuel pour l´exercice 2003 est disponible sur le site Internet du CEPMB.
Personne ressource : Sylvie Dupont
No sans frais : 1 877-861-2350; Tél.: (613) 954-8299; Fax : (613) 952-7626
Courriel : sdupont@pmprb-cepmb.gc.ca
VENTES
- Au Canada, la valeur totale des ventes au prix départ-usine de tous les médicaments pour usage humain a augmenté de 14,5 % par rapport à l'exercice 2002, pour se situer à 15,0 milliards de dollars.
- La valeur des ventes de médicaments brevetés a totalisé 10,1 milliards de dollars en 2003, soit 14,8 % de plus qu'en 2002. Les médicaments brevetés accaparent actuellement 67,4 % de la valeur totale des ventes, soit la même proportion qu'en 2002.
CONFORMITÉ
- Soixante-dix médicaments brevetés ont été lancés sur le marché en 2003, dont 18 nouvelles substances actives. En date du 31 mars 2004, l'examen du prix de 64 DIN avait été effectué. Les prix de 52 de ces DIN ont été jugés conformes aux Lignes directrices. Par ailleurs, les prix de 12 DIN semblaient supérieurs aux prix autorisés en vertu des Lignes directrices et des enquêtes ont été engagées.
TENDANCES DES PRIX
- Les prix des médicaments brevetés, mesurés à l'aide de l'Indice des prix des médicaments brevetés (IPMB) ont accusé une baisse de 1,1 % en 2003. Ce résultat suit la tendance des prix à la baisse et d'augmentations négligeables de l'IPMB amorcée en 1993.
- De 1995 à 2001, les prix canadiens des médicaments brevetés se situaient entre 5 % et 12 % sous la médiane des prix pratiqués dans les sept pays utilisés aux fins de la comparaison des prix. En 2002, les prix canadiens étaient de 1 % supérieurs aux prix internationaux médians. En 2003, les prix des médicaments brevetés sont revenus à leurs niveaux du milieu des années 1990, pour se situer à environ 5 % sous la médiane des prix pratiqués dans les sept pays de comparaison. Les prix canadiens étaient inférieurs à ceux du Royaume Uni, de l'Allemagne et des États-Unis, mais supérieurs à ceux de la France, de l'Italie et de la Suède.
RECHERCHE ET DÉVELOPPEMENT
- Pour 2003, les brevetés ont déclaré des dépenses dans la R-D totalisant 1,19 milliard de dollars, ce qui représente une diminution de 0,5 % par rapport à l'exercice précédent où ces dépenses totalisaient 1,2 milliard de dollars. Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes a reculé, passant de 9,9 % qu'il était en 2002 à 8,8 % en 2003. Dans le cas des brevetés membres de Rx&D, ce ratio est passé de 10,0 % à 9,1 % au cours de la même période.
- La valeur des dépenses dans la recherche fondamentale a diminué de 9,3 % en 2003 pour se situer à 180 millions et représenter 15,7 % de l'ensemble des dépenses courantes de R-D.
Le 31 mai 2004
L'honorable Pierre S. Pettigrew, C.P., député
Ministre de la Santé
Chambre des communes
Ottawa (Ontario)
K1A 0A6
Monsieur le ministre,
J'ai l'honneur de vous présenter, conformément aux articles 89 et 100 de la Loi sur les brevets, le Rapport annuel du Conseil d'examen du prix des médicaments brevetés pour l'exercice terminé le 31 décembre 2003.
Je vous prie d'agréer, Monsieur le ministre, l'assurance de mes sentiments distingués.
Le président,

Robert G. Elgie

Que l'on lise le journal, écoute les nouvelles ou suive des discussions politiques, force est de remarquer que la santé est devenue le sujet de l'heure. Nos publications vont dans le même sens. Toutefois, nous assistons à un phénomène particulier. D'une part, les Canadiens et les Canadiennes portent de plus en plus d'intérêt aux soins de santé, à la pérennité du régime de santé et à son orientation future et, d'autre part, ils se renseignent sur la façon dont le régime fonctionne et sur les mesures qui pourraient être mises en place pour assurer un service encore meilleur à la population.
Le Conseil d'examen du prix des médicaments brevetés fait partie de cet engrenage. En effet, en vertu de son double mandat, le CEPMB exerce un contrôle sur les prix des médicaments brevetés pour les maintenir à des niveaux non excessifs. Le CEPMB collige également de l'information sur les tendances des prix de tous les médicaments et sur l'utilisation qui en est faite afin d'aider les décideurs des différents régimes d'assurance-médicaments à prendre des décisions éclairées. Dans le contexte du débat actuel sur les soins de santé, le deuxième volet de notre mandat, qui est d'informer et de sensibiliser la population, se révèle une contribution de plus en plus importante au régime de soins de santé.
L'information des Canadiens et des Canadiennes et des décideurs pose, il va sans dire, son lot de défis. En effet, la réglementation des prix des médicaments est en soi un sujet complexe dans lequel s'opposent diverses positions, différents intervenants et autant de perspectives. De par sa nature, la couverture médiatique s'intéresse plus souvent qu'autrement aux situations les plus dramatiques et aux controverses qui touchent les soins de santé. Paradoxalement, en cette ère où la technologie, notamment l'Internet et différentes formes de médias, facilite les communications, il devient difficile de trouver le juste point suscitant des débats éclairés et un partage d'idées et de points de vue.
Le CEPMB s'efforce de fournir des données concrètes sur les tendances des prix et, grâce à une collaboration avec les provinces et les territoires, sur l'utilisation faite des médicaments et sur différents autres sujets relatifs aux médicaments. En plus de son site Internet, le CEPMB gère un programme de publications, des services d'information et participe à des conférences et à des symposiums. Le CEPMB est à l'affût de nouvelles occasions d'aider les Canadiens et les Canadiennes à mieux comprendre les questions touchant les médicaments, une composante importante du système de soins de santé de notre pays.
Le rapport annuel est à cet égard un de nos principaux véhicules de communication sur le rôle que jouent les médicaments dans notre régime de soins de santé. Ce rapport constitue pour le CEPMB une occasion toute choisie de mieux renseigner et informer le grand public. Il nous donne également la possibilité d'intéresser les Canadiens et les Canadiennes à ce que nous faisons et à solliciter leurs points de vue.
Le CEPMB cherche également des moyens de conjuguer les résultats du travail du CEPMB à ceux d'autres intervenants du système, qu'il s'agisse de favoriser les occasions d'échanger de l'information et de simplifier nos processus. Le Programme commun d'examen des médicaments, une initiative fédérale, provinciale et territoriale, témoigne des efforts déployés en ce sens. Ce Programme offre aux régimes fédéral, provinciaux et territoriaux d'assurancemédicaments participant, un examen des preuves cliniques disponibles et des recommandations quant à l'inscription des nouveaux médicaments sur les formulaires. Le CEPMB, qui siège à ce comité à titre d'observateur, tient compte de ce processus pour rendre son processus d'examen du prix plus célère.
Il est important que les contribuables et les patients sachent si le prix d'un médicament est ou non conforme à nos Lignes directrices au moment d'acheter un médicament ou, encore, de déterminer son admissibilité à un remboursement au titre d'un régime public. Beaucoup de nouveaux médicaments nous obligent à faire des examens complexes qui nécessitent la consultation de spécialistes. Les brevetés corrigent souvent leurs rapports et revendiquent la possibilité de présenter des faits nouveaux, voire même de nouveaux rapports (l'approche dite « compte-gouttes »). En réponse à ces pressions et prenant appui des recommandations d'un groupe de travail formé d'intervenants, nous nous sommes engagés dans un Projet d'examen des échéanciers. Le défi que pose ce projet est de veiller à ce que l'échéancier de l'examen du prix effectué par le CEPMB tienne compte des changements que Santé Canada apportera à l'examen de l'innocuité et de l'efficacité des médicaments ainsi que des activités de l'examen des médicaments courants.
En 2003, nous avons mis en place diverses initiatives avec l'objectif des changements additionnels et à une consultation publique. À cette fin, nous avons élargi le processus d'examen scientifique et effectué un examen interne des procédures de fonctionnement. Cet examen a donné lieu à une amélioration de notre efficacité, ouvrant ainsi la voie à des consultations publiques sur des échéanciers d'examen de prix plus rigoureux.
La recherche de nouvelles façons de mieux imbriquer les différents processus d'examen au Canada profitera aux consommateurs canadiens, aux patients et à notre régime de santé canadien, voire même aux fabricants. Nous encourageons les fabricants à saisir les occasions de simplifier le processus en soumettant au CEPMB leurs rapports aux fins du Programme commun d'évaluation des médicaments. Nous encourageons également les fabricants à demander conseil avant de fixer le prix des médicaments qu'ils se préparent à offrir sur le marché canadien.
À l'instar de tous les autres pays industrialisés, le Canada connaît des pressions budgétaires importantes, notamment aux niveaux de ses régimes publics de soins de santé et d'assurance-médicaments. Nous devons améliorer nos sources d'information et notre capacité d'analyse si nous voulons arriver à bien comprendre les tendances quant à l'utilisation faite des médicaments et voir quelles seraient les meilleures politiques qui permettraient d'aborder les préoccupations du public.
Les Canadiens et les Canadiennes s'attendent également à ce que leurs gouvernements conjuguent leurs efforts pour améliorer et consolider le régime de soins de santé. Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) et le Programme commun d'évaluation des médicaments constituent des exemples éloquents des avantages auxquels peut donner lieu ce type de collaboration. Les Canadiens et les Canadiennes s'attendent également à ce que les institutions publiques et privées fassent preuve d'une plus grande transparence et qu'elles rendent davantage compte de leurs activités.
Autrement dit, ils s'attendent à être bien informés et à avoir accès à des renseignements opportuns et exacts sur les nouveaux médicaments, sur leurs prix et sur les éléments de preuve à l'appui de l'indication la plus appropriée.
Le CEPMB continue de réglementer les prix des médicaments brevetés et d'exercer un suivi diligent des tendances pharmaceutiques au Canada et dans les différents pays de comparaison pour s'assurer que ses Lignes directrices reflètent les objectifs de la Loi sur les brevets et pour protéger les intérêts des Canadiens et des Canadiennes en veillant à ce que les médicaments brevetés ne soient pas vendus à des prix excessifs au Canada.
Enfin, reconnaissant l'importance croissante de ses responsabilités en matière d'échange d'information, le CEPMB se propose de continuer de travailler en collaboration avec ses intervenants et ses partenaires aux fins de l'exercice de ses activités de réglementation et d'information, et ce, pour le plus grand bénéfice de tous les Canadiens et de toutes les Canadiennes.
Le CEPMB ne saurait exercer son mandat avec autant d'efficacité s'il ne pouvait compter sur le dévouement et le professionnalisme des membres de son personnel et des membres du Conseil. Je profite donc de l'occasion pour souligner les efforts et les contributions de nos employés. Permettez-moi de remercier plus particulièrement Mme Ingrid Sketris et M. Anthony Boardman pour leur participation insigne aux travaux du Conseil au cours des cinq dernières années. Je leur souhaite tout le succès possible dans leurs projets futurs.

Robert G. Elgie
Le Conseil d'examen du prix des médicaments brevetés est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets (Loi). Le Ministre de la Santé est responsable de l'application des dispositions pharmaceutiques de la Loi formulées aux articles 79 à 103.
Même s'il fait techniquement partie du portefeuille de la Santé le CEPMB exerce son mandat en toute indépendance du Ministre de la Santé. [1] Il fonctionne d'une façon indépendante des autres organismes, dont Santé Canada, qui vérifie l'innocuité et l'efficacité des médicaments et approuve l'inscription des médicaments sur les formulaires respectifs des provinces aux fins de leur admissibilité à un remboursement.
MANDAT
Le CEPMB est investi d'un double rôle :
RÉGLEMENTATION - Protéger les intérêts des consommateurs et contribuer au régime de santé canadien en exerçant un contrôle pour que les prix départ-usine des médicaments brevetés ne soient pas excessifs.
RAPPORTS - Éclairer les processus décisionnel et d'élaboration des politiques en établissant des rapports sur les tendances des prix des médicaments et sur les dépenses que les brevetés engagent dans la R-D.
COMPÉTENCE DU CEPMB
RÉGLEMENTATION - Le CEPMB passe en revue les prix départ-usine, à savoir les prix auxquels les brevetés vendent leurs médicaments pour usage humain ou vétérinaire distribués au Canada sous ordonnance ou en vente libre aux grossistes, aux hôpitaux et aux pharmacies pour que ces prix ne soient pas excessifs. Le CEPMB exerce un contrôle sur le prix de chaque médicament breveté, soit de chaque concentration de chaque forme posologique de chaque médicament breveté offert sur le marché canadien. C'est habituellement à ce niveau que Santé Canada attribue le numéro d'identification de drogue (DIN). C'est également à ce niveau que le CEPMB exerce son contrôle.
Au Canada, c'est Santé Canada qui évalue les nouveaux médicaments pour en assurer la conformité à la Loi sur les aliments et drogues et à son règlement d'application. L'autorisation officielle de commercialiser ou de distribuer un médicament est accordée au moyen d'un Avis de conformité (avis). Dans certains cas, un médicament peut être temporairement distribué même si l'avis de conformité n'a pas été émis, nommément à titre de drogue de recherche ou de médicament distribué dans le cadre du Programme d'accès spécial.
Le CEPMB n'est pas habilité à exercer un contrôle sur les prix des médicaments non brevetés, incluant les médicaments génériques vendus en vertu de licences obligatoires. Il n'a non plus aucun droit de regard sur les prix de vente au gros et au détail ni sur les honoraires des pharmaciens. La distribution et l'ordonnance des médicaments ne relèvent pas non plus de la compétence du CEPMB.
Le Règlement sur les médicaments brevetés (Règlement) exige des brevetés que, aux fins de la réglementation des prix, ils soumettent deux fois par année des données sur les prix et sur les ventes de chaque concentration de chaque forme posologique de chaque médicament breveté qu'ils offrent sur le marché canadien. Les brevetés sont également tenus en vertu du Règlement de présenter une fois par année un rapport sur leurs dépenses de R-D au Canada.
Les fabricants doivent également informer le CEPMB de leur intention de vendre un nouveau médicament breveté sur le marché canadien, mais ils ne sont pas tenus de faire approuver au préalable le prix auquel ils offriront leur médicament.
Les brevetés doivent se conformer aux dispositions de la Loi sur les brevets de manière à maintenir les prix des médicaments brevetés à des niveaux non excessifs. Lorsque, à l'issue d'une audience publique, le Conseil arrive à la conclusion que le prix d'un médicament vendu sur tout marché est excessif, il peut obliger le breveté à réduire le prix de son médicament et prendre les mesures qui s'imposent pour que le breveté rembourse les recettes excédentaires qu'il a perçues.
RAPPORTS - Le CEPMB rend annuellement compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur une année civile, passe en revue les principales activités du CEPMB, analyse les prix des médicaments brevetés et les tendances des prix de tous les médicaments, et fait rapport des dépenses de R-D déclarées par les titulaires de brevets pharmaceutiques. Le CEPMB fait également rapport de ses activités au moyen de son feuillet trimestriel La Nouvelle et de différentes études.
En vertu d'une entente intervenue entre les ministres fédéral, provinciaux et territoriaux de la Santé et à la demande expresse du ministre de la Santé, le CEPMB effectue des études de recherche sur l'utilisation et la gestion des produits pharmaceutiques au Canada et en fait rapport au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP).
La valeur totale des ventes au prix départ-usine des médicaments pour usage humain est évaluée à 15 milliards de dollars pour l'exercice 2003, ce qui représente une augmentation de 14,5 % par rapport à l'exercice 2002. Les brevetés ont fait rapport de ventes de médicaments brevetés totalisant 10,1 milliards de dollars, soit 14,8 % de plus que l'exercice précédent.
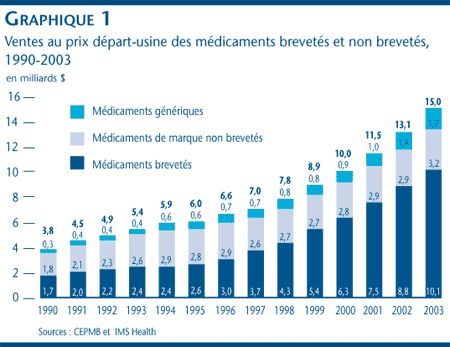
Le graphique 1 ventile la valeur totale des ventes au prix départ-usine des médicaments selon les médicaments brevetés, les médicaments de marque non brevetés et les médicaments génériques, de 1990 à 2003.
CONFORMITÉ ET LIGNES DIRECTRICES SUR LES PRIX EXCESSIFS
En vertu de l'article 82 de la Loi sur les brevets (Loi), les brevetés sont tenus de notifier le CEPMB de leur intention de lancer un médicament sur le marché canadien et de la date à laquelle ils comptent le faire.
En vertu du Règlement sur les médicaments brevetés, 1994 (Règlement), les brevetés doivent :
- remplir le formulaire Renseignements identifiant le médicament (Formulaire 1) dans les trente jours suivant la réception de l'Avis de conformité ou de la date de la première vente du médicament, soit la première éventualité
- faire rapport de l'information sur les prix de lancement et des ventes des nouveaux médicaments brevetés (Formulaire 2) dans les 60 jours suivant la date de la première vente
- tant qu'un brevet est en vigueur, continuer de soumettre des données détaillées sur les prix et les ventes de chaque médicament breveté, et ce, pour chaque semestre de l'exercice (Formulaire 2).
Le CEPMB passe en revue sur une base régulière les données fournies sur le prix de tous les médicaments brevetés offerts sur le marché canadien afin de s'assurer que les prix pratiqués sont conformes à ses Lignes directrices. Ces Lignes directrices sont publiées dans le Compendium des Lignes directrices, politiques et procédures (Compendium) qui est affiché sur notre site Internet sous la rubrique Loi, Règlement et Lignes directrices. Vous pouvez également en obtenir copie en composant notre numéro sans frais 1 877 861-2350.
LIGNES DIRECTRICES SUR LES PRIX
Les Lignes directrices sur les prix tiennent compte des facteurs de détermination des prix cités à l'article 85 de la Loi. Elles ont été formulées en consultation avec différents intervenants, dont les ministres de la Santé des provinces et des territoires, des associations de consommateurs et des représentants du secteur pharmaceutique. D'une façon générale, les Lignes directrices prévoient ce qui suit :
- les prix de la plupart des nouveaux médicaments brevetés sont limités de manière à ce que le coût de revient de la thérapie à l'aide de ce médicament ne soit pas supérieur au coût de la thérapie utilisée au Canada pour traiter la même condition
- les prix des médicaments brevetés constituant une découverte ou apportant une amélioration importante ne peuvent être supérieurs à la médiane des prix pratiqués dans les sept pays industrialisés nommés dans le Règlement, à savoir l'Allemagne, la France, l'Italie, la Suède, la Suisse, le Royaume Uni et les États-Unis)
- les taux d'augmentation des prix des médicaments brevetés existants ne peuvent être supérieurs à l'Indice des prix à la consommation
- le prix d'un médicament breveté au Canada ne peut en aucun temps être supérieur au prix le plus élevé pour le même médicament dans les pays de comparaison nommés dans le Règlement.
Le personnel du Conseil passe en revue les prix de tous les médicaments brevetés commercialisés au Canada. Le personnel effectue une enquête lorsque le prix d'un médicament breveté lui apparaît supérieur au prix que permettent les Lignes directrices du Conseil et que les circonstances justifient la tenue d'une enquête pour faire la lumière sur les faits. Vous trouverez à l'annexe 1, page 48 de plus amples explications sur les critères qui justifient la tenue d'une enquête. Une enquête peut mener aux résultats suivants :
- sa fermeture lorsque le prix se révèle conforme aux Lignes directrices
- un engagement de conformité volontaire (engagement) en vertu duquel le fabricant s'engage à réduire le prix de son médicament et à prendre d'autres mesures pour se conformer aux Lignes directrices, ou
- une audience publique pour déterminer si le prix du médicament est excessif ainsi que l'ordonnance qu'il y a lieu d'imposer.
Depuis 2001, dans un effort pour améliorer la transparence de son processus d'examen du prix, le CEPMB publie chaque mois sur son site Internet la liste des Nouveaux médicaments brevetés déclarés au CEPMB. Cette liste contient de l'information sur le statut de l'examen (par ex. sous examen, conforme aux Lignes directrices, engagement de conformité volontaire, avis d'audience). Les médicaments classés « sous examen » comprennent les médicaments sous enquête.
NOUVELLES SUBSTANCES ACTIVES APPROUVÉES EN 2003
Santé Canada a approuvé 16 nouvelles substances actives (NSA) en 2003, mais elles n'ont pas toutes été offertes sur le marché canadien la même année. [2] La liste du CEPMB des nouvelles substances actives n'est pas nécessairement identique à celle des nouvelles substances approuvées par la Direction des produits thérapeutiques de Santé Canada pour l'une ou l'autre des raisons suivantes :
- la NSA n'est pas brevetée et, par conséquent, n'est pas assujettie à la compétence du CEPMB
- la NSA ne figure pas sur la liste de la Direction des produits thérapeutiques parce qu'elle est vendue au titre du Programme d'accès spécial avant même d'avoir reçu son Avis de conformité
- la NSA peut avoir été approuvée, mais elle n'a pas encore été vendue.
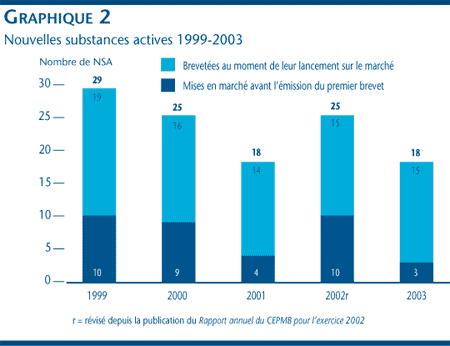
Comme le montrent le tableau 1 à la page 13 et le graphique 2, trois des 18 NSA brevetées qui sont devenues assujetties à l'examen du Conseil étaient vendues sur le marché canadien avant 2003.
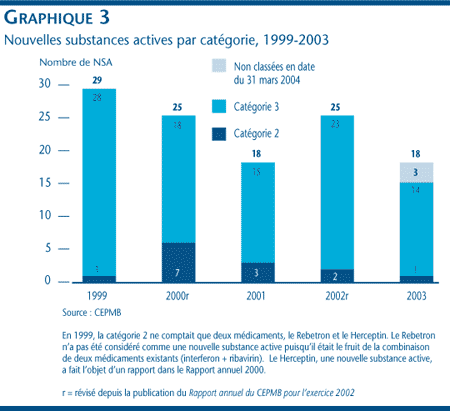
Une nouvelle substance active peut être associée à différents DIN lorsqu'elle est distribuée sous diverses formes posologiques et dans diverses concentrations. Les 18 NSA approuvées en 2003 ont été commercialisées sous 28 présentations (DIN). Le graphique 3 ventile les NSA brevetées pour usage humain par catégorie attribuée aux fins de l'examen des prix pour la période de 1999 à 2003 inclusivement. [3]
Tableau 1 Nouveaux médicaments brevetés pour usage humain lancés sur le marché canadienen 2003 - Nouvelles substances actives
| Nouvelles substances actives lancées sur le marché canadien en 2003 |
| Nom de marque |
Nom chimique |
Société |
Nbre de DIN |
Catégorie ATC |
| Angiomax |
bivalirudine |
Oryx Pharmaceuticals Inc. |
1 |
B01AE |
| Bextra |
valdecoxib |
Pfizer Canada Inc. |
2 |
M01AH03 |
| Cialis |
tadalafil |
Eli Lilly Canada Inc. |
2 |
G04BE08 |
| Crestor |
rosuvastatine calcique |
AstraZeneca Canada Inc. |
3 |
C10AA07 |
| Dukoral |
vaccin anticholérique |
Aventis Pasteur Limitée |
1 |
J07AE01 |
| Elidel |
pimecrolimus |
Novartis Pharmaceuticals Canada Inc. |
1 |
D11AX15 |
| Ezetrol |
ezetimibe |
Merck Frosst Canada Inc. |
1 |
C10AX09 |
| Hectorol |
doxercalciférol |
Shire Biochem Inc. |
1 |
A11CC |
| Invanz |
ertapenem sodique |
Merck Frosst Canada Inc. |
1 |
J01DH03 |
| Keppra |
lévétiracétam |
Lundbeck Canada Inc. |
3 |
N03AX14 |
| Ketek |
télithromycine |
Aventis Pharma Inc. |
1 |
J01FA15 |
| Pegasys |
peginterferon alfa-2a |
Hoffmann La-Roche Canada |
2 |
L03AB11 |
| Solagé |
méquinol/trétinoïne |
Galderma Canada Inc. |
1 |
D11AX56 |
| TNKase |
tenecteplase |
Hoffmann La-Roche Canada |
1 |
B01AD11 |
| Xigris |
drotrécogine alfa |
Eli Lilly Canada Inc. |
2 |
B01AD10 |
| Nouvelles substances actives disponibles sur le marché canadien avant 2003 [4] |
| Nom de marque |
Nom chimique |
Société |
Nbre de DIN |
Catégorie ATC |
| Agenerase |
amprénavir |
GlaxoSmithKline |
3 |
J05AE05 |
| Alertec |
modafinil |
Shire Biochem Inc. |
1 |
N06BA07 |
| Evra |
norelgestromin/ethinyl estradiol |
Janssen-Ortho Inc. |
1 |
G03AA11 |
Les renseignements de l'année 2000 ont été mis à jour pour inclure l'examen du prix du Dostinex (cabergoline, Pfizer Canada, Inc.) effectué par le Groupe consultatif sur les médicaments pour usage humain (GCMUH). [5] Ce médicament avait fait l'objet d'un examen préliminaire et avait été rapporté comme médicament de catégorie 3 dans le rapport annuel pour l'exercice 2000. Pour de plus amples renseigements sur le Dostinex, veuillez consulter la page 17.
En 2003, le GCMUH a recommandé l'inscription d'un nouveau médicament breveté (représentant 2 DIN) dans la deuxième catégorie de nouveaux médicaments :
- Xigris (drotrecogine alfa, Eli Lilly Canada Inc.), indiqué pour le traitement de la septie. Le rapport sommaire de ce médicament est présenté sur notre site Internet sous la rubrique Médicaments brevetés.
Depuis la publication de notre rapport annuel pour l'exercice 2002, nous avons mis à jour les graphiques 2 et 3 de manière à y inclure le BLES (surfactant d'extrait de lipide bovin-protéines associées B & C, BLES Biochemicals Inc.), une nouvelle substance active lancée sur le marché canadien en 2002. Le fabricant de cette NSA n'avait pas été en mesure de présenter ses rapports sur ce médicament dans les délais requis pour le rapport annuel 2002. Le BLES a été soumis à l'examen du GCMUH qui a recommandé son inscription dans la troisième catégorie des nouveaux médicaments. Son prix a fait l'objet d'un examen et été a jugé conforme aux Lignes directrices.
Les rapports sommaires des examens du prix des NSA sont affichés sur notre site Internet une fois complétés.
NOUVEAUX MÉDICAMENTS BREVETÉS COMMERCIALISÉS AU CANADA EN 2003
Au total, 70 nouveaux médicaments pour usage humain (DIN) ont été lancés sur le marché canadien en 2003. Certains de ces nouveaux médicaments représentent une ou plusieurs concentrations d'une NSA et d'autres, de nouvelles présentations de médicaments existants.
Aux fins de notre examen du prix, tout médicament breveté lancé sur le marché canadien ou commercialisé avant l'obtention de son premier brevet entre le 1er décembre 2002 et le 30 novembre 2003 est réputé être un nouveau médicament breveté en 2003. [6]
Des 70 nouveaux DIN brevetés, sept (10 %) ont été commercialisés au Canada avant 2003, l'année d'obtention d'un premier brevet canadien qui les assujettit automatiquement à la compétence du Conseil. Ces DIN sont identifiés par les lettres PBA (pour premier brevet accordé) dans l'annexe 2, à la page 49. Le tableau 2 présente le nombre de médicaments brevetés selon la première année de leur commercialisation. Pour ces médicaments, le délai écoulé entre la date de la première vente et celle de l'obtention du premier brevet varie entre plusieurs mois et neuf années.
Tableau 2 Nouveaux medicaments brevetés pour usage humain en 2003, ventilation selon l'année de leur première vente
| Année de leur première vente |
Nbre de DIN |
| 2003 |
63 |
| 2002 |
2 |
| 2001 |
3 |
| 1999 |
1 |
| 1996 |
1 |
| Total |
70 |
EXAMEN DU PRIX DES NOUVEAUX MÉDICAMENTS BREVETÉS POUR USAGE HUMAIN
La liste des 70 nouveaux médicaments brevetés, incluant le statut de l'examen des prix en date du 31 mars 2004, est présentée à l'annexe 2, à la page 49. Des 70 nouveaux DIN brevetés, 64 avaient fait l'objet d'un examen du prix au moment de la publication du présent rapport. De ces 64 DIN, 52 ont été commercialisés à des prix jugés conformes aux Lignes directrices du Conseil et 12 à des prix supérieurs aux prix autorisés, justifiant ainsi l'amorce d'une enquête. De plus amples explications sur les critères qui justifient la tenue d'une enquête sont présentés à l'annexe 1, à la page 48.
EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS POUR USAGE HUMAIN
Aux fins du présent rapport, les médicaments existants désignent tous les médicaments brevetés commercialisés sur le marché canadien avant le 1er décembre 2002. Les Lignes directrices du CEPMB limitent les augmentations des prix des médicaments existants aux variations de l'Indice des prix à la consommation (IPC). Par ailleurs, le prix d'un médicament breveté ne peut être supérieur à son prix de vente le plus élevé des sept pays de comparaison nommés dans le Règlement (qui sont l'Allemagne, la France, l'Italie, la Suède, la Suisse, le Royaume Uni et les États-Unis).
Au total, 974 médicaments brevetés existants pour usage humain (DIN) ont été commercialisés au Canada au cours de l'exercice 2003. En début d'exercice, 67 enquêtes étaient en cours et 6 nouvelles se sont ajoutées en cours d'année parce que les prix de ces médicaments ne semblaient pas conformes. En fin d'exercice, 39 des 73 enquêtes demeuraient en cours.
Au moment de la rédaction du présent rapport :
- les prix des 891 DIN existants (91,5%) ont, après examen, été jugés conformes aux Lignes directrices du Conseil
- 39 DIN étaient sous enquête en raison des prix pratiqués au cours d'exercices antérieurs
- 3 DIN, tous concernant le Nicoderm, faisaient l'objet d'une audience en vertu de l'article 83 de la Loi (voir la rubrique Activités quasi-judiciaires à la page 19)
- 41 DIN étaient encore sous examen.
Le tableau 3 qui suit présente un aperçu du statut d'examen, de conformité et d'enquête en date du 31 mars 2004, des médicaments nouveaux et existants commercialisés au Canada au cours de l'exercice 2003.
Au cours des 12 derniers mois, le CEPMB s'est intéressé d'une façon toute particulière à certaines initiatives touchant le projet d'examen des échéanciers (voir page 37). Ce projet a donné lieu à une diminution importante du nombre d'enquêtes en cours qui sont passées de 67 à 51 entre le 31 mars 2003 et le 31 mars 2004.
Tableau 3 Médicaments brevetés pour usage humain commercialisés au Canada en 2003 - Statut de l'examen du prix en date du 31 mars 2004
| |
Nouveaux
médicaments
commercialises
en 2003 |
Médicaments
existants |
Total |
| Conformes aux Lignes directrices |
52 |
891 |
943 |
| Sous examen |
6 |
41 |
47 |
| Sous enquête |
12 |
39 |
51 |
| Avis d'audience |
- |
3 |
3 |
| Total |
70 |
974 |
1 044 |
SUIVI DU RAPPORT ANNUEL 2002
Dans son rapport annuel de l'an dernier, le Conseil mentionnait que les prix de 82 des 1 027 médicaments brevetés pour usage humain commercialisés au Canada en 2002 étaient sous examen au moment d'être mis sous presse. Il est ressorti de ces examens que les prix de 52 de ces médicaments étaient conformes aux Lignes directrices et que les prix de 5 DIN ne semblaient pas conformes et justifiaient la tenue d'une enquête. Les prix de 25 DIN encore sous examen sont comptabilisés dans le tableau 3.
Le Conseil mentionnait également dans son rapport annuel de 2002 que 67 DIN étaient sous enquête. Trente-quatre de ces enquêtes étaient closes au moment de la rédaction du présent rapport et dans 32 de ces cas, les prix ont été reconnus conformes aux Lignes directrices. Deux cas, à savoir l'Aromasin et le Dostinex, ont été réglés au moyen d'un Engagement de conformité volontaire (voir la rubrique Engagements de conformité volontaire à la page 17).
MÉDICAMENTS BREVETÉS POUR USAGE VÉTÉRINAIRE
En mars 1999, le CEPMB a mis à l'essai un processus d'examen qui ne s'engage que sur réception d'une plainte concernant le prix d'un médicament pour usage vétérinaire breveté. Pour de plus amples renseignements sur ce processus, veuillez consulter la section du présent rapport portant l'intitulé « Projet témoin de réglementation des prix des médicaments pour usage vétérinaire », à la page 36.
En 2003, le Conseil dénombrait 89 médicaments brevetés pour usage vétérinaire, dont deux lancés sur le marché canadien au cours de l'exercice 2003. Notre rapport annuel 2002 mentionnait que les prix de 13 de ces médicaments étaient sous examen. Depuis, les prix de huit de ces 13 médicaments ont été jugés conformes aux Lignes directrices, alors que les prix de cinq autres, plus ceux des deux nouveaux médicaments lancés sur le marché canadien en 2003, étaient sous examen au moment de la rédaction du présent rapport. Les rapports sommaires de l'examen du prix des médicaments pour usage vétérinaire sont affichés sur notre site Internet sous les rubriques Médicaments brevetés; et Rapports sur les nouveaux médicaments brevetés pour usage vétérinaire.
En vertu de l'article 98(4) de la Loi sur les brevets (Loi), le CEPMB peut délivrer un certificat de décision préalable (certificat) s'il est convaincu qu'il n'aura pas de motifs suffisants pour rendre l'ordonnance prévue à l'article 83.
VIREAD, GILEAD SCIENCES INC.
Le 13 avril 2004, le Président du Conseil a publié un Avis et Commentaires dans lequel il proposait d'émettre, en vertu de l'article 98(4) de la Loi, un certificat portant sur le prix du médicament breveté Viread.
À l'issue de négociations entre Gilead Sciences Inc. (Gilead) et le personnel du Conseil, Gilead a demandé au Conseil d'émettre un certificat portant sur le prix moyen de vente du Viread à 15,12 $ le comprimé de 300 mg. Le personnel du Conseil a recommandé au Conseil de conclure qu'il n'avait pas de motifs justifiant une ordonnance en vertu de l'article 83 de la Loi en ce qui concerne le Viread, et ce, à la lumière des facteurs mentionnés à l'article 85 de la Loi :
- Le prix canadien proposé pour 2004 est inférieur à la médiane des prix internationaux. De fait, le prix canadien du Viread est le deuxième plus bas de tous les prix pratiqués dans les sept pays de comparaison
- Le prix proposé reflète la relation du prix du Viread par rapport aux prix des autres médicaments de la même catégorie thérapeutique pratiqués dans d'autres pays
- La demande d'examen du prix proposé souscrit aux politiques du Conseil selon lesquelles les brevetés devraient demander conseil concernant le prix auquel ils envisagent offrir leur médicament breveté
- Les variations du prix du Viread au cours des prochaines années seront assujetties aux Lignes directrices.
Le Viread est indiqué pour le traitement des infections au VIH-1. Le 18 mars 2003, Santé Canada a émis un Avis de conformité conditionnel à Gilead pour le comprimé Viread de 300 mg. Le Viread a été lancé sur le marché canadien le 15 mars 2004.
Les personnes intéressées à faire valoir leurs représentations dans la présente instance devaient soumettre un mémoire écrit au Conseil au plus tard le 7 mai 2004. Le personnel du Conseil et Gilead ont été invités à répondre par écrit aux mémoires soumis au Conseil au plus tard le 25 mai 2004.
La décision du président du Conseil dans cette affaire sera affichée sur le site Internet du CEPMB dès qu'il aura eu l'occasion de prendre connaissance des mémoires reçus.
L'Avis et Commentaires de même que le certificat proposé sont disponibles sur le site du CEPMB sous les rubriques Publications; Avis et Commentaires - Viread.
En vertu de la politique de conformité et d'application du CEPMB, les brevetés ont la possibilité de conclure un engagement de conformité volontaire (engagement) lorsque, après enquête, le personnel du Conseil arrive à la conclusion que le prix d'un médicament semble supérieur au prix maximal autorisé en vertu des Lignes directrices sur les prix excessifs. L'approbation de cet engagement par le président constitue une alternative aux procédures quasi-judiciaires qui s'engagent avec la publication d'un Avis d'audience. La politique du Conseil sur la conformité et l'application autorise la présentation d'un engagement de conformité volontaire après la publication d'un Avis d'audience. L'engagement soumis à ce point requiert l'aval du Conseil.
En 2003, le président du Conseil a approuvé deux engagements visant deux médicaments brevetés, à savoir l'Aromasin et le Dostinex.
De plus, le 31 mars 2003, le Conseil a approuvé un engagement soumis par le titulaire du brevet du médicament Remicade.
En mai 2004, avant la publication du présent rapport, le président du Conseil a approuvé un engagement pour le médicament breveté One-Alpha.
REMICADE, SCHERING CANADA INC.
Le 16 décembre 2002, le président du Conseil a publié un Avis d'audience dont l'objet était de déterminer si, en vertu des articles 83 et 85 de la Loi sur les brevets (Loi), le médicament breveté Remicade était vendu ou avait été vendu par Schering Canada Inc. (Schering) à des prix supérieurs aux prix autorisés en vertu de ses Lignes directrices. Cette affaire avait été commentée à la page 16 de notre rapport annuel pour l'exercice 2002.
Le Remicade est vendu en vertu d'un Avis de conformité délivré par Santé Canada le 6 juin 2001 pour le traitement de la maladie de Crohn. Un Avis de conformité a également été délivré le 27 septembre 2001 pour le traitement de l'arthrite rhumatoïde.
Une conférence préparatoire a été organisée en février 2003 au cours de laquelle la date de l'audience a été fixée au 22 avril suivant. Le 18 mars, Schering et le personnel du Conseil ont conjointement soumis à l'approbation du Conseil un engagement proposant un règlement aux problèmes mentionnés dans l'Avis d'audience. Le Conseil a accepté cet engagement qui fait profiter les patients d'une réduction immédiate de 20 % du prix du Remicade et qui ramène ainsi le prix du médicament à un niveau conforme aux Lignes directrices du CEPMB. Aux termes de l'engagement, le prix de transaction d'une fiole de Remicade ne pouvait être supérieur à 909,51 $ pour le reliquat de l'année 2003. Il a été établi dans l'engagement que, conformément aux Lignes directrices, le prix du Remicade ne pourra augmenter davantage que l'Indice des prix à la consommation (IPC). Enfin, en guise de remboursement des recettes excessives qu'il a perçues, Schering a remis environ 7,8 millions de dollars au gouvernement du Canada.
AROMASIN, PHARMACIA CANADA INC.
Le 26 avril 2003, le président a approuvé l'engagement que lui a soumis Pharmacia Canada Inc. pour son médicament Aromasin (exemestane). Cette affaire avait été commentée à la page 16 de notre rapport annuel pour l'exercice 2002.
DOSTINEX, PFIZER CANADA INC.
Le 21 octobre 2003, le président a approuvé l'engagement que lui a soumis Pfizer Canada Inc. pour son médicament Dostinex (cabergoline).
Le Dostinex a été lancé sur le marché canadien le 30 juin 2000 par Pharmacia Canada Inc. (devenue depuis Pfizer Canada Inc.). Ce médicament est utilisé pour le traitement de l'hyperprolactinémie, l'inhibition de la lactation physiologique et la suppression de la lactation établie. Le 8 novembre 2000, le brevet associé au Dostinex étant arrivé à échéance, son fabricant a fait valoir qu'il n'était plus, dès lors, assujetti à la compétence du CEPMB. Dans les faits, quatre demandes de brevet avaient été déposées pour le Dostinex, mais aucun des brevets demandés n'avait encore été délivré. Dostinex est encore commercialisé sur le marché canadien. Dans l'édition de juin 2003 de la « Liste de médicaments du Québec », le médicament était offert à 12,65 $ le comprimé.
Aux termes des Lignes directrices, le Dostinex a été classé comme nouveau médicament de la catégorie 2 étant donné qu'il donne lieu à une amélioration importante des bienfaits thérapeutiques. La médiane des prix pratiqués dans les différents pays de comparaison a été établie à l'aide de la Comparaison des prix internationaux. Il en est ressorti que le prix de lancement du Dostinex était supérieur au prix maximal non excessif (MNE) et que le breveté avait perçu entre le 30 juin et le 8 novembre 2000 des recettes excédentaires totalisant 42 116,31 $.
Les modalités et les conditions de l'engagement ont été négociées par le personnel du Conseil et le breveté. À la lumière des éléments de preuve portés à sa connaissance, le président a approuvé l'engagement soumis par Pfizer. Selon les modalités de l'engagement, Pfizer a remboursé les recettes excédentaires qu'il avait perçues entre le 30 juin et le 8 novembre 2000 en remettant au gouvernement du Canada un chèque de 42 116,31 $.
ONE-ALPHA, LEO PHARMA INC.
Le 6 mai 2004, le président du Conseil a approuvé un engagement soumis par LEO Pharma Inc. pour son médicament One-Alpha (alfacalcidol).
One-Alpha est indiqué pour l'hypocalcémie, de l'hyperthyroïdisme secondaire et de l'ostéotrophie chez les patients souffrant d'insuffisance rénale chronique.
LEO Pharma a commencé à vendre son médicament One-Alpha le 1er janvier 2001, mais son brevet est arrivé à échéance le 12 mai 2004.
Aux termes des Lignes directrices sur les prix excessifs, la solution injectable One-Alpha a été classée dans la troisième catégorie des nouveaux médicaments, celle-ci représentant une nouvelle forme posologique d'un médicament existant. Avant l'introduction de la formulation parentérale, One-Alpha était disponible sur le marché canadien sous forme de gélules et de gouttes. Après avoir appliqué les Lignes directrices, le personnel du Conseil est arrivé à la conclusion qu'à 15,00 $ le millilitre, le prix du médicament One-Alpha dépassait de 20 % le prix maximum non excessif de 12,50 $ établi pour 2001. Malgré la réduction de son prix en 2002 et 2003, le prix du One-Alpha était encore supérieur au prix autorisé par les Lignes directrices sur les prix excessifs, cette fois dans une mesure de moins de 5 %. Après calcul, le personnel est arrivé à la conclusion que LEO Pharma a perçu entre le 1er janvier 2001 et le 31 décembre 2003 des recettes excessives totalisant 23 049,10 $.
En application des modalités de l'engagement, LEO Pharma a, dans les 30 jours qui ont suivi l'acceptation de l'engagement, réduit le prix de vente moyen de son médicament de manière à ce qu'il ne dépasse pas le prix maximal non excessif établi à 13.3750 $ le millilitre pour 2004. Enfin, en guise de remboursement des recettes excessives perçues entre le 1er janvier 2001 et le 31 décembre 2003, LEO Pharma a versé le montant de 23 049,10 $ au gouvernement du Canada.
Les prix de l'Aromasin et du Remicade sont assujettis à la compétence du Conseil jusqu'à la date d'échéance de leurs brevets respectifs.
En vertu de l'article 103 de la Loi sur les brevets, le Ministre de la Santé peut conclure avec toute Province des ententes concernant le partage avec Celle-ci des sommes perçues en vertu d'ordonnances Faites au titre de la loi.
Les modalités des engagements sont présentées sur Notre site Interet sous la rubrique Publications.
FASTURTEC, SANOFI-SYNTHELABO CANADA INC.
Le président du Conseil a émis un avis d'audience le 21 mai 2004 afin de déterminer, aux termes des articles 83 et 85 de la Loi sur les brevets, si Sanofi-Synthelabo Canada Inc. vend ou a vendu au Canada, le médicament connu sous le nom de Fasturtec sur un marché canadien à un prix que le Conseil juge excessif.
Fasturtec est vendu au Canada en vertu du Programme d'accès spécial de Santé Canada depuis le 21 mai 2002. Ce médicament est indiqué pour le traitement et la prévention de l'hyperuricémie chez les enfants et les adultes atteints d´un cancer. Il est administré par intraveineuse.
Une audience publique est prévue pour le 23 août 2004 et une conférence préparatoire à l'audience se tiendra le 6 juillet 2004.
Toute demande de renseignements doit être adressée à la Secrétaire du Conseil.
REMICADE, SCHERING CANADA INC.
Le 16 décembre 2002, le président du Conseil a émis un Avis d'audience aux fins de déterminer en vertu des articles 83 et 85 de la Loi sur les brevets si Schering Canada Inc. vendait ou avait vendu sur le marché canadien son médicament Remicade à des prix non conformes aux Lignes directrices. Vous trouverez les détails de cette affaire dans la section « Engagements de conformité volontaire » du présent rapport à la page 17.
NICODERM, HOECHST MARION ROUSSEL CANADA INC.
Le 20 avril 1999, le président du Conseil a émis un Avis d'audience aux fins de déterminer en vertu des articles 83 et 85 de la Loi sur les brevets si Hoechst Marion Roussel Canada Inc. (HMRC) vendait ou avait vendu sur le marché canadien son médicament Nicoderm à des prix que le Conseil considère excessifs et, le cas échéant, déterminer l'ordonnance qu'il y a lieu d'imposer. Ce cas a été mentionné dans le rapport annuel de l'an dernier à la page 17.
Suite aux décisions rendues en 1999 et 2000 par lesquelles le Conseil confirmait qu'il était habilité à tenir une audience sur le prix du Nicoderm, HMRC a déposé deux demandes de révision judiciaire devant la Cour fédérale du Canada visant à faire infirmer les décisions du Conseil. Ces deux demandes n'ont pas encore été entendues sur le fond, mais la Cour fédérale et la Cour d'appel fédérale ont entendu des requêtes interlocutrices.
Le 25 juin 2003, le protonotaire de la Cour fédérale a entendu une requête dans laquelle HMRC demandait d'obliger le personnel du Conseil à déposer son rapport au président. Dans une décision rendue le 14 novembre 2003, le protonotaire a rejeté la demande de HMRC. HMRC a interjeté appel de cette décision devant la Cour fédérale. Le 31 mars 2004, la Cour fédérale a rendu elle aussi une décision négative.
Bien que la Cour fédérale n'ait pas encore arrêté une date d'audience sur le fond, il est prévu que l'audience aura lieu vers la fin de l'automne.
Le Nicoderm est un timbre de nicotine transdermique administré pour atténuer les symptômes d'assuétude à la nicotine chez les personnes qui cessent de fumer.
Les décisions du Conseil sont affichées sur notre site Internet, sous les rubriques Publications; Audiences.
Comme le révèle le tableau 4 présenté à la page 21, le CEPMB estime que la valeur totale des ventes au prix départ-usine des médicaments pour usage humain au Canada a augmenté de 14,5 % par rapport à l'exercice 2002 pour se situer à 15 milliards de dollars. [7] Cette augmentation est légèrement supérieure à l'augmentation de 13,9 % enregistrée en 2002 et constitue la sixième augmentation de suite de plus de 10 %.
Selon l'information que les brevetés ont soumis au CEPMB, la valeur des ventes des médicaments brevetés a augmenté de 14,8 % en 2003 pour totaliser 10,1 milliards de dollars. Ce taux de croissance est le taux le plus bas enregistré depuis 1996.
Le graphique 1, présenté à la page 10, révèle la valeur des ventes des différents médicaments, brevetés et non brevetés. Pour 2003, les médicaments brevetés ont comme en 2002 représenté 67,4 % de l'ensemble des ventes de médicaments. La part du marché occupée par les médicaments brevetés a constamment augmenté entre 1996 (alors que les médicaments brevetés représentaient 45 % de la valeur des ventes de médicaments) et 2002.
Les médicaments non brevetés comprennent les produits dont les brevets sont arrivés à échéance, les produits qui ne bénéficient pas encore ou qui ne bénéficieront jamais de la protection d'un brevet ainsi que les copies génériques des médicaments de marque. Avant 1996, les ventes des médicaments de marque non brevetés représentaient près de la moitié de la valeur totale des ventes de médicaments. Cette proportion a depuis baissé d'une façon constante pour se situer à 21,3 % (3,2 milliards de dollars) en 2003. Par contre, la valeur des ventes de médicaments génériques a varié d'une façon légère, mais constante entre 1996 et 2003, passant de 11,7 % (0,7 milliard de dollars) à 11,3 % (1,7 milliard de dollars).
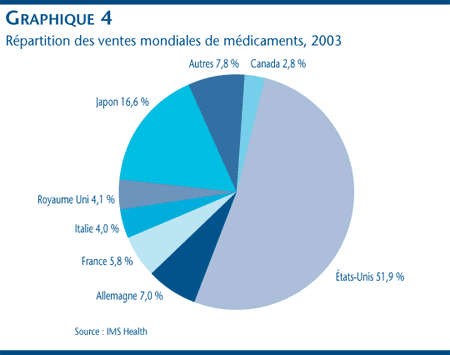
La valeur au prix départ-usine des ventes de médicaments pour usage humain sur les grands marchés mondiaux a été évaluée à 409 milliards de dollars pour l'année terminée en novembre 2003. [8] Comme le montre le graphique 4, la valeur des ventes de médicaments au Canada a représenté 2,8 % de ce montant. Le marché des États-Unis est le plus important au monde, avec plus de deux fois la valeur combinée des ventes au Canada, en France, en Allemagne, en Italie et au Royaume Uni.
Tableau 4 - Ventes au prix départ-usine de tous les médicaments et des médicaments brevetés pour usage humain et vétérinaire (1990-1998) et pour usage humain seulement (1999-2003)
| Exercice |
Total |
Médicaments brevetés |
Médicaments brevetés (% de la valeur totale des ventes) |
Ventes
(milliards $) |
Variation*
(%) |
Ventes
(milliards $) |
Variation*
(%) |
| 2003 |
15,0 |
14,5 |
10,1 |
14,8 |
67,4 |
| 2002 |
13,1 |
13,9 |
8,8 |
17,3 |
67,4 |
| 2001 |
11,5 |
15,0 |
7,5 |
18,9 |
65,0 |
| 2000 |
10,0 |
12,4 |
6,3 |
16,7 |
63,0 |
| 1999** |
8,9 |
16,8 |
5,4 |
27,0 |
61,0 |
| 1998 |
7,8 |
11,4 |
4,3 |
18,9 |
55,1 |
| 1997 |
7,0 |
7,0 |
3,7 |
22,6 |
52,3 |
| 1996 |
6,6 |
10,0 |
3,0 |
12,8 |
45,0 |
| 1995 |
6,0 |
1,7 |
2,6 |
10,8 |
43,9 |
| 1994 |
5,9 |
9,3 |
2,4 |
-2,1 |
40,7 |
| 1993 |
5,4 |
12,5 |
2,4 |
9,4 |
44,4 |
| 1992 |
4,8 |
9,1 |
2,2 |
14,0 |
43,8 |
| 1991 |
4,4 |
18,9 |
2,0 |
13,1 |
43,2 |
| 1990 |
3,7 |
- |
1,7 |
- |
43,2 |
* Le pourcentage de variation reflète les valeurs exactes de la valeur totale des ventes et non les valeurs arrondies.
** Le pourcentage de variation par rapport à 1998 de 16,8 % pour l'ensemble des médicaments et de 27,0 % pour les médicaments brevetés ne reflète que la variation des ventes des médicaments pour usage humain.
Sources : CEPMB et IMS Health |
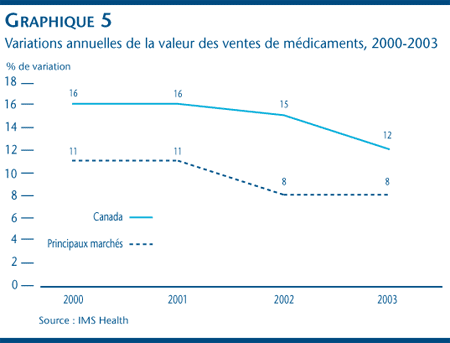
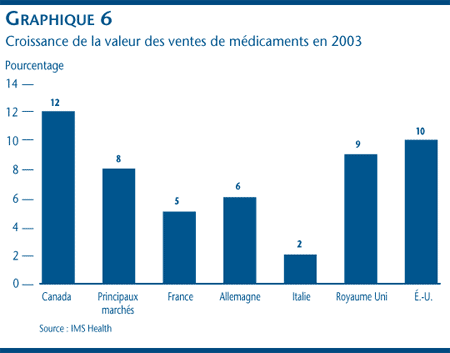
Selon IMS Health, la valeur des ventes de médicaments a augmenté plus rapidement au Canada ces dernières années qu'elle n'a augmenté sur les autres grands marchés, ce que révèle également le graphique 5. Le graphique 6 montre pour sa part que le taux de croissance annuelle des ventes au Canada (qui, en 2003, était de 12 %) est supérieur à celui des États-Unis (10 %), du Royaume Uni (9 %), de l'Allemagne (6 %), de la France (5 %) et de l'Italie (2 %).
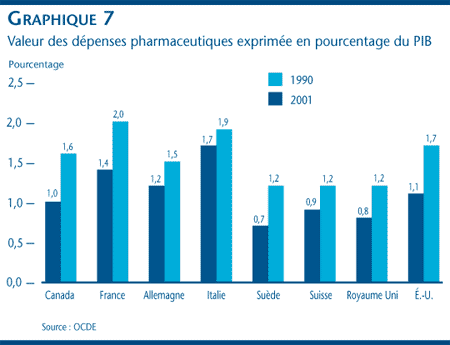
Le graphique 7 présente la valeur des achats de produits pharmaceutiques par rapport aux PIB de différents pays rapportés par l'OCDE. [9] Pour la période de 1990 à 2001, chaque pays a enregistré une augmentation de son ratio de dépenses pharmaceutiques par rapport au PNB. Le ratio du Canada, qui est passé de 1,0 % à 1,6 %, demeure dans la fourchette des ratios déclarés pour les autres pays, exception faite du ratio des États- Unis qui, à 1,7 %, lui est légèrement supérieur.
PRIX DES MÉDICAMENTS BREVETÉS EN 2003
Le CEPMB compile l'Indice des prix des médicaments brevetés (IPMB) qui lui permet d'observer les tendances des prix départ-usine des médicaments brevetés. L'IPMB mesure la variation moyenne par rapport à l'année précédente des prix départ-usine des médicaments brevetés offerts sur le marché canadien. L'IPMB est calculé chaque année à l'aide des données sur les prix et les ventes déclarées par les brevetés. [10]
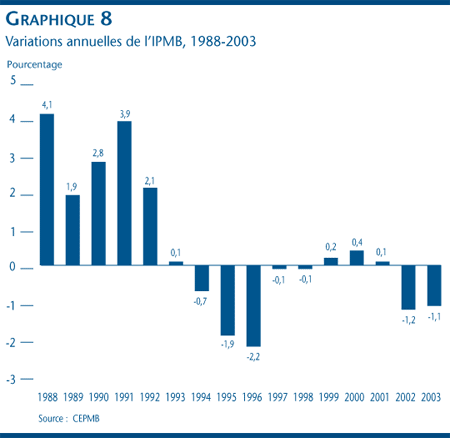
Les prix départ-usine des médicaments brevetés, mesurés à l'aide de l'IPMB, comme le montre le graphique 8, ont diminué de 1,1 % en 2003. Ce résultat s'inscrit dans la tendance des prix à la baisse et d'augmentations négligeables amorcée en 1993. La stabilité des prix observée en 2003 est généralisée. En effet, les prix de la plupart des médicaments brevetés ont reculé ou augmenté de moins de 1 % en 2003.
TENDANCES DES PRIX DE TOUS LES MÉDICAMENTS - BREVETÉS ET NON BREVETÉS
La Loi sur les brevets prévoit que le CEPMB doit tenir compte, entre autres, des variations de l'Indice des prix à la consommation (IPC) lorsqu'il vérifie si le prix d'un médicament breveté est excessif. Comme l'illustre le graphique 9, les prix des médicaments brevetés, mesurés à l'aide de l'IPMB, n'ont pas autant augmenté que l'IPC depuis 1988. [11] Cette tendance s'est maintenue en 2003, en ce sens que l'indice des prix à la consommation a augmenté davantage que l'indice des prix des médicaments brevetés, enregistrant une augmentation de 3,9 %. [12]
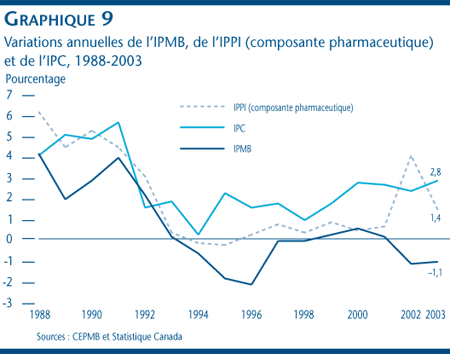
Il n'est donc pas étonnant que les augmentations des prix mesurées à l'aide de l'IPMB aient toujours été inférieures à celles de l'IPC. Ce fait est attribuable à une caractéristique des Lignes directrices du CEPMB qui prévoit que les augmentations de prix sur une période de trois ans ne peuvent être supérieures au taux moyen d'augmentation de l'IPC sur une même période. Cette exigence, appliquée aux médicaments brevetés sur une base individuelle, limite les augmentations des prix des médicaments à celles de l'inflation sur une période de trois ans ou plus. [13] En pratique, le taux d'augmentation de l'IPMB n'atteint jamais le plafond établi, car les fabricants n'augmentent pas tous leurs prix dans toute la mesure autorisée en vertu des Lignes directrices du CEPMB et certains les réduisent même.
INDICE DES PRIX DES PRODUITS INDUSTRIELS (IPPI)
Le graphique 9, à la page 23, présente les variations annuelles de la composante pharmaceutique de l'Indice des prix des produits industriels de Statistique Canada [IPPI (composante pharmaceutique)]. Cette composante mesure les variations des prix départ-usine de tous les produits pharmaceutiques, brevetés et non brevetés, fabriqués au Canada pour la consommation au pays et pour l'exportation. [14] En 2003, la composante pharmaceutique de l'IPPI a augmenté de 1,4 %, après n'avoir pratiquement pas bougé entre 1993 et 2001 et avoir augmenté de 4,0 % en 2002. [15]
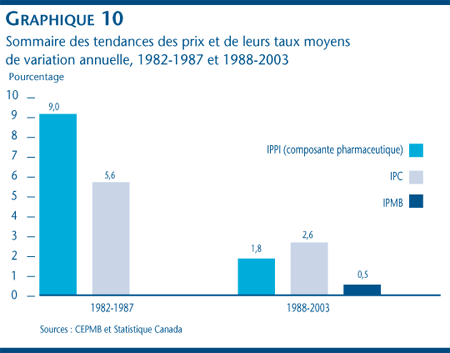
Comme le montre le graphique 10, la tendance des prix départ-usine des produits pharmaceutiques s'est nettement renversée depuis 1987. En effet, entre 1988 et 2003, l'IPPI (composante pharmaceutique) a enregistré une augmentation moyenne de 1,8 % par année, soit une augmentation supérieure à celle de l'IPMB qui se situe à 0,5 %, mais inférieure à l'augmentation de 2,6 % de l'IPC. La situation était bien différente entre 1982 et 1987 où les prix de tous les médicaments mesurés à l'aide de l'IPPI (composante pharmaceutique) ont enregistré une augmentation moyenne de 9,0 % par année alors que l'indice des prix à la consommation connaissait une hausse annuelle moyenne de 5,6 %.
TENDANCES DES PRIX DES MÉDICAMENTS AU CANADA ET AUX ÉTATS-UNIS
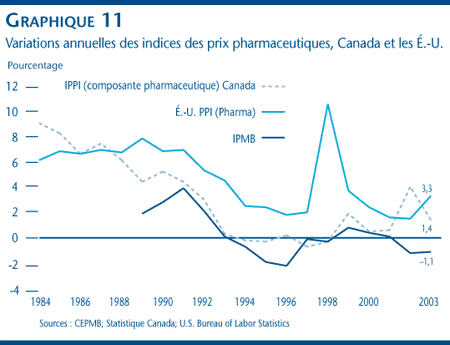
Le graphique 11 présente une comparaison des variations annuelles de la composante pharmaceutique de l'Indice des prix des produits [PPI (composante pharmaseutique)] des États-Unis et des variations annuelles de l'IPPI (composante pharmaceutique) avant et après 1987. Le PPI (composante pharmaceutique) mesure les augmentations des prix départ-usine de tous les produits pharmaceutiques. [16] Cet indice est compilé comme l'IPPI (composante pharmaceutique) de Statistique Canada.
Ici encore, la tendance à la hausse des prix s'est inversée à compter de 1987. En effet, avant 1987, l'IPPI (composante pharmaceutique) canadien a augmenté plus rapidement que le PPI (composante pharmaceutique) des États-Unis. Par contre, de 1987 à 2003, la croissance du IPPI (composante pharmaceutique) canadien a été beaucoup plus lente, exception faite de l'année 2002. La croissance de l'IPMB a été plus lente que celle du PPI (composante pharmaceutique) des États-Unis au cours de cette période.
RELATION ANTÉRIEURE ET ACTUELLE ENTRE LES PRIX DES MÉDICAMENTS PRATIQUÉS AU CANADA ET CEUX PRATIQUÉS À L'ÉTRANGER
Les résultats présentés dans la section précédente donnent un aperçu de l'évolution des prix des médicaments au Canada. On peut également en tirer des comparaisons des prix pratiqués au Canada aux prix pratiqués dans d'autres pays.
La Loi sur les brevets (Loi) et le Règlement sur les médicaments brevetés (Règlement) exigent des brevetés qu'ils fassent rapport au CEPMB des prix publics départ-usine des médicaments brevetés dans les sept pays de comparaison nommés dans le Règlement, à savoir la France, l'Allemagne, l'Italie, la Suède, la Suisse, le Royaume Uni et les États-Unis. Le CEPMB utilise cette information aux fins suivantes :
- L'application des tests prévus dans les Lignes directrices aux fins de la comparaison des prix pratiqués dans les différents pays
- La comparaison des prix pratiqués au Canada avec ceux des autres pays.
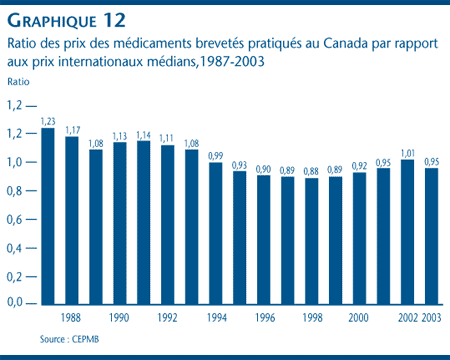
Le graphique 12 illustre la relation qui existe entre les prix pratiqués au Canada et la médiane des prix pratiqués dans les sept pays de comparaison nommés dans le Règlement pour la période de 1987 à 2003. [17] En 1987, les prix canadiens se situaient en moyenne à 23 % au-dessus des prix internationaux médians. Ce ratio a baissé et s'est stabilisé entre 1994 et 2001 à des niveaux variant entre 5 % et 12 % sous le prix médian. En 2002, le ratio était de 1,01. En 2003, le ratio se maintenait sous la parité avec des prix canadiens se situant en moyenne à 95 % du prix international médian correspondant.
Dans le rapport annuel de 2002, le CEPMB mentionnait qu'il se proposait de faire la lumière sur les facteurs pouvant expliquer le changement de relation des prix des médicaments brevetés pratiqués au Canada par rapport à ceux pratiqués dans les pays de comparaison.
Les statistiques présentées dans le graphique 12 correspondent à une moyenne pondérée en fonction du revenu du ratio du prix canadien par rapport au prix international médian pour chaque médicament ayant fait l'objet d'un rapport pour chaque année. Ce calcul sous-tend la conversion des prix exprimés dans la devise des différents pays de comparaison en équivalents exprimés en dollars canadiens. [18] De cette manière, les variations des ratios moyens permettent de dégager :
- les tendances au niveau des prix canadiens
- les tendances au niveau des prix internationaux
- les variations des taux de change
- les variations de l'ensemble des médicaments couverts (alors que des nouveaux médicaments brevetés sont lancés sur le marché canadien et que les brevets d'autres médicaments, ceux-là plus anciens, arrivent à échéance)
- les variations des parts de recettes pour les différents médicaments.
Les variations des taux de change constituent la principale cause des fluctuations annuelles des ratios moyens. L'augmentation annoncée des ratios moyens entre 2001 et 2002 était d'une part attribuable à la revalorisation du dollar canadien par rapport aux principales devises étrangères et, d'autre part, aux fluctuations à court terme des devises étrangères. L'augmentation de 2000 disparaît lorsque le ratio est calculé avec des taux de change et des prix étrangers à leurs valeurs de 2001. Des expériences semblables faites avec les prix canadiens, les pondérations de dépenses et l'ensemble des médicaments utilisés pour calculer le ratio démontrent que ces facteurs ne sont aucunement associés à l'augmentation.
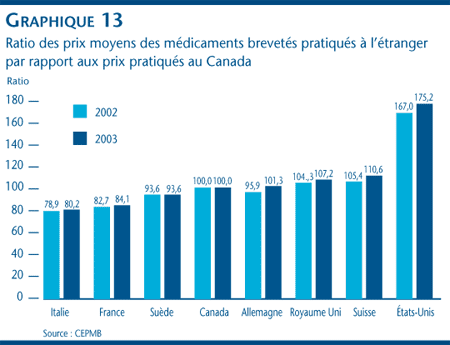
Le graphique 13 illustre la relation qui existe entre les prix des médicaments brevetés pratiqués au Canada et les prix pratiqués dans les sept pays de comparaison. En 1987, les prix canadiens étaient en général inférieurs à ceux pratiqués aux États-Unis, mais supérieurs à ceux pratiqués dans les autres pays. Depuis le milieu des années 1990, la situation a radicalement changé et les prix canadiens se situent aujourd'hui dans la juste moyenne des prix pratiqués dans les six pays de comparaison européens. La situation n'a d'ailleurs pratiquement pas changé en 2003, les prix canadiens des médicaments brevetés étant demeurés légèrement inférieurs aux prix pratiqués au Royaume Uni, en Allemagne et en Suisse, mais supérieurs à ceux de la France, de l'Italie et de la Suède. Comme pour les années précédentes, les prix pratiqués aux États-Unis semblent beaucoup plus élevés que ceux pratiqués en Europe et au Canada. [19]
VALEUR DES DÉPENSES PHARMACEUTIQUES AU PRIX DE DÉTAIL
Malgré l'influence modérée des prix, le total de la valeur des achats des médicaments au prix de détail a beaucoup augmenté ces dernières années au Canada. Selon l'Institut canadien d'information sur la santé (ICIS), la valeur estimée des dépenses pharmaceutiques au prix de détail a augmenté de 10,4 % en 2001 pour se situer à 16,7 milliards de dollars, de 8,8 % en 2002 pour se situer à 18,1 milliards de dollars et, enfin, de 8,1 % en 2003 pour totaliser 19,6 milliards de dollars. [20]
La valeur des dépenses pharmaceutiques au prix de détail a représenté en 2001 15,7 % des dépenses dans le domaine de la santé, 16,0 % en 2002 et 16,2 % en 2003. L'ICIS a également mentionné que les médicaments d'ordonnance accaparent une part de plus en plus grande des coûts d'achat des médicaments au détail qui est passée de 70,3 % qu'elle était en 1990 à un taux prévu de 81,6 % en 2003.
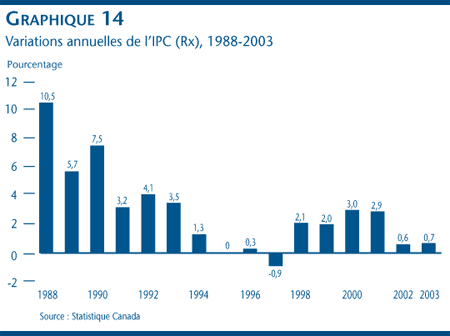
Les consommateurs cherchent souvent à comprendre pourquoi la valeur totale de la variation des coûts des médicaments est habituellement supérieure à celle des prix des médicaments.[21] Cette différence est entre autres attribuable aux différences des concepts utilisés pour estimer les prix. Le CEPMB fait rapport des variations moyennes des prix départ-usine tandis que les variations des coûts des médicaments reflètent la variation des prix de détail. Ces prix comprennent les prix de gros auxquels sont ajoutées les marges bénéficiaires ainsi que les honoraires des pharmaciens. Statistique Canada mesure pour sa part les variations des prix de détail des médicaments d'ordonnance à l'aide de l'IPC (Rx). Le graphique 14 nous permet de constater que les prix de détail des médicaments d'ordonnance ont toujours augmenté depuis 1997 et que cette augmentation a été de 0,7 % en 2003 par rapport à l'exercice précédent. [22]
L'augmentation des prix de détail n'explique pas à elle seule l'augmentation des coûts des médicaments. Plusieurs autres facteurs, la plupart associés aux variations du volume et de l'utilisation faite des médicaments, peuvent avoir une incidence sur l'augmentation des dépenses. Ces facteurs sont présentés dans le graphique 15. Le contrôle du prix départ-usine ou du prix de détail ne permet pas nécessairement de contrôler l'ensemble des dépenses. Même si les prix des médicaments étaient constants (ou s'ils reculaient comme l'ont fait l'ensemble des médicaments brevetés), les changements au niveau des autres facteurs (par ex. les volumes de médicaments consommés) pourraient facilement entraîner des augmentations marquées au poste des dépenses pour médicaments. Selon les résultats des études des régimes provinciaux d'assurance-médicaments effectuées par le CEPMB, la consommation plus grande de médicaments existants et nouveaux est à la source de la croissance récente des dépenses. [23]
GRAPHIQUE 15
Facteurs ayant une incidence sur l'ensemble des dépenses relatives aux médicaments
- augmentation de la population
- changements démographiques et changement de la condition de santé de la population (de plus en plus de personnes prennent des médicaments)
- changements des prix unitaires des médicaments (brevetés et non brevetés)
- majorations des marges bénéficiaires du grossiste et du détaillant ainsi que des honoraires du pharmacien
- changements des habitudes d'ordonnance des médecins (en faveur des médicaments nouveaux et généralement plus dispendieux servant à traiter la même condition)
- utilisation plus grande des médicaments (plus d'ordonnances par patient par année)
- utilisation de la pharmacothérapie plutôt que d'autres traitements (dans certains cas pour éviter la chirurgie)
- apparition de nouvelles maladies nécessitant une pharmacothérapie
- introduction de nouveaux médicaments pour traiter des conditions pour lesquelles il n'existait pas jusque là de pharmacothérapies efficaces
- introduction de nouveaux médicaments représentant des améliorations importantes par rapport aux pharmacothérapies existantes.
Source : CEPMB
TENDANCES AU NIVEAU DU VOLUME DES VENTES DE MÉDICAMENTS BREVETÉS AU CANADA
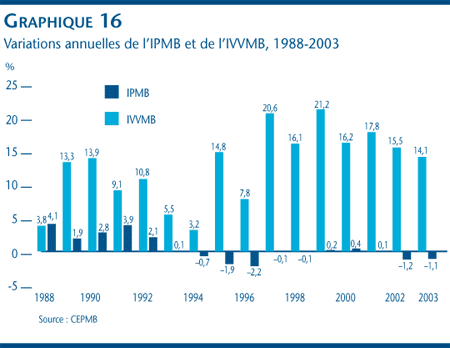
Le CEPMB utilise les données sur les prix et sur les ventes que lui soumettent les brevetés pour dégager les tendances au niveau des quantités de médicaments brevetés vendus au Canada. À cette fin, le CEPMB compile l'Indice du volume des ventes de médicaments brevetés (IVVMB). [24] Le graphique 16 présente les taux moyens de croissance annuelle de l'utilisation faite des médicaments d'ordonnance selon l'IVVMB. Selon les résultats de cette analyse, les volumes de ventes de médicaments brevetés ont toujours augmenté plus rapidement que les prix. À preuve, entre 1988 et 2003, le taux annuel moyen d'augmentation des volumes de médicaments brevetés vendus a été d'environ 12,7 %. En 2003, le taux moyen d'augmentation des volumes par rapport à l'exercice précédent a été de 14,1 %.
TENDANCES SELON LA CATÉGORIE THÉRAPEUTIQUE PRINCIPALE (CLASSIFICATION ATC)
Aux fins de l'examen des prix des médicaments, le CEPMB classe tous les médicaments commercialisés sur le marché canadien suivant la classification anatomique, thérapeutique, chimique (ATC) de l'Organisation mondiale de la Santé. Le tableau 5 ventile, par catégorie thérapeutique, les différents médicaments brevetés commercialisés au Canada en 2003. [25]
La colonne d'extrême droite du tableau 5 présente la contribution de chaque catégorie thérapeutique à la croissance générale des ventes (calculée comme croissance des ventes de la catégorie pondérée par la part de l'ensemble des coûts associée à cette catégorie). Cette mesure a permis d'identifier les principaux facteurs d'augmentation des coûts qui sont :
- les médicaments pour le système nerveux (dont les médicaments administrés pour traiter la dépression)
- les médicaments pour le système cardiovasculaire (dont les agents réducteurs de lipides et les médicaments administrés pour traiter l'hypertension)
- les médicaments pour le sang et les organes sanguiformateurs
- les aliments pour le tube digestif et le métabolisme (dont les médicaments administrés pour traiter les ulcères).
Ces quatre catégories de médicaments sont à la source de presque les deux tiers de la croissance de la valeur des ventes au prix départ-usine entre 2002 et 2003.
Tableau 5 Ventes au prix départ-usine des médicaments brevetés pour usage humain, selon les principales catégories thérapeutiques, 2003
| Catégorie ATC principale |
Valeur
des ventes
en millions
de $ |
Pourcentage
de la valeur
des ventes
% |
Augmentation de la
valeur des ventes par
rapport à 2002 |
Contribution à
l'augmentation
des coûts
% |
| en millions de $ |
% |
| A : Tube digestif et métabolisme |
1355,8 |
13,4 |
164,9 |
13,8 |
12,3 |
| B : Sang et organes sanguiformateurs |
604,6 |
6,0 |
166,0 |
37,8 |
12,4 |
| C : Système cardiovasculaire |
2544,8 |
25,2 |
210,4 |
9,0 |
15,7 |
| D : Produits dermatologiques |
75,3 |
0,75 |
17,0 |
29,2 |
1,3 |
| G : Système génito-urinaire et hormones sexuelles |
315,7 |
3,1 |
51,6 |
19,5 |
3,8 |
| H : Préparations hormonales systémiques, excluant les hormones sexuelles |
90,1 |
0,89 |
13,9 |
18,2 |
1,0 |
J : Anti-infectieux généraux et pour usage systémique, et
P : Produits antiparasitaires [26] |
1082,5 |
10,7 |
112,6 |
11,6 |
8,4 |
| L : Agents antinéoplasiques et immunomodulateurs |
835,2 |
8,3 |
130,5 |
18,5 |
9,7 |
| M :Système musculo-squelettique |
703,7 |
7,0 |
87,2 |
14,1 |
6,5 |
| N : Système nerveux |
1734,7 |
17,2 |
314,8 |
21,7 |
23,5 |
| R : Système respiratoire |
617,9 |
6,1 |
58,8 |
10,5 |
4,4 |
| S : Organes sensoriels |
112,3 |
1,11 |
11,4 |
11,3 |
0,9 |
| V : Divers |
37,3 |
0,37 |
1,5 |
4,2 |
0,1 |
| Total |
10109,9 |
100,0* |
1340,6 |
100,0* |
100,0* |
Source: CEPMB
* Le pourcentage ne totalise pas nécessairement 100, certains chiffres ayant été arrondis. |
En septembre 2001, après avoir pris connaissance d'une analyse de rentabilité préparée par le CEPMB et l'Institut canadien d'information sur la santé (ICIS), les ministres fédéral, provinciaux et territoriaux ont annoncé la mise en place du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP). L'objet du SNIUMP est de fournir des analyses critiques sur les tendances des prix des médicaments d'ordonnance, de l'utilisation qui en est faite et des coûts de manière à fournir au régime de santé canadien une mine de renseignements exacts sur l'utilisation faite des médicaments d'ordonnance et les causes d'augmentation des coûts.
Les responsabilités du CEPMB en ce qui a trait à ce nouveau système ont été établies par le ministre de la Santé en vertu de l'article 90 de la Loi sur les brevets. Dans sa lettre datée d'octobre 2002 au CEPMB, le ministre demandait au CEPMB [traduction] « de faire enquête sur les tendances des prix des médicaments, des dépenses et des facteurs de coûts et, à la demande du comité directeur, d'effectuer toute autre analyse dont il est fait mention dans l'analyse de rentabilité. » Les dispositions de cette lettre du ministre ont été reprises dans un protocole d'entente intervenu entre Santé Canada et le CEPMB couvrant la période du 1er avril 2002 au 31 mars 2005.
Le SNIUMP comporte les deux volets suivants :
- L'élaboration et la mise en oeuvre d'une base de données sur les ordonnances de médicaments qui intégrera les données des différents régimes publics d'assurance-médicaments
- La production d'analyses fondées sur les renseignements tirés de cette base de données.
L'ICIS est responsable du premier volet tandis que le CEPMB s'occupe du second volet, tel que demandé par le ministre de la Santé.
Un comité directeur, formé de représentants de Santé Canada et de différents régimes publics d'assurancemédicaments, conseille l'ICIS et le CEPMB relativement à l'établissement des bases de données et la préparation d'analyses au titre du SNIUMP. Le comité directeur a tenu trois réunions en 2003 au cours desquelles il a discuté de questions techniques touchant nommément l'élaboration de bases de données et la direction d'études analytiques.
Conformément à l'esprit des réunions du comité directeur, le CEPMB a confirmé dans son programme de recherche l'importance accordée aux régimes publics. En juin 2003, les responsables des régimes publics d'assurance-médicaments ont accepté de transmettre au CEPMB leurs données regroupées sur leurs achats de médicaments de manière à lui permettre d'accélérer ses analyses. En date de novembre 2003, neuf régimes publics d'assurance-médicaments avaient transmis leurs données au CEPMB.
La mise en oeuvre au titre du SNIUMP des projets décrits ci-après a été approuvée pour l'exercice 2004- 2005. Les deux premiers projets s'inscrivent dans la foulée d'analyses des facteurs de coûts effectuées par le CEPMB en relation avec la structure et la performance des programmes provinciaux de remboursement des médicaments.
ÉTUDE SUR LES FACTEURS DE COÛTS DES SERVICES DE SANTÉ NON ASSURÉS
Cette étude, terminée au printemps 2004, passe en revue les médicaments offerts de 1999-2000 à 2001- 2002 au titre du Programme des services de santé non assurés de la Direction générale de la santé des Premières nations et des Inuits de Santé Canada. L'étude met à la disposition des décideurs des données sur les dépenses de médicaments afin de les aider à bien relever le défi que pose la prestation de programmes et de services dans un contexte budgétaire freiné par des niveaux de ressources limitées.
RAPPORT SUR LES TENDANCES DES MÉDICAMENTS
L'étude sur les tendances des médicaments, qui a commencé au printemps 2004, doit passer en revue les tendances aux niveaux des dépenses des régimes provinciaux d'assurance-médicaments, des dépenses selon la catégorie thérapeutique, de la croissance des dépenses non regroupées, les coûts par bénéficiaire et les coûts des médicaments selon la dose thérapeutique quotidienne.
MÉTHODE D'ANALYSE DE L'INCIDENCE DU BUDGET
Ce projet mènera à la formulation d'une méthodologie de calcul de l'incidence financière nette pour un régime d'assurance-médicaments provincial qui ajoute de nouveaux médicaments sur son formulaire aux fins de leur admissibilité à un remboursement. Le CEPMB effectue ce projet en partenariat avec l'Office canadien de coordination de l'évaluation des technologies de la santé (OCCETS), car il chevauche le programme commun d'examen des médicaments de ce dernier organisme. Le CEPMB sollicitera les points de vue et commentaires des parties intéressées.
MÉTHODE DE PRÉVISION DES DÉPENSES DE PROGRAMME
La dernière décennie a connu une croissance rapide et imprévisible des dépenses des régimes publics d'assurance- médicaments. L'établissement des budgets des régimes d'assurance-médicaments est ainsi devenu un défi de taille. L'objet du projet est de formuler les meilleures pratiques de prévisions budgétaires des régimes d'assurance-médicaments.
Les parties intéressées et les spécialistes du secteur privé seront consultés afin d'obtenir leurs points de vue et conseils sur la méthodologie à suivre pour ce projet.
INDICE DU COÛT THÉRAPEUTIQUE
Pour tenir compte du fait que les patients ont tendance à passer d'un médicament à un autre, le CEPMB établira un indice permettant de calculer l'augmentation moyenne des coûts par dose thérapeutique quotidienne (DTQ). Les résultats seront calculés pour tous les médicaments et également par catégorie thérapeutique à l'aide des données fournies par les régimes d'assurancemédicaments participants.
Le CEPMB consultera des spécialistes du secteur privé pour le conseiller concernant la méthodologie à suivre.
Pour de plus amples renseignements sur la participation du CEPMB et de l'ICIS au SNIUMP, veuillez consulter leur site respectif aux adresses suivantes : www.pmprb-cepmb.gc.ca et www.cihi.ca.
En contrepartie de l'adoption en 1987 des modifications à la Loi sur les brevets (Loi), les Compagnies de recherche pharmaceutique du Canada (Rx&D) se sont engagées pour le compte de l'industrie des médicaments de marque à investir dans la recherche-développement (R-D) au Canada au moins 10 % de la valeur des recettes tirées de leurs ventes, et ce, à compter de l'année 1996.[27]
Aux termes de la Loi, le CEPMB comptabilise les dépenses annuelles des brevetés dans la R-D et en fait rapport. Le CEPMB ne peut toutefois exercer aucune influence sur le type de recherche-développement effectué ni sur les sommes investies par les brevetés. Le présent chapitre révèle les principales statistiques sur l'état actuel des investissements dans la recherchedéveloppement pharmaceutique au Canada.
SOURCES DES DONNÉES
L'information présentée dans la présente section est tirée des rapports soumis par les brevetés au Conseil. La Loi oblige les brevetés à faire rapport au CEPMB des recettes qu'ils tirent des ventes de leurs médicaments, y compris les recettes tirées des ventes de médicaments non brevetés et les recettes découlant d'ententes de production sous licence, ainsi que des dépenses de R-D qu'ils engagent au Canada pour leurs différents médicaments. La Loi n'oblige pas les brevetés qui n'ont fait aucune vente au cours de l'exercice à soumettre un rapport sur leurs dépenses de R-D. Étant donné que de nouveaux brevets sont accordés chaque année et que d'autres arrivent à échéance, la liste des sociétés tenues de faire rapport de leurs dépenses de R-D varie d'une année à l'autre.
Le Règlement sur les médicaments brevetés, 1994 (Règlement) exige que la société pharmaceutique certifie l'exactitude de l'information qu'elle fournit au Conseil. Le CEPMB ne vérifie pas systématiquement l'information qui lui est présentée, mais tente plutôt de relever toute anomalie ou contradiction et, lorsqu'il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour confirmer que les données qu'il a soumises ont été bien interprétées, chaque breveté est invité à confirmer, avant la publication du rapport annuel, l'exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes calculé par le CEPMB.
En 2003, 83 sociétés pharmaceutiques distribuant des médicaments brevetés pour usage humain ou pour usage vétérinaire ont soumis au CEPMB un rapport sur leurs dépenses de R-D. De ce nombre, 35 étaient membres de Rx&D.
DÉFAUT DE PRÉSENTER UN RAPPORT AU CEPMB
En vertu du paragraphe 89(3) de la Loi, le CEPMB doit faire rapport de l'identité des brevetés qui n'ont pas soumis les rapports réglementaires en application de l'article 88 de la Loi. Pour l'exercice 2003, un seul breveté, Draxis Health Inc., ne s'est pas acquitté de son obligation de présenter un rapport sur ses dépenses de R-D comme l'exige le paragraphe 88 (1) (c) de la Loi. Le cas fait actuellement l'objet d'une enquête.
Dans son rapport annuel de 2002, le CEPMB mentionnait qu'il menait une enquête sur le défaut de Pharmascience Inc. de présenter un rapport sur ses dépenses de R-D pharmaceutique. Le dossier a depuis été fermé à la suite de la présentation par Pharmascience Inc. des données sur ses dépenses de R-D pour les exercices 2002 et 2003 tel que mentionné à l'annexe 3 du présent rapport.
Les résultats pour l'exercice 2002 présentés dans la présente section tiennent également compte des données soumises par deux autres sociétés, à savoir Les Laboratories et Rare Disease Therapeutics Inc. Ces données n'étaient pas parvenues dans les délais requis pour leur inclusion dans le Rapport annuel du CEPMB pour l'exercice 2002.
RECETTES TIRÉES DES VENTES
Pour des fins de rapport, les recettes tirées des ventes s'entendent des recettes tirées des ventes de médicaments au Canada ainsi que des recettes découlant d'ententes de vente sous licence. [28]
Comme l'illustre le tableau 6, la valeur des recettes tirées des ventes de médicaments au Canada déclarées par les brevetés a totalisé 13,6 milliards de dollars en 2003, soit 12,7 % de plus qu'en 2002. De ce montant, moins de 1 % des recettes découlent des ententes de vente sous licence. Les recettes tirées des ventes déclarées par les brevetés membres de Rx&D ont totalisé 10,9 milliards de dollars sur la même période, ce qui représente 80,1 % du total des recettes tirées des ventes.
DÉPENSES DE R-D
En vertu de l'article 6 du Règlement, les brevetés ne doivent inclure dans leurs rapports que leurs dépenses de R-D qui auraient été admissibles au crédit d'impôt à l'investissement pour la recherche scientifique et le développement expérimental aux termes de la Loi de l'impôt sur le revenu, dans sa version du 1er décembre 1987. Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d'immobilisation et l'amortissement autorisé. Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données courantes n'étant pas admissibles au crédit d'impôt à l'investissement, ils ne doivent pas être pris en compte dans les rapports au CEPMB.
Comme le montre le tableau 6, la valeur des dépenses de R-D déclarées par l'ensemble des brevetés a totalisé 1,192 milliard de dollars en 2003, soit 0,5 % de moins qu'en 2002. Les dépenses déclarées par les brevetés membres de Rx&D ont totalisé 993 millions de dollars en 2003, ce qui représente 83,2 % du montant des dépenses de R-D déclarées.
Tableau 6 Dépenses de R-D et ratios des dépenses de R-D par rapport aux recettes tirées des ventes des sociétés déclarantes, 1988-2003
| Année |
Nbre de
sociétés
déclarantes |
Total des
dépenses de
R-D (en
millions de $)1 |
Variation par
rapport à
l'exercice 2002
(%) |
Totals des
recettes tirées2
des ventes
(en millions de $) |
Variation par
rapport à
l'exervice 2002
(%) |
Ratio des
dépenses dans
la R-D/Recettes
tirées des
ventes
Tous les
brevetés3 (%) |
Brevetés
membres
de Rx&D4 (%) |
| 2003 |
83 |
1192,4 |
-0,5 |
13617,2 |
12,7 |
8,8 |
9,1 |
| 20025 |
79 |
1198,7 |
13,0 |
12081,2 |
12,5 |
9,9 |
10,0 |
| 2001 |
74 |
1060,1 |
12,6 |
10732,1 |
15,3 |
9,9 |
10,6 |
| 2000 |
79 |
941,8 |
5,3 |
9309,6 |
12,0 |
10,1 |
10,6 |
| 1999 |
78 |
894,6 |
12,0 |
8315,5 |
19,2 |
10,8 |
11,3 |
| 1998 |
74 |
798,9 |
10,2 |
6975,2 |
10,9 |
11,5 |
12,7 |
| 1997 |
75 |
725,1 |
9,0 |
6288,4 |
7,4 |
11,5 |
12,9 |
| 1996 |
72 |
665,3 |
6,4 |
5857,4 |
9,9 |
11,4 |
12,3 |
| 1995 |
71 |
625,5 |
11,5 |
5330,2 |
7,5 |
11,7 |
12,5 |
| 1994 |
73 |
561,1 |
11,4 |
4957,4 |
4,4 |
11,3 |
11,6 |
| 1993 |
70 |
503,5 |
22,1 |
4747,6 |
14,0 |
10,6 |
10,7 |
| 1992 |
71 |
412,4 |
9,6 |
4164,4 |
6,9 |
9,9 |
9,8 |
| 1991 |
65 |
23,2 |
3894,8 |
18,1 |
9,7 |
9,6 |
| 1990 |
65 |
305,5 |
24,8 |
3298,8 |
11,0 |
9,3 |
9,2 |
| 1989 |
66 |
244,8 |
47,4 |
2973,0 |
9,4 |
8,2 |
8,1 |
| 1988 |
66 |
165,7 |
- |
2718,0 |
- |
6,1 |
6,5 |
Source : CEPMB
1 Le total des dépenses de R-D comprend les dépenses de recherche scientifique et de développement - dépenses en capital et autres - admissibles au crédit d'impôt à l'investissement au titre de la Loi de l'impôt sur le revenu et de son règlement d'application, dans leur version du 1er décembre 1987.
2 Le total des recettes tirées des ventes comprend les ventes de médicaments brevetés et non brevetés pour usage humain et pour usage vétérinaire.
3 Les ratios de R-D par rapport aux recettes tirées des ventes ci-haut présentés comprennent les dépenses de recherche financée par des subventions gouvernementales. Si l'on fait exclusion de la recherche financée par le gouvernement, le ratio pour l'ensemble des brevetés est de 8,7 % et celui des brevetés membres de Rx&D, 9,1%.
4 Rx&D a déjà rapporté que ses membres avaient atteint pour des années antérieures un ratio de R-D par rapport aux recettes tirées des ventes supérieur à celui calculé par le CEPMB. Il importe ici de préciser que la Loi sur les brevets n'oblige que les sociétés ayant un brevet actif se rapportant à un médicament commercialisé au Canada à soumettre au CEPMB un rapport sur leurs dépenses de R-D. Ceci dit, certains brevetés membres de Rx&D ne font pas rapport de leurs dépenses de R-D - dont, par exemple, des sociétés de biotechnologie qui font de la R-D, mais qui n'ont pas vendu leur médicament breveté au Canada.
5 Révisé depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002. |
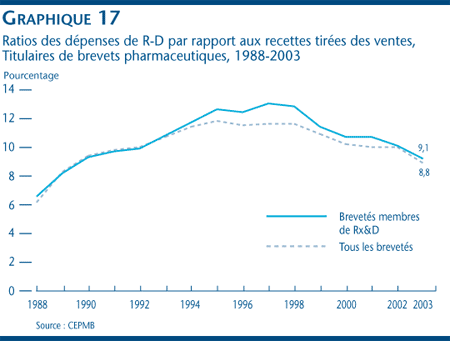
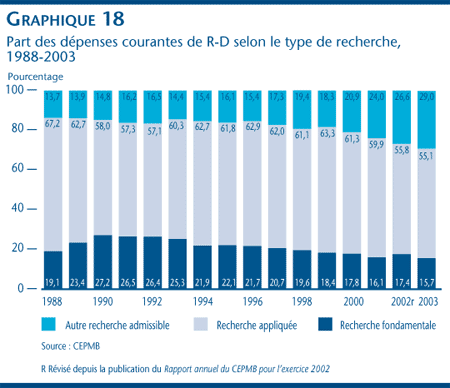
RATIOS DE DÉPENSES DE R-D PAR RAPPORT AUX RECETTES TIRÉES DES VENTES
Le ratio des recettes de R-D par rapport aux recettes tirées des ventes du secteur de la production de médicaments brevetés est de 8,8 % en 2003. Le ratio des brevetés membres de Rx&D est pour sa part passé de 10,0% qu'il était en 2002 à 9,1% en 2003.
Comme le montre le graphique 17, les ratios de dépenses de R-D par rapport aux recettes tirées des ventes pour tous les brevetés et pour les brevetés membres de Rx&D ont augmenté entre 1988 et le milieu des années 1990, mais ont baissé au cours des dernières années. Pour tous les brevetés, membres ou non de Rx&D, les ratios des dépenses de R-D par rapport aux recettes tirées des ventes n'ont jamais été aussi bas depuis 1989.
Le tableau 8, à l'annexe 3, à la page 52, affiche les ratios de R-D par rapport aux recettes tirées des ventes. Des 83 brevetés ayant soumis des rapports sur leurs dépenses de R-D au CEPMB, 63 ont présenté un ratio de R-D par rapport aux recettes tirées des ventes de 10 % et moins en 2003. Les recettes de ces derniers brevetés représentaient 70,2 % de l'ensemble des recettes tirées des ventes.
Le tableau 9, à l'annexe 3, à la page 52, constitue une liste de tous les brevetés ayant présenté des rapports au CEPMB et leurs ratios respectifs de dépenses de R-D par rapport aux recettes tirées des ventes.
DÉPENSES COURANTES DE R-D SELON LE TYPE DE DÉPENSES
En 2003, les dépenses courantes de R-D ont totalisé 1,143 milliard de dollars, soit 95,8 % de l'ensemble des dépenses de R-D. [29] Les coûts d'acquisition de biens d'équipement et les coûts d'amortissement admissibles représentent respectivement 2,8 % et 1,5 % de l'ensemble des dépenses de R-D.
DÉPENSES COURANTES DE R-D SELON LE TYPE DE RECHERCHE
Le tableau 10, à l'annexe 3, à la page 55, ventile les dépenses courantes de R-D selon le type de recherche, à savoir la recherche fondamentale, la recherche appliquée et autres types de recherche admissible. La recherche fondamentale désigne les travaux effectués pour faire avancer les connaissances scientifiques, sans application spécifique en vue. Les brevetés ont fait état de dépenses de recherche fondamentale totalisant 180 millions de dollars ou 15,7 % du total des dépenses courantes de R-D. La valeur des dépenses dans la recherche fondamentale a diminué en 2003, pour se situer à 9,3 % de l'ensemble des dépenses courantes de R-D.
La recherche appliquée vise une application pratique, notamment l'amélioration des procédés de fabrication, les essais précliniques et les essais cliniques. Les brevetés ont déclaré des dépenses dans la recherche appliquée totalisant 630 millions de dollars ou, encore, 55,1 % des dépenses courantes de R-D. Les essais cliniques ont accaparé 77,4 % des dépenses de recherche appliquée.
Les dépenses au titre « autre R-D admissible » (qui comprennent les coûts engagés pour la préparation des rapports réglementaires, les études sur la biodisponibilité et la phase IV des essais cliniques) ont représenté en 2003, 29,0 % des dépenses courantes de R-D. Le graphique 19, à l'annexe 3, à la page 52 ventile les dépenses courantes de R-D selon le type de recherche, de 1988 à 2003.
DÉPENSES COURANTES DE R-D SELON LE MILIEU DE RECHERCHE ET LA PROVENANCE DES FONDS
Les titulaires de brevets pharmaceutiques peuvent inclure dans leurs dépenses de R-D la recherche qu'ils effectuent eux-mêmes à l'interne ainsi que la recherche qu'ils font effectuer à l'externe, notamment par des universités, des hôpitaux et d'autres sociétés pharmaceutiques. Le tableau 11, présenté à l'annexe 3, à la page 55, révèle qu'un peu plus de la moitié (55,1 % des dépenses courantes de R-D) de la recherche a été effectuée par les brevetés eux-mêmes.
La valeur de la recherche effectuée à l'externe pour le compte des brevetés a augmenté en 2003 pour représenter 22,6 % de l'ensemble des dépenses courantes de R-D. Quant à la recherche effectuée par les universités et par les hôpitaux, sa valeur a représenté 11,1 % des dépenses courantes de R-D.
En 2003, comme pour les exercices précédents, la plupart des activités de R-D effectuées par les brevetés ont été financées à l'interne. (Pour de plus amples détails, voir le Tableau 12, à l'annexe 3, à la page 56).
DÉPENSES COURANTES DE R-D SELON LA RÉGION GÉOGRAPHIQUE
Les tableaux 13 et 14, que vous trouverez à l'annexe 3, aux pages 56 et 57, ventilent les dépenses courantes de R-D selon les provinces dans lesquelles elles ont été engagées. Cette année encore, les dépenses ont été surtout engagées en Ontario et au Québec qui ont ainsi accaparé 89,2 % de la valeur totale des dépenses courantes.
Chaque année, le CEPMB élabore son programme de recherche dans le cadre de son processus de planification annuelle. Ce programme présente les projets en cours, les programmes actuellement en préparation ainsi que les projets sur le point d'être mis en æuvre. Il présente également les initiatives soumises à des consultations publiques ou qui pourraient l'être.
Le Programme national d'information sur l'utilisation des médicaments prescrits (SNIUMP), un partenariat avec l'Institut canadien d'information sur la santé (ICIS), a été mis en æuvre au cours de l'exercice 2002. Au titre de ce programme, le CEPMB a entrepris diverses études de recherche sur la gestion et sur l'utilisation de produits médicamenteux. Les projets de recherche au titre du SNIUMP sont inscrits à notre programme de recherche.
Notre programme de recherche est affiché sur notre site Internet sous la rubrique Publications. Ses mises à jour sont publiées dans notre feuillet trimestriel La Nouvelle.
En vertu de la Loi sur les brevets, tous les médicaments brevetés offerts sur le marché canadien, dont les médicaments pour usage vétérinaire, sont assujettis à la compétence du CEPMB.
Plusieurs faits survenus au cours de la deuxième moitié des années 1990 ont amené le CEPMB à modifier ses exigences en matière de rapport sur les médicaments pour usage vétérinaire. Ainsi, dans la foulée d'une consultation publique menée en 1999, le CEPMB a mis à l'essai une approche de réglementation des prix des médicaments vétérinaires qui ne s'enclenche que sur réception de plaintes. En raison de cette approche, le personnel du Conseil ne fait l'examen des prix que des nouveaux médicaments. Quant aux médicaments pour usage vétérinaire existants, ils ne font l'objet d'un examen que sur réception d'une plainte fondée. Le Conseil s'attend à ce que les brevetés pratiquent des prix conformes à ses Lignes directrices sur les prix excessifs et qu'ils conservent en dossier toutes les données sur les prix afin d'être en mesure de les soumettre à la demande du Conseil.
En 2003, le Conseil a évalué l'approche d'examen du prix des médicaments pour usage vétérinaire sur réception d'une plainte fondée et est arrivé à la conclusion qu'il y avait lieu de l'adopter sur une base permanente. Les résultats de cette évaluation ont été présentés dans le numéro de janvier 2004 de La Nouvelle.
En 2004, pour tenir compte des nouvelles exigences en matière de rapports proposées, le personnel du Conseil a commencé à travailler à la modification du Règlement sur les médicaments brevetés (Règlement) et de ses Lignes directrices sur les prix excessifs. Des consultations sur les changements proposés seront effectuées au moyen d'un Avis et Commentaires publié dans La Nouvelle puis, par la suite, dans la Gazette du Canada comme le prévoit le processus officiel. Toute modification du Règlement doit être approuvée par le ministre de la Santé. Dans l'intervalle, les procédures et les Lignes directrices qui régissent actuellement les médicaments pour usage vétérinaire, à savoir les Dispositions spéciales visant les titulaires de brevets de médicaments pour usage vétérinaire demeurent en vigueur.
Il importe de préciser que le Conseil n'envisage pas de se désister de sa compétence sur les prix des médicaments brevetés pour usage vétérinaire. Il propose plutôt un changement administratif qui permettra d'améliorer et d'officialiser le processus d'examen du prix d'un médicament vétérinaire sur réception d'une plainte. Le Conseil conserve sa pleine compétence et ses pouvoirs réglementaires sur les médicaments brevetés pour usage vétérinaire comme le prévoit la Loi sur les brevets.
Dans son deuxième rapport qu'il a soumis en novembre 2001 au Conseil, le Groupe de travail sur les questions relatives à l'examen des prix a recommandé d'assujettir le processus d'examen du prix à des étapes et à un échéancier. [30] Considérant cette recommandation ainsi que les difficultés que posent à nos experts scientifiques les nouveaux médicaments, les nouveaux types de rapports des brevetés et les pressions exercées par les brevetés pour pouvoir étoffer leurs rapports et même en soumettre d'autres, le CEPMB a entrepris le Projet d'examen des échéanciers.
Au cours des 18 derniers mois, le CEPMB s'est penché sur différentes initiatives internes visant à apporter d'autres changements et à mener une consultation publique. En premier lieu, nous avons peaufiné le processus d'examen scientifique confié aux bons soins du Groupe consultatif sur les médicaments pour usage humain. Ainsi, notre Groupe consultatif se réunit désormais sur une base trimestrielle plutôt que semestrielle, et nous avons mis en oeuvre un processus qui nous permet une communication plus célère des résultats des examens du Groupe consultatif. Nous avons également effectué un examen interne de nos procédures de fonctionnement, ce qui a amélioré notre efficacité interne et augmentera notre capacité d'organiser plus rapidement les consultations publiques sur des échéanciers plus rigoureux dans le futur. Enfin, nous avons été en mesure d'assigner des ressources additionnelles pour récupérer l'arriéré accumulé au niveau des enquêtes.
Ces initiatives ont donné lieu à une augmentation du nombre d'examens des nouveaux médicaments et à une réduction importante du nombre d'enquêtes en instance.
Les prochaines étapes de l'examen des échéanciers du CEPMB porteront sur l'établissement d'échéanciers plus spécifiques pour les différentes étapes du processus d'examen et la consultation auprès de l'industrie et des autres intervenants.
Le programme de communication du CEPMB prévoit l'élaboration et l'application de politiques, de plans et d'activités de communication. En plus d'assurer la gestion des programmes de communication du CEPMB, le Secrétariat répond aux demandes d'information du grand public et s'occupe de la gestion, de la gouverne et de l'organisation des différentes activités de communication, y compris des relations avec les médias.
Nous cherchons à intégrer la fonction des communications dans le processus de planification stratégique et, de plus, l'évaluer comme une partie intégrante du Plan stratégique.
Notre planification des communications se fait à l'enseigne d'un volet éducatif. Nous cherchons en effet à mieux faire connaître et comprendre notre mandat, notre rôle et notre champ de compétences.
Au cours de l'exercice 2003, nous nous sommes tout particulièrement attachés à la transparence de nos activités ainsi qu'à l'amélioration du dialogue avec nos intervenants et les membres du grand public. Notre objectif est de faciliter la participation des intervenants en améliorant à cette fin nos modes de communication. Dans cet esprit, nous avons effectué un examen de nos processus d'échange de l'information, mené un sondage auprès des utilisateurs de notre site Internet et, au cours du premier semestre 2004, réaménagé notre site pour faciliter encore plus l'accès au CEPMB.
Au cours des prochaines années, la transparence et l'accessibilité demeureront les principaux éléments de notre programme de communication.
Le Conseil est formé d'au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi sur les brevets, le président du Conseil assume également les fonctions de chef de la direction du CEPMB et, à ce titre, il est investi de la responsabilité de la supervision et de la direction des activités du Conseil. Un directeur exécutif supervise le travail du personnel. Les cadres supérieurs du CEPMB sont le directeur exécutif, la directrice de la conformité et de l'application, le directeur des politiques et de l'analyse économique, le directeur des services généraux, la secrétaire du Conseil et la conseillère juridique principale.
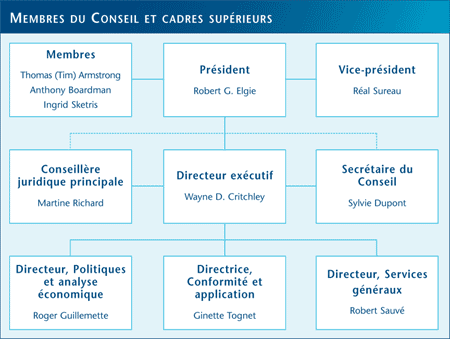
BIOGRAPHIE DES MEMBRES DU CONSEIL
PRÉSIDENT : ROBERT G. ELGIE
C.M., LL.B., M.D., F.R.C.S. (C), LL.D. (hon.)
Le Dr Elgie a été nommé membre et président du Conseil en mars 1995. Il a été reconduit dans ses fonctions actuelles pour un autre mandat, celui-là allant de mars 2000 à mars 2005.
Avocat et neurochirurgien, membre du Collège royal des chirurgiens du Canada, le Dr Elgie a fondé en 1991 l'Institut du droit de la santé de l'Université de Dalhousie et y a occupé le poste de directeur jusqu'en 1996. De 1992 à 1996, il a occupé à temps partiel le poste de président de la Commission des accidents de travail de la Nouvelle-Écosse. Le Dr Elgie a enseigné à la faculté de médecine des universités Queen's et Toronto. Il a occupé plusieurs postes à l'Hôpital général de Scarborough, dont celui de chef du corps médical. En 1977, il a été élu à l'Assemblée législative de l'Ontario et a occupé plusieurs postes au sein du Cabinet. Il a quitté l'Assemblée législative en septembre 1985 pour occuper jusqu'en 1991 le poste de président de la Commission des accidents de travail de l'Ontario. En octobre 2000, le Dr Elgie a été nommé membre du Conseil de presse de l'Ontario.
En mai 2001, le Dr Elgie a reçu un doctorat honorifique en droit de l'Université de Dalhousie en reconnaissance de ses réalisations insignes. En janvier 2003, le Dr Elgie a été nommé membre de l'Ordre du Canada.
VICE-PRÉSIDENT : RÉAL SUREAU , F.C.A.
Monsieur Sureau a été nommé membre et vice-président du Conseil en octobre 1995. En octobre 2000, il a été reconduit dans ses fonctions actuelles pour un mandat allant d'octobre 2000 à octobre 2005.
Monsieur Sureau, qui est comptable agréé depuis 1963, a fait ses études aux universités Queen's et McGill.
De 1957 à 1973, Monsieur Sureau a exercé les fonctions d'expert et de vérificateur comptable dans un cabinet régional. De 1973 à 1982, il a occupé le poste de viceprésident aux Finances à la scierie Forex Inc. De 1982 à 1992, il a été directeur financier du groupe Canam Manac Group Inc., un leader nord-américain de la fabrication de poutres d'acier triangulé et de semiremorques. Il a par la suite poursuivi sa carrière comme expert-conseil en affaires et directeur d'entreprise.
Monsieur Sureau a été membre de l'Ordre des comptables agréés du Québec et a siégé à plusieurs de ses comités. Il en a également été le président en 1995-1996. Il a reçu le titre honorifique de Fellow comptable agréé en 1986.
Monsieur Sureau est président du cabinet Gestion Sureau Limitée. Depuis 1982, Monsieur Sureau a siégé à différents conseils d'administration d'émetteurs assujettis et d'organismes privés, dont Gaz Métro Inc. où il siège à titre de membre du conseil d'administration, du comité de gouvernance, du comité de la caisse de retraite et, depuis 1995, de président du comité de vérification.
MEMBRES
THOMAS (TIM) ARMSTRONG C.r., O. Ont.
M. Armstrong a été nommé membre du Conseil le 3 octobre 2002 pour un mandat qui se terminera en octobre 2007.
Avocat de profession, M. Armstrong a eu une brillante carrière dans la fonction publique de l'Ontario. Il a été président du Conseil des relations de travail de l'Ontario de 1974 à 1976, sous-ministre du travail de 1976 à 1986, agent général de l'Ontario à Tokyo de 1986 à 1990, sous-ministre de l'Industrie, du commerce et de la technologie de 1991 à 1992, et conseiller du Premier ministre de l'Ontario en matière de développement économique de 1992 à 1995. Depuis 1996, il siège comme représentant principal du Canada à la Japan Bank for International Cooperation. Il siège également comme arbitre et médiateur dans les modes alternatifs de règlement de conflits, plus particulièrement en relations de travail.
M. Armstrong a reçu l'Ordre de l'Ontario en 1995 pour sa contribution insigne à la fonction publique de l'Ontario.
ANTHONY BOARDMAN B.A., Ph.D.
M. Boardman a siègé au Conseil de janvier 1999 à janvier 2004.
M. Boardman est professeur Van Dusen d'administration des affaires, Division de la stratégie et de l'économie d'entreprise au Saunder School of Business de l'Université de la Colombie-Britannique. M. Boardman est diplômé (B.A., 1970) de l'Université Kent de Canterbury en Angleterre ainsi que de l'Université Carnegie-Mellon (Ph.D., 1975). Avant d'enseigner à l'Université de la Colombie-Britannique, M. Boardman a enseigné à la Wharton School de l'Université de la Pennsylvanie.
Les domaines de recherche auxquels s'intéresse actuellement M. Boardman sont la privatisation, l'analyse coûts-avantages et la gestion stratégique. M. Boardman a également oeuvré comme expert-conseil pour différents organismes privés et publics, dont Vodafone, Stora Enzo, Pricewaterhouse Coopers, le Trésor de la Nouvelle-Zélande ainsi que pour tous les niveaux de gouvernement au Canada. M. Boardman a enseigné à des cadres supérieurs en Finlande, en Chine, en Australie et ailleurs dans le monde et s'est vu décerner des prix dans le cadre de ses activités d'enseignant. Comme membre du MBA Core Team de l'Université de la Colombie-Britannique, il s'est également vu décerner le prix Alan Blizzard en 2001. De 1995 à 2001, M. Boardman a siégé au comité scientifique sur la pharmacothérapie dont le mandat était de conseiller le B.C. Pharmacare concernant le rapport coût-efficacité des nouveaux médicaments.
Au cours de sa carrière, M. Boardman a signé de nombreux articles savants. Il travaille actuellement à la préparation de la troisième édition de son livre Cost-Benefit Analysis: Concepts and Practice.
INGRID S. SKETRIS BSc(Phm), Pharm.D., MPA(HSA)
Mme Sketris a siègé au Conseil de mai 1999 à mai 2004.
Mme Sketris est professeure au Collège de pharmacie et à l'École des études en administration des services de santé de l'Université de Dalhousie. Elle est également professeure agrégée au département de la santé communautaire et d'épidémiologie de cette même université. Elle travaille à titre d'experte-conseil en pharmacie auprès du département de pharmacie du Centre des sciences de la santé Queen Elizabeth II de Halifax. Depuis 2000, Mme Sketris est titulaire de la chaire en services de recherche sur la santé de la Fondation canadienne de recherche sur les services de santé/Institut canadien de recherche en santé (cofinancée par la Nova Scotia Health Research Foundation).
Mme Sketris est diplômée de l'Université de Toronto (BSc(Phm), 1977), de l'Université du Minnesota (Pharm.D,1979), de l'University of Tennessee Center for the Health Sciences (résidence en toxicologie clinique/pharmacie, 1980) ainsi que de l'Université de Dalhousie (MPA(HSA) 1989).
Mme Sketris est Fellow de l'Association canadienne des pharmaciens d'hôpitaux et du American College of Clinical Pharmacy. Mme Sketris siège actuellement aux comités de rédaction du Canadian Journal of Clinical Pharmacology et du Clinical Therapeutics. De 1996 à 1998, elle a été membre du comité consultatif scientifique de l'Office canadien de coordination de l'évaluation des technologies de la santé. Au niveau de la recherche, Mme Sketris s'intéresse tout particulièrement à l'incidence des changements de la politique d'assurance-médicaments et à l'utilisation des médicaments et des services de santé par la population de la Nouvelle-Écosse.
Mme Sketris siège actuellement comme représentante du CEPMB au comité de l'Institut canadien d'information sur la santé (ICIS) chargé d'examiner l'utilisation faite du Système de classification anatomique, thérapeutique, chimique (ATC) et des doses thérapeutiques quotidiennes (DTQ) dans les analyses.
Mme Sketris a publié de nombreux articles traitant de la thérapeutique pour les cas de grefffe et de la pharmacoépidémiologie.
Pour l'exercice 2003-2004, le Conseil dispose d'un budget de 5 212 000 $ et d'un effectif approuvé de 44 employés. Ce budget inclut la somme de 424 000 $ pour la Stratégie d'accès thérapeutique [31] et 832 000 $ pour le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP). [32]
Tableau 7 Performance financière
| |
Dépenses réelles pour 2002-2003
(en milliers $) |
Budget pour 2003-2004
(en milliers $) |
| Total CEPMB |
4 231,3 |
5 212,0 |
| Équivalents temps plein |
36,0 |
44,0 |
Vous trouverez de plus amples renseignements concernant le budget du CEPMB sur notre site Internet sous la rubrique Rapports au Parlement.
Le CEPMB ne ménage aucun effort pour informer tous ses intervenants, et ce, entre autres à l'aide de ses publications. Certaines publications, dont le Rapport annuel et La Nouvelle, sont publiées à intervalles réguliers alors que d'autres sont publiées aux moments opportuns, en réponse à un programme ou pour satisfaire les besoins de l'organisation.
Vous pouvez obtenir des exemplaires de ces publications, en téléphonant au 1 877 861-2350 ou au (613) 952-7360 ou, encore, en visitant notre site Internet.
| Publications |
Mois de publication |
| Rapport annuel |
Juin |
| Articles |
| - Augmentation des prix - Vérification de la conformité aux Lignes directrices Octobre |
October |
| - Lignes directrices du CEPMB sur les prix : Augmentations des prix en 2004 |
Janvier 2004 |
| Facteurs de rajustement du prix selon l'IPC |
Avril |
| Audiences |
| - Affaire Hoescht Marion Roussel Canada (HMRC) et le médicament Nicoderm |
Avril 1999 (en cours) |
| - Affaire Schering Canada Inc. et le médicament Remicade |
Décembre 2002 - Avril 2003 |
| - Affaire Sanofi-Synthelabo Canada Inc. et le médicament Fasturtec |
Mai 2004 |
| La Nouvelle |
Trimestriel |
| Avis et Commentaires |
| - Appendice 7 du Compendium des Lignes directrices, politiques et procédures - Formes posologiques comparables |
Janvier |
| - Proposition de Certificat de décision préalable concernant le prix du Viread |
Avril 2004 |
| Médicaments brevetés |
| - Ayant fait l'objet d'un rapport au CEPMB en 2003 (y compris le statut de l'examen de chaque médicament) |
Mensuel |
| - Rapports sur les nouveaux médicaments brevetés : |
| 1. Xatral |
Janvier |
| 2. Pulmozyme |
Avril |
| 3. Gleevec |
Juillet |
| 4. Pariet |
|
| 5. Aranesp |
Octobre |
| 6. Xigris |
Jabvier 2004 |
| 7. Crestor |
Avril 2004 |
| 8. Bextra |
|
| Programme de recherche |
Janvier |
| Discours |
| - Questions associées à la réglementation des prix des médicaments brevetés |
Mars |
| - Le Conseil d'examen du prix des médicaments brevetés, son rôle et ses responsabilités |
Septembre |
| - Les médicaments brevetés et leur prix : tendances et développement |
Mars 2004 |
| Études - F-P-T |
| - Médicaments non brevetés à fournisseur exclusif les plus vendus - comparaison des prix à l'échelle internationale, 1998-1999 |
Mai |
| - Une étude sur les prix des médicaments produits par des sources multiples les plus vendus au Canada |
Juin |
| Sommaire des réunions du Conseil |
Trimestriel |
| Engagements de conformité volontaire |
| - Aromasin |
Avril |
| - Dostinex |
Octobre |
| - One-Alpha |
Mai 2004 |
Le glossaire qui suit a été préparé dans le but de faciliter votre compréhension. Pour de plus amples explications et définitions, veuillez consulter la Loi sur les brevets, le Règlement sur les médicaments brevetés, le Compendium des Lignes directrices, des politiques et des procédures du CEPMB et le Règlement sur les aliments et drogues ou, encore, communiquez directement avec le CEPMB.
ATC :
Système de classification Anatomique, Thérapeutique, Chimique (ATC) conçu et tenu à jour par Collaborating Centre for Drug Statistics Methodology de l'Organisation mondiale de la santé (OMS). Ce système distingue les médicaments selon leur site d'action et leurs caractéristiques thérapeutiques et chimiques. Le CEPMB utilise ce système pour la sélection des médicaments de comparaison aux fins de l'examen des prix. (ATC)
AVIS DE CONFORMITÉ (NOC) :
Avis donné par la Direction générale des produits de santé et des aliments de Santé Canada en vertu de l'article C.08.004 du Règlement sur les aliments et drogues. L'émission de cet avis confirme que le médicament respecte les normes prescrites par Santé Canada pour usage humain et vétérinaire et que sa vente est autorisée sur le marché canadien. (Notice of Compliance)
BREVET :
Instrument émis par le Commissaire des brevets sous forme de lettres patentes conférant à son titulaire un monopole pour une période limitée concernant les réclamations qui y sont faites. Le brevet donne à son titulaire et à ses représentants légaux le droit exclusif de fabriquer, de construite, d'exploiter et de vendre à d'autres pour qu'ils l'exploitent l'objet de l'invention. (Patent)
BREVET EN INSTANCE :
Demande pour un brevet qui n'a pas encore été délivré. (Pending Patent)
Nota : En ce qui concerne les médicaments vendus avant qu'ils soient brevetés, la politique du Conseil est de faire, une fois le médicament breveté, l'examen de son prix en remontant jusqu'à la date à laquelle la demande de brevet a été laissée à la connaissance du public pour inspection. (Voir le Bulletin du CEPMB no 15, page 7.)
BREVETÉ OU TITULAIRE DU BREVET :
Désigne aux termes du paragraphe 79(1) de la Loi sur les brevets « la personne ayant pour le moment droit à l'avantage d'un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d'un brevet pour une telle invention ou qui exerce ou a exercé les droits d'un titulaire dans un cadre autre qu'une licence prorogée en vertu du paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets. » (Patentee)
CERTIFICAT DE DÉCISION PRÉALABLE (CDP) :
Un certificat révocable émis à la demande du breveté en vertu de l'article 98(4) de la Loi sur les brevets lorsque le Conseil estime que le prix pratiqué ou proposé n'est pas supérieur au prix maximal qu'autorisent ses Lignes directrices. (Advance Ruling Certificate)
CESSION D'UN BREVET :
Avis donné par le breveté au Commissaire des brevets l'informant qu'il renonce irrévocablement à ses droits de propriété à l'égard du brevet en cause et les cède au domaine public. (Dedication of Patent)
Nota : Depuis le 30 janvier 1995, le Conseil ne reconnaît pas la cession d'un brevet lorsque cette mesure constitue un moyen de se soustraire à sa compétence. (Voir le Bulletin no 17 du CEPMB, à la page 3)
DÉPENSES COURANTES DE RECHERCHE-DÉVELOPPEMENT :
désigne les dépenses autres qu'en capital directement liées à la recherche, dont : (a) salaires, (b) matériel direct, (c) entrepreneurs et sous-traitants, (d) coûts directement associés aux frais indirects de production, (e) paiements aux institutions désignées, (f) paiements aux organismes subventionnaires et (g) paiements aux autres organismes. Ces éléments sont décrits plus en détail dans le formulaire 3 du Guide de rapport du breveté disponible sur notre site web sous la rubrique Loi, Règlement et Lignes directrices. (Current Research and Development Expenditures)
DÉPENSES DE RECHERCHE-DÉVELOPPEMENT :
Aux termes du Règlement sur les médicaments brevetés, dans sa version de 1994, et plus particulièrement de ses articles 5 et 6, la recherche-développement s'entend des activités qui auraient été considérées admissibles au crédit d'impôt à l'investissement pour la recherche scientifique et le développement expérimental en vertu e la Loi de l'impôt sur le revenu dans sa version en vigueur le 1er décembre 1987. (Research and Development Expenditures)
DROGUE DE RECHERCHE :
Médicament autorisé par Santé Canada aux fins d'une autorisation clinique (c.-à-d. essais sur des humains), mais dont la vente pour l'indication à l'étude n'est pas encore autorisée. (Investigational New Drug)
ENGAGEMENT DE CONFORMITÉ VOLONTAIRE :
Engagement écrit pris par le breveté de baisser le prix de son médicament pour le rendre conforme aux Lignes directrices du CEPMB sur les prix excessifs (voir chapitre 1 du Compendium des Lignes directrices, politiques et procédures). La Politique de conformité et d'application (voir chapitre 2, section 7) prévoit que le Président peut, plutôt que d'émettre un avis d'audience, approuver un engagement conforme aux exigences de la Loi sur les brevets et aux politiques du Conseil et servant les intérêts du grand public. La politique du Conseil sur la conformité et l'application autorise la présentation d'un engagement de conformité après la publication d'un Avis d'audience. L'engagement soumis à ce point requiert l'aval du Conseil. Le Conseil doit rendre publics tous les engagements approuvés par le Président ou par le Conseil. (Voluntary Compliance Undertaking)
INDICE DU PRIX DES MÉDICAMENTS BREVETÉS (IPMB) :
Indice établi par le CEPMB pour mesurer la variation annuelle des prix de transaction des médicaments brevetés vendus au Canada. Cet indice est établi à partir des données sur les prix et sur les ventes déclarées par les brevetés. (Patented Medicine Price Index)
INGRÉDIENT ACTIF :
Substance chimique ou biologique responsable de l'effet pharmacologique d'un produit médicamenteux. (Active Ingredient)
LICENCE OBLIGATOIRE :
Référence faite à l'article 79(1) de la Loi sur les brevets, une licence émise par le Commissaire des brevets avant le 20 décembre 1991 accordée en vertu du paragraphe 39(4) de la Loi sur les brevets, L.R.C. (1985), ch. P-4, repris dans le paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets, qui permet au titulaire de la licence d'importer, de fabriquer, d'utiliser ou de vendre une invention brevetée relative à un médicament. Le montant des redevances que le titulaire de la licence doit verser au breveté est déterminé par le Commissaire aux brevets qui établit les conditions des licences en vertu de l'article 39(5) de la Loi sur les brevets. (Licence, compulsory)
LICENCE VOLONTAIRE :
Engagement contractuel entre un breveté et un titulaire de licence permettant à ce dernier de bénéficier des retombées d'un brevet ou d'exercer des droits à l'égard de celui-ci moyennant une contrepartie (par ex : royautés sous forme de pourcentage des recettes tirées des ventes du médicament utilisant le brevet). (Licence, Voluntary).
MÉDICAMENT :
Toute substance ou tout mélange de substances qui est appliqué ou administré in vivo pour faciliter le diagnostic, le traitement, l'atténuation ou la prévention d'une maladie, de symptômes, de troubles ou d'état physiques anormaux ou pour modifier des fonctions organiques chez les humains et les animaux. Cette substance ou ce mélange de substances peut avoir été produit biologiquement, chimiquement ou autrement. Pour être plus précis, cette définition comprend les vaccins, les préparations topiques, les anesthésiques et les produits diagnostics utilisés in vivo, quel que soit le mode d'administration (par ex. préparations transdermiques, capsules, solutions injectables, solutions pour inhalation, etc.) Cette définition exclut toutefois les appareils médicaux, les produits diagnostiques in vivo et les désinfectants qui ne sont pas utilisés in vivo (Voir Compendium des Lignes directrices, politiques et procédures, Introduction, paragraphe 1.5). (Medicine)
NUMÉRO D'IDENTIFICATION DE DROGUE (DIN) :
Numéro d'identification que la Direction générale de la protection de la santé de Santé Canada attribue à chaque médicament vendu sous ou sans ordonnance et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN est assigné en tenant compte des éléments suivants : le fabricant du produit, l'ingrédient actif ou les ingrédients actifs, la concentration de l'ingrédient actif, la forme posologique, le nom du produit et son mode d'administration. (Drug Identification Number)
PRODUIT GÉNÉRIQUE :
Produit médicamenteux contenant le même ingrédient actif, la même concentration et la même forme posologique qu'un produit de marque. (Generic product)
PRODUIT MÉDICAMENTEUX :
Présentation particulière d'un médicament qui se distingue par sa forme posologique et la concentration de l'ingrédient actif. (Drug product)
PRODUIT MÉDICAMENTEUX EXISTANT :
Tout médicament breveté (DIN) pour lequel un prix de référence a été fixé conformément aux Lignes directrices du Conseil (Voir le chapitre 1, paragraphe 3,3 du Compendium des Lignes directrices, politiques et procédures). (Drug Product, Existing)
PRODUIT MÉDICAMENTEUX NOUVEAU :
Un nouveau médicament dont le prix de lancement est sous examen. Les médicaments sont considérés nouveaux l'année au cours de laquelle ils sont lancés sur le marché canadien ou, encore, l'année où leur premier brevet leur a été attribué s'ils étaient déjà offerts sur le marché. Aux fins de l'examen des prix, les produits médicamenteux nouveaux pour une année donnée sont ceux qui ont été lancés sur le marché entre le 1er décembre de l'exercice précédent et le 30 novembre de l'exercice faisant l'objet du rapport annuel. En raison des dates limites de présentation des rapports en vertu du Règlement sur les médicaments brevetés et le mode de calcul des prix de référence, les produits médicamenteux lancés sur le marché canadien en décembre sont comptabilisés dans l'exercice suivant. (Voir le chapitre 1, paragraphe 3,2 du Compendium des Lignes directrices, politiques et procédures). (Drug Product, New)
PROGRAMME DE MÉDICAMENTS D'URGENCE :
Voir Programme spécial d'accès. (Emergency Drug Release (EDR) Program)
PROGRAMME D'ACCÈS SPÉCIAL :
Programme en vertu duquel Santé Canada autorise la vente à des médecins de médicaments n'ayant pas encore reçu l'avis de conformité et qui ne seraient autrement pas disponibles sur le marché canadien. (Auparavant appelé Programme de médicaments d'urgence) (Special Access Program)
RECHERCHE-DÉVELOPPEMENT :
Recherche fondamentale ou appliquée visant à créer de nouveaux matériaux, dispositifs, produits ou procédés ou à améliorer ceux qui existent (par exemple les procédés de fabrication) (Research and Development)
RECHERCHE ET DÉVELOPPEMENT-RECHERCHE APPLIQUÉE :
Travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris avec une application pratique en vue. Ils peuvent viser à créer de nouveaux produits ou procédés, à améliorer ceux qui existent à l'aide de procédés de fabrication ou, encore d'études précliniques et cliniques. (Research and Development-Applied Research)
RECHERCHE ET DÉVELOPPEMENT-RECHERCHE FONDAMENTALE:
Travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris sans aucune application pratique en vue (Research and Development-Basic Research)
RECHERCHE ET DÉVELOPPEMENT-RECHERCHE CLINIQUE :
Évaluation des effets d'un nouveau médicament sur les humains. Cette évaluation comporte généralement trois phases successives, commençant par des tests limités d'innocuité du médicament chez les humains en santé suivis de tests plus poussés portant sur l'innocuité et l'efficacité chez les sujets atteints de la maladie pour laquelle le médicament a été mis au point. (Research and Development-Clinical Research)
RECHERCHE ET DÉVELOPPEMENT-RECHERCHE PRÉCLINIQUE :
Tests menés sur des animaux afin d'évaluer les effets pharmacologiques et toxicologiques des médicaments. (Research and Development-Preclinical Research:)
RECHERCHE ET DÉVELOPPEMENT-AUTRES R-D ADMISSIBLES :
Comprend les dépenses de recherche-développement qui ne correspondent à aucune des catégories de R-D susmentionnées. Elle comprend les présentations sur la réglementation des médicaments, les études de biodisponibilité ainsi que les essais cliniques de Phase IV. (Research and Development-Other Qualifying)
Voici la liste des acronymes utilisés dans le présent rapport annuel et dans d'autres publications du CEPMB de même que par les parties intéressées.
| AC : |
Avis de conformité |
| ACC : |
Association des consommateurs du Canada |
| ACIMVL : |
Association canadienne de l'industrie des médicaments en vente libre |
| ACMG : |
Association canadienne du médicament générique |
| ATC : |
Anatomique, thérapeutique, chimique - système de classification |
| BDPP : |
Base de données sur les produits pharmaceutiques (Santé Canada) |
| CCCEM : |
Comité consultatif canadien d'expertise sur les médicaments |
| CDP ou certificat : |
Certificat de décision préalable |
| CEPMB : |
Conseil d'examen du prix des médicaments brevetés |
| CPI : |
Comparaison des prix internationaux |
| CTT : |
Comparaison de la classe thérapeutique |
| DGPT : |
Direction générale des produits thérapeutiques (Santé Canada) |
| DGSPNI : |
Direction générale de la santé des Premières nations et Inuits |
| DIN : |
Numéro d'identification du médicament (Drug Identification Number) |
| DMU : |
Distribution des médicaments d'urgence |
| DTQ : |
Dose thérapeutique quotidienne |
| DVA : |
Département des Anciens combattants (Department of Veterans Affairs - États-Unis) |
| ECV ou engagement : |
Engagement de conformité volontaire |
| F-P-T : |
Fédéral, provincial, territorial |
| FSS : |
Classification fédérale des approvisionnements (Federal Supply Schedule - États-Unis) |
| GCMUH ou Groupe consultatif : |
Groupe consultatif sur les médicaments pour usage humain |
| ICIS : |
Institut canadien d'information sur la santé |
| IPPI : |
Indice des prix des produits industriels |
| IPC : |
Indice des prix à la consommation |
| IPC (Rx) : |
Indice des prix à la consommation pour les médicaments d'ordonnance |
| IPMB : |
Indice des prix des médicaments brevetés |
| IVVMB : |
Indice du volume des ventes des médicaments brevetés |
| IPP : |
Indice des prix des produits (Product Price Index - États-Unis) |
| ME : |
Mémoire d'entente |
| MNBSE : |
Médicament non breveté de source exclusive |
| MNE : |
(prix) Maximum non excessif |
| NSA : |
Nouvelle substance active |
| NICE : |
National Institute for Clinical Excellence (Royaume Uni) |
| OCCETS : |
Office canadien de coordination de l'évaluation des technologies de la santé |
| OCDE : |
Organisation de coopération et de développement économiques |
| ODB : |
Régime d'assurance-médicaments de l'Ontario (Ontario Drug Benefit Plan) |
| OMS : |
Organisation mondiale de la santé |
| PAS : |
Programme d'accès spécial (Santé Canada) |
| PBA : |
Premier brevet accordé |
| PCME : |
Processus commun d'examen des médicaments |
| PTM : |
Prix de transaction moyen |
| PIB : |
Produit intérieur brut |
| R-D: |
Recherche-développement |
| Rx&D: |
Compagnies de recherche pharmaceutique du Canada |
| SNIUMP : |
Système national d'information sur l'utilisation des médicaments prescrits |
| SSNA : |
Soins de santé non assurés |
| VL : |
(médicaments en) vente libre |
CRITÈRES JUSTIFIANT UNE ENQUÊTE
Un prix est considéré conforme aux Lignes directrices dans la mesure où aucun critère ne justifie une enquête. Les critères correspondent aux normes qu'applique le Conseil pour utiliser de la façon la plus efficiente possible les ressources dont il dispose pour les enquêtes. L'existence de ces critères ne sous-tend pas que le Conseil tolère les écarts à ses Lignes directrices. Le Conseil estime que ses critères permettent de reconnaître et de soumettre à une enquête tous les cas importants de prix non conformes à ses Lignes directrices. Dans la plupart des cas, lorsque le prix d'un médicament dépasse le prix maximal autorisé d'un montant trop minime pour justifier une enquête, le breveté est appelé à remettre les recettes excédentaires perçues en offrant l'année suivante son médicament à un prix inférieur au max maximal autorisé. Le Conseil s'attend à ce que les prix de tous les médicaments brevetés soient conformes à ses Lignes directrices et tout élément de preuve démontrant que le prix d'un médicament se maintient au-delà de ce que permettent ses Lignes directrices, ne serait-ce que d'un petit montant, peut justifier la tenue d'une enquête.
CRITÈRES JUSTIFIANT LA TENUE D'UNE ENQUÊTE
Le personnel du Conseil ouvre une enquête sur le prix d'un médicament breveté lorsque l'une ou l'autre des conditions suivantes est remplie :
NOUVEAUX MÉDICAMENTS
- le prix de lancement dépasse d'au moins 5 % le prix maximal jugé non excessif
- les recettes excédentaires perçues au cours de la période de lancement totalisent 25 000 $ ou plus
- des plaintes dûment fondées ont été formulées.
MÉDICAMENTS EXISTANTS
- le prix dépasse d'au moins 5 % le prix maximal jugé non excessif et les recettes excédentaires cumulatives perçues au cours de toute la durée du brevet à compter du 1er janvier 1992 sont égales ou supérieures à 25 000 $
- les recettes excédentaires cumulatives perçues au cours de toute la durée du brevet à compter du 1er janvier 1992 sont égales ou supérieures à 50 000 $
- des plaintes dûment fondées ont été formulées.
Vous trouverez de plus amples renseignements concernant les critères qui justifient la tenue d'une enquête à l'appendice 5 du Compendium des Lignes directrices, des politiques et des procédures. Le Compendium est affiché sur notre site web sous la rubrique « Loi, Règlement et Lignes directrices ».
PRODUITS MÉDICAMENTEUX BREVETÉS LANCÉS SUR LE MARCHÉ EN 2003
| Nom de marque |
Société |
DIN |
NSA1/PBA2 |
ATC3 |
Statut |
Catégorie |
| 3TC 300 mg/comprimé |
GlaxoSmithKline |
02247825 |
|
J |
Conforme aux Lignes directrices |
1 |
| Accuretic (20/25) comprimé |
Pfizer Canada Inc. |
02237369 |
|
C |
Conforme aux Lignes directrices |
1 |
| Actonel 35 mg/comprimé |
Procter & Gamble Pharmaceuticals Canada Inc. |
02246896 |
|
M |
Conforme aux Lignes directrices |
1 |
| Agenerase 15 mg/mL |
GlaxoSmithKline |
02243543 |
NSA/PBA |
J |
À l'étude |
|
| Agenerase 50 mg/gélule |
GlaxoSmithKline |
02243541 |
NSA/PBA |
J |
À l'étude |
|
| Agenerase 150 mg/gélule |
GlaxoSmithKline |
02243542 |
NSA/PBA |
J |
À l'étude |
|
| Alertec 100 mg/comprimé |
Shire Biochem Inc. |
02239665 |
NSA/PBA |
N |
Conforme aux Lignes directrices |
3 |
| Alphagan P 1,5 mg/mL |
Allergan Inc. |
02248151 |
|
S |
À l'étude |
|
| Angiomax 250 mg/fiole |
Oryx Pharmaceuticals Inc. |
02246533 |
NSA |
B |
Conforme aux Lignes directrices |
3 |
| Avandamet (1/500) comprimé |
GlaxoSmithKline |
02247085 |
|
A |
Conforme aux Lignes directrices |
3 |
| Avandamet (2/500) comprimé |
GlaxoSmithKline |
02247086 |
|
A |
Conforme aux Lignes directrices |
3 |
| Avandamet (4/500) comprimé |
GlaxoSmithKline |
02247087 |
|
A |
Conforme aux Lignes directrices |
3 |
| Avelox 1,6 mg/mL |
Bayer Inc. |
02246414 |
|
J |
Conforme aux Lignes directrices |
3 |
| Bextra 10 mg/comprimé |
Pfizer Canada Inc. |
02246621 |
NSA |
M |
Conforme aux Lignes directrices |
3 |
| Bextra 20 mg/comprimé |
Pfizer Canada Inc. |
02246622 |
NSA |
M |
Conforme aux Lignes directrices |
3 |
| Children's Motrin 50 mg/comprimé |
McNeil, Produits aux consommateurs |
02247343 |
|
M |
Conforme aux Lignes directrices |
1 |
| Children's Motrin Junior 100 mg/comprimé |
McNeil, Produits aux consommateurs |
02247344 |
|
M |
Conforme aux Lignes directrices |
1 |
| Cialis 10 mg/comprimé |
Eli Lilly Canada Inc. |
02248088 |
NSA |
G |
À l'étude |
|
| Cialis 20 mg/comprimé |
Eli Lilly Canada Inc. |
02248089 |
NSA |
G |
À l'étude |
|
| Cipro XL 500 mg/comprimé |
Bayer Inc. |
02247916 |
|
J |
Conforme aux Lignes directrices |
1 |
| Concerta 18 mg/comprimé |
Janssen-Ortho Inc. |
02247732 |
|
N |
À l'étude |
|
| Concerta 36 mg/comprimé |
Janssen-Ortho Inc. |
02247733 |
|
N |
À l'étude |
|
| Concerta 54 mg/comprimé |
Janssen-Ortho Inc. |
02247734 |
|
N |
À l'étude |
|
| Coversyl 8 mg/comprimé |
Servier Canada Inc. |
02246624 |
|
C |
Conforme aux Lignes directrices |
1 |
| Coversyl Plus (4/1,25) comprimé |
Servier Canada Inc. |
02246569 |
|
C |
Conforme aux Lignes directrices |
3 |
| Crestor 10 mg/comprimé |
AstraZeneca Canada Inc. |
02247162 |
NSA |
C |
Conforme aux Lignes directrices |
3 |
| Crestor 20 mg/comprimé |
AstraZeneca Canada Inc. |
02247163 |
NSA |
C |
Conforme aux Lignes directrices |
3 |
| Crestor 40 mg/comprimé |
AstraZeneca Canada Inc. |
02247164 |
NSA |
C |
Conforme aux Lignes directrices |
3 |
| Diovan-HCT (160/25) comprimé |
Novartis Pharmaceuticals Canada Inc. |
02246955 |
|
C |
Conforme aux Lignes directrices |
1 |
| Dukoral (1/250/250/250/250) fiole |
Aventis Pasteur Limited |
02247208 |
NSA |
J |
À l'étude |
|
| Elidel 10 mg/gm |
Novartis Pharmaceuticals Canada Inc.
|
02247238 |
NSA |
D |
Conforme aux Lignes directrices |
3 |
| Evra (150/20) timbre cutané |
Janssen-Ortho Inc. |
02246340 |
NSA/PBA |
G |
À l'étude |
|
| Exelon 2 mg/mL |
Novartis Pharmaceuticals Canada Inc. |
02245240 |
|
N |
À l'étude |
|
| Ezetrol 10 mg/comprimé |
Merck Frosst Canada Inc. |
02247521 |
NSA |
C |
Conforme aux Lignes directrices |
3 |
| Gamunex 100 mg/mL |
Bayer Inc. |
02247724 |
|
J |
À l'étude |
|
| Hectorol 2,5 mcg/gélule |
Shire Biochem Inc. |
02243790 |
NSA |
A |
Conforme aux Lignes directrices |
3 |
| Invanz 1000 mg/fiole |
Merck Frosst Canada Inc. |
02247437 |
NSA |
J |
À l'étude |
|
| Keppra 250 mg/comprimé |
Lundbeck Canada Inc. |
02247027 |
NSA |
N |
Conforme aux Lignes directrices |
3 |
| Keppra 500 mg/comprimé |
Lundbeck Canada Inc. |
02247028 |
NSA |
N |
Conforme aux Lignes directrices |
3 |
| Keppra 750 mg/comprimé |
Lundbeck Canada Inc. |
02247029 |
NSA |
N |
Conforme aux Lignes directrices |
3 |
| Ketek 400 mg/comprimé |
Aventis Pharma Inc. |
02247520 |
NSA |
J |
Conforme aux Lignes directrices |
3 |
| Losec 40 mg/gélule |
AstraZeneca Canada Inc. |
02016788 |
|
A |
Conforme aux Lignes directrices |
1 |
| Lumigan 0,3 mg/mL |
Allergan Inc. |
02245860 |
PBA |
S |
Conforme aux Lignes directrices |
3 |
| Maxilene 40 mg/gm |
RGR Pharma Ltd. |
02244533 |
|
D |
Conforme aux Lignes directrices |
1 |
| Maxilene 50 mg/gm |
RGR Pharma Ltd. |
02245939 |
|
D |
Conforme aux Lignes directrices |
1 |
| Minirin 0,1 mg/comprimé |
Ferring Pharmaceuticals Inc. |
02246500 |
|
H |
Conforme aux Lignes directrices |
1 |
| Nasacort AQ 55 mcg/dose |
Aventis Pharma Inc. |
02213834 |
PBA |
R |
Conforme aux Lignes directrices |
1 |
| Palladone XL 12 mg/gélule |
Purdue Pharma |
02243159 |
|
N |
Conforme aux Lignes directrices |
1 |
| Palladone XL 16 mg/gélule |
Purdue Pharma |
02243160 |
N |
Conforme aux Lignes directrices |
1 |
| Palladone XL 24 mg/gélule |
Purdue Pharma |
02243161 |
|
N |
Conforme aux Lignes directrices |
1 |
| Pegasys 180 mcg/seringue |
Hoffmann-LaRoche Canada Ltée |
02248077 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Pegasys 180 mcg/fiole |
Hoffmann-LaRoche Canada Ltée |
02248078 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Pennsaid 16 mg/mL |
Dimethaid Healthcare Ltée |
02247265 |
|
M |
À l'étude |
|
| Preterax (2/0,625) comprimé |
Servier Canada Inc. |
02246568 |
|
C |
Conforme aux Lignes directrices |
1 |
| Rapamune 1 mg/comprimé |
Wyeth-Ayerst Canada Inc. |
02247111 |
|
L |
Conforme aux Lignes directrices |
3 |
| Reactine Allergy & Sinus (5/120) comprimé |
Pfizer Canada Inc. |
02246162 |
|
R |
À l'étude |
|
| Refacto 1000 unit/fiole |
Wyeth-Ayerst Canada Inc. |
02245951 |
|
B |
Conforme aux Lignes directrices |
1 |
| Risperdal M-Tab 0,5 mg/ comprimé |
Janssen-Ortho Inc. |
02247704 |
|
N |
Conforme aux Lignes directrices |
1 |
| Risperdal M-Tab 1 mg/ comprimé |
Janssen-Ortho Inc. |
02247705 |
|
N |
Conforme aux Lignes directrices |
1 |
| Risperdal M-Tab 2 mg/ comprimé |
Janssen-Ortho Inc. |
02247706 |
|
N |
Conforme aux Lignes directrices |
1 |
| Solagé 20,1 mg/mL |
Galderma Canada Inc. |
02243257 |
NSA |
D |
Conforme aux Lignes directrices |
3 |
| Tarka (1/240) comprimé |
Les Laboratoires Abbott Limitée |
02240945 |
|
C |
Conforme aux Lignes directrices |
1 |
| Tarka (2/180) comprimé |
Les Laboratoires Abbott Limitée |
02238096 |
|
C |
Conforme aux Lignes directrices |
1 |
| Tarka (4/240) comprimé |
Les Laboratoires Abbott Limitée |
02238097 |
|
C |
Conforme aux Lignes directrices |
1 |
| Timentin (30000/1000) fiole |
GlaxoSmithKline |
02247880 |
|
J |
À l'étude |
|
| TNKase 50 mg/fiole |
Hoffmann-LaRoche Canada Ltée |
02244826 |
NSA |
B |
À l'étude |
|
| Urso DS 500 mg/comprimé |
Axcan Pharma Inc. |
02245894 |
|
A |
Conforme aux Lignes directrices |
1 |
| Xigris 5 mg/fiole |
Eli Lilly Canada Inc. |
02247129 |
NSA |
B |
Conforme aux Lignes directrices |
2 |
| Xigris 20 mg/fiole |
Eli Lilly Canada Inc. |
02247130 |
|
B |
Conforme aux Lignes directrices |
2 |
| Zyprexa 15 mg/comprimé |
Eli Lilly Canada Inc. |
02238850 |
|
N |
Conforme aux Lignes directrices |
1 |
Les Lignes directrices du Conseil établissent trois catégories de nouveaux produits médicamenteux brevetés aux fins de l'examen du prix de lancement.
- Catégorie 1 - nouveau DIN d'une forme pharmaceutique existante d'un médicament existant ou un nouveau DIN d'une autre forme pharmaceutique du médicament qui est comparable à la forme pharmaceutique existante, habituellement une nouvelle concentration d'un médicament existant (extension de gamme de produits pharmaceutiques).
- Catégorie 2 - premier produit médicamenteux mis au point pour traiter une condition ou qui constitue une amélioration importante par rapport aux médicaments existants. Les médicaments de cette catégorie sont souvent qualifiés de « découverte » ou d' « amélioration importante ».
- Catégorie 3 - nouveau DIN, nouveau médicament ou nouvelle forme pharmaceutique d'un médicament existant qui procurent tout au plus des bienfaits modestes ou minimes par rapport aux médicaments existants.
Les définitions complètes de ces catégories sont présentées au chapitre 3, section 3, du Compendium des Lignes directrices, politiques et procédures du CEPMB.
1 NSA : Nouvelle substance active
2 PBA : Premier brevet accordé
3 ATC : Système de classification anatomique, thérapeutique, chimique. |
Tableau 8 Ratio des dépenses de R-D par rapport aux recettes tirées des ventes selon le nombre de sociétés ayant présenté un rapport et le total des recettes tirées des ventes
| Ratio des dépenses de R-D/recettes tirées des ventes |
Nbre de sociétés ayant présenté un rapport |
2003 Recettes tirées des ventes |
Nbre de sociétés ayant présenté un rapport |
2002R Recettes tirées des ventes |
| ($millions) |
% Share |
($millions) |
% Share |
| 0 % |
21 |
707,5 |
5,1 |
17 |
355,6 |
3,0 |
| 0 %-10 % |
42 |
8 845,0 |
64,9 |
40 |
6 552,5 |
54,2 |
| > 10 % |
20 |
4 064,6 |
30,0 |
22 |
5 173,0 |
42,8 |
| Total |
83 |
13 617,2 |
100,0* |
79 |
12 081,2 |
100,0* |
Source : CEPMB
* Le total de la colonne ne totalise pas nécessairement 100,0, certains chiffres ayant été arrondis.
R: Données révisées depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002 |
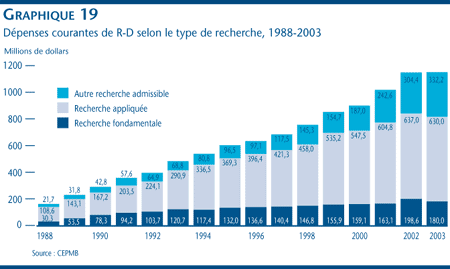
Tableau 9 Ratio des dépenses de R-D par rapport aux recettes tirées des ventes des différents brevetés1, 2003 et 2002
| Breveté |
Ratio de R-D par rapport aux
recettes tirées des ventes (%) |
| 2003 |
2002 |
| 3M Canada Company |
0,5 |
0,8 |
| Abbott Limitée, Les laboratoires2 |
2,5 |
1,7 |
| Actelion Pharmaceutiques Canada Inc.2 |
8,0 |
23,5 |
| Agouron Pharmaceuticals, Inc. |
3,8 |
16,6 |
| Alcon Canada Inc. |
0,0 |
0,0 |
| Allergan Inc.2 |
7,2 |
5,5 |
| Altana Pharma Inc.2,3 |
11,1 |
7,8 |
| Amersham Health Inc. |
0,0 |
0,0 |
| Amgen Canada Inc.2,6 |
8,4 |
20,1 |
| AstraZeneca Canada Inc.2 |
8,9 |
9,1 |
| Aventis Pasteur Limitée6 |
83,9 |
75,7 |
| Aventis Pharma Inc.2 |
11,7 |
14,3 |
| Axcan Pharma Inc.2 |
23,9 |
21,6 |
| Ayerst, Laboratoires vétérinaires, Division de Wyeth-Ayerst Canada Inc. |
0,0 |
0,0 |
| Baxter Corporation |
0,02 |
0,05 |
| Bayer Inc., Division de la santé2,6 |
3,5 |
5,3 |
| Bayer Inc., Division de l'agriculture |
2,1 |
2,4 |
| Berlex Canada Inc.2 |
6,5 |
6,2 |
| Biogen Canada Inc.6 |
42,5 |
41,1 |
| Biovail Pharmaceuticals Canada, Division of Biovail Corporation6 |
19,3 |
33,9 |
| Boehringer Ingelheim (Canada) Ltée2 |
20,9 |
32,8 |
| Bracco Diagnostics Canada Inc. |
0,0 |
0,0 |
| Bristol-Myers Squibb, Groupe pharmaceutique2 |
8,3 |
9,2 |
| Canderm Pharma Inc. |
3,9 |
6,2 |
| Chiron Canada ULC |
31,1 |
8,4 |
| Dimethaid Research Inc.7 |
47,9 |
- |
| Draxis Health Inc. (n'a pas présenté son rapport sur ses dépenses de R-D en 2003) |
- |
10,5 |
| Elan Pharmaceuticals, Inc. |
0,0 |
2,3 |
| Eli Lilly Canada Inc. (dont Elanco Animal Health Division)2,6 |
8,3 |
8,9 |
| Enzon Pharmaceuticals Inc. |
0,9 |
0,0 |
| ESP Pharma Inc.7 |
0,0 |
- |
| Ferring Inc. |
1,5 |
1,1 |
| Fournier Pharma Inc.2 |
1,6 |
1,8 |
| Fujisawa Canada Inc.2 |
12,7 |
11,6 |
| Galderma Canada Inc. |
0,9 |
1,0 |
| Genzyme Canada Inc.6 |
0,7 |
0,8 |
| GlaxoSmithKline2,6 |
10,1 |
10,0 |
| GlaxoSmithKline Consumer Healthcare Inc. |
0,0 |
0,0 |
| Grifols Biologicals Inc., (filiale de Probitas Pharma auparavant Alpha Therapeutic Corporation) |
0,0 |
0,0 |
| Guilford Pharmaceuticals |
0,0 |
0,0 |
| Hoffmann-La Roche Canada Ltée2,6 |
3,8 |
3,8 |
| ICN Canada Ltée |
2,1 |
1,6 |
| Intermune Inc. |
0,0 |
0,0 |
| Janssen-Ortho Inc.2,6 |
9,8 |
8,2 |
| Johnson & Johnson Merck, Consumer Pharmaceuticals of Canada |
0,0 |
0,0 |
| Leo Pharma Inc.2 |
5,9 |
5,2 |
| Les Laboratories Inc.2,8 |
0,0 |
0,0R |
| Lundbeck Canada Inc.2 |
0,0 |
1,0 |
| McNeil Canada, Produits aux consommateurs |
2,2 |
1,8 |
| Medicis Canada Ltd. |
0,0 |
0,0 |
| Merck Frosst Canada Ltd.2,6 |
13,4 |
12,3 |
| Merck Frosst - Schering Pharma7 |
17,7 |
- |
| Merial Canada Inc. |
0,7 |
0,6 |
| Novartis Animal Health Canada Inc. |
0,04 |
0,7 |
| Novartis Consumer Health Canada Inc. |
1,4 |
1,4 |
| Novartis Ophthalmics |
10,1 |
11,0 |
| Novartis Pharmaceuticals Canada Inc.2 |
10,0 |
12,5 |
| Novo Nordisk Canada Inc.6 |
1,4 |
0,9 |
| Organon Canada Ltée2 |
1,3 |
2,3 |
| Organon Sanofi-Synthélabo Canada4 |
11661,6 |
0,0 |
| Ortho Dermatological, Division de Johnson & Johnson Inc. |
0,0 |
0,0 |
| Paladin Laboratories Inc.2 |
6,6 |
5,7 |
| Pfizer Canada Inc., Animal Health Group |
1,7 |
1,6 |
| Pfizer Canada Inc.2 |
9,5 |
12,0 |
| Pfizer Canada Inc., Consumer Healthcare Division |
0,9 |
1,0 |
| Pharmaceutical Partners of Canada Inc.7 |
0,0 |
- |
| Pharmacia Canada Inc. |
5,5 |
6,7 |
| Pharmascience Inc. |
10,8 |
9,1R |
| Procter & Gamble Pharmaceuticals Canada, Inc.2 |
6,0 |
8,3 |
| Purdue Pharma2 |
2,6 |
3,9 |
| Rare Disease Therapeutics Inc. |
0,0 |
0,0R |
| Ratiopharm6 |
0,0 |
0,0 |
| RGR Pharma Ltd.7 |
0,3 |
- |
| Sanofi-Synthélabo Canada Inc.2 |
53,4 |
42,0 |
| Schering Canada Inc.2 |
3,4 |
8,9 |
| Servier Canada Inc.2 |
10,3 |
14,9 |
| Shire-BioChem Inc.2,6 |
16,6 |
98,0 |
| Solvay Pharma Inc.2 |
0,05 |
0,8 |
| Stiefel Canada Inc.2 |
3,2 |
1,2 |
| Tyco Healthcare Group Canada Inc. |
0,0 |
0,02 |
| Wyeth-Ayerst Canada Inc.2 |
13,6 |
13,5 |
| Yamanouchi Pharmaceutical Co. Ltd. |
0,0 |
0,0 |
Source : CEPMB
1 Les recettes tirées des redevances sont comprises dans le ratio de chaque société, mais elles sont soustraites lorsqu'il y a lieu du total pour l'ensemble du secteur afin d'éviter la double comptabilisation. Les subventions des gouvernements fédéral et provinciaux ne sont pas comptabilisés dans les dépenses utilisées pour le calcul des ratios des dépenses de R-D de chaque société par rapport aux recettes tirées de leurs ventes, mais elles le sont dans les statistiques pour l'ensemble des brevetés. La liste des sociétés qui ont soumis un rapport sur les prix de leurs médicaments n'est pas identique à celle des sociétés ayant soumis un rapport sur leurs activités de R-D à cause des différences au niveau des modalités de rapport entre les brevetés et leurs sociétés affiliées ou les détenteurs de licence de production ainsi que du fait que les titulaires d'un brevet pour un médicament vétérinaire sont tenus de présenter chaque année un rapport sur leurs dépenses de R-D, mais pas nécessairement sur les prix qu'ils pratiquent et la valeur de leurs ventes.
2 Membre de Rx&D.
3 Auparavant appelée BYK Canada Inc.
4 Entreprise en coparticipation formée de Organon Canada Ltée et de Sanofi-Synthélabo Canada Inc. Le ratio a été vérifié auprès de la société. Organon Canada Ltée et Sanofi-Synthélabo Canada Inc. assument à parts égales les dépenses de R-D.
5 Auparavant appelée Altimed Pharmaceutical Inc.
6 Membre de BIOTECanada.
7 N'était pas un breveté en 2002.
8 Les Laboratories Inc. est le titulaire du brevet, mais BLES Biochemicals, l'exploitant du brevet et le fabricant, a soumis les rapports sur les prix et sur la valeur des ventes en 2002 et en 2003.
R Données révisées depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002. |
Tableau 10 Dépenses courantes de R-D selon le type de recherche, 2003 et 2002
| Type de recherche |
2003 |
2002R |
% de variation
2003-2002 |
| Millions $ |
% |
Millions $ |
% |
| Fondamentale |
180,0 |
15,7 |
198,6 |
17,4 |
-9,3 |
| - Chimique |
77,8 |
6,8 |
104,4 |
9,1 |
-25,4 |
| - Biologique |
102,2 |
8,9 |
94,1 |
8,2 |
8,6 |
| Appliquée |
629,7 |
55,1 |
636,6 |
55,8 |
-1,08 |
| - Processus de fabrication |
99,8 |
8,7 |
117,4 |
10,3 |
-14,9 |
| - Essai préclinique I |
24,8 |
2,1 |
46,3 |
4,1 |
-46,4 |
| - Essai préclinique II |
17,6 |
1,5 |
30,1 |
2,6 |
-41,5 |
| - Essai clinique I |
54,1 |
4,7 |
40,1 |
3,5 |
34,9 |
| - Essai clinique II |
102,5 |
8,9 |
104,8 |
9,1 |
-2,1 |
| - Essai clinique III |
330,9 |
28,9 |
297,9 |
26,1 |
11,1 |
| Autre R-D admissible |
332,2 |
29,0 |
304,3 |
26,6 |
9,1 |
| Total |
1 142,5 |
100,0* |
1 139,9 |
100,0* |
0,2 |
Source : CEPMB
* Le total réel de cette colonne ne correspond pas nécessairement à 100,0, certains chiffres ayant été arrondis.
R : Données révisées depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002. |
Tableau 11 Dépenses courantes de R-D selon le milieu de recherche, 2003 et 2002
| Milieu de recherche |
2003 |
2002R |
% de variation
2003-2002 |
| Millions $ |
% |
Millions $ |
% |
| À l'interne |
| - Brevetés |
630,0 |
55,1 |
622,0 |
54,5 |
1,27 |
| - Universités et hôpitaux |
127,5 |
11,1 |
139,8 |
12,2 |
-8,84 |
| - Autres sociétés |
258,5 |
22,6 |
277,6 |
22,5 |
-6,8 |
| - Autres |
126,4 |
11,0 |
100,3 |
8,8 |
26,0 |
| Total |
1 142,5 |
100,0* |
1 139,9 |
100,0* |
0,2 |
Source : CEPMB
* Le total réel de cette colonne ne correspond pas nécessairement à 100,0, certains chiffres ayant été arrondis.
R : Données révisées depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002. |
Tableau 12 Dépenses courantes de R-D selon la provenance des fonds, 2003 et 2002
| Provenance des fonds |
2003 |
2002R |
% de variation
2003-2002 |
| Millions $ |
% |
Millions $ |
% |
| Sociétés pharmaceutiques |
1 127,1 |
94,5 |
1 115,3 |
93,0 |
0,9 |
| Gouvernements fédéral et provinciaux |
11,2 |
0,9 |
14,4 |
1,2 |
-22,2 |
| Autres |
54,1 |
4,5 |
68,9 |
5,7 |
-21,4 |
| Total |
1 192,4 |
100,0* |
1 198,7 |
100,0* |
-0,6 |
Source : CEPMB
* Le total réel de cette colonne ne correspond pas nécessairement à 100,0, certains chiffres ayant été arrondis.
R : Données révisées depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002. |
Tableau 13 Dépenses courantes de R-D selon la région géographique, 2003 et 2002
| Région géographique |
2003 |
2002R |
% de variation
2003-2002 |
| Millions $ |
% |
Millions $ |
% |
| Provinces atlantiques |
21,4 |
1,9 |
26,5 |
2,3 |
-19,2 |
| Québec |
482,3 |
42,2 |
488,8 |
42,9 |
-1,3 |
| Ontario |
537,2 |
47,0 |
480,6 |
42,2 |
11,8 |
| Provinces de l'Ouest |
101,5 |
8,9 |
140,1 |
12,3 |
-27,5 |
| Territoires |
0,1 |
0,008 |
3,9 |
0,3 |
-97,8 |
| Total |
1 142,5 |
100,0* |
1 139,9 |
100,0* |
0,2 |
Source : CEPMB
* Le total réel de cette colonne ne correspond pas nécessairement à 100,0, certains chiffres ayant été arrondis.
R : Données révisées depuis la publication du Rapport annuel du CEPMB pour l'exercice 2002. |
Tableau 14 Dépenses courantes de R-D selon la province et le milieu de recherche, 2003
| Province |
|
Milieux de recherche |
Pourcentage des
dépenses |
| Brevetés |
Autres
sociétés |
Universités |
Hôpitaux |
Autres |
Total |
Membres
de Rx&D |
|
| Terre-Neuve |
(000) $ |
885,20 |
881,96 |
1 067,24 |
468,12 |
2 018,06 |
5 320,57 |
4 624,97 |
0,46 |
| % |
16,63 |
16,57 |
20,05 |
8,79 |
37,92 |
100,00 |
0,48 |
|
| Île-du-Prince-Édouard |
(000) $ |
203,45 |
536,23 |
117,55 |
0,0 |
119,90 |
977,12 |
899,83 |
0,086 |
| % |
20,82 |
54,87 |
12,03 |
0,0 |
12,27 |
100,00 |
0,095 |
|
| Nouvelle-Écosse |
(000) $ |
3 354,56 |
3 315,18 |
863,59 |
2 921,08 |
1 830,31 |
12 284,72 |
10 824,16 |
1,075 |
| % |
27,30 |
26,98 |
7,03 |
23,77 |
14,88 |
100,00 |
1,13 |
|
| Nouveau- Brunswick |
(000) $ |
737,28 |
855,84 |
45,7 |
587,36 |
601,39 |
2 827,57 |
2 086,41 |
0,247 |
| % |
26,07 |
30,26 |
1,61 |
20,77 |
21,26 |
100,00 |
0,219 |
|
| Québec |
(000) $ |
302 252,77 |
94 268,06 |
10 389,02 |
24 196,22 |
51 201,43 |
482 307,49 |
462 853,35 |
42,21 |
| % |
62,66 |
19,54 |
2,15 |
5,017 |
10,61 |
100,00 |
48,67 |
|
| Ontario |
(000) $ |
306 277,25 |
118 085,99 |
19 913,55 |
38 513,54 |
54 423,67 |
537 214,01 |
380 818,94 |
47,01 |
| % |
57,01 |
21,98 |
3,70 |
7,16 |
10,13 |
100,00 |
40,12 |
|
| Manitoba |
(000) $ |
2 629,33 |
5 113,69 |
1 033,21 |
3 489,93 |
2 042,66 |
14 308,83 |
11 289,51 |
1,25 |
| % |
18,37 |
35,73 |
7,22 |
24,39 |
14,27 |
100,00 |
1,19 |
|
| Saskatchewan |
(000) $ |
1 422,84 |
1 719,60 |
1 879,68 |
754,29 |
1 509,27 |
7 285,67 |
6 428,00 |
0,638 |
| % |
19,52 |
23,60 |
25,80 |
10,35 |
20,71 |
100,00 |
0,67 |
|
| Alberta |
(000) $ |
6 884,41 |
10 105,78 |
7 201,94 |
3 481,06 |
6 186,82 |
33 860,01 |
30 781,57 |
2,964 |
| % |
20,33 |
29,84 |
21,27 |
10,28 |
18,27 |
100,00 |
3,237 |
|
| Colombie- Britannique |
(000) $ |
5 348,66 |
23 691,36 |
6 327,09 |
4 176,50 |
6 531,89 |
46 075,51 |
38 441,03 |
4,033 |
| % |
11,60 |
51,41 |
13,73 |
9,06 |
14,17 |
100,00 |
4,04 |
|
| Yukon; T.N.-O; Nunavut |
(000) $ |
0,00 |
0,00 |
83,0 |
3,32 |
0,00 |
86,32 |
83,0 |
0,008 |
|
| % |
0,00 |
0,00 |
96,15 |
3,84 |
0,00 |
100,00 |
0,009 |
|
| Canada |
(000) $ |
629 995,75 |
258 573,69 |
48 921,57 |
78 591,42 |
126 465,39 |
1 142 547,82 |
949 130,77 |
100,00 |
| % |
55,14 |
22,63 |
4,28 |
6,87 |
11,06 |
100,00 |
100,00 |
|
Source : CEPMB
1 Le pourcentage figurant sous chaque catégorie de R-D correspond au pourcentage de toutes les dépenses encourues par la province au titre de cette catégorie.
2 Les dépenses présentées en pourcentage correspondent au pourcentage des dépenses de R-D dans cette province comparé à l'ensemble des dépenses de R-D faites au Canada.
3 Le total des colonnes verticales et horizontales ne correspond pas nécessairement, certains chiffres ayant été arrondis. |
1er janvier 2003 au 31 décembre 2003 (PDF)
[1] Le portefeuille de la Santé contribue de multiples façons à améliorer l´état de santé des Canadiens et des Canadiennes. Il est formé de Santé Canada et des trois agences suivantes : les Instituts de recherche en santé du Canada, le Conseil de contrôle des renseignements relatifs aux matières dangereuses et le Conseil d´examen du prix des médicaments brevetés.
[2] Rapport annuel sur la performance, janvier-décembre 2003, Direction des produits thérapeutiques, Santé Canada.
[3] Les Lignes directrices du Conseil établissent trois catégories de nouveaux médicaments brevetés aux fins de l´examen du prix de lancement.
- Catégorie 1 - nouveau DIN d´une forme pharmaceutique existante d´un médicament existant ou un nouveau DIN d´une autre forme pharmaceutique du médicament qui est comparable à la forme pharmaceutique existante, habituellement une nouvelle concentration d´un médicament existant (extension d´une gamme de produits).
- Catégorie 2 - premier médicament mis au point pour traiter une condition ou qui constitue une amélioration importante par rapport aux médicaments existants. Les médicaments de cette catégorie sont souvent qualifiés de « découverte » ou d´ « amélioration importante ».
- Catégorie 3 - nouveau DIN, nouveau médicament ou nouvelle forme pharmaceutique d´un médicament existant qui procure tout au plus des bienfaits modestes ou minimes par rapport aux médicaments existants.
[4] Ces médicaments sont devenus assujettis à la compétence du CEPMB en 2003 à compter de la délivrance d´un brevet.
[5] Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) est composé de trois experts scientifiques indépen-dants. Son rôle est de formuler des recommandations sur la classification des nouveaux médicaments et sur le choix des médica-ments comparables.
[6] En raison des dates de présentation des rapports des brevetés établies par le Règlement sur les médicaments brevetés et la méthode de calcul des prix de référence, les médicaments lancés sur le marché canadien ou brevetés en décembre sont comptabilisés dans les nouveaux médicaments de l´exercice suivant.
[7] La valeur totale des ventes au prix départ-usine est établie en additionnant la valeur des ventes déclarée par les brevetés et la valeur estimée des ventes de médicaments génériques au Canada. Le Règlement sur les médicaments brevetés oblige les brevetés à soumettre au CEPMB les données sur leurs ventes annuelles de médicaments brevetés et non brevetés au Canada.
IMS Health publie des rapports sur les ventes estimées des produits des différentes sociétés pharmaceutiques. La valeur des ventes des médicaments génériques est établie en additionnant la valeur des ventes des médicaments génériques effectuées au Canada par des sociétés membres de l´Association canadienne des médicaments génériques (ACMG). L´augmentation de 16,4 % de la valeur des ventes de médicaments génériques estimée pour 2003 est en partie attribuable à l´inclusion de la société Cobalt Pharmaceuticals Inc. qui n´était pas prise en compte dans les estimations des années antérieures (la société n´étant alors pas membre de l´ACGM). Si l´on fait exclusion de la société Cobalt Pharmaceuticals Inc., la croissance de la valeur des ventes des médicaments génériques serait de 15,9 % pour 2003.
Depuis 1999, le calcul de la valeur des ventes au prix départ-usine de tous les médicaments brevetés et non brevetés ne porte que sur les médicaments pour usage humain.
[8] IMS Health´s Drug Monitor, Novembre 2003 (www.imshealth.com). « Pour 13 marchés étrangers, les données sur la valeur des ventes portent sur les achats effectués directement ou indirectement (pharmacies, hôpitaux et commandes postales lorsque indiqué) auprès de grossistes et de fabricants. La valeur des ventes se fonde sur les données sur les ventes sous ordonnance et en vente libre et représente les prix départ-usine. Ces 13 marchés accaparent plus des deux tiers du marché mondial ». Ces 13 pays sont l´Argentine, l´Australie, le Brésil, le Canada, la France, l´Allemagne, l´Italie, le Japon, le Mexique, la Nouvelle-Zélande, l´Espagne, le Royaume Uni et les États-Unis.
[9] La mesure des dépenses utilisée est le « total des dépenses pour l´achat de médicaments et autres produits médicaux non durables » de l´Organisation de coopération et de développement économiques (OCDE). Même si elle est largement dominée par les produits pharmaceutiques, cette mesure comporte quelques produits non pharmaceutiques vendus dans les pharmacies. Elle ne comprend pas les achats de médicaments par les hôpitaux. Ce graphique a été établi à l´aide de données tirées du site Internet de l´OCDE dont l´adresse est www.ocde.org.
[10] Pour comprendre comment est calculé l´IPMB, consultez le document du CEPMB intitulé Description de la méthodologie de l´indice-chaîne Laspeyres utilisée pour calculer l´indice des prix des médicaments brevetés (IPMB), mars 1997, révisé en juin 2000. Consultez également le document intitulé Description des principaux indices des prix des produits pharmaceutiques produit conjointement par Statistique Canada et le CEPMB, janvier 2001. L´IPMB mesure la variation des prix des médicaments brevetés existants, mais non les effets des variations sur les ventes des quantités de médicaments consommés ou substitués (par exemple, l´utilisation de nouveaux médicaments plutôt que de médicaments plus anciens généralement vendus à prix moindres). Depuis la publication du rapport annuel de 1999, l´IPMB ne porte que sur les changements des prix des médicaments brevetés pour usage humain.
[11] L´année 1992 est la seule année où l´IPMB a augmenté davantage que l´IPC. Pour faciliter et encourager la conformité des brevetés, la méthodologie du prix rajusté en fonction de l´IPC utilise le taux d´inflation prévu et publié par le ministère des Finances. En 1992, le taux prévu était de 3,2 % alors que le taux actuel n´était que de 1,5 %. Cette méthodologie du prix rajusté en fonction de l´IPC est présentée à l´appendice 4 du Compendium des Lignes directrices, politiques et procédures.
[12] Statistique Canada, CANSIM, Série V735319.
[13] Les Lignes directrices du CEPMB sur les prix excessifs limitent également les augmentations sur douze mois des prix. Ces augmentations ne peuvent en effet être supérieures à une fois et demi le taux d´inflation de l´année en cours.
[14] L´IPPI (composante pharmaceutique) ne couvre pas les produits pharmaceutiques importés et vendus au Canada, mais il couvre les produits pharmaceutiques et les médicaments non brevetés exportés. Selon Statistique Canada environ 60 % des ventes effectuées en 2003 sont des ventes de médicaments importés.
[15] Statistique Canada, CANSIM, Série V1576093.
[16] U.S. Bureau of Labor Statistics, Producer Price Index - Commodities, Series ID: Wpu063.
[17] La méthodologie suivie par le CEPMB pour ses comparaisons des prix canadiens aux prix pratiqués dans les pays de comparaison est décrite dans le Compendium des Lignes directrices, politiques et procédures et dans deux documents publiés en 1998 en même temps que le Guide pour la prochaine décennie, intitulés Tendances des prix des médicaments brevetés et Vérification des prix des médicaments brevetés pratiqués à l´étranger.
[18] Le CEPMB effectue les conversions des devises sur une période donnée en utilisant une moyenne simple du cours d´échange au comptant des 36 mois précédents. Cette approche a un effet de lissage, en ce sens qu´elle limite l´influence des rajustements transitoires des taux de change sur les comparaisons des prix pratiqués au Canada à ceux pratiqués dans différents pays. Elle permet également d´intégrer progressivement les effets des fluctuations à long terme des taux de change. De cette façon, une augmentation ou une diminution de la valeur du dollar canadien peut continuer de produire des rajustements des ratios des prix canadiens par rapport aux prix étrangers sur une période de trois ans après la variation du taux de change.
[19] L´industrie pharmaceutique des États-Unis a fait valoir que ses prix disponibles au public américain ne reflètent pas vraiment les prix pratiqués puisque des rabais et des remises sont régulièrement accordés sur une base confidentielle. En janvier 2000, dans la foulée d´une consultation publique, le CEPMB a mis en oeuvre une politique prévoyant la prise en compte du prix de la Classification fédérale des approvisionnements dans le calcul des prix moyens des médicaments brevetés pratiqués aux États-Unis. Les prix de la Classification fédérale correspondent aux prix négociés avec le U.S. Department of Veterans Affairs. Ces prix sont moins élevés que les autres prix disponibles au public et dont les fabricants font rapport au CEPMB.
[20] Voir le document intitulé National Health Expenditure Trends, 1975-2003 de l´Institut canadien d´information sur la santé (ICIS). Ces prévisions ont été tirées de plusieurs sources de données : Enquête nationale sur la consommation des ménages (pour les achats privés de médicaments d´ordonnance) de Statistique Canada, Comptes publics des gouvernements fédéral et provinciaux (pour les dépenses des régimes publics consacrées à l´achat de médicaments), données fournies par l´Association canadienne des compagnies d´assurance de personnes (pour les médicaments remboursés par des assureurs privés) et l´information fournie par le cabinet de recherche commerciale A.C.Nielson (Canada) (pour les achats de produits grand public). Pour de plus amples renseignements concernant ce rapport et l´ICIS, consultez le site Internet de l´ICIS à l´adresse www.cihi.ca.
[21] Dans son étude intitulée Analysis of Drug Claim Costs 1997-2001, Green Shield Canada mentionne que les coûts des médicaments associés à une réclamation moyenne ont généralement augmenté au taux annuel composé de 7,4 % et que les prix des médicaments ont reculé en moyenne de 0,2 % au cours de la même période.
[22] Statistique Canada, CANSIM, Série V737546.
[23] CEPMB, Régimes d´assurance – médicaments provinciaux : Vue d´ensemble – évolution des prix des médicaments 1995-1996 – 1999-2000, septembre 2001.
[24] Comme pour l´IPMB, l´IVVMB est calculé à l´aide de la formule de l´indice-chaîne Laspeyres à la différence que les ratios de volumes pour des périodes successives remplacent les ratios de prix de l´IPMB. Ici encore, la valeur globale de l´indice constitue une moyenne pondérée des recettes des ratios au niveau des différents produits.
L´IVVMB ne couvre que les médicaments brevetés et, de ce fait, ne représente pas toujours fidèlement les tendances d´utilisation des médicaments sur l´ensemble du marché pharmaceutique.
[25] Il importe de préciser que la part relative des ventes de tous les médicaments selon la catégorie ATC ne correspond pas nécessairement aux parts des médicaments brevetés.
[26] Afin de protéger la confidentialité des données, ces deux groupes ont été jumelés.
[27] Tel que publié dans le Résumé de l´étude d´impact de la réglementation du Règlement sur les médicaments brevetés, 1988, publié dans la partie II de la Gazette du Canada, vol. 122, n o 20 – SOR/DORS/88-474.
[28] Les ventes de médicaments pour usage humain et les médicaments pour usage vétérinaire sont visées aux fins du présent chapitre de ce rapport.
[29] Les dépenses courantes de R-D comprennent les dépenses autres qu´en capital directement associées à la recherche, dont (a) les salaires, (b) matériel direct, (c) entrepreneurs et sous-traitants, (d) coûts directement associés aux coûts indirects de production, (e) paiements aux institutions désignées, (f) paiements aux organismes subventionnaires et (g) les paiements aux autres organismes. Ces éléments sont décrits plus en détail dans le Guide du breveté concernant la façon de remplir les formulaires; formulaire 3, disponible sur notre site Internet sous la rubrique Loi, Règlement et Lignes directrices.
[30] Rapport du Groupe de travail sur les questions relatives à l´examen des prix remis au Conseil d´examen du prix des médicaments brevetés, intitulé « Processus d´examen du prix des nouveaux médicaments brevetés », Novembre 2000.
[31] La Stratégie d´accès thérapeutique est une initiative de Santé Canada qui vise à aider les Canadiens et les Canadiennes à maintenir et à améliorer leur santé. Ainsi, Santé Canada voit à assurer que les médicaments pour usage humain, et tout autre produit thérapeutique, soient sécuritaires, de haute qualité, efficace, utilisés correctement et disponible en temps opportun et à des coûts acceptables. Le CEPMB a reçu des fonds par le biais de la Stratégie pour son Project d´examen des échéanciers. Pour de plus amples renseignements sur cette initiative, voir la page 37 du présent rapport.
[32] Pour de plus amples renseignements concernant le Système national d´information sur l´utilisation des médicaments prescrits (SNIUMP), voir la page 30 du présent rapport.