Rapport annuel 2006

Table des matières
- Mission et valeurs du CEPMB
- Lettre au Ministre de la Santé
- Faits saillants 2006
- Message du président
- Le conseil d’examen du prix des médicaments brevetés : mandat et compétences
- Gouvernance
- Réglementation des prix des médicaments brevetés
- Conformité et Lignes directrices sur les prix excessifs
- Engagements de conformité volontaire
- Audiences
- Décision de la Cour fédérale dans l’affaire de LEO Pharma Inc. et le médicament breveté Dovobet
- Rapport sur les principales tendances
- Tendances des ventes de médicaments brevetés
- Tendances des prix
- Comparaison des prix pratiqués dans les pays de comparaison avec ceux pratiqués au Canada
- Utilisation des médicaments brevetés
- Tendances de l’industrie canadienne de fabrication de médicaments
- Ventes de médicaments au Canada par rapport aux ventes dans d’autres pays
- Analyse des dépenses de recherche-développement
- Système national d'information sur les médicaments prescrits
- Suivi des prix des médicaments non brevetés distribués sous ordonnance et rapport des tendances observées
- Modification du Règlement sur les médicaments brevetés, 1994
- Examen des Lignes directrices sur les prix excessifs
- Communications
- Glossaire
- Annexe 1 - Critères justifiant la tenue d'une enquête
- Annex 2 - Médicaments brevetés lancés sur le marché canadien en 2006 (I)
- Annex 2 - Médicaments brevetés lancés sur le marché canadien en 2006 (II)
- Annex 3 - Recherche et développement
Le Conseil d'examen du prix des médicaments brevetés a pour mission de contribuer aux soins de santé de la population canadienne en s'assurant que le prix de chaque médicament breveté n'est pas excessif, en analysant les tendances des prix de tous les médicaments ainsi que les dépenses de recherche-développement des brevetés et en faisant rapport des conclusions de ses analyses à la population canadienne. Il remplit ce mandat :
- en encourageant le respect volontaire de ses Lignes directrices
- en faisant l'examen des prix et en prenant lorsqu'il y a lieu les mesures de redressement nécessaires
- en consultant les parties intéressées au sujet des Lignes directrices et autres questions de politique
- en renseignant la population sur son mandat, ses activités et ses réalisations par ses activités de communication, la diffusion d'information et la sensibilisation du public.
Pour remplir cette mission, le Conseil exerce un leadership novateur fondé sur :
- l'efficacité et l'efficience
- l'équité
- l'intégrité
- le respect mutuel
- la transparence
- un milieu de travail favorable et motivant.
Vous pouvez obtenir nos publications via notre site Web (www.pmprb-cepmb.gc.ca) ou en téléphonant à notre numéro d'interurbains sans frais
(1-877-861-2350).
Conseil d'examen du prix des médicaments brevetés
Centre Standard Life
Boîte L40
333, avenue Laurier ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 613-952-7360
Télécopieur : 613-952-7620
ATMT : 613-957-4373
Toutes nos publications sont disponibles en français et en anglais
No de catalogue : H78-2006; ISBN : 978-0-662-69746-6
PDF : No de catalogue : H78-2006F-PDF ISBN : 978-0-662-09029-8

MANDAT DE RÉGLEMENTATION
Les activités de réglementation du CEPMB ont été en progression cette année encore.
Conformité
- En 2006, 99 nouveaux médicaments brevetés pour usage humain (DIN) ont fait l'objet d'un rapport au CEPMB. De ce nombre, 29 médicaments, représentant 43 DIN, sont de nouvelles substances actives. En date du 31 mars 2007, l'examen de 79 des 99 nouveaux médicaments brevetés avait été effectué. De ces 79 médicaments, 68 ont été reconnus conformes aux Lignes directrices et 11 sont sous enquête.
- En 2006, 1 181 médicaments brevetés pour usage humain étaient assujettis à la compétence du CEPMB.
Application
- Le Conseil a approuvé quatre engagements de conformité volontaire, dont un en mai 2007 dans le contexte d'une audience publique.
- Le Conseil a émis huit avis d'audience en 2006, portant à dix le nombre d'audiences en cours. Les audiences dans les affaires du Dovobet et du Nicoderm, ouvertes il y a quelques années, sont encore en instance.
MANDAT DE RAPPORT
Comme on peut le voir dans la section sur les tendances des prix des produits pharmaceutiques du présent rapport, le CEPMB a approfondi ses analyses des indices des prix des produits pharmaceutiques. Le CEPMB a publié différents rapports et études. Au titre du Système national d'information sur l'utilisation des médicaments prescrits, il a publié les Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes d'assurance- médicaments. Au titre de l'initiative sur les prix des médicaments non brevetés distribués sous ordonnance, il a publié Tendances des prix pratiqués au Canada et dans les pays de comparaison ainsi que Tendances de la valeur des ventes au Canada et structure du marché.
Tendances des ventes
- En 2006, les ventes au Canada des médicaments brevetés ont augmenté de 3,7 %, pour totaliser 12 milliards de dollars. La croissance annuelle de la valeur des ventes était de 27 % en 1999 et est demeurée dans les deux chiffres jusqu'en 2003.
- La part des médicaments brevetés de l'ensemble des ventes a baissé en 2006, passant de 71,4 % qu'elle était en 2005 à 68,1 % en 2006.
- Ce sont les agents antinéoplasiques et les agents immunomodulateurs (pour la chimiothérapie) qui ont le plus contribué en 2006 à l'augmentation de la croissance des ventes de cette catégorie de médicaments.
Tendances des ventes
- Prix au Canada – les prix départusine des médicaments au Canada, mesurés à l'aide de l'Indice des prix des médicaments brevetés (IPMB), ont diminué d'une moyenne de 0,2 % en 2006. Cette légère diminution de l'IPMB est attribuable aux prix moins élevés chargés aux hôpitaux. Comme pour les années précédentes, l'IPMB a varié selon la catégorie de clients (hôpitaux, pharmacies, grossistes) et selon également les provinces et les territoires.
- Pendant la même période, l'Indice des prix à la consommation (IPC) était de 2,0 %. L'analyse des prix selon le groupe thérapeutique principal a révélé une variabilité considérable des prix.
- Ratio des prix au Canada par rapport aux pays de comparaison – le ratio des prix pratiqués au Canada par rapport à la médiane des prix pratiqués dans les pays de comparaison était légèrement sous la parité. Cinq des sept pays de comparaison ont enregistré en 2006 une baisse générale des prix. Aux États-Unis, les prix ont augmenté d'une moyenne de plus de 7 %.
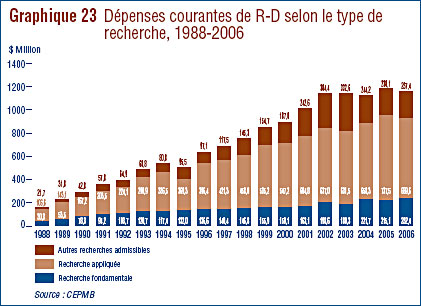
Recherche et développement
- Les brevetés ont fait rapport de dépenses de R-D de 1,210 milliard de dollars pour 2006, soit 1,9 % de moins qu'en 2006. Les brevetés membres de Rx&D ont fait état de dépenses de R-D totalisant 949 millions de dollars. En 2005, ce chiffre était de 1,0 milliard de dollars.
- Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes a poursuivi sa baisse, passant de 8,7 % en 2005 à 8,1 % en 2006. Cette même tendance a été observée au niveau des brevetés membres de Rx&D dont les ratios sont passés de 8,8 % à 8,5%. Les ratios des dépenses de R-D par rapport aux recettes tirées des ventes de l'ensemble des brevetés sont inférieurs à 10% depuis 2001. Pour les brevetés membres de Rx&D, ils se situent sous 10 % depuis 2003.
- Les brevetés ont investi 232,4 millions de dollars dans la recherche fondamentale, ce qui représente 20.0 % de l'ensemble des dépenses de R-D. Par rapport à 2005, les dépenses en recherche fondamentale ont augmenté de 8.0 %.
Consultations
Le Conseil a consulté en 2006 ses intervenants sur ses Lignes directrices sur les prix excessifs. Le processus d'examen des Lignes directrices prévoit, tel qu'annoncé dans le communiqué du Conseil le 31 mai 2007 et affiché sur son site Web, la création de groupes de travail et la tenue à l'automne 2007 de séances de discussion bilatérales auxquelles seront conviés des représentants des gouvernements, de l'industrie pharmaceutique et des consommateurs.
Le moins que l'on puisse dire, c'est que l'année 2006 s'est révélée une année de changements et de défis pour le CEPMB ainsi que pour moimême alors que j'ai été nommé à la présidence du Conseil.
Au cours de la dernière année, le CEPMB a connu une forte augmentation du nombre d'audiences émises en vertu de la Loi sur les brevets, la première étape d'une révision en profondeur de nos Lignes directrices sur les prix excessifs clôturée par une vaste consultation publique. Le CEPMB a également publié différentes études et analyses aux titres du Système national d'information sur les médicaments prescrits (SNIUMP) et de son mandat de suivi et de rapport sur les prix des médicaments non brevetés distribués sous ordonnance. Comme on pourra le constater dans le présent rapport, ces nouvelles activités se sont ajoutées à nos activités de fond, dont en ce qui concerne l'année 2006 l'examen de plus de 1 100 médicaments brevetés, dont 99 nouveaux médicaments récemment assujettis à la compétence du Conseil.
Toujours en 2006, le Conseil a émis six Avis d'audience afin de déterminer si les médicaments brevetés visés sont ou ont été vendus sur un marché canadien à des prix que le Conseil juge excessifs. Au cours des premiers mois de 2007, le Conseil a émis deux autres Avis d'audience, portant ainsi à huit le nombre d'avis d'audiences émis par le Conseil entre 1987 et 2005.
Comme je l'avais annoncé dans le rapport annuel pour l'année 2005, le Conseil a publié un guide de discussion et a consulté ses intervenants sur les changements proposés à ses Lignes directrices sur les prix excessifs. Cette consultation poursuivait un objectif auquel le CEPMB accorde beaucoup d'importante, à savoir s'assurer que ses Lignes directrices, qui portent sur le processus d'examen du prix, sont aujourd'hui encore pertinentes et utiles pour les membres de son personnel, pour les brevetés et pour les autres intervenants. Le Conseil tient également à ce que ses Lignes directrices reflètent l'interprétation qu'il donne des facteurs de fixation des prix mentionnés dans la Loi sur les brevets.
Au nombre des principales questions abordées dans le cadre de l'examen des Lignes directrices, citons le classement des nouveaux médicaments, les tests appliqués aux prix, la définition de l'expression « sur un marché », la révision du prix de référence ainsi que l'application des principes directeurs du processus d'examen du prix au mandat du Conseil.
Le Conseil poursuit son analyse et entend tenir au cours de l'automne 2007 des consultations bilatérales avec des groupes représentant le secteur pharmaceutique, les gouvernements fédéral, provinciaux et territoriaux et les consommateurs.
Par ailleurs, le Conseil continue d'assurer un soutien en matière d'analyse aux ministres fédéral, provinciaux et territoriaux de la Santé au titre du SNIUMP. À ce titre, nous avons tout récemment publié les Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes d'assurance-médicaments et L'Observateur des médicaments émergents. Par ailleurs, dans le contexte de notre fonction de suivi des prix des médicaments non brevetés distribués sous ordonnance, nous avons publié deux rapports en 2006 à savoir Tendances des prix pratiqués au Canada et dans les pays de comparaison et Tendances de la valeur des ventes au Canada et structure du marché. Sous peu, nous publierons le rapport Marché des médicaments dont le brevet est récemment arrivé à échéance. Enfin, au moyen de ces différents rapports trimestriels, le Conseil vient combler une lacune en matière d'information et aide les décideurs à mieux distinguer les tendances des prix des médicaments distribués en vente libre ainsi que les facteurs qui exercent une incidence sur les prix des médicaments au Canada.
Le CEPMB est de plus en plus appelé à relever de nouveaux défis, qu'il s'agisse de l'examen des Lignes directrices sur les prix excessifs, des audiences publiques sur les prix de médicaments qui semblent excessifs et d'autres activités. Heureusement, grâce à la détermination, au dévouement et à l'expertise de ses membres et de ses employés, le Conseil réussit à relever tous ces défis, à protéger les intérêts des Canadiens et à favoriser l'intégrité de notre régime de soins de santé.

Brien G. Benoit, MD
Président du Conseil
Le Conseil d'examen du prix des médicaments brevetés est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets (Loi). Le Ministre de la Santé est responsable de l'application des dispositions pharmaceutiques de la Loi formulées aux articles 79 à 103.
Même s'il fait techniquement partie du portefeuille de la Santé, le CEPMB exerce son mandat en toute indépendance du Ministre de la Santé1. Il fonctionne également d'une façon indépendante des autres organismes, dont Santé Canada qui vérifie l'innocuité et l'efficacité des médicaments, et des régimes d'assurance-médicaments qui en approuvent l'inscription sur leurs formulaires respectifs des médicaments admissibles à un remboursement.
MANDAT
Le mandat du CEPMB est composé des deux volets suivants :
Réglementation
Exercer un contrôle sur les prix des médicaments brevetés pour qu'ils ne soient pas excessifs sur tout marché canadien, protégeant ainsi les intérêts des consommateurs et contribuant au régime de santé canadien.
Rapport
Faire rapport des tendances des prix des médicaments ainsi que des dépenses de R-D au Canada des titulaires de brevets pharmaceutiques, éclairant ainsi les processus de prise de décisions et d'élaboration de politiques.
COMPÉTENCES
Réglementation
Le CEPMB passe en revue les prix auxquels les brevetés vendent aux grossistes, aux hôpitaux, aux pharmacies et aux autres clients leurs médicaments brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre et s'assure que ces prix ne sont pas excessifs sur tout marché canadien. Le CEPMB exerce un contrôle sur le prix de chaque médicament breveté, plus précisément sur chaque concentration de chaque forme posologique de chaque médicament breveté offert sur le marché canadien. C'est habituellement à ce niveau que Santé Canada attribue le numéro d'identification de drogue (DIN).
Au Canada, c'est Santé Canada qui évalue les nouveaux médicaments pour en assurer la conformité à la Loi sur les aliments et drogues et à son règlement d'application. L'autorisation officielle de commercialiser ou de distribuer un médicament au Canada est accordée au moyen d'un Avis de conformité. Dans certains cas, un médicament peut être temporairement distribué même si l'Avis de conformité n'a pas été émis, nommément à titre de drogue de recherche ou de médicament distribué dans le cadre du Programme spécial d'accès.
Le CEPMB n'est pas habilité à exercer un contrôle sur les prix des médicaments non brevetés. Il n'a pas droit de regard sur les prix de vente au gros et au détail ni sur les honoraires des pharmaciens. La distribution et l'ordonnance des médicaments ne relèvent pas non plus de la compétence du CEPMB.
Le Règlement sur les médicaments brevetés, 1994 (Règlement) exige des brevetés qu'ils fassent deux fois par année rapport au CEPMB des prix et des ventes de chaque concentration de chaque forme posologique de chaque médicament breveté qu'ils offrent sur le marché canadien. Les brevetés sont également tenus en vertu du Règlement de présenter une fois par année un rapport sur leurs dépenses de R-D au Canada.
Les fabricants doivent informer le CEPMB de leur intention de vendre un nouveau médicament breveté sur le marché canadien, mais ils ne sont pas tenus de faire approuver au préalable le prix auquel ils vendront leur médicament. Les brevetés doivent se conformer aux dispositions de la Loi de manière à maintenir les prix des médicaments brevetés à des niveaux non excessifs. Lorsque, à l'issue d'une audience publique, le Conseil arrive à la conclusion que le prix d'un médicament vendu sur tout marché canadien est excessif, il peut obliger le breveté à réduire le prix de son médicament et prendre les mesures qui s'imposent pour que le breveté rembourse les recettes excessives qu'il a encaissées.
Rapports
Le CEPMB rend annuellement compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur une année civile analyse également les tendances des prix de tous les médicaments et fait rapport des dépenses de R-D au Canada déclarées par les titulaires de brevets pharmaceutiques.
Se référant à l'article 90 de la Loi, le ministre de la Santé a confié deux nouvelles responsabilités au CEPMB, à savoir le Système national d'information sur l'utilisation des médicaments prescrits, et le suivi des tendances des prix des médicaments non brevetés distribués sous ordonnance et les rapports sur les tendances observées.
Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP)
En 2001, en vertu d'une entente intervenue entre les ministres fédéral, provinciaux et territoriaux de la Santé, le ministre fédéral de la Santé a chargé le CEPMB d'effectuer des recherches au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP). L'objet de ce système est de fournir des analyses critiques des prix, de l'utilisation faite des médicaments et des tendances des prix des médicaments de manière à fournir au régime de soins de santé une vue plus globale de la façon dont les médicaments d'ordonnance sont utilisés au Canada et des sources d'augmentation des coûts.
Prix des médicaments non brevetés distribués sous ordonnance
En 2005, le ministre de la Santé s'est fait le porte-parole de ses homologues de la Santé et a demandé au CEPMB d'exercer un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Les ministres de la Santé souhaitaient ainsi constituer une source centralisée et fiable d'information sur les prix des médicaments non brevetés aux fins, entre autres, de la Stratégie nationale sur les produits pharmaceutiques.
1 Le portefeuille de la Santé contribue de multiples façons à améliorer l'état de santé de la population canadienne. Il est formé de Santé Canada et des cinq agences suivantes : l'Agence de santé publique du Canada, les Instituts de recherche en santé du Canada, le Conseil de contrôle des renseignements relatifs aux matières dangereuses, l'Agence canadienne de contrôle de la procréation assistée et le Conseil d'examen du prix des médicaments brevetés.
Le Conseil est formé d'au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi sur les brevets, le président du Conseil assume également les fonctions de chef de la direction du CEPMB et, à ce titre, assure la supervision et la direction des activités du Conseil. Une directrice exécutive supervise le travail du personnel. Outre la directrice exécutive, les cadres supérieurs du CEPMB sont la directrice de la conformité et de l'application, le directeur des politiques et de l'analyse économique, le directeur des services intégrés, la secrétaire du Conseil et la conseillère juridique principale.
Depuis le début de l'année 2006, le ministre de la Santé a effectué trois nominations au Conseil : le Dr Brien G. Benoit au poste de président, Mme Mary Catherine Lindberg au poste de vice-présidente et Mme Anne Warner La Forest à titre de membre. Le Conseil compte actuellement de tous ses membres.
MEMBRES DU CONSEIL

Président
Brien G. Benoit, BA, MD, MSc, FRCSC, FACS
M. Brien G. Benoit a été nommé au Conseil du CEPMB en mai 2005. En octobre 2005, il a été nommé viceprésident du Conseil et a exercé les pouvoirs et les fonctions du président du Conseil jusqu'en juin 2006 où il a été nommé à la présidence du Conseil.
Le Dr Benoit, un neurochirurgien, est membre du Corps des médecins titulaires actifs de l'Hôpital d'Ottawa. Il est également professeur de neurochirurgie à l'Université d'Ottawa. Le Dr Benoit a occupé divers postes administratifs au cours de sa carrière, dont médecin-chef à l'Hôpital Civic d'Ottawa de 1996 à 1998, directeur du programme de neurochirurgie à l'Université d'Ottawa de 1995 à 2003, titulaire de la chaire en neurochirurgie à l'Université d'Ottawa de 1997 à 2003, et chirurgien-chef adjoint au campus Civic de l'Hôpital d'Ottawa de 2002 à 2004. De 1993 à 2004, le Dr Benoit a également occupé le poste de président du comité de la salle d'opération au Campus Civic de l'Hôpital d'Ottawa.
Le Dr Benoit a publié de nombreux articles dans des revues spécialisées et a reçu diverses distinctions, dont le prix d'excellence en enseignement chirurgical du département de chirurgie de l'Université d'Ottawa qui lui a été décerné en 1991 et en 2000.
En plus d'être Fellow du Collège royal des chirurgiens du Canada (neurochirurgie), le Dr Benoit est membre de plusieurs associations professionnelles, dont l'Association médicale canadienne, l'Association médicale de l'Ontario, le Collège royal des médecins et chirurgiens du Canada et le American College of Surgeons pour ne nommer que celles-là.
Vice-présidente
Mary Catherine Lindberg, BSP
Mme Mary Catherine Lindberg vient d'être nommée membre et vice-présidente du Conseil d'examen du prix des médicaments brevetés en juin 2006.
Mme Lindberg occupe actuellement le poste de directrice exécutive du Council of Academic Hospitals, un regroupement de 25 hôpitaux universitaires affiliés à tous égards à une université et à sa faculté de médecine. Avant d'occuper ce poste, elle était sous-ministre adjointe au Ministère de la Santé et des soins de longue durée où elle supervisait l'enregistrement et la vérification de l'admissibilité des paiements du Régime d'assurancemaladie de l'Ontario aux médecins, le Programme des médicaments de l'Ontario et les laboratoires.
Mme Lindberg a été la maître d'oeuvre du Programme de médicaments Trillium. Elle a également dirigé pour le compte du gouvernement de l'Ontario les négociations avec les médecins, les pharmaciens, les chiropraticiens, les physiothérapeutes, les optométristes et les propriétaires de laboratoires privées.
Titulaire d'un diplôme en pharmacie de l'Université de la Saskatchewan, Mme Lindberg a droit de pratique en Saskatchewan et en Ontario.
Membres
Thomas (Tim) Armstrong, BA, LLB, QC, O. Ont.
M. Tim Armstrong siège à notre Conseil depuis octobre 2002.
M. Armstrong a pratiqué le droit de 1958 à 1974. Il a commencé sa carrière à la division du contentieux des affaires civiles au ministère fédéral de la Justice pour passer ensuite au secteur privé au sein du cabinet Jolliffe, Lewis & Osler et, plus tard, dans le cabinet Armstrong & MacLean spécialisé en droit administratif où il était associé principal. Pendant toutes ces années, il a été appelé à plaider devant différents tribunaux administratifs, différentes cours de l'Ontario, la Cour fédérale et la Cour suprême du Canada.
C'est en 1974, qu'il a choisi de relever de nouveaux défis dans la fonction publique de l'Ontario à titre de président du Conseil des relations de travail de l'Ontario (1974-1976), de sous-ministre du Travail (1976-1986), d'agent général de l'Ontario à Tokyo (1986-1990) et de sous-ministre de l'Industrie, du commerce et de la technologie (1991-1992). De 1992 à 1995, M. Armstrong a oeuvré comme avocat-conseil au sein du cabinet d'avocats McCarthy Tétrault de 1995 à 2002. Au cours des années 1990, il a siégé au conseil d'administration d'Algoma Steel, de deHavilland Aircraft et de Interlink Freight.
Depuis 1996, M. Armstrong est représentant principal du Canada à la Japan Bank for International Cooperation. Il a également été nommé médiateur-arbitre en relations de travail. Cette nomination a d'ailleurs recueilli le consensus des gouvernements fédéral et provincial. En 1998 et 1999, M. Armstrong a occupé le poste de facilitateur-médiateur à la Commission de restructuration des services de santé de l'Ontario. En 2002-2003, il a servi comme médiateur- arbitre pour le gouvernement de l'Ontario en vertu de la City of Toronto Labour Disputes Resolution Act, 2002.
M. Armstrong est actuellement président de l'Institut de radioprotection du Canada et vice-président du Conseil de presse de l'Ontario.
M. Armstrong a été reçu membre de l'Ordre de l'Ontario en 1995 en reconnaissance de sa contribution insigne à la fonction publique de l'Ontario.
Anthony Boardman, BA, PhD
M. Boardman siège à notre Conseil depuis janvier 1999. Son mandat a été reconduit en mars 2005.
M. Boardman est professeur Van Dusen d'administration des affaires au Sauder School of Business de l'Université de la Colombie-Britannique, plus particulièrement au sein de la Division de l'économie des entreprises. Il est diplômé de l'Université Kent de Canterbury (BA, 1970) ainsi que de l'Université Carnegie-Mellon (PhD, 1975). Avant de devenir professeur à l'Université de la Colombie-Britannique, M. Boardman a enseigné à la Wharton School de l'Université de la Pennsylvanie.
M. Boardman mène actuellement des recherches sur les partenariats publicprivé, sur les analyses coûts-avantages et sur la gestion stratégique. Il a travaillé comme expert-conseil pour différents organismes privés et publics, dont Vodafone, Stora Enzo, PricewaterhouseCoopers, le ministère du Trésor de la Nouvelle-Zélande ainsi que pour les différents gouvernements du Canada. Il a enseigné la gestion dans différents pays, dont la Finlande, la Chine, l'Australie, et a reçu au cours de sa carrière différents prix soulignant l'excellence de ses activités en enseignement dont le prix Alan Blizzard pour sa contribution au sein de l'équipe cadre du MBA. Entre 1995 et 2001, M. Boardman a siégé au Comité scientifique sur l'initiative de pharmacoéconomie de la Colombie-Britannique. Il siège actuellement au National Academies Committee on Medical Isotope Production Without Highly Enriched Uranium.
Au cours de sa carrière, M. Boardman a signé de nombreux articles savants. Il a récemment publié la troisième édition de son livre Cost-Benefit Analysis: Concepts and Practice.
Anne Warner La Forest, LLB (UNB), LLM (Cantab)
Anne Warner La Forest siège au Conseil depuis mars 2007.
Mme La Forest est professeur de droit à l'Université du Nouveau-Brunswick. De plus, elle siège depuis 2004 à la Commission des valeurs mobilières du Nouveau-Brunswick où elle préside le Comité sur les ressources humaines.
En 1991, après avoir pratiqué le droit pendant plusieurs années dans le cabinet Fraser & Beatty de Toronto, Mme La Forest a joint la faculté de droit de l'Université Dalhousie. De 1996 à 2004, elle a occupé le poste de doyenne de la faculté de droit à l'Université du Nouveau-Brunswick.
Membre des barreaux du Nouveau- Brunswick, de la Nouvelle-Écosse et de l'Ontario, Mme La Forest a une très vaste expérience en arbitrage et a agi à titre de consultante dans des affaires relative au droit de la personne, à l'emploi, à la propriété et à l'extradition. Elle a été membre du Tribunal des droits de la personne de la NouvelleÉcosse ainsi que membre du Conseil de recherche en sciences sociales et en sciences humaines et présidente du Comité d'attribution des bourses de recherche. Elle a oeuvré comme arbitre dans la province de la Nouvelle-Écosse ainsi que comme Commissaire à la Commission des droits de la personne de la NouvelleÉcosse. Elle est Fellow du Cambridge Commonwealth Society et membre du Conseil des gouverneurs de l'Institut national de la magistrature.
Mme La Forest détient également un baccalauréat spécialisé en droit international de l'Université de Cambridge, au Royaume-Uni.
Au cours de sa carrière, Mme Warner La Forest a publié des articles, des livres ainsi que des arrêts remarqués. Elle a aussi participé à nombreuses conférences de droit nationales et internationales, parfois à titre de présidente et d'autres fois à titre de panéliste.
BUDJET
Pour l'exercice 2006-2007, le Conseil a disposé d'un budget de 11 690,025 $ et d'un effectif approuvé de 62 employés. Ce budget comprend les ressources requises pour le Système national d'information sur les médicaments prescrits (SNIUMP) et pour le suivi des prix des médicaments non brevetés distribués sous ordonnance et le rapport des tendances observées au titre de la Stratégie nationale sur les produits pharmaceutiques.
En juin 2006, le CEPMB a obtenu des crédits additionnels pour les exercices 2006-2007 et 2007-2008, portant son budget de 6,5 millions à 11,6 millions de dollars. Ces crédits ont été accordés au CEPMB aux fins de ses audiences publiques dans le cadre desquelles il détermine, en vertu des articles 83 et 85 de la Loi, si les médicaments sous examen sont ou été vendus sur un marché canadien à des prix que le Conseil juge excessifs. Une partie de ces crédits devait également être affectée à l'examen des Lignes directrices sur les prix excessifs, un outil qui aide les brevetés à fixer les prix de leurs médicaments brevetés à des niveaux considérés non excessifs.

- Conformité et Lignes directrices sur les prix excessifs
- Engagements de conformité volontaire
- Audiences
- Décision de la Cour fédérale dans l'affaire de LEO Pharma Inc. et le médicament breveté Dovobet
En vertu de l'article 82 de la Loi sur les brevets (Loi), les brevetés sont tenus d'informer le CEPMB de leur intention de lancer un médicament sur le marché canadien et de la date à laquelle ils comptent le faire.
En vertu du Règlement sur les médicaments brevetés, 1994 (Règlement), les brevetés doivent :
- remplir le formulaire Renseignements identifiant le médicament (Formulaire 1) dans les 30 jours suivant la réception de l'Avis de conformité ou la date de la première vente du médicament, soit la première de ces deux éventualités
- faire rapport des prix de lancement de leurs médicaments brevetés et de la valeur de leurs ventes (Formulaire 2) dans les 60 jours suivant la date de la première vente
- tant qu'un brevet lié au médicament est en vigueur, soumettre des données détaillées sur les prix et sur les ventes de chaque médicament breveté et ce, pour chaque semestre de l'exercice (Formulaire 2), soit le 30 janvier et le 30 juillet et ce, pour la durée du brevet.
Le CEPMB passe en revue sur une base régulière les données fournies sur les prix de tous les médicaments brevetés offerts sur le marché canadien afin de s'assurer que les prix pratiqués sont conformes à ses Lignes directrices. Ces Lignes directrices sont publiées dans le Compendium des Lignes directrices, politiques et procédures.2
Lignes directrices sur les prix excessifs
Les Lignes directrices sur les prix excessifs tiennent compte des facteurs de détermination des prix mentionnés à l'article 85 de la Loi. Elles ont été formulées en consultation avec différents intervenants, dont les ministres de la Santé des provinces et des territoires, des associations de consommateurs et des représentants du secteur pharmaceutique.
D'une façon générale, les Lignes directrices prévoient ce qui suit :
- les prix de la plupart des nouveaux médicaments brevetés sont limités de manière à ce que le coût de revient de la thérapie utilisant ce médicament ne soit pas supérieur au coût de la thérapie jusque là utilisée au Canada pour traiter la même maladie ou condition
- les prix des médicaments brevetés constituant une découverte ou apportant une amélioration importante ne peuvent en règle générale être supérieurs à la médiane des prix pratiqués dans les sept pays industrialisés nommés dans le Règlement, à savoir la France, l'Allemagne, l'Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis
- les taux d'augmentation des prix des médicaments brevetés existants ne peuvent être supérieurs aux taux d'augmentation de l'Indice des prix à la consommation
- le prix d'un médicament breveté au Canada ne peut en aucun temps être supérieur au prix le plus élevé pratiqué pour le même médicament dans les pays de comparaison nommés dans le Règlement.
Le personnel du Conseil passe en revue les prix de tous les médicaments brevetés vendus au Canada et effectue une enquête lorsque le prix d'un médicament breveté lui apparaît supérieur au prix que permettent les Lignes directrices du Conseil et que les circonstances justifient la tenue d'une enquête pour faire la lumière sur les faits. Vous trouverez à l'annexe 1, page 54, de plus amples explications sur les critères qui justifient la tenue d'une enquête. Une enquête peut mener aux résultats suivants :
- sa fermeture lorsque le prix se révèle conforme aux Lignes directrices un engagement de conformité volontaire (engagement) en vertu duquel le fabricant s'engage à réduire le prix de son médicament et à appliquer d'autres mesures ordonnées par le Conseil pour se conformer aux Lignes directrices, y compris le remboursement des recettes excessives en fonction d'un prix excessif, ou
- une audience publique pour déterminer si le prix du médicament est excessif ainsi que l'ordonnance qu'il y a lieu d'imposer.
Dans un effort pour améliorer la transparence de son processus d'examen du prix, le CEPMB publie chaque mois sur son site Web la liste des nouveaux médicaments brevetés déclarés au CEPMB. Cette liste contient de l'information sur le statut de l'examen (par ex. sous examen, conforme aux Lignes directrices, engagement de conformité volontaire, avis d'audience). Comme il en a été fait mention dans la livraison d'avril 2005 de La Nouvelle, les médicaments qui font l'objet d'une enquête ne sont plus classés sous la rubrique « sous examen » depuis 2005. Ainsi, lorsque le prix semble supérieur aux limites autorisées par les Lignes directrices et lorsque les conditions justifiant une enquête sont en place, le médicament en cause est inscrit sous une nouvelle rubrique portant l'intitulé « sous enquête ».
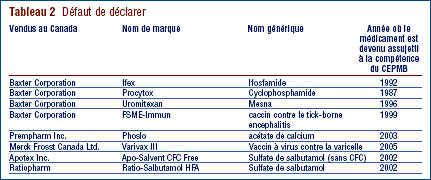
Défaut de déclarer
Dans l'exercice du volet réglementation de son mandat (dont vous trouverez une description à la page 2), le CEPMB s'attend à ce que les brevetés soumettent leurs rapports dans les délais impartis pour tous les médicaments brevetés et vendus au Canada.
Tout retard à ce niveau cause un problème pour le CEPMB en ce sens qu'il retarde l'examen du prix. La plupart des brevetés présentent leurs rapports, mais certains négligent de le faire dans les délais spécifiés dans le Règlement. En 2006, 12 nouveaux médicaments (12 DIN) ont fait l'objet d'un premier rapport au CEPMB. Ces médicaments étaient brevetés et vendus au Canada avant 2006.
Les médicaments Ifex, Procytox, Uromitexan, PhosLo, FSME-Immun, Varivax III, Apo-Salvent CFC Free et Ratio-Salbutamol HFA étaient brevetés et vendus au Canada avant même d'être assujettis à la compétence du CEPMB en matière d'examen du prix. Ces médicaments sont vendus au Canada par Baxter Corporation, Prempharm Inc., Merck Frosst Canada Ltd., Apotex Inc. et Ratiopharm.
Ordonnances du Conseil
Le Conseil n'a pas eu à rendre d'ordonnances au cours des deux périodes de rapport, soit entre janvier et juin 2006 et juillet et décembre 2006.
Les brevetés sont légalement tenus de soumettre au Conseil tous les renseignements requis dans les délais prescrits.
L'information sur les exigences en matière de rapports est présentée dans la Loi, dans son règlement d'application, dans la Politique de conformité et d'application des Lignes directrices et dans le Guide du breveté. Tous ces documents sont affichés sur notre site Web sous la rubrique « Loi, Règlement et Lignes directrices ».
Groupe consultatif sur les médicaments pour usage humain
Le Conseil a créé le Groupe consultatif sur les médicaments pour usage humain (GCMUH) pour lui recommander aux niveaux du classement des nouveaux médicaments dans l'une ou l'autre des trois catégories de médicaments et de la sélection des médicaments de comparaison.
Le GCMUH effectue l'évaluation scientifique des médicaments brevetés et formule des conseils scientifiques crédibles, indépendants et éclairés concernant l'élaboration et l'application des Lignes directrices du CEPMB. L'approche du Groupe se fonde sur l'expérience clinique et ses recommandations reflètent les connaissances médicales et scientifiques ainsi que la pratique clinique.
Le GCMUH est constitué des trois membres suivants :
• Dr Jean Gray MD, FRCPC, Professeure émérite en médecine et en pharmacologie à l'Université Dalhousie;
• Dr Mitchell Levine MD, MSc, FRCPC, FISPE, Professeur, Département de l'épidémiologie clinique et de la biostatistique, St. Joseph's Healthcare Hamilton Centre for Evaluation of Medicines; et
• James McCormack, BSc(Pharm), Pharm D, Professeur en sciences pharmaceutiques, Université de la Colombie-Britannique
Au cours de l'exercice 2006, le GCMUH a passé en revue 34 médicaments.
Nouveaux médicaments brevetés lancés sur le marché canadien en 2006
Au total, 99 nouveaux DIN ou nouveaux médicaments brevetés pour usage humain ont été lancés sur le marché canadien en 2006. Certains de ces médicaments représentent une ou plusieurs concentrations d'une nouvelle substance active (NSA) et d'autres, de nouvelles présentations de médicaments existants.
Aux fins de notre examen du prix, tout médicament breveté lancé sur le marché canadien ou commercialisé avant l'attribution de son premier brevet entre le 1er décembre 2005 et le 30 novembre 2006 est réputé avoir été breveté en 2006.3
Le graphique 1 présente l'information sur les nouveaux médicaments brevetés pour usage humain lancés sur le marché canadien entre 1988 et 2006.
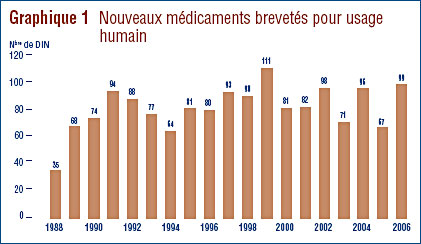
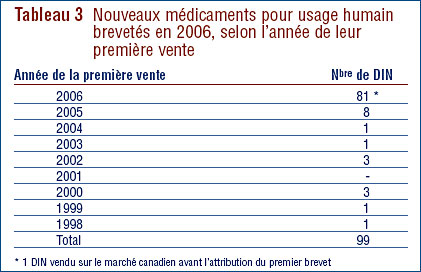
Dix-neuf (19 %) de ces 99 nouveaux DIN brevetés ont été commercialisés au Canada avant d'avoir obtenu un premier brevet qui les aurait automatiquement assujettis à la compétence du CEPMB. Ces DIN sont identifiés par les lettres PBA (pour « premier brevet accordé ») dans l'annexe 2, à la page 55. Le tableau 3 présente le nombre de médicaments brevetés classés selon la première année de leur commercialisation. Pour ces médicaments, le délai écoulé entre la date de la première vente et celle de l'obtention d'un premier brevet varie entre plusieurs mois et huit années.
Nouvelles substances actives lancées sur le marché canadien en 2006
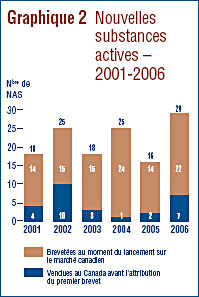 Une nouvelle substance active (NSA) peut être associée à plusieurs DIN lorsqu'elle est distribuée sous plusieurs concentrations ou sous plusieurs formes posologiques. Les 29 NSA lancées sur le marché canadien en 2006 ont été commercialisées sous 43 DIN. Comme on peut le voir dans le graphique 2 et dans le tableau 4, 7 des 29 NSA brevetées devenues assujetties à la compétence du CEPMB en 2006 étaient vendues sur le marché canadien avant 2006.
Une nouvelle substance active (NSA) peut être associée à plusieurs DIN lorsqu'elle est distribuée sous plusieurs concentrations ou sous plusieurs formes posologiques. Les 29 NSA lancées sur le marché canadien en 2006 ont été commercialisées sous 43 DIN. Comme on peut le voir dans le graphique 2 et dans le tableau 4, 7 des 29 NSA brevetées devenues assujetties à la compétence du CEPMB en 2006 étaient vendues sur le marché canadien avant 2006.
La liste du CEPMB des NSA brevetées n'est pas nécessairement identique à celle des nouvelles substances actives approuvées par la Direction des produits thérapeutiques de Santé Canada pour l'une ou pour l'autre des raisons suivantes :
- la NSA n'est pas brevetée et, par conséquent, n'est pas assujettie à la compétence du CEPMB
- la NSA ne figure pas sur la liste de la Direction des produits thérapeutiques parce qu'elle est vendue au titre du Programme spécial d'accès avant qu'elle ait obtenu son Avis de conformité
- la NSA peut avoir été approuvée, mais elle n'a pas encore fait l'objet d'une vente.
Pour 2006, Santé Canada a fait rapport de 16 nouvelles substances actives, mais ces substances n'ont pas toutes été lancées sur le marché canadien cette même année.4
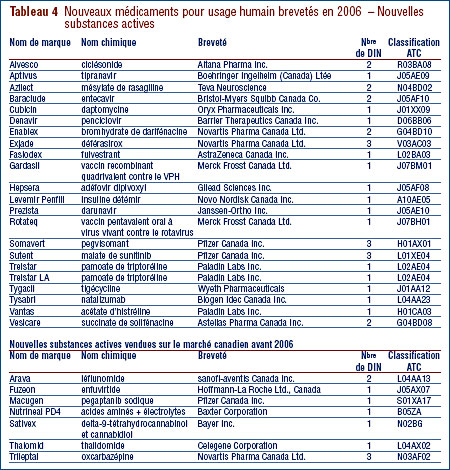
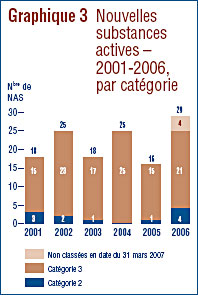 Le graphique 3 ventile pour la période 2001 à 2006 inclusivement les NSA brevetées pour usage humain selon la catégorie dans laquelle elles ont été classées aux fins de l'examen du prix.5
Le graphique 3 ventile pour la période 2001 à 2006 inclusivement les NSA brevetées pour usage humain selon la catégorie dans laquelle elles ont été classées aux fins de l'examen du prix.5
Dès que l'examen du prix est terminé et que le prix du médicament a été jugé conforme aux Lignes directrices, le CEPMB affiche le rapport sommaire de l'examen du prix de la nouvelle substance active est affiché sur son site Web.
Examen du prix des nouveaux médicaments brevetés pour usage humain
La liste des 99 nouveaux médicaments brevetés, incluant leur statut de l'examen de leur prix au moment de la rédaction du présent rapport, est présentée à l'annexe 2, à la page 55.
- en date du 31 mars 2007, 79 de ces médicaments avaient fait l'objet d'un examen du prix. De ce nombre :
- les prix de 68 de ces médicaments ont été jugés conformes aux Lignes directrices
- les prix de 11 de ces médicaments semblaient supérieurs aux prix autorisés par les Lignes directrices, justifiant ainsi la tenue d'une enquête. Vous trouverez à l'annexe 1, page 54, de plus amples explications sur les critères qui justifient la tenue d'une enquête
- les prix des 20 autres médicaments étaient encore sous examen.
Examen du prix des médicaments brevetés pour usage humain existants
Aux fins du présent rapport, les médicaments existants désignent tous les médicaments brevetés vendus sur le marché canadien avant le 1er décembre 2005. Les Lignes directrices du CEPMB limitent les augmentations des prix des médicaments existants aux variations de l'Indice des prix à la consommation (IPC). Par ailleurs, le prix d'un médicament breveté ne peut être supérieur à son prix de vente le plus élevé des sept pays de comparaison nommés dans le Règlement (ces pays sont la France, l'Allemagne, l'Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis).
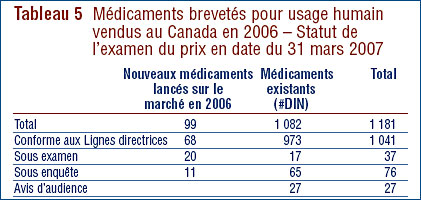
Au moment de la rédaction du présent rapport, 1 082 DIN existants étaient offerts sur le marché canadien :
- les prix de 973 DIN existants (89,9 %) ont été jugés conformes aux Lignes directrices
- les prix de 59 DIN faisaient l'objet d'une enquête (le paragraphe précédent fait état des tests appliqués aux prix des médicaments existants)
- 41 enquêtes ont été engagées en 2006
- 16 enquêtes ont été engagées en 2005
- 2 enquêtes ont été engagées en 2003
- 2 enquêtes sur le prix de lancement d'un médicament ont été engagées en 2004
- 4 enquêtes sur le prix de lancement du médicament ont été engagées en 2005
- 27 DIN - Nicoderm (3 DIN), Dovobet, Adderall XR (6 DIN), Risperdal Consta (3 DIN), Airomir, Copaxone, Concerta (4 DIN), Strattera (5 DIN), Quadracel, Pentacel et Penlac faisaient l'objet d'une audience en vertu de l'article 83 de la Loi (voir la rubrique « Audiences » à la page 16)
- 17 DIN étaient encore sous examen.
Le tableau 5 présente un aperçu du statut d'examen, de conformité et d'enquête des médicaments brevetés pour usage humain, nouveaux et existants, vendus au Canada en 2006.
PCEM / CEPMB
Le Programme commun d'évaluation des médicaments (PCEM), un processus uniformisé d'évaluation des nouveaux médicaments, fournit aux régimes d'assurance-médicaments fédéral, provinciaux et territoriaux (F-P-T) participants des conseils quant à l'opportunité d'ajouter certains médicaments à leurs formulaires respectifs. À l'exception du Québec, toutes les provinces et tous les territoires participent à ce programme.
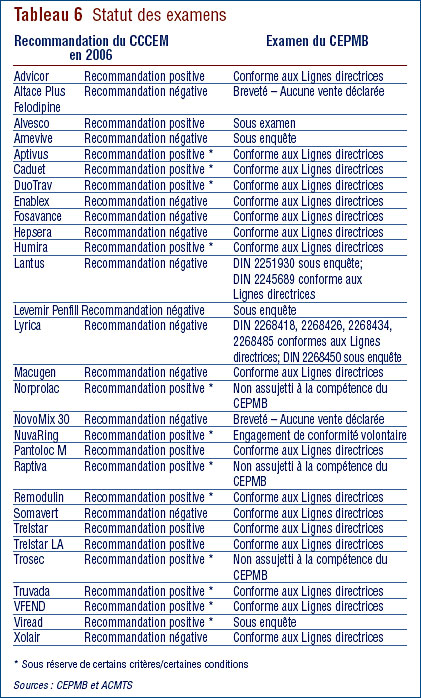
Le PCEM fait l'examen des nouveaux médicaments et communique les recommandations du Comité consultatif canadien d'expertise sur les médicaments (CCCEM) concernant les médicaments qui devraient être admissibles à un remboursement par les régimes publics d'assurancemédicaments. Au moment de prendre des décisions concernant l'inscription de médicaments sur les formulaires de médicaments admissibles à un remboursement, les différents régimes publics d'assurance-médicaments évaluent la recommandation du CCCEM à la lumière de leur mandat, de leurs priorités et des ressources financières disponibles. Vous trouverez de plus amples renseignements sur le PCEM et sur le CCCEM sur le site Web de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) (http://www.cadth.ca).
Le tableau 6 présente de l'information sur le statut des examens du PCEM et sur l'examen du prix du CEPMB. Le PCEM fait l'examen du prix du médicament après que le médicament a obtenu son avis de conformité de Santé Canada. Le CEPMB fait pour sa part l'examen du prix de tous les médicaments brevetés offerts sur le marché canadien. Un médicament peut être vendu avant d'être breveté et, dans un tel cas, le médicament n'est alors pas assujetti à la compétence du CEPMB.
Suivi : Nouveaux médicaments brevetés mentionnés dans des rapports annuels antérieurs
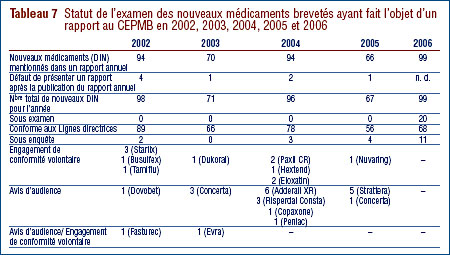
Le tableau 7 présente une mise à jour du statut des nouveaux médicaments brevetés, au niveau du DIN, dont il a été fait état dans des rapports annuels antérieurs.6
Mise à jour : Médicaments existants dont il a été fait mention dans le rapport annuel 2005
Dans son rapport annuel de l'an dernier, le Conseil mentionnait que les prix de 22 des 969 médicaments brevetés pour usage humain vendus au Canada en 2005 étaient sous examen au moment d'aller sous presse. Il est ressorti de ces examens que les prix de six de ces DIN étaient conformes aux Lignes directrices, que les prix de 10 autres DIN semblaient supérieurs aux prix autorisés et justifiaient la tenue d'une enquête. Par ailleurs, les prix de six de ces DIN sont encore sous examen. Ces DIN sont comptabilisés dans le tableau 5, à la page 13. Le CEPMB mentionnait également dans son rapport annuel de 2005 que 37 DIN étaient sous enquête6. Onze de ces enquêtes étaient closes au moment de la rédaction du présent rapport et dans huit cas, les prix ont été finalement jugés conformes aux Lignes directrices. Trois DIN, à savoir les médicaments brevetés Eloxatin (2 DIN) et Hextend (1 DIN) ont été réglés au moyen d'un Engagement de conformité volontaire (voir la rubrique « Engagements de conformité volontaire » à la page 15). Six DIN (Penlac, Concerta (3 DIN), Quadracel et Pentacel) ont fait l'objet d'un Avis d'audience. Vingt autres DIN sont encore sous enquête. Tous ces DIN sont comptabilisés dans le tableau 5, à la page 13. De plus, il était mentionné dans le rapport annuel de 2005 que 15 DIN étaient visés par un Avis d'audience et, au moment d'aller sous presse, ces audiences avaient encore cours.
Médicaments brevetés pour usage vétérinaire
Le processus d'examen du prix des médicaments pour usage vétérinaire ne s'engage encore que sur réception d'une plainte. Le personnel du Conseil ne fait que l'examen du prix de lancement des nouveaux médicaments brevetés pour usage vétérinaire. Les médicaments existants ne font l'objet d'un examen du prix que suite à la réception d'une plainte bien étoffée. Le Conseil n'a reçu en 2006 aucune plainte concernant le prix d'un médicament breveté pour usage vétérinaire.
Nous mentionnions de plus dans notre rapport annuel pour l'exercice 2005 que les prix de tous les médicaments brevetés pour usage vétérinaire avaient fait l'objet d'un examen et avaient été jugés conformes aux Lignes directrices. Un seul médicament, le Paylean 20, distribué par Elanco Animal Health Canada, une division de Eli Lilly and Company, était vendu avant de faire l'objet d'un rapport au CEPMB en 2006. Le prix de ce médicament est actuellement sous examen. En 2006, 6 nouveaux DIN pour usage vétérinaire ont fait l'objet d'un rapport au CEPMB et ces six DIN sont actuellement sous examen. Vous trouverez les rapports sommaires de l'examen du prix des médicaments pour usage vétérinaire sur notre site Web sous la rubrique « Mandat de réglementation; Médicaments brevetés; Rapports sur les nouveaux médicaments brevetés pour usage vétérinaire ».
2 Vous trouverez le Compendium des Lignes directrices, politiques et procédures sur le site Web du CEPMB sous « Loi, Règlement et Lignes directrices ». Vous pouvez également commander un exemplaire du Compendium en communiquant avec le CEPMB à notre numéro d'interurbains sans frais : 1-877-861-2350.
3 En raison des dates de présentation des rapports établies par le Règlement sur les médicaments brevetés, 1994 et de la méthode de calcul des prix de référence, les médicaments lancés sur le marché canadien ou brevetés en décembre d'une année sont comptabilisés dans les nouveaux médicaments de l'année suivante.
4 Rapport annuel sur la performance, Section 4, janvier-décembre 2006, Direction des produits thérapeutiques, Santé Canada.
5 Les Lignes directrices du CEPMB établissent trois catégories de nouveaux médicaments brevetés aux fins de l'examen du prix de lancement :
- Catégorie 1 – nouveau DIN d'une forme pharmaceutique existante d'un médicament existant ou un nouveau DIN d'une autre forme pharmaceutique du médicament qui est comparable à la forme pharmaceutique existante, habituellement une nouvelle concentration d'un médicament existant (extension d'une gamme de produits)
- Catégorie 2 – premier médicament mis au point pour traiter une condition ou qui constitue une amélioration importante par rapport aux médicaments existants. Les médicaments de cette catégorie sont souvent qualifiés de « découverte » ou de « amélioration importante ».
- Catégorie 3 – un nouveau DIN, nouveau médicament ou nouvelle forme pharmaceutique d'un médicament existant qui procure tout au plus des bienfaits modestes ou minimes par rapport aux médicaments existants.
Vous trouverez les définitions de ces catégories à la section 3 du chapitre 3 du Compendium des Lignes directrices, politiques et procédures.
6 Dans le rapport annuel de 2005, 37 DIN étaient alors sous enquête. L'information pertinente quant à ces 37 DIN aurait due se lire comme suit : 27 enquêtes ouvertes en 2005 (3 correspondant à des médicaments existants); 1 enquête en 2004; 2 enquêtes en 2003; et 7 enquêtes ouvertes correspondant à des médicaments nouveaux (3 en 2003 et 4 en 2004 relatives aux prix d'introduction.)
Engagement écrit pris par le breveté de baisser le prix de son médicament pour le rendre conforme aux Lignes directrices du CEPMB sur les prix excessifs. Vous trouverez une définition plus détaillée de cette expression et une explication dans la section « Glossaire » du présent rapport (page 51).
En vertu de la politique de conformité et d'application du CEPMB, les brevetés ont la possibilité de négocier un engagement de conformité volontaire lorsque, après enquête, le personnel du Conseil arrive à la conclusion que le prix de leur médicament breveté semble supérieur au prix maximal autorisé en vertu des Lignes directrices sur les prix excessifs.
Publication des engagements de conformité volontaire
Le Conseil publie les engagements de conformité volontaire suite à leur approbation par le président du Conseil. Ce document devient public dès que le breveté est informé de l'acception de son engagement de conformité volontaire. Comme le prévoit notre politique de conformité et d'application, les engagements sont affichés sur notre site Web. Ils font également l'objet d'un article dans La Nouvelle et, bien sûr, dans notre Rapport annuel.
L'acceptation d'un engagement par le président du Conseil constitue une alternative aux procédures quasi-judiciaires qui s'engagent suite à la publication d'un Avis d'audience.
La politique du Conseil sur la conformité et l'application autorise la présentation d'un engagement de conformité volontaire même après la publication d'un Avis d'audience, mais l'engagement soumis à ce point requiert l'aval du Conseil.
En 2006, trois engagements de conformité volontaire ont été acceptés pour les médicaments brevetés suivants :
NuvaRing, Organon Canada Ltd.
Eloxatin, sanofi-aventis Canada Inc. Hextend, Hospira Healthcare Corporation
En 2007, le Conseil a approuvé un engagement de conformité volontaire dans l'affaire de 3M Canada Company et de son médicament Airomir.
Nuvaring MD est un nouveau contraceptif. Il s'agit d'un anneau vaginal souple et transparent à libération lente.
Le 20 juin 2006, le vice-président du Conseil a accepté l'engagement de conformité volontaire soumis par Organon Canada Ltd. (Organon) pour son médicament NuvaRingMD.
Organon a réduit le prix de transaction moyen de son médicament NuvaRingMD au même niveau ou sous le niveau du prix maximum non excessif établi à 13,6791 $. De plus, le breveté a remboursé au gouvernement du Canada une partie des recettes excessives encaissées entre le 17 janvier et le 30 juin 2005 de la vente de son médicament à un prix excessif, que le personnel du Conseil a évaluées à 115 584,93 $. Par ailleurs, Organon a remboursé le reliquat des recettes excessives encaissées entre le 1er juillet 2005 et le 30 juin 2006 en réduisant le prix de son médicament RemeronMD 15mg, 30mg et 45mg. Le prix du NuvaRingMD demeurera assujetti à la compétence du CEPMB jusqu'à l'échéance du brevet, soit jusqu'en 2018.
L'Eloxatin est indiqué pour traiter les patients souffrant d'un cancer métastatique du colon ou du rectum qui a resurgi ou qui a progressé durant la thérapie de première ligne en association avec le bolus 5-FU/LV et l'irinotecan ou dans les six mois suivant celle-ci.
Le 14 juillet 2006, le président du Conseil a approuvé l'engagement de conformité volontaire pour le médicament breveté Eloxatin.
En vertu de cet engagement, sanofiaventis a reconnu que, au moment du lancement du médicament sur le marché canadien, les prix maximum non excessifs étaient de 430,9208 $ pour la fiole de 50 mg et de 922,6750 $ pour la fiole de 100 mg. Il a également reconnu que, en 2006, ces prix étaient de 490,5901 $ pour la fiole de 50 mg et de 1 030,0175 $ pour la fiole de 100 mg. En lieu d'une réduction du prix de la fiole et pour éviter une distorsion de la relation entre le prix de la fiole de 50 mg et le prix de la fiole de 100 mg, sanofi-aventis s'est engagé à maintenir à 1 000,00 $ le prix de la fiole de 100 mg tant et aussi longtemps que le prix MNE de la fiole de 50 mg n'aura pas atteint 500 $.
Pour rembourser les recettes excessives tirées de la vente du médicament breveté Eloxatin à des prix excessifs, sanofi-aventis a fait des paiements totalisant 1 767 078,84 $ à des hôpitaux, des centres anticancéreux et des organismes de lutte contre le cancer qui ont acheté son médicament à des prix jugés excessifs. Le montant des remises a été établi au prorata des achats du médicament Eloxatin effectués au quatre coins du pays jusqu'en date du 31 mars 2006 inclusivement.
Le prix du médicament breveté Eloxatin est assujetti à la compétence du CEPMB jusqu'en juin 2019 inclusivement.
Hextend est indiqué pour le traitement de l'hypovolémie lorsque le volume plasmatique doit être augmenté.
Le président du Conseil a approuvé le 14 juillet 2006 l'engagement de conformité volontaire pour le médicament Hextend.
Hospira Healthcare Corporation (Hospira) a reconnu que le prix MNE d'un millilitre de son médicament est de 0,0858 $ pour 2004 et 2005. Hospira veillera à ce que le prix de transaction moyen de son médicament ne soit jamais plus supérieur au prix MNE – si le prix du médicament Hextend aux États-Unis exprimé dans la devise du pays ne change pas ou augmente, le prix MNE sera le moindre prix entre le prix rajusté pour tenir compte de l'IPC et 0,0858 $ le mL, et si le prix du médicament aux États-Unis exprimé dans la devise du pays diminue, une comparaison des prix internationaux utilisant le nouveau prix pratiqué aux États-Unis sera effectuée pour établir, comme le prévoient les Lignes directrices, un nouveau prix MNE. Hospira a veillé également à ce que le prix de transaction moyen pour 2006 se situe dans les limites du prix MNE établi pour 2006. Enfin, Hospira a remboursé les recettes excessives qu'il a tirées entre le 15 mars et le 31 décembre 2004 de la vente de son médicament à un prix excessif en versant au gouvernement du Canada la somme de 8 823,60 $.
Le prix du médicament Hextend sera assujetti à l'examen du CEPMB jusqu'en 2014, alors que le brevet lié à ce médicament arrivera à échéance.
L'Airomir est indiqué pour le traitement de l'asthme, de la bronchite chronique et d'autres troubles respiratoires.
Le Conseil a approuvé l'engagement de conformité volontaire négocié par 3M Canada Company (3M Canada) et le personnel du Conseil et prévoyant le paiement de toutes les recettes excessives tirées de la vente du médicament à un prix excessif entre le 1er janvier 2004 et le 29 décembre 2006. Le personnel du Conseil a estimé à 485 498,58 $ le montant de ces recettes. Par ordre du Conseil, les procédures qui ont été entamées suite à l'émission d'un avis d'audience sont terminées.
Le 20 février 2006, le Conseil a émis un Avis d'audience sur la base des allégations formulées par le personnel du Conseil selon lequel 3M Canada a vendu son médicament Airomir à des prix supérieurs aux prix autorisés en vertu des Lignes directrices. Le Conseil a tenu une conférence préparatoire à l'audience le 19 mai 2006 en prévision de l'audience qui devait commercer le 19 octobre suivant. À la demande de 3M Canada, l'audience a été reportée. Le Conseil a plus tard été informé que 3M Canada avait vendu ses droits de commercialisation du médicament Airomir à Graceway Canada Company (Graceway) le 29 décembre 2006. Le 9 mai 2007, le Conseil a reçu une demande d'approbation d'un engagement de conformité volontaire qui réglait les différents points de litige mentionnés dans l'Avis d'audience.
L'article 103 de la Loi sur les brevets prévoit que le ministre de la Santé peut conclure avec les provinces une entente concernant la distribution des sommes perçues au titre des Engagements de conformité volontaire.
Aux fins de l'application des Lignes directrices sur les prix excessifs, Graceway est le titulaire du brevet lié au médicament Airomir en date du 29 décembre 2006. Ainsi, en vertu du Règlement sur les médicaments brevetés, 1994, Graceway doit présenter au CEPMB un rapport semestriel sur les prix et sur les ventes de son médicament ainsi qu'un rapport annuel sur ses dépenses de R-D.
Le personnel du Conseil fait l'examen des prix de tous les médicaments brevetés vendus au Canada afin de s'assurer qu'ils ne sont pas excessifs. Lorsque le prix d'un médicament breveté semble supérieur au prix autorisé en vertu des Lignes directrices, le Conseil peut tenir une audience publique et, s'il apparaît que le prix du médicament est effectivement excessif, émettre une ordonnance obligeant le breveté à réduire le prix de son médicament et à rembourser les recettes excessives tirées de la vente du médicament à un prix excessif.
Depuis janvier 2006, le Conseil a émis huit Avis d'audience, portant à 10 le nombre total d'audiences menées de front. Cette augmentation récente du nombre d'Avis d'audience ne représente pas nécessairement une tendance à long terme, mais sûrement une rupture avec l'expérience antérieure du Conseil. À titre de comparaison, ce nombre d'audiences correspond au nombre total d'Avis d'audience que le Conseil a émis entre l'année de sa création, en 1987, et 2005. En ce qui concerne les huit Avis d'audience émis avant 2006, un a été mené à terme, cinq ont été réglés au moyen d'engagements de conformité volontaire, alors que les deux autres, le Dovobet et le Nicoderm, sont encore en instance.
Cette augmentation du nombre d'audiences peut s'expliquer par des facteurs tels que l'apparition sur le marché de nouveaux médicaments qui ont délogé de nouvelles substances chimiques, en partie en raison des avis d'augmentation des prix fournis par des tierces parties après une longue période de stabilité des prix.
L'objet de ces audiences est de déterminer si, en vertu des articles 83 et 85 de la Loi, les brevetés vendent ou ont vendu leurs médicaments sur un marché au Canada à des prix que le Conseil juge excessifs et, le cas échéant, déterminer l'ordonnance qu'il y a lieu de rendre.
| Dans l'affaire de |
Indication |
Statut |
Adderall XR
Shire BioChem Inc. |
Le Adderall XR est indiqué pour le traitement du trouble d'hyperactivité avec déficit de l'attention (THADA). |
Plaidoyer final : 18 juin
Le 18 décembre 2006, le Conseil a rendu sa décision sur la question du brevet en instance (CEPMB-06-D1-ADDERALL XR). Shire BioChem a déposé une requête dans laquelle il demandait au Conseil de modifier son Avis d'audience de manière à limiter son enquête à la période subséquente à l'émission du brevet 2,348,090, lequel a été attribué le 13 avril 2004. Le Conseil a rejeté la requête de Shire. Shire a répliqué en demandant à la Cour fédérale du Canada d'effectuer une révision judiciaire de la décision rendue par le Conseil. La cause n'a pas encore été entendue.
|
Airomir
3M Canada Company |
L'Airomir est indiqué pour prévenir et pour soulager les symptômes de bronchospasme causés par l'asthme, la bronchite chronique et autres troubles broncho-pulmonaires. |
Engagement de conformité volontaire approuvé le 14 mai 2007
(vous trouverez de plus amples détails à la page 16 du présent rapport)
|
Concerta
Janssen-Ortho Inc. |
Le Concerta est indiqué pour le traitement des troubles d'hyperactivité avec déficit de l'attention (THADA). |
Audience : 11-12 juin 2007
Plaidoyer final : 29 août 2007 |
Copaxone
Teva Neuroscience G.P.- S.E.N.C. |
Le Copaxone, présenté sous la forme d'une seringue contenant 20 mg/1,0 mL du médicament, est une nouvelle forme posologique d'un composé existant (acétate de glatiramère) indiqué pour réduire la fréquence des rechutes chez les malades en traitement ambulatoire atteints de la sclérose en plaques à périodes progressives et rémittentes |
Plaidoyer final : 27 juin 2007 |
Dovobet
LEO Pharma Inc. |
Le Dovobet est un médicament indiqué pour le traitement topique des lésions actives du psoriasis vulgaris chez les patients adultes. |
Ordonnance du Conseil : devrait être rendue sous peu |
Nicoderm
Hoechst Marion Roussel Canada Inc. |
Le Nicoderm est un timbre de nicotine transdermique indiqué pour atténuer les symptômes d'assuétude chez les personnes qui cessent de fumer. |
Ordonnance du Conseil : devrait être rendue sous peu |
Penlac – vernis à ongles
sanofi-aventis Canada Inc. |
Le Penlac est une nouvelle formulation d'un composé existant (le ciclopirox). Il est indiqué pour le traitement des ongles des patients immunocompétents atteints d'une onychomycose ou infection fongique des ongles ne touchant pas la lunule. |
Conférence préparatoire : 6 juin 2007 |
Quadracel et Pentacel
sanofi pasteur Limitée |
Le Quadracel est indiqué pour la promovaccination des nourrissons à partir de l'âge de deux mois et comme vaccin de rappel pour les enfants jusqu'à sept ans contre la diphtérie, le tétanos, la coqueluche et la poliomyélite.
Le Pentacel est indiqué pour l'immunisation systématique des enfants de 2 à 59 mois contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et l'haemophilus influenzae de type b. Le médicament est offert au Canada sous forme de fiole monodose de Act HIB (poudre lyophilisée pour injection) et d'une ampoule à dose unique (0.5 mL) de Quadracel (suspension pour injection).
|
Conférence préparatoire : 17 août 2007 |
Risperdal Consta
Janssen-Ortho Inc. |
Le Risperdal Consta est une nouvelle formulation d'un composé existant (le risperidone) indiqué pour le traitement des manifestations de schizophrénie et de troubles psychotiques associés. |
Plaidoyer final : 8 juin 2007 |
Strattera
Eli Lilly Canada Inc. |
Le Strattera est indiqué pour le traitement du trouble déficitaire de l'attention (TDA) chez les enfants d'au moins six ans, les adolescents et les adultes. |
Audience : dates non encore fixées |
Les dates des audiences du Conseil sont annoncées sur son site Web et dans son feuillet d'information La Nouvelle.
Le 21 mars 2007, la Cour fédérale du Canada a rendu sa décision et les motifs sur lesquels elle fonde sa décision relativement à la demande de révision judiciaire de la décision rendue par le Conseil dans l'affaire de LEO Pharma Inc. et du prix de son médicament breveté Dovobet.
Le 29 novembre 2004, le Conseil a émis un Avis d'audience suite auquel il a tenu une audience publique sur le prix du Dovobet, un médicament dermatologique indiqué pour le psoriasis. Après avoir pris connaissance de la décision sur le fond rendue par le Conseil en avril 2006, LEO Pharma a soumis à la Cour fédérale une requête de révision judiciaire. Dans sa requête, LEO Pharma a soulevé différents points, dont la norme de révision judiciaire de la décision du Conseil, la catégorie thérapeutique dans laquelle le médicament a été classé, l'application du test de la comparaison des prix internationaux, l'exclusion dans le calcul du prix de transaction moyen des médicaments offerts à titre gratuit et des allégations de partialité causée par la structure même du Conseil.
Dans décision, le juge Blais a confirmé la décision du Conseil sur les différents points, à l'exception de l'exclusion des médicaments offerts è titre gratuit du calcul du prix de transaction moyen du Dovobet.
Norme de contrôle judiciaire
Dans sa décision, le juge Blais a mentionné que, considérant la nature des questions soulevées, la norme de contrôle judiciaire doit être le « caractère raisonnable ». Le juge Blais a affirmé : « Il importe de noter qu'une décision du Conseil à savoir si le prix d'un médicament est ou non excessif est subjective. La Loi sur les brevets et son règlement d'application n'étant pas très explicites sur ce sujet, la décision du Conseil doit être considérée avec réserve. (traduction). »7
Concernant les allégations de partialité, après avoir appliqué la norme du bien-fondé, le juge Blais a décidé de maintenir la structure du Conseil. Il a rejeté l'argument de la demanderesse selon lequel le Conseil ne démontre pas l'indépendance institutionnelle et l'impartialité requises pour assurer au breveté une audience impartiale comme l'exigent les principes de justice fondamentale.
Lignes directrices du Conseil sur les prix excessifs
Dans sa décision, le juge Blais a reconnu que le libellé de l'article 85 de la Loi sur les brevets est très général et qu'il laisse ainsi au Conseil un grand pouvoir discrétionnaire lorsqu'il est appelé à déterminer si le prix d'un médicament est ou non excessif. Le juge Blais a également confirmé que le Conseil peut appliquer la logique et la méthodologie préconisée par ses Lignes directrices lorsqu'il applique les facteurs de fixation des prix mentionnés au paragraphe 85(1) de la Loi dans la mesure où il ne s'estime pas lié par celles-ci.
En ce qui concerne l'application des tests de prix pertinents, le juge Blais a souscrit à la décision du Conseil selon laquelle le prix du Dovobet ne peut être plus élevé que la somme des prix des deux substances qui le constituent (le Dovonex et le Diprosone).
Médicaments distribués à titre gratuit
En ce qui concerne l'exclusion du calcul du prix de transaction moyen des quantités du médicament Dovobet distribuées à titre gratuit, le juge Blais a statué que ces médicaments devaient être considérés dans le calcul étant donné que le Règlement sur les médicaments brevetés, 1994 prévoit que les brevetés doivent faire rapport des prix auxquels ils vendent leurs médicaments brevetés en tenant compte dans leur calcul de ce prix des « réductions de prix consenties en guise de promotion ou sous forme de rabais, escomptes, remises, marchandise gratuite, services gratuits, cadeaux ou autres avantages de semblable nature. (caractère gras ajouté)
7 Cour fédérale du Canada, http://decisions.fct-cf.gc.ca/en/2007/2007fc306/2007fc306.html, page 8, para 15.
- Tendances des ventes de médicaments brevetés
- Tendances des prix
- Comparaison des prix pratiqués dans les pays de comparaison avec ceux pratiqués au Canada
- Utilisation des médicaments brevetés
- Tendances de l'industrie canadienne de fabrication de médicaments
- Ventes de médicaments au Canada par rapport aux ventes dans d'autres pays
- Analyse des dépenses de recherche-développement
Tendances des ventes de médicaments brevetés8
En vertu du Règlement sur les médicaments brevetés, 1994 (Règlement), les brevetés doivent faire rapport au CEPMB de leurs ventes de médicaments brevetés au Canada, dont les quantités vendues et les recettes nettes par médicament, par catégorie de clients et par province/territoire. Le CEPMB utilise ces éléments d'information pour analyser les tendances aux niveaux des ventes, de l'utilisation faite des médicaments et des prix. Vous trouverez dans la présente section les résultats de cette analyse.9
Ventes et prix
La population canadienne consacre aujourd'hui beaucoup plus d'argent à l'achat de médicaments qu'elle ne le faisait il y a encore à peine dix ans. Il est toutefois important de préciser qu'une augmentation des dépenses en médicaments n'est pas nécessairement attribuable à une augmentation des prix des médicaments. Selon les rapports annuels antérieurs, les prix des médicaments brevetés n'ont que très peu augmenté alors que la valeur des ventes, elle, augmentait de 10 à 20 %. Dans ces cas, ce sont le volume et la composition de l'utilisation faite des médicaments qui sont à l'origine de la croissance de la valeur des ventes.10 Différents facteurs peuvent être à l'origine de tels changements, dont les suivants :
- augmentation de la population du pays
- variations de la composition démographique de la population (par ex. vieillissement de la population et, partant, une plus grande incidence de problèmes de santé)
- augmentation de l'incidence des problèmes de santé nécessitant une pharmacothérapie
- nouvelles habitudes d'ordonnance des médecins (par ex. tendance à prescrire des nouveaux médicaments pour traiter une condition qu'ils avaient l'habitude de traiter avec des médicaments existants souvent offerts à moindres prix)
- recours plus régulier à des pharmacothérapies en remplacement d'autres formes de traitement
- recours à de nouveaux médicaments pour traiter des conditions pour lesquelles il n'existait encore aucun traitement efficace.
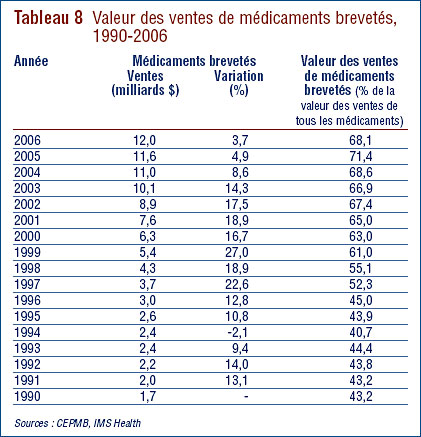
Tendances des ventes9
Le tableau 8 présente la valeur des ventes au prix du fabricant (prix départusine) des médicaments au Canada pour les années 1990 à 2006. Les ventes de médicaments brevetés ont totalisé 12,0 milliards de dollars en 2006, soit 3,7 % de plus qu'en 2005 où ce montant totalisait 11,5 milliards de dollars. En guise de comparaison, le taux annuel de croissance des ventes de médicaments était de 27,0 % en 1999 et s'est maintenu dans les deux chiffres jusqu'en 2003. La croissance de la valeur des ventes a reculé à 8,6 % en 2004 et à 4,9 % en 2005.
La troisième colonne du tableau 8 présente la valeur des ventes des médicaments brevetés exprimée en pourcentage de la valeur des ventes de tous les médicaments, brevetés et non brevetés.11 Entre 1994 et 2006, le pourcentage de la valeur des ventes de médicaments brevetés par rapport à la valeur des ventes de tous les médicaments est passé de 43 % qu'il était à plus de 68 %.
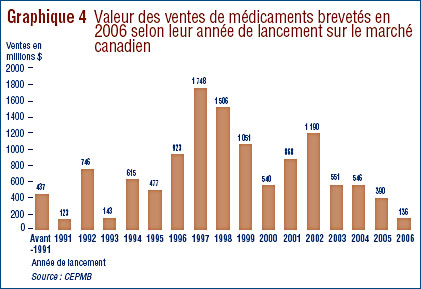
Cette baisse marquée de la croissance des ventes de médicaments brevetés enregistrée ces dernières années est assez surprenante. Il a été mentionné dans le rapport annuel de l'an dernier que la croissance des ventes au cours des années 1990 était essentiellement associée à de nouveaux médicaments « gros calibre » générant d'importants volumes de ventes et que depuis le début de la présente décennie, l'industrie des médicaments n'a pas lancé sur le marché de nouveaux produits de grande vente en nombre suffisant pour soutenir un taux de croissance des ventes à deux chiffres de l'ordre de ceux enregistrés au cours des années 1990. En 2005, les ventes des médicaments brevetés au Canada étaient toujours dominées par les médicaments lancés sur le marché entre 1995 et 1999.
Cette tendance s'est répétée en 2006. Le graphique 4, à la page 22, présente pour 2006 une ventilation de la valeur des ventes de médicaments brevetés selon l'année de leur première vente au Canada. Ce graphique illustre clairement que les ventes de médicaments brevetés sont encore à la remorque des médicaments apparus sur notre marché au cours de la dernière partie des années 1990. En 2006, les médicaments lancés sur le marché canadien au cours de la période de sept années allant de 2000 à 2006 totalisaient des ventes de 4,2 milliards de dollars par rapport à 5,7 milliards de dollars pour les médicaments lancés sur le marché au cours d'une période de cinq années allant de 1995 à 1999. Ce dernier montant représente presque la moitié de la valeur des ventes de 2006.
Ventes selon la catégorie thérapeutique
Le CEPMB classe généralement les médicaments à l'aide du système de classification anatomique thérapeutique chimique (ATC) de l'Organisation mondiale de la santé. Ce système hiérarchique classe les médicaments selon leur utilisation thérapeutique principale et leur composition chimique. Au plus haut niveau de ce système, à savoir au niveau 1, le système ATC classe les médicaments selon la partie de l'anatomie à laquelle ils sont principalement associés.
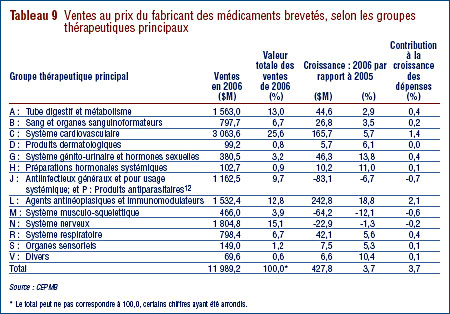
Le tableau 9, à la page 23, ventile les ventes des médicaments brevetés effectuées au Canada en 2006 selon le groupe thérapeutique principal, à savoir le niveau de classification ATC 1. Il présente les ventes effectuées en 2006 dans les différents groupes de médicaments, leur part de l'ensemble des ventes ainsi que le taux d'augmentation de la valeur de leurs ventes par rapport à 2005. La dernière colonne de ce tableau correspond au résultat de la multiplication du taux de croissance des ventes de chaque groupe thérapeutique par sa part de l'ensemble des ventes. Ce résultat correspond à la composante de la croissance de l'ensemble des ventes attribuables aux médicaments du groupe thérapeutique. La mesure ainsi obtenue permet de dégager les groupes thérapeutiques qui ont le plus contribué à la croissance de la valeur des ventes. En 2005-2006, ces groupes étaient les suivants :
- agents antinéoplasiques et immunomodulateurs
- médicaments pour le système cardiovasculaire (agents réducteurs de lipides sériques et médicaments servant à traiter l'hypertension).
Ces deux catégories de médicaments ont été respectivement à la source de 2,1 % et de 1,4 % de la croissance de la valeur des ventes de médicaments. C'est la troisième année consécutive que les agents antinéoplasiques et immunomodulateurs constituent la principale source d'augmentation de la valeur des ventes, avant les médicaments pour le système cardiovasculaire qui ont occupé cette place pendant de nombreuses années. On remarquera que plusieurs des groupes thérapeutiques ayant constitué au cours des années antérieures des facteurs importants d'augmentation de la valeur des ventes, et plus particulièrement les médicaments pour le tube digestif et pour le système nerveux, ont peu contribué en 2006 à la croissance de la valeur des ventes.
8 Dans le présent chapitre, on entend par « médicament breveté » tout produit assujetti à la compétence du CEPMB pour l'examen de son prix.
9 Les résultats statistiques présentés dans le présent rapport se fondent sur les données que les brevetés ont soumises au CEPMB à la fin de l'exercice 2006. Il arrive que des fabricants révisent d'une façon substantielle leurs données après avoir transmis leurs rapports au CEPMB et après également que le CEPMB les aient utilisées dans la préparation de son rapport. C'est d'ailleurs pour cette raison que les résultats présentés dans le présent rapport pourraient être révisés dans un prochain rapport annuel.
10 Selon les études effectuées par le CEPMB sur les régimes publics d'assurance-médicaments, c'est l'augmentation de l'utilisation faite des médicaments existants et des nouveaux médicaments qui est à la source de la majeure partie de la croissance des dépenses récemment enregistrée. CEPMB, Régimes d'assurance-médicaments provinciaux : Vue d'ensemble – évolution des prix des médicaments, 1995-1996 - 1999-2000, Septembre 2001.
11 Le dénominateur dans ce ratio, la valeur totale des ventes, comprend la valeur des ventes des médicaments brevetés, des médicaments génériques et des médicaments de marque non brevetés. L'estimé de la valeur totale des ventes utilisé pour calculer le ratio de 2006 se fonde sur les données tirées de la base de données du Canadian Pharmaceutical Market : Drug Store and Hospital Purchases de IMS Health, décembre 2006. Pour les années antérieures, les données d'IMS Health n'ont été utilisées que pour calculer la valeur des ventes des médicaments génériques. Quant à la valeur des ventes des médicaments de marque non brevetés, elle était alors estimée à l'aide des données fournies par les brevetés. Pour mettre un terme aux anomalies dans ce dernier estimé causées par les variations annuelles de la liste des brevetés, le CEPMB n'utilise désormais que les données d'IMS.
12 Pour des raisons de confidentialité, ces deux groupes ont été combinés.
Le CEPMB compile l'Indice des prix des médicaments brevetés (IPMB). Cet indice nous permet d'observer les tendances des prix des médicaments brevetés. L'IPMB mesure la variation moyenne par rapport à l'année précédente des prix auxquels les fabricants vendent leurs médicaments brevetés sur le marché canadien (prix départ-usine). L'indice, calculé à l'aide de l'indicechaîne Laspeyres, est en fait la moyenne de la variation des prix au niveau du médicament pondérée en fonction des ventes du médicament.13 La méthodologie utilisée ressemble à celle qu'utilise Statistique Canada pour compiler l'Indice des prix à la consommation (IPC). L'IPMB est actualisé à chaque semestre à partir des données sur les prix et sur les ventes dont les brevetés font rapport au Conseil.14 L'IPMB ne couvre que les prix des médicaments brevetés pour usage humain.15
Il est important de bien comprendre la relation théorique qui existe entre l'IPMB et les coûts en médicaments. L'IPMB ne mesure pas les effets des changements de l'utilisation faite des médicaments sur les dépenses en médicaments. Cette mesure est prise par un autre indice appelé l'indice du volume des ventes de médicaments brevetés — l'IVVMB, à la page 32. L'IPMB ne mesure pas non plus l'incidence sur les coûts des nouvelles habitudes d'ordonnance des médecins ou de l'introduction de nouveaux médicaments. L'IPMB est conçu pour isoler la composante de variation des ventes attribuable aux variations des prix des médicaments brevetés.
Le graphique 5 présente les variations annuelles de l'IPMB pour les années 1988 à 2006. Selon la mesure prise par l'IPMB, les prix des médicaments brevetés pratiqués par les brevetés ont augmenté en moyenne de 0,2 % en 2006. Ce léger recul de l'IPMB fait suite à deux années d'augmentations assez marquées.
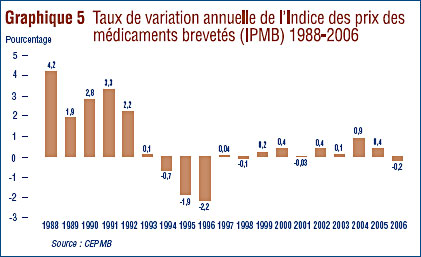
Comparaison de l'IPMB et de l'IPC
La Loi sur les brevets (Loi) prévoit que le CEPMB doit tenir compte des variations de l'Indice des prix à la consommation (IPC) lorsqu'il est appelé à déterminer si le prix d'un médicament breveté est ou non excessif. Le graphique 6 présente les variations annuelles de l'IPMB par rapport aux variations de l'IPC pour les mêmes années. L'inflation des prix, mesurée au moyen de l'IPC, a été supérieure à l'augmentation moyenne des prix des médicaments brevetés presque chaque année depuis 1988.16 La situation s'est répétée en 2006 alors que l'IPC a augmenté de 2,0 %17 et l'IPMB a reculé de 0,2 %.
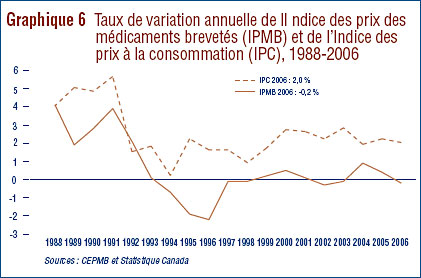
Il n'est pas surprenant que l'IPMB n'ait pas augmenté au même rythme que l'IPC. Les Lignes directrices du Conseil sur les prix excessifs prévoient que les prix des médicaments brevetés ne peuvent augmenter davantage que le taux moyen d'augmentation de l'indice des prix à la consommation calculé sur une période de trois ans. (Les Lignes directrices limitent également les augmentations annuelles de prix à une fois et demi le taux d'inflation calculé à l'aide de l'IPC.) Ces exigences ont pour effet de limiter les augmentations de l'IPMB sur toute période de trois années.18 En pratique, les variations de l'IPMB n'atteignent jamais cette limite étant donné que certains brevetés n'augmentent pas les prix de leurs médicaments dans toute la mesure autorisée en vertu des Lignes directrices du CEPMB lorsqu'ils ne les réduisent pas.
Variation des prix selon le groupe thérapeutique principal
Le tableau 10 présente les taux moyens de variation des prix des médicaments brevetés selon leur groupe thérapeutique principal. Ce tableau a été établi en appliquant la méthode de calcul de l'IPMB aux données sur les prix des différents médicaments brevetés ventilés par groupe thérapeutique principal. Le tableau présente la part des ventes de tous médicaments brevetés appartenant aux différents groupes thérapeutiques ainsi que le taux moyen de variation des prix. La dernière colonne du tableau présente le résultat de la multiplication du taux moyen de variation des prix des médicaments du groupe par sa part de l'ensemble des ventes, ce qui donne une mesure approximative de la variation générale de l'IPMB attribuable aux médicaments du groupe thérapeutique correspondant. Selon cette mesure, ce sont les agents antinéoplasiques et les agents immunomodulateurs qui, en 2006, ont le plus contribué à la variation des prix.19 On remarquera que les taux moyens de variation des prix dans toutes les catégories thérapeutiques sont inférieurs au taux d'inflation.
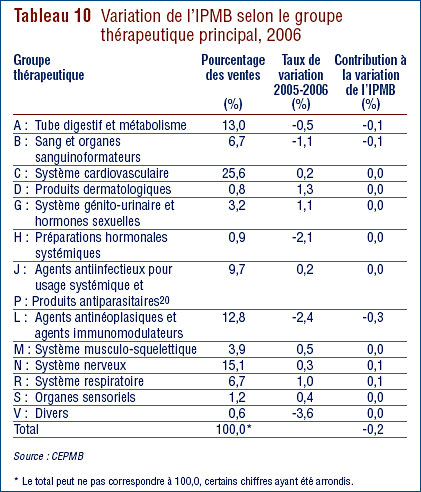
Variation des prix selon la catégorie de clients
Le graphique 7 présente les taux moyens de variation des prix selon la catégorie de clients.21 Ces taux ont été obtenus en appliquant la méthodologie du calcul de l'IPMB aux données sur la valeur des ventes de médicaments brevetés ventilées entre les ventes aux hôpitaux, aux pharmacies et aux grossistes.22 En 2006, par rapport aux taux de 2005, les taux de variation des prix ont fluctué entre 1,0 % (ventes directes aux pharmacies) et -3,8 % (ventes aux hôpitaux). On remarquera que le taux de variation de la valeur des ventes aux grossistes (qui accaparent près des trois quarts des ventes) est à peu près le même que le taux de variation de l'IPMB. Aucune catégorie de clients n'a enregistré un taux de variation de prix largement inférieure à l'inflation mesurée à l'aide de l'IPC.
D'après ce qu'on peut voir sur le graphique 7, la baisse légère de l'IPMB est attribuable aux prix plus bas payés par les hôpitaux : si IPMB n'avait couvert que les ventes faites aux pharmacies et aux grossistes, il n'aurait augmenté en 2006 que d'environ 0,4 % par rapport à 2005.
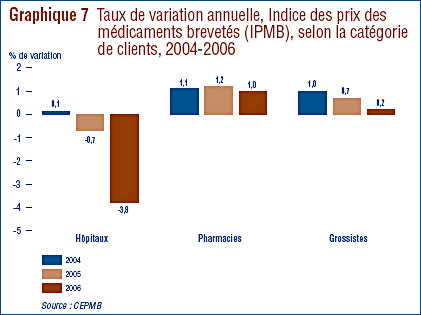
Variation des prix selon la province/le territoire
Le graphique 8 présente les taux moyens de variation des prix des médicaments brevetés selon la province ou le territoire. Les résultats ont été obtenus en appliquant la méthodologie du calcul de l'IPMB aux données sur les prix ventilées selon la province ou le territoire dans lequel les ventes ont été effectuées. En 2006, les taux moyens de variation des prix selon la province ou le territoire ont fluctué entre 1,2 % (Île-du-Prince-Édouard) et -2,0% (Territoires du Nord-Ouest). Les augmentations moyennes des prix dans six des 13 juridictions provinciales/ territoriales ont été compensées par de faibles reculs des prix en Ontario et au Québec, donnant ainsi lieu à une diminution moyenne du prix national de 0,2 %. Aucune province ni territoire n'a enregistré un taux de variation des prix supérieur à l'inflation mesurée à l'aide de l'IPC.
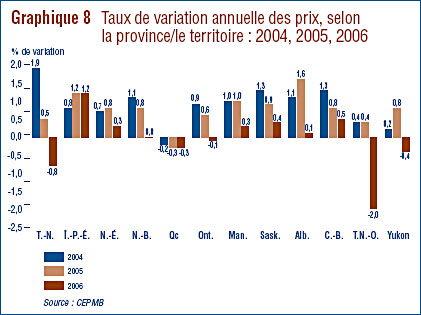
Variation des prix selon le pays
La Loi et le Règlement obligent les brevetés à faire rapport au CEPMB des prix départ-usine publiquement disponibles pratiqués dans les sept pays de comparaison nommés dans le Règlement. Ces pays sont la France, l'Allemagne, l'Italie, la Suède, la Suisse, le Royaume-Uni et les États- Unis. Le CEPMB utilise ces données aux fins suivantes :
- pour effectuer les comparaisons des prix internationaux prévues dans les Lignes directrices, et
- pour comparer les prix des médicaments pratiqués au Canada avec les prix pratiqués dans d'autres pays
Le graphique 9 présente les taux de variation annuelle de 2006 par rapport à 2005 des prix pour le Canada et pour les sept pays de comparaison nommés dans le Règlement. Les valeurs ont été obtenues en appliquant la méthodologie de l'IPMB (avec pondération pour tenir compte des tendances des ventes au Canada) aux données sur les prix pratiqués dans les différents pays de comparaison fournies par les brevetés. On remarquera que deux résultats sont présentés pour les États-Unis : le premier résultat porte exclusivement sur les prix pratiqués aux États-Unis déclarés par les brevetés alors que le deuxième tient compte des prix de la Classification fédérale des approvisionnements (FSS).23
Cinq des sept pays de comparaison ont enregistré en 2006 une baisse des prix des médicaments brevetés, exclusion
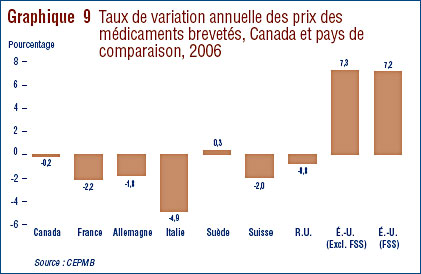
13 Pour être plus précis, au niveau défini par le Numéro d'identification du médicament (DIN).
14 Les résultats de l'IPMB pour une année sont obtenus en faisant la moyenne des IPMB du premier et du second trimestre de cette année.
15 Pour comprendre comment est calculé l'IPMB, voir le document du CEPMB intitulé « Description de la méthodologie de l'indice-chaîne Laspeyres utilisée pour calculer l'indice des prix des médicaments brevetés (IPMB) » juin 2000. Depuis 1999, l'IPMB ne porte plus que sur les variations des prix des médicaments brevetés pour usage humain.
16 1992 est la seule année où l'IPMB a augmenté davantage que l'IPC. Dans un effort pour faciliter et encourager la conformité des brevetés, la méthodologie de rajustement des prix en fonction de l'IPC du CEPMB utilise le taux d'IPC prévu et publié par le ministère des Finances. En 1992, le taux prévu était de 3,2 % alors que le taux réel n'était que de 1,5 %. Cette méthodologie du prix rajusté en fonction de l'IPC est présentée à l'appendice 4 du Compendium des Lignes directrices, politiques et procédures. Vous trouverez le Compendium sur le site Web du CEPMB sous « Lois, Règlement et Lignes directrices ».
17 Statistique Canada, CANSIM, Série V735319.
18 Théoriquement, cette limite fait en sorte que l'IPMB pourrait augmenter davantage que l'IPC sur une période de douze mois. Toutefois, cette situation ne s'est jamais produite depuis que le CEPMB a adopté cette méthodologie.
19 R représente le taux général de variation de l'IPMB et N, les groupes thérapeutiques nommés 1,2… R(i) représente le taux moyen de variation du prix du groupe thérapeutique principal i obtenu avec la méthodologie de l'IPMB. R étant une moyenne des variations des prix de tous les médicaments pondérée en fonction de la valeur des ventes, il devient facile de calculer la relation suivante :
R = w(1)R(1) + w(2)R(2) + … + w(N)R(N)
où w(i) représente la part du groupe thérapeutique principal de l'ensemble des ventes. Cette dernière équation constitue la base de la décomposition par groupe thérapeutique présentée à la dernière colonne du tableau 10. Chaque terme du côté droit multiple le taux moyen de variation du prix pour un groupe thérapeutique donné par sa part de l'ensemble des ventes. La valeur ainsi obtenue peut facilement être considérée comme la contribution correspondante du groupe thérapeutique à la variation de l'IPMB. L'envergure de cette contribution dépend du taux de variation du prix pour le groupe thérapeutique en question et de son importance relative (mesurée par sa part de l'ensemble des ventes).
Tel que mentionné, la décomposition dans le tableau 10 est approximative étant donné que les pondérations utilisées sont tirées des données sur les ventes annuelles alors que l'IPMB est calculé avec des données couvrant des périodes de six mois.
20 Pour des raisons de confidentialité, les données relatives à ces deux groupes ont été combinées.
21 Le Règlement sur les médicaments brevetés, 1994 prévoit que les brevetés doivent fournir des données sur les ventes qu'ils font à quatre catégories de clients (hôpitaux, pharmacies, grossistes et autres).
22 Les résultats pour une quatrième catégorie de clients, la catégorie « autres », ne sont pas fournis. Les acheteurs de la catégorie "autres" sont essentiellement des établissements de soins de santé autres que les hôpitaux, notamment des cliniques médicales et des centres de soins infirmiers.
23 L'industrie pharmaceutique des États-Unis a fait valoir que les prix publiquement disponibles dans ce pays ne reflètent pas vraiment les prix réels en raison des remises et des rabais consentis sur une base confidentielle. Depuis janvier 2000, dans la foulée d'une consultation publique, le CEPMB inclut les prix figurant dans la Classification fédérale des approvisionnements (Federal Supply Schedule ou FSS) des États-Unis dans son calcul des prix moyens des médicaments brevetés pratiqués aux États-Unis. Les prix de la Classification fédérale des approvisionnements sont négociés entre les fabricants et le département des Anciens combattants des États-Unis. Ils sont généralement moins élevés que les autres prix publiquement disponibles pratiqués aux États-Unis et divulgués dans les rapports des brevetés au CEPMB.
Les tableaux 11 et 12 présentent des statistiques qui permettent de comparer les prix des médicaments pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. Chaque tableau présente quatre série de ratios de prix moyens. Ils sont différents l'un de l'autre selon (1) la formule de calcul de la moyenne utilisée et (2) la méthode de conversion des prix exprimés dans la devise des différents pays en équivalents en dollars canadiens. Les deux tableaux présentent également le nombre de médicaments (DIN) et le volume des ventes couvertes par les statistiques.24
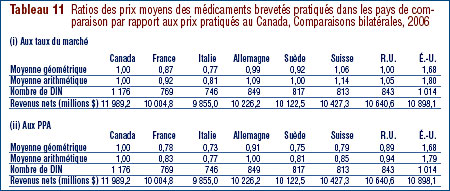
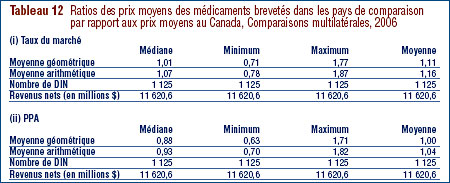
Le CEPMB faisait jusqu'ici rapport des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada sous forme de ratios calculés à l'aide d'une moyenne géométrique pondérée en fonction du volume des ventes des différents ratios. Les résultats obtenus sont présentés dans les tableaux 11 et 12 (sous la rubrique « Moyenne géométrique »). Ces tableaux présentent aussi les résultats obtenus avec une moyenne arithmétique pondérée en fonction du volume des ventes (sous la rubrique « Moyenne arithmétique »).25 Ces statistiques permettent de répondre aux questions comme la suivante
« Combien les Canadiens auraient-ils payé, en plus ou en moins, leurs médicaments brevetés en 2006 s'ils les avaient achetés aux prix pratiqués dans le pays X ? »
Par exemple, on peut voir dans le tableau 11 que, pour 2006, le ratio du prix moyen en France par rapport au prix moyen au Canada calculé avec la moyenne arithmétique est 0,92. Ce ratio signifie que les Canadiens auraient payé leurs médicaments brevetés 8 % de moins en 2006 s'ils avaient pu les acheter aux prix pratiqués en France.
Pendant de nombreuses années, le CEPMB a fait rapport des ratios des prix moyens pratiqués dans les pays de comparaison par rapport aux prix moyens pratiqués au Canada après avoir converti les prix pratiqués dans les pays de comparaison en équivalents en dollars canadiens en utilisant pour ce faire les moyennes des taux de change (ou, plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois, taux qu'utilise généralement le CEPMB lorsqu'il applique ses Lignes directrices sur l'examen du prix). Depuis l'an dernier, le CEPMB fait rapport des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada après avoir converti les devises étrangères au moyen de la parité des pouvoirs d'achat (PPA). Le taux de parité des pouvoirs d'achat (PPA) de deux pays représente le coût de la vie relatif dans ces deux pays. En pratique, le coût de la vie est calculé à l'aide d'un panier de produits et de services aux prix courants. Étant donné que les taux de PPA représentent les niveaux de prix relatifs au coût de la vie dans chacun des pays, ils constituent un moyen simple et fiable de rajuster les prix pour tenir compte des différences de revenus et d'autres valeurs monétaires dans la comparaison des prix pratiqués dans les différents pays. Lorsqu'appliqués au calcul des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d'achat fournissent des statistiques qui nous permettent de répondre à des questions comme celle-ci :
« Dans quelle mesure les Canadiens auraient-il dû sabrer dans leur consommation de biens et de services pour acheter des médicaments brevetés ou, encore, auraient-ils pu augmenter leur consommation de biens et de services si, en 2006, ils avaient vécu et acheté leurs médicaments brevetés dans le pays X? »
On ne peut répondre à tel type de questions en ne comparant que les prix des médicaments. Il faut en effet calculer ce que chaque prix représente en termes de biens et de services sacrifiés. C'est ce que permettent de faire les PPA.
Comparaisons bilatérales
Le tableau 11 compare les prix pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. D'après les résultats de la conversion des différentes devises aux taux de change du marché (faite avec la moyenne géométrique), les prix des médicaments brevetés pratiqués au Canada se situent dans la juste moyenne des prix pratiqués sur les différents marchés. Les prix en France et en Italie sont beaucoup moins élevés que les prix au Canada alors que les prix en Suisse et aux États-Unis sont plus élevés. Comme cela a été le cas dans les années antérieures, les prix des médicaments brevetés aux États-Unis sont beaucoup plus élevés que les prix pratiqués au Canada et dans les autres pays de comparaison.
Le graphique 10 présente ces résultats dans une perspective historique. En 1987, les prix des médicaments brevetés au Canada étaient en général inférieurs aux prix pratiqués aux États- Unis, mais supérieurs aux prix des autres pays de comparaison. Au milieu des années 1990, la situation avait radicalement changé, les prix au Canada se situant alors dans la juste moyenne des prix pratiqués dans les six pays européens de comparaison.
Toutefois, les ratios moyens de prix obtenus suite à la conversion des devises aux taux de parité des pouvoirs d'achat présentent un tableau tout autre. Si l'on tient compte des différences du coût de la vie dans les sept pays de comparaison, le Canada apparaît comme un pays où les prix des médicaments brevetés sont élevés. En effet, il semble que les Canadiens ont dû consacrer un coût de consommation plus grand pour se procurer des médicaments brevetés en 2006 que n'ont dû le faire les résidents des pays de comparaison, exclusion faite des États-Unis. Le cas de la Suisse est particulièrement éloquent à cet égard. En termes purement monétaires, les prix des médicaments brevetés en Suisse sont beaucoup plus élevés qu'au Canada. Toutefois, en termes réels – à savoir en termes de consommation sacrifiée – les Suisses paient leurs médicaments moins cher que les consommateurs canadiens et ce, en raison du coût de la vie beaucoup plus élevé en Suisse qu'au Canada.
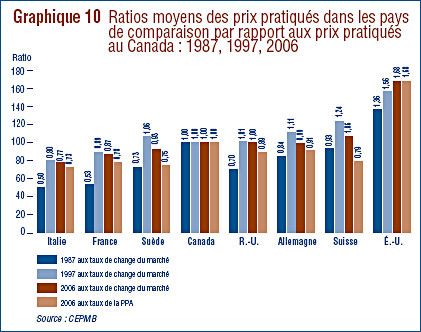
Comparaisons multilatérales des prix26
Le tableau 12 révèle les ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada et ce, pour plusieurs mesures multilatérales de prix. La première de ces mesures est le « prix international médian » calculé à l'aide des prix observés dans les sept pays de comparaison. D'autres ratios de prix moyen comparent la moyenne minimale, maximale et simple des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada.

Sous l'angle des résultats obtenus avec les taux de change du marché (calculés à l'aide de la moyenne géométrique), le ratio de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada s'est maintenu à 1,01 en 2006, ce qui représente un recul marqué de la valeur enregistrée pour 2005 (1,09). Le graphique 11 présente ce résultat dans une perspective historique. En 1987, les médianes des prix pratiqués dans les pays de comparaison étaient en moyenne de 19 % inférieures aux prix canadiens (ou, inversement, les prix canadiens étaient de 23 % supérieurs à la médiane des prix internationaux). Mais en 1998, elles dépassaient les prix canadiens de 14 %. Pour toutes la décennie, le ratio moyen de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada s'est maintenu au-dessus de la parité. Ceci étant dit, les prix pratiqués au Canada continuent d'être sous la médiane des prix internationaux.
Les résultats obtenus avec les autres mesures multilatérales ne sont pas surprenants. Fait intéressant, la moyenne des prix pratiqués dans les pays de comparaison semble produire des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada plus élevés que les médianes des prix pratiqués dans les pays de comparaison. Cette situation s'explique par l'influence des prix pratiqués aux États-Unis où les prix sont beaucoup plus élevés que dans tous les autres pays. Les prix pratiqués aux États-Unis sont presque toujours pris en compte dans le calcul du prix moyen pratiqué dans les pays de comparaison, mais bien rarement dans la médiane des prix pratiqués dans les pays de comparaison.
Comme pour les comparaisons bilatérales, les différences entre les résultats obtenus avec les taux de change du marché et les résultats obtenus avec les PPA sont frappantes. Elles confirment l'idée que le Canada peut apparaître comme un pays où les prix des médicaments brevetés sont moyens en termes purement monétaires, mais où sa population doit sacrifier beaucoup plus de sa consommation d'autres produits et services pour acheter des médicaments brevetés que les résidents de la plupart des autres pays de comparaison. Avec la conversion des devises à l'aide de la PPA, le ratio moyen de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada (moyenne géométrique) est de 0,88 pour 2006, soit beaucoup moins que la valeur de 1,01 obtenue avec les taux de change du marché.
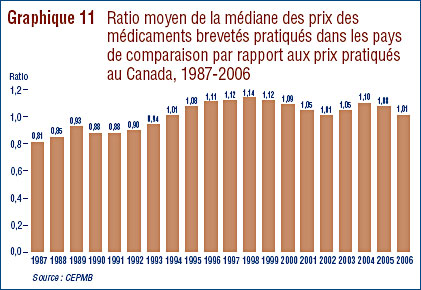
Le graphique 12 présente avec encore plus de détails les ratios au niveau du produit de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, ventilés selon la valeur des ventes déclarées. Ce graphique ventile les ventes de chaque médicament breveté en 2006 selon la valeur de son ratio de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada (ou, pour être plus précis, selon la fourchette dans laquelle le ratio s'inscrit). Le graphique indique que les ratios de prix au niveau du médicament étaient largement concentrés en 2006 au niveau de la parité : les cas où le ratio de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada se situait entre 0,75 et 1,25 réunissaient 71,2 % des ventes au Canada. Pour 9,75 % des ventes, la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison se situait à moins de 75 % du prix canadien. Pour 19,3 % des ventes, la médiane des prix des médicaments brevetés pratiqués dans les pays de dépassait de plus de 25 % le prix canadien.
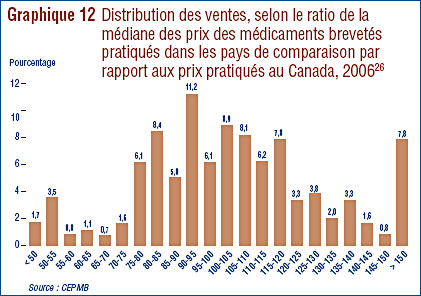
Ratios des prix moyens : Analyse des variations
Le graphique 11, à la page 31, laisse voir une baisse marquée du ratio moyen de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada entre les années 2005 et 2006. En raison de la construction du ratio moyen, les quatre facteurs suivants peuvent être à l'origine de la baisse observée :
- appréciation de la valeur du dollar canadien par rapport aux autres devises
- baisse des prix pratiqués dans les autres pays
- majoration des prix au Canada
- utilisation de pondérations en fonction des ventes qui favorisent les médicaments présentant des ratios de la médiane des prix des médica- ments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada relativement bas
D'autres analyses de données révèlent que la baisse observée du ratio moyen de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada est attribuable à l'appréciation récente du dollar canadien face aux autres devises et, dans une moindre mesure, aux variations des prix des médicaments pratiqués dans les pays de comparaison. Si l'on convertit les devises en utilisant les taux de change de 2005 plutôt que ceux de 2006, le ratio moyen pour 2006 de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada est de cinq points plus élevé que la valeur de 1,01 présenté dans le tableau 12, à la page 29. Par ailleurs, si on utilise les prix pratiqués dans les pays de comparaison en 2005, le ratio moyen de 2006 augmente de un ou deux points. D'autre part, comme on pouvait s'y attendre du fait que l'IPMB a été relativement constant entre 2005 et 2006, les variations des prix pratiqués au Canada ne semblent avoir aucune incidence sur le ratio moyen de la médiane des prix des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada.
24 Le nombre de médicaments et la valeur des ventes varient selon le médicament de comparaison étant donné qu'il n'est pas toujours possible de trouver pour chaque médicament breveté vendu au Canada les prix auxquels le médicament est vendu dans les pays de comparaison. À cet égard, il convient ici de préciser que tous les ratios des prix moyens présentés dans les Tableaux 11 et 12, à la page 29, couvrent au moins 82 % de la valeur des ventes au Canada en 2006. Les ratios déclarés des prix pratiqués aux États-Unis par rapport aux prix pratiqués au Canada couvrent environ 91 % des ventes de 2006.
25 Si RG représente le ratio moyen des prix calculé à l'aide de moyenne géométrique, RA correspond au ratio moyen des prix obtenu avec la moyenne arithmétique. Si p(i) représente le prix du médicament i pratiqué au Canada, pf(i) représente le prix de ce médicament à l'étranger (converti en dollars canadiens) et w(i) sa part de la valeur des ventes au Canada.
Alors RG = ? [pf(i)/p(i)]w(i) (où ? représente le résultat de la multiplication de tous les médicaments brevetés), alors que RA = Sw(i)[pf(i)/p(i)] (où S correspond à la somme de tous les médicaments brevetés).
Il peut ainsi être démontré que RG ne peut être supérieur à RA. Il est également possible de démontrer que l'écart entre RA et RG augmentera dans la même proportion que la variation des ratios des différents médicaments et que RG ne sera égal à RA que dans le cas où tous les ratios de prix ont la même valeur.
26 Dans des rapports annuels antérieurs, le CEPMB effectuait les comparaisons de prix multilatérales à l'aide des ratios des prix pratiqués au Canada par rapport aux prix pratiqués dans les pays de comparaison. Toutefois, par souci d'uniformité (avec l'approche adoptée pour les comparaisons bilatérales), nous utiliserons désormais pour ces comparaisons les ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada.
Les données sur les prix et sur la valeur des ventes utilisées pour le calcul de l'IPMB servent également à déterminer les tendances des quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule à cette fin l'Indice de volume des ventes de médicaments brevetés (IVVMB)27. Le graphique 13 présente pour les années 1988 à 2006 les taux moyens de croissance de l'utilisation des médicaments brevetés, mesurée à l'aide de l'IVVMB. Les résultats obtenus confirment que la croissance de l'utilisation faite des médicaments brevetés est le principal facteur d'augmentation de la valeur des ventes. Les taux de croissance de l'utilisation des dernières années talonnent en effet de près les taux de croissance de la valeur des ventes.28 Cette tendance s'est maintenue en 2006 : le taux d'utilisation des médicaments brevetés a augmenté de 5,4 %.
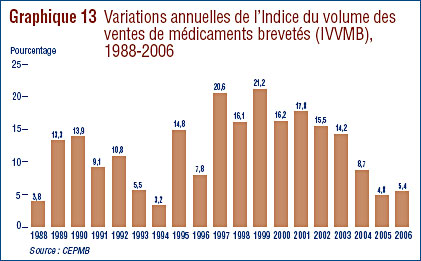
Croissance de l'utilisation des médicaments selon la catégorie thérapeutique
Le tableau 13 présente les taux moyens de croissance de l'utilisation faite des médicaments brevetés. Ces taux sont ventilés selon les groupes thérapeutiques principaux. Les résultats présentés dans ce tableau ont été obtenus en appliquant la méthodologie de l'IVVMB aux données du premier niveau de la classification ATC. Comme dans le tableau 10, la dernière colonne présente la contribution du groupe thérapeutique à la variation de l'IVVMB. Cette contribution a été calculée en multipliant le taux de variation du volume des ventes des médicaments des différents groupes thérapeutiques par leur part de l'ensemble des ventes. Chaque entrée représente approximativement la composante de la variation de l'IVVMB attribuable aux médicaments du groupe thérapeutique. Les pourcentages les plus élevés de cette colonne identifient les principaux médicaments à l'origine des variations de volume.29 Cette mesure indique que les principales sources de croissance de l'utilisation étaient les suivantes en 2006 :
- agents antinéoplasiques et immunomodulateurs
- médicaments utilisés pour traiter le système cardiovasculaire
Ces deux catégories de médicaments ont grosso modo été à l'origine des deux tiers de la croissance de l'utilisation calculée au moyen de l'IVVMB. Comme nous l'avons vu, l'utilisation de médicaments pour le système musculo-squelettique a beaucoup diminué (-11,2 %), causant à elle seule une diminution de 0,4 % de l'IVVMB.
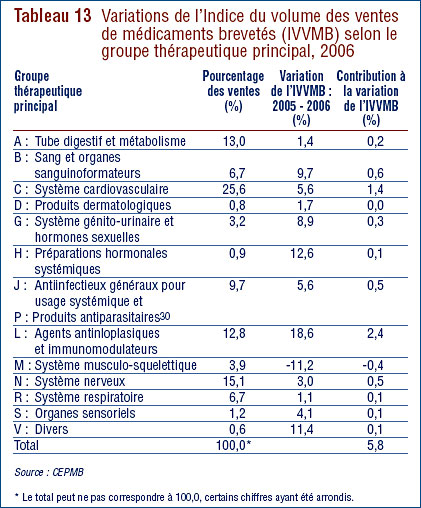
27 À l'instar de l'IPMB, l'IVVMB est calculé à l'aide de la formule de l'indice-chaîne de Laspeyres. Les ratios des volumes des ventes pour des périodes successives remplacent alors les ratios de prix de l'IPMB. Ici encore, la valeur cumulée de l'indice est obtenue sous forme d'une moyenne des ratios pondérée en fonction des recettes générées par les différents médicaments. Puisque l'IVVMB ne couvre que les médicaments brevetés, il ne représente pas les tendances de l'utilisation faite des médicaments sur l'ensemble du marché des médicaments.
28 Dans des conditions normales, les taux annuels de variation de l'IPMB et de l'IVVMB totaliseront une valeur correspondant approximativement au taux de change pour les ventes de médicaments brevetés. La relation algébrique n'est pas exacte en raison (1) des interactions des variations de prix et de quantité, (2) de l'incidence positive sur les ventes de nouveaux médicaments brevetés, (3) de l'incidence négative sur les ventes de l'arrivée des brevets à échéance et du retrait de médicaments du marché. Le dernier effet semble avoir été inhabituellement important en 2006, ce qui explique pourquoi les ventes n'ont augmenté que de 3,7 % en 2006 par rapport à 2005, alors que l'utilisation (mesurée à l'aide de l'IVVMB) a augmenté d'un taux moyen de 5,4 %.
29 Comme c'est le cas pour le tableau 10, à la page 26, cette décomposition de la variation de l'IVVMB est approximative étant donné qu'elle se fonde sur les données annuelles des ventes, alors que l'IVVMB est calculé à l'aide de données couvrant des périodes de six mois.
30 Pour des raisons de confidentialité, les données relatives à ces deux groupes ont été combinées.
À l'échelle mondiale, l'industrie de la fabrication de médicaments est dominée par des multinationales établies dans plusieurs pays. La plupart de ces multinationales ont des filiales au Canada qui, avec une poignée de fabricants canadiens, ont la mainmise sur la fabrication, la vente et la distribution de médicaments au Canada.
Selon Statistique Canada, l'industrie canadienne de fabrication de médicaments a livré en 2006 pour 7,9 milliards de dollars de médicaments, ce qui représente 1,3 % de la valeur totale des livraisons du secteur manufacturier canadien31. L'industrie canadienne fournit de l'emploi à 29 375 personnes, soit à 1,6 % de l'effectif du secteur manufacturier.32
Le graphique 14 présente les variations annuelles des livraisons et de l'emploi dans le secteur canadien de la fabrication de médicaments.
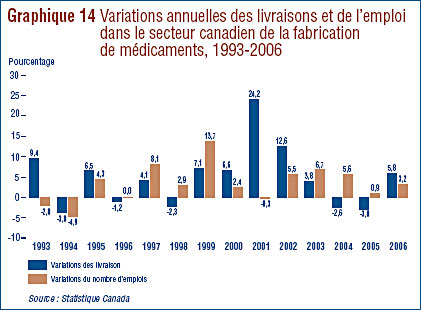
31 Depuis la publication de notre Rapport annuel 2005, Statistique Canada a révisé ses données sur les livraisons manufacturières publiées dans ses Enquêtes annuelles sur les manufactures pour les années 2002 à 2004. Cette révision a donné lieu à une réduction marquée des estimés des livraisons de médicaments et de produits pharmaceutiques par les fabricants.
32 Statistique Canada, CANSIM, Séries V800188 et V1709627.
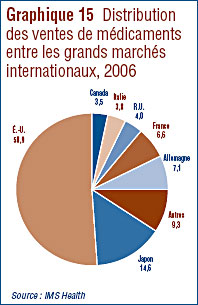 IMS Health fait régulièrement rapport des ventes des fabricants au secteur du détail dans différents pays. Selon IMS Health, ces ventes sur les principaux marchés ont totalisé 440,3 milliards de dollars en 2006.33 Le graphique 15 présente la répartition de ce montant entre les marchés. En ce qui concerne le Canada, ses ventes de médicaments ont représenté 3,5 % de l'ensemble des ventes sur les principaux marchés mondiaux. Le marché des États-Unis est de loin le plus important marché au monde. En effet, la valeur ventes de médicaments sur ce marché est supérieure au total combiné des ventes effectuées sur tous les autres grands marchés.
IMS Health fait régulièrement rapport des ventes des fabricants au secteur du détail dans différents pays. Selon IMS Health, ces ventes sur les principaux marchés ont totalisé 440,3 milliards de dollars en 2006.33 Le graphique 15 présente la répartition de ce montant entre les marchés. En ce qui concerne le Canada, ses ventes de médicaments ont représenté 3,5 % de l'ensemble des ventes sur les principaux marchés mondiaux. Le marché des États-Unis est de loin le plus important marché au monde. En effet, la valeur ventes de médicaments sur ce marché est supérieure au total combiné des ventes effectuées sur tous les autres grands marchés.
Le graphique 16 présente la part des ventes du Canada sur les principaux marchés pour la période de 2001 à 2006.34 Cette part des ventes est passée de 2,4 % qu'elle était en 2001 à 3,5 % en 2006.
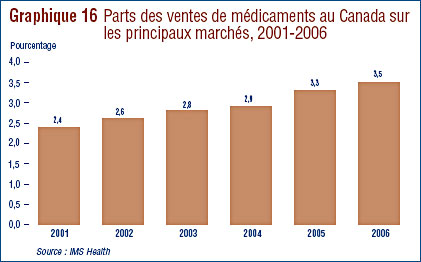
Le graphique 17 compare la croissance des ventes de médicaments au Canada à celle des autres grands marchés. Au cours des dernières années, les taux d'augmentation des ventes de médicaments au Canada ont été supérieurs à ceux des autres pays. La même tendance a été remarquée au Canada en 2006 avec une croissance annuelle des ventes de 7%.35 Pour la même période, le taux de croissance des ventes a été de 5 % sur les autres grands marchés.
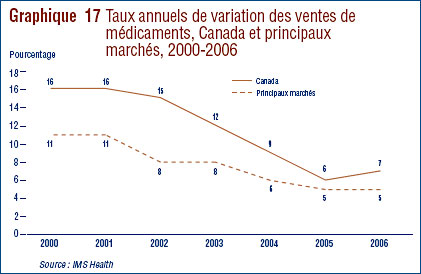
Le graphique 18 présente les taux de croissance des ventes sur les différents marchés mondiaux pour 2005 et 2006. Selon les données de IMS Health, la croissance des ventes au Canada (7 %) a été égale à celle observée aux États-Unis et supérieure à celle observée dans tous les autres pays de comparaison.
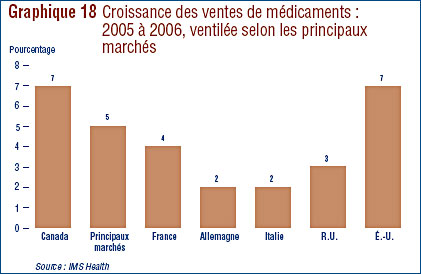
Il est également possible de comparer les coûts en médicaments entre les pays à l'aide de la proportion du produit intérieur consacrée à l'achat de médicaments.36 Le graphique 19 présente les dépenses en médicaments exprimées en pourcentage du Produit intérieur brut (PIB) du Canada et des sept pays de comparaison (données de 2004). Dans les sept pays de comparaison, les dépenses en médicaments ont accaparé entre 1,1 % et 2,0 % du PIB.
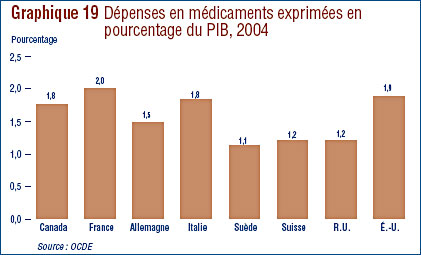
Au cours des dernières années, la part du PIB consacrée aux dépenses en médicaments a augmenté dans la plupart des pays industrialisés. Le tableau 14 montre que les dépenses en médicaments ont, entre 2000 et 2004, augmenté plus rapidement que le PIB au Canada et dans les différents pays de comparaison exception faite de la Suède. En ce qui concerne le Canada et les États-Unis, les résultats sont particulièrement frappants : les dépenses en médicaments y ont enregistré un taux de croissance presque deux fois plus élevé que le taux de croissance du produit intérieur.
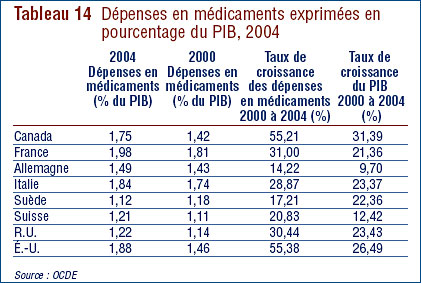
Composition of Expenditures
Le tableau 15 présente la valeur des ventes de médicaments au prix du breveté dans certains pays de comparaison.37 Ces ventes sont ventilées selon le groupe thérapeutique principal. À quelques exceptions près, ces résultats révèlent un degré d'uniformité remarquable entre les différents pays. Dans tous les pays, les ventes sont dominées par les médicaments pour le système cardiovasculaire et pour le système nerveux qui accaparent entre 37 % et 47 % de l'ensemble des ventes. Viennent ensuite les médicaments indiqués pour traiter des problèmes gastro-intestinaux et des troubles respiratoires – qui comptent entre 22 % et 28 % des ventes.
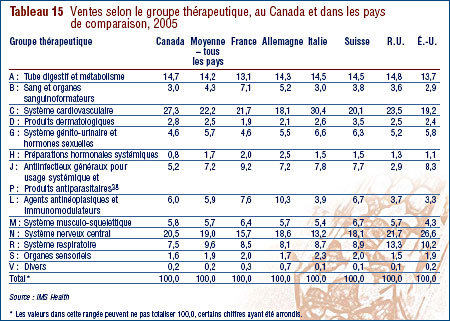
33 IMS Health's Retail Drug Monitor, Décembre 2005 (www.imshealth.com). IMS Retail Drug Monitor présente des estimés des achats directs (achats effectués directement auprès du fabricant) et des achats indirects des pharmacies (achats effectués auprès d'un grossiste) dans 13 pays industrialisés. Ces pays sont l'Argentine, l'Australie, le Brésil, le Canada, la France, l'Allemagne, l'Italie, le Japon, le Mexique, la Nouvelle-Zélande, l'Espagne, le Royaume-Uni et les États-Unis. Les valeurs sont exprimées aux prix du fabricant (prix départ-usine) et couvrent tous les médicaments d'ordonnance et certains médicaments en vente libre. Ces 13 marchés représentent globalement plus des deux tiers du marché mondial des produits pharmaceutiques. La part du Canada du marché mondial des produits pharmaceutiques est d'environ 2,5 %.
34 Pour calculer les parts présentées dans les graphiques 15 et 16, il faut en premier lieu convertir dans une même devise les données sur la valeur des ventes de chaque pays. À cette fin, IMS Health utilise les taux de change du marché. Ainsi, les parts présentées pour le Canada dans ces graphiques sont susceptibles d'être largement influencés par les variations de la valeur relative du dollar canadien.
35 Pour diverses raisons, ce taux de croissance n'est pas le même que celui présenté dans le tableau 8, à la page 21. La principale raison est qu'il a été calculé à l'aide de données sur les ventes couvrant des médicaments brevetés et des médicaments non brevetés. De plus, ces données ne couvrent que les ventes faites aux pharmacies.
36 Les comparaisons faites sur cette base tiennent compte des différences aux niveaux des prix des médicaments, de l'utilisation qui en est faite, des habitudes de choix thérapeutiques et du revenu national.
37 Les données utilisées ne portent que sur les ventes aux pharmacies.
38 Pour des raisons de confidentialité, les données relatives à ces deux groupes ont été combinées.
En contrepartie de l'adoption en 1987 des modifications à la Loi sur les brevets (Loi), les Compagnies de recherche pharmaceutique du Canada (Rx&D) se sont engagées pour le compte de l'industrie des médicaments de marque à investir dans la recherche-développement (R-D) au Canada au moins 10 % de la valeur des recettes tirées de leurs ventes et ce, à compter de l'année 1996.39
Le présent chapitre révèle les principales statistiques sur les investissements actuellement faits dans la recherchedéveloppement pharmaceutique au Canada. En application de la Loi, le CEPMB comptabilise les dépenses annuelles des brevetés dans la R-D et en fait rapport. Le CEPMB n'a toutefois pas droit de regard sur le type de recherche-développement effectuée ni sur les sommes investies dans la R-D par les brevetés.
La Loi oblige les brevetés à faire rapport au CEPMB des recettes qu'ils tirent des ventes de leurs médicaments, y compris des recettes tirées des ventes de médicaments non brevetés et des recettes découlant d'ententes de production sous licence ainsi que des dépenses de R-D qu'ils engagent au Canada pour leurs différents médicaments. Le Règlement sur les médicaments brevetés, 1994 (Règlement) exige qu'un fondé de pouvoir de la société pharmaceutique certifie l'exactitude de l'information fournie au Conseil. Le CEPMB ne vérifie pas systématiquement l'information qui lui est présentée, mais cherche plutôt les anomalies ou les contradictions et, lorsqu'il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour confirmer que les données qu'il a soumises ont été bien interprétées, chaque breveté est invité à confirmer, avant la publication du rapport annuel, l'exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes calculé par le CEPMB.
Les sociétés pharmaceutiques qui n'ont fait aucune vente de leurs médicaments brevetés ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D. Ainsi, alors que de nouveaux brevets sont attribués et que d'autres arrivent à échéance, la liste des sociétés pharmaceutiques ayant soumis un rapport sur leurs dépenses de R-D varie d'année en année.
Pour 2006, 72 sociétés pharmaceutiques40 vendant des médicaments brevetés pour usage humain ou pour usage vétérinaire ont présenté des rapports sur leurs dépenses de recherche-développement. De ce nombre, 28 étaient membres de Rx&D.
Recettes tirées des ventes
Pour des fins de rapport, les recettes tirées des ventes s'entendent des recettes tirées des ventes de médicaments au Canada41 ainsi que des recettes découlant d'ententes de ventes sous licence.
Comme l'illustre le tableau 16, la valeur des recettes tirées des ventes de médicaments au Canada déclarées par les brevetés a totalisé 14,9 milliards de dollars en 2006, plus précisément 4,7 % de plus qu'en 2005. Les recettes tirées des ventes déclarées par les brevetés membres de Rx&D ont totalisé 11,1 milliards de dollars sur la même période, ce qui représente 75 % du total des recettes tirées des ventes. De ce montant, moins de 1 % des recettes découlent d'ententes de vente sous licence.
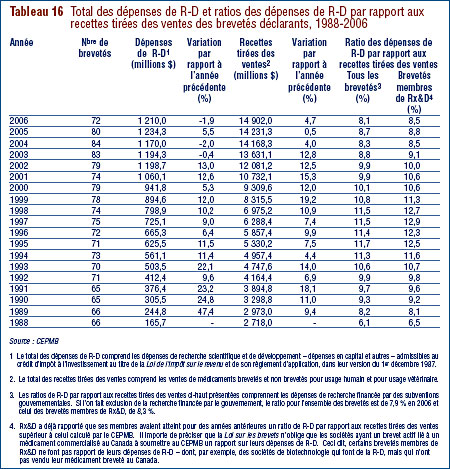
Dépenses de R-D
En vertu de l'article 6 du Règlement, les brevetés ne doivent inclure dans leurs rapports que leurs dépenses de R-D qui auraient été admissibles au crédit d'impôt à l'investissement pour la recherche scientifique et le développement expérimental aux termes de la Loi de l'impôt sur le revenu, dans sa version du 1er décembre 1987. Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d'immobilisation et l'amortissement autorisé. Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données courantes n'étant pas admissibles au crédit d'impôt à l'investissement, ils ne doivent pas figurer dans les rapports au CEPMB.
Comme le montre le tableau 16, la valeur des dépenses de R-D déclarées par l'ensemble des brevetés a totalisé 1,210 milliard de dollars en 2006, soit une baisse de 1,9 % depuis 2005. Les dépenses déclarées par les brevetés membres de Rx&D ont totalisé 949 millions de dollars en 2006, ce qui représente 78,4 % du total des dépenses de R-D déclarées ainsi qu'une diminution de 8,7 % par rapport à 2005. À titre de comparaison, les brevetés non membres de Rx&D ont déclaré des dépenses de R-D de 261 millions de dollars en 2006, soit 34,5 % de plus qu'en 2005.
Ratios de dépenses de R-D par rapport aux recettes tirées des ventes
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes de tous les brevetés est de 8,1 % pour 2006 alors qu'il était de 8,7 % en 2005. Quant au ratio des brevetés membres de Rx&D, il est passé de 8,8 % qu'il était en 2005 à 8,5 % en 2006. Comme le montre le graphique 20, les ratios de dépenses de R-D par rapport aux recettes tirées des ventes pour tous les brevetés et pour les brevetés membres de Rx&D ont baissé d'une façon assez marquée au cours des dernières années après avoir atteint un sommet à la fin des années 1990. C'est la sixième fois en autant d'années que le ratio des dépenses de R-D par rapport aux recettes tirées des ventes est inférieur à 10 % et la quatrième année où les brevetés membres de Rx&D n'ont pas atteint l'engagement qu'ils ont pris.
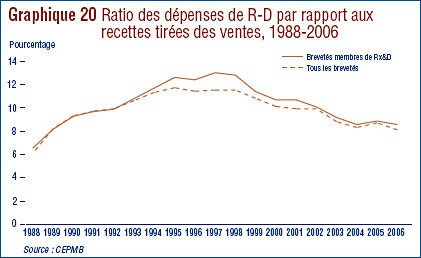
Le tableau 21 à l'annexe 3, à la page 58, affiche les ratios des dépenses de R-D par rapport aux recettes tirées des ventes. Des 72 brevetés ayant soumis des rapports sur leurs dépenses de R-D au CEPMB, 56 (77,7 %) ont présenté pour 2006 un ratio de R-D par rapport aux recettes tirées des ventes de 10 % et moins. Les recettes de ces derniers brevetés représentaient 68,1 % de l'ensemble des recettes tirées des ventes. Le tableau 22 à l'annexe 3, à la page 57, présente une liste de tous les brevetés déclarants et de leurs ratios de dépenses de R-D par rapport aux recettes tirées des ventes.

Dépenses courantes de R-D selon le type de dépenses42
En 2006, les dépenses courantes de R-D ont totalisé 1,159 milliard de dollars, soit 95,8 % de l'ensemble des dépenses de R-D. Les coûts d'acquisition de biens d'équipement et les coûts d'amortissement admissibles représentent respectivement 2,4 % et 1,8 % de l'ensemble des dépenses de R-D.
Dépenses courantes de R-D selon le type de recherche
Le tableau 17 et le graphique 21 ventilent les dépenses courantes de R-D engagées en 2006 selon le type de recherche, à savoir la recherche fondamentale, la recherche appliquée et autres types de recherche admissible. La recherche fondamentale désigne les travaux effectués pour faire avancer les connaissances scientifiques, sans application spécifique en vue. Les brevetés ont fait état de dépenses de recherche fondamentale totalisant 232,4 millions de dollars ou 20,0 % du total des dépenses courantes de RD. La valeur des dépenses dans la recherche fondamentale a augmenté de 8,0 % en 2006 par rapport à l'année précédente.
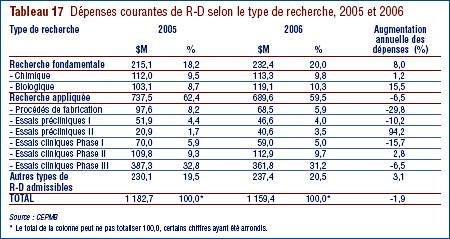
La recherche appliquée vise une application pratique, notamment l'amélioration des procédés de fabrication, les essais précliniques et les essais cliniques. Les brevetés ont déclaré des dépenses dans la recherche appliquée totalisant 689,6 millions de dollars ou, encore, 59,5 % des dépenses courantes de R-D. Les essais cliniques ont accaparé 77,3 % des dépenses de recherche appliquée.
Les dépenses au titre « autres types de R-D admissibles » (qui comprennent les coûts engagés pour la préparation des rapports réglementaires, les études sur la biodisponibilité et la phase IV des essais cliniques) ont représenté en 2006, 20,5 % des dépenses courantes de R-D.
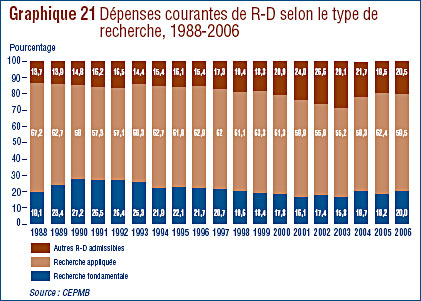
Dépenses courantes de R-D selon le milieu de recherche et la provenance des fonds
Les titulaires de brevets pharmaceutiques peuvent inclure dans leurs dépenses de R-D la recherche qu'ils effectuent eux-mêmes à l'interne ainsi que la recherche qu'ils font effectuer à l'externe, notamment par des universités, des hôpitaux et d'autres sociétés pharmaceutiques. Le tableau 18 révèle qu'un peu plus de la moitié (50,5 % des dépenses courantes de R-D) de la recherche a été effectuée par les brevetés eux-mêmes, ce qui représente une légère baisse par rapport à 2005 (52,6 %). La valeur de la recherche effectuée à l'externe pour le compte des brevetés a augmenté en 2006 pour représenter 22,1 % de l'ensemble des dépenses courantes de R-D. Quant à la recherche effectuée par les universités et par les hôpitaux, sa valeur a représenté 16,2 % des dépenses courantes de R-D.
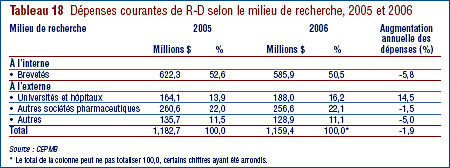
Les brevetés font également rapport de la provenance des fonds ayant servi à financer les dépenses de R-D. Le tableau 19 montre que les brevetés ont financé à même leurs propres fonds presque 87 % de leurs dépenses de R-D.
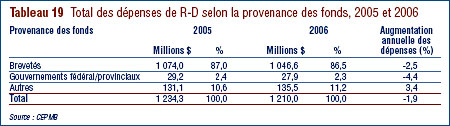
Dépenses courantes de R-D selon la région géographique
Le tableau 20 ventile les dépenses courantes de R-D selon la région dans laquelle elles ont été engagées (Vous trouverez dans le tableau 23 présenté dans l'annexe 3, à la page 61, de plus amples détails sur la distribution des dépenses courantes de R-D entre les provinces et le milieu de recherche). Cette année encore, les dépenses ont été surtout engagées en Ontario et au Québec qui ont accaparé 89,8 % de la valeur totale des dépenses courantes de R-D au Canada. Entre 2005 et 2006, les dépenses de R-D ont diminué dans toutes les régions du pays.
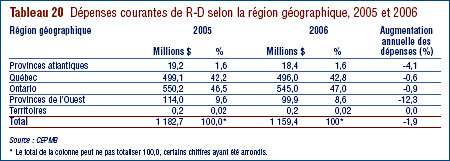
Le contexte mondial
Le graphique 22 compare pour les années 2000 et 2004 les ratios des dépenses de R-D par rapport aux recettes tirées des ventes du Canada aux mêmes ratios des sept pays de comparaison.43 Comme nous l'avons vu, le ratio du Canada était de 10,1 % en 2000. Cette année-là, seule l'Italie présentait un ratio plus bas (6,2%). La Suisse présentait le ratio d'investissements dans la R-D par rapport aux recettes tirées des ventes le plus élevé (102,5 %), suivie de la Suède (44,4 %). La France, l'Allemagne et les États-Unis ont affiché des ratios variant entre 16 et 18 % tandis que le Royaume-Uni présentait un ratio deux fois plus élevé (35,1 %). Une tendance très semblable a été relevée pour 2004. L'Italie présentait alors le ratio le moins élevé (6,6 %), suivi du Canada (8,3 %). Les ratios de tous les autres pays de comparaison étaient cette année-là également de beaucoup supérieurs à notre ratio, même s'ils avaient baissé en Suisse et en Suède.
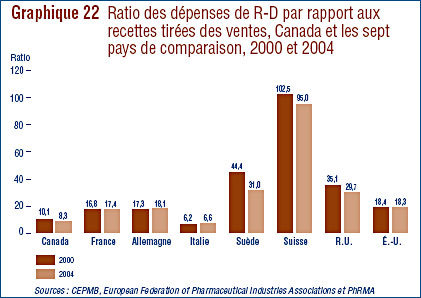
39 Tel que publié dans le Résumé de l'étude d'impact de la réglementation du Règlement sur les médicaments brevetés, 1988, publié dans la Partie II de la Gazette du Canada, Vol. 122, no 20 – SOR/DORS/88-474
40 Le nombre de brevetés qui soumettent leurs rapports au CEPMB varie chaque année.
41 Dans la présente section du rapport sont incluses les recettes tirées des ventes des médicaments pour usage humain ainsi que les recettes tirées des ventes des médicaments pour usage vétérinaire.
42 Les dépenses courantes de R-D comprennent les dépenses autres qu'en capital directement associées à la recherche, dont (a) les salaires, (b) le matériel direct, (c) les honoraires des entrepreneurs et des sous-traitants, (d) autres coûts directs tels que les coûts indirects de production, (e) les paiements aux institutions désignées, (f) les paiements aux organismes subventionnaires et (g) les paiements à d'autres organismes. Ces éléments sont décrits plus en détail dans le formulaire 3 du Guide du breveté qui peut être consulté sur le site Web du CEPMB sous la rubrique « Loi, Règlement et Lignes directrices ».
43 Dans le graphique 22, les ventes s'entendent des ventes au pays et ne comprennent pas les ventes à l'exportation.
Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) a pour mandat de préparer des analyses critiques sur les tendances des prix des médicaments d'ordonnance, sur l'utilisation qui en est faite et sur les coûts engagés pour l'achat de médicaments. Ces analyses fournissent au régime de santé canadien une mine de renseignements sur l'utilisation faite des médicaments d'ordonnance et sur les facteurs d'augmentation des coûts. L'Institut canadien d'information sur la santé (ICIS) et le CEPMB y travaillent en partenariat. Un comité directeur formé de représentants de Santé Canada et des différents régimes publics d'assurance-médicaments a été constitué pour conseiller l'ICIS et le CEPMB en matière d'établissement des bases de données du SNIUMP et d'analyses. Le mandat du SNIUMP compte les deux volets principaux suivants :
- l'élaboration et la mise en oeuvre d'une base de données sur les ordonnances dans laquelle seront colligées les données des différents régimes publics d'assurancemédicaments
- la production d'analyses utilisant les renseignements versés dans cette base de données.
L'ICIS est responsable du premier volet de ce mandat tandis que le CEPMB s'occupe du second.
Le CEPMB a effectué des analyses des tendances des prix des médicaments observées entre 1997-1998 et 2004- 2005. Pour ces analyses, il a utilisé les données sur les médicaments distribués sous ordonnance colligées au niveau du DIN. Ces données lui ont été fournies par huit régimes publics d'assurance-médicaments du pays.
Plus récemment, deux autres documents ont été publiés pour éclairer le processus de prise de décisions.
- Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes d'assurance-médicaments. Ces Lignes directrices présentent la méthodologie d'analyse de l'incidence du prix d'un médicament sur les budgets d'assurancemédicaments ainsi que les normes relatives aux rapports qui doivent être soumis au Programme commun d'examen des médicaments administré par l'Agence canadienne des médicaments et des technologies en santé (ACMTS) ou, encore, aux régimes fédéral, provinciaux ou territoriaux participant au Programme commun d'examen des médicaments.
- L'Observateur des médicaments émergents. Cette publication présente un sommaire de l'information sur les nouveaux médicaments rendus aux dernières phases de la recherche et susceptibles d'avoir une incidence assez marquée sur le plan de la valeur thérapeutique. Les prochaines livraisons de cette nouvelle publication électronique traiteront du développement clinique de médicaments émergents et de leur potentiel. Elles présenteront également des analyses du marché afin d'informer les décideurs de l'incidence que pourraient avoir ces médicaments sur les budgets des régimes d'assurance-médicaments.
Vous trouverez ces études sur notre site Web tout comme la liste des études en cours.
En octobre 2005, les ministres fédéral, provinciaux et territoriaux de la Santé ont annoncé qu'ils avaient convenu de demander au CEPMB de faire un suivi des prix des médicaments non brevetés distribués sous ordonnance. Ainsi, en novembre 2005, le CEPMB a été chargé par le ministre fédéral de la Santé de faire le suivi des prix de ces médicaments et de faire rapport de ses observations.
Jusqu'ici, le CEPMB a publié trois rapports au titre de ce mandat. Le premier rapport qui porte l'intitulé Tendances des prix pratiqués au Canada et dans les pays de comparaison a été publié en juillet 2006. Ce rapport s'est intéressé aux tendances des prix et de la valeur des ventes au Canada et dans les pays de comparaison des médicaments non brevetés distribués sous ordonnance. Le deuxième rapport, celui-là publié en octobre 2006, a pour intitulé Tendances de la valeur des ventes au Canada et structure du marché. On y analyse dans ce rapport les taux de croissance annuelle des ventes, les sources de cette croissance, les parts de marché, la concentration des ventes et les comparaisons des prix pratiqués dans les différents pays selon leur niveau de concentration. En juin 2007, le CEPMB publiera le troisième rapport de cette série qui porte l'intitulé Marché des médicaments dont le brevet est récemment arrivé à échéance. Ce rapport passe en revue les médicaments de marque dont le brevet est arrivé à échéance entre 2001 et 2003 et observe le délai d'émergence des médicaments génériques sur le marché. Les rapports sont affichés sur notre site Web sous « Mandat de rapport; Suivi et rapport des prix des médicaments d'ordonnance non brevetés ».
Le quatrième rapport, attendu au cours de l'été, s'intéressera aux tendances des prix des médicaments non brevetés distribués sous ordonnance au Canada et dans d'autres pays par une source exclusive. L'analyse couvrira des sujets tels que les nouvelles tendances de la valeur des ventes et des prix, les comparaisons des prix internationaux et les facteurs déterminant l'introduction d'un médicament sur le marché canadien en utilisant pour ce faire une analyse à plusieurs variables.
Par la suite, le CEPMB publiera chaque année des mises à jour de ces quatre rapports.
Le 31 décembre 2005, les modifications proposées au Règlement sur les médicaments brevetés ont été publiées dans la Partie I de la Gazette du Canada. Suite à cette publication, le Conseil a reçu de nombreux mémoires et a pris connaissance de leur contenu. Le Conseil a par la suite chargé le personnel du Conseil de réviser le document destiné au ministre de la Santé afin qu'il puisse le soumettre à son approbation au cours de l'automne.
Alors que ce document révisé en était à l'étape de la finalisation aux fins de présentation au Comité du Cabinet du Conseil du Trésor, le personnel du Conseil a rencontré en février et en mars 2007 des représentants de Rx&D, de l'Association canadienne du médicament générique et de BIOTECanada et discuté avec eux de la mise en oeuvre des modifications proposées. Les discussions ont entre autres porté sur la révision des différents formulaires de rapport que les brevetés sont tenus de remplir. Dans le cours de ces rencontres, des représentants de l'industrie ont exprimé certaines préoccupations concernant certaines des modifications proposées du fait que leur mise en oeuvre causerait une augmentation de leur charge de travail pour se conformer au Règlement. Le Conseil a donc chargé le personnel de réviser à nouveau le projet de modifications aux fins d'approbation du Ministre de la santé. Les documents pertinents seront alors soumis au Comité du Cabinet du Conseil du Trésor pour publication du Règlement modifié dans la Partie II de la Gazette du Canada.
Dès l'entrée en vigueur du nouveau règlement modifié, le Conseil informera les brevetés des nouvelles exigences en matière de rapport. Les formulaires révisés seront également affichés sur notre site Web.
En 2006, le Conseil a engagé une vaste initiative par laquelle il a consulté ses intervenants concernant les modifications qu'il envisage apporter à ses Lignes directrices sur les prix excessifs afin qu'elles continuent :
- de faciliter l'examen des prix des médicaments brevetés par le personnel du Conseil
- d'encourager la conformité volontaire des brevetés de manière à ce qu'ils ne vendent pas leurs médicaments breveté à des prix excessifs au Canada.
La publication en mai 2006 du Guide de discussion aux fins de la consultation sur les Lignes directrices du Conseil sur les prix excessifs (Guide) a constitué la première étape de cette initiative. Le Guide a invité les intervenants à exprimer leurs points de vue concernant les trois sujets suivants : le classement des nouveaux médicaments, les tests appliqués au prix de lancement et l'interprétation aux fins de l'examen du prix de l'expression « sur un marché » mentionnée dans la Loi sur les brevets. Au total, le Conseil a reçu 45 mémoires dans lesquels des intervenants et des groupes d'intervenants ont exprimé différents points de vue concernant les Lignes directrices : brevetés, représentants d'associations de patients et de fournisseurs de soins de santé, de régimes publics et privés d'assurance-médicaments, membres du Groupe consultatif sur les médicaments pour usage humain, chercheurs en milieu universitaire et experts-conseils.
En novembre 2006, le Conseil a convié environ 140 de ses intervenants à une des séances de discussion tenues à Edmonton, Montréal, Toronto, Halifax et Ottawa. Les participants ont discuté du classement des médicaments dans les catégories, de l'interprétation de l'expression « sur un marché », ainsi que de deux nouveaux sujets, à savoir la révision du prix de référence et les principes qui pourraient guider l'application des facteurs de fixation des prix mentionnés dans la Loi au processus d'examen du prix. (Vous trouverez le Guide et les sommaires des discussions sur le site Web du CEPMB à l'adresse : www.pmprb-cepmb.gc.ca/consultationswww.pmprbcepmb. gc.ca/consultations.)
Les Lignes directrices cherchent à rendre le processus d'examen du prix encore plus transparent et plus prévisible pour les intervenants. Le Conseil reconnaît que l'environnement pharmaceutique a beaucoup changé depuis 1994, année de la dernière révision en profondeur des Lignes directrices sur les prix excessifs, et qu'il importe aujourd'hui de s'assurer que les Lignes directrices sont aujourd'hui encore justes et pertinentes. Il faut également reconnaître que les Lignes directrices ont jusqu'ici bien réussi à encourager la conformité volontaire en amenant les brevetés à ne pas vendre leurs médicaments à des prix excessifs. À l'heure actuelle, plus de 1 100 médicaments brevetés sont assujettis à la compétence du Conseil en matière d'examen du prix. Même s'il a dû émettre des Avis d'audience et si plusieurs enquêtes sur des prix excessifs ont été engagées en 2006, le taux de conformité des médicaments brevetés aux Lignes directrices est quand même très élevé, se situant à plus de 90 %.
Le Conseil se propose de poursuivre son analyse en 2007. Dans leur forme actuelle, les Lignes directrices ne traitent pas de tous les facteurs mentionnés dans la Loi et dont le Conseil doit tenir compte au moment de déterminer si le prix d'un médicament breveté est ou non excessif. Par exemple, les Lignes directrices sont muettes concernant l'examen de la deuxième partie de l'alinéa 85(1)(c) « le prix de vente du médicament et d'autres médicaments de la même catégorie thérapeutique à l'étranger ».
Les Lignes directrices ne traitent pas non plus de l'application du paragraphe 85(2) – « Si, après avoir tenu compte de ces facteurs, il est incapable de décider si le prix d'un médicament vendu sur un marché canadien est excessif, le Conseil peut tenir compte des facteurs suivants : a) les coûts de réalisation et de mise en marché; b) tous les autres facteurs précisés par les règlements d'application du présent paragraphe ou qu'il estime pertinents. » Les Lignes directrices actuelles ne donnent aucune indication de ce qu'il faut faire lorsqu'il n'est pas possible, en vertu du paragraphe 85(1), de déterminer si le prix d'un médicament est ou non excessif, sur la façon d'évaluer les coûts de fabrication et de commercialisation du médicament et autres facteurs pertinents.
Ces lacunes se sont imposées à l'examen des Lignes directrices dans leur forme actuelle. Tel que l'a annoncé La Nouvelle dans sa livraison d'avril 2007, le Conseil planifie tenir des consultations bilatérales avec des groupes représentant les différents secteurs de l'industrie pharmaceutique, les gouvernements fédéral, provinciaux et territoriaux et les consommateurs. Ce processus devrait s'enclencher au cours de l'été 2007.
Conscient que cette première révision importante des Lignes directrices depuis 1994 peut être source d'incertitude chez les brevetés et chez les intervenants en ce qui a trait au futur processus d'examen du prix, le Conseil a l'intention de continuer de communiquer avec eux par le truchement de La Nouvelle, de son site Web et d'autres médias, selon le cas.
PROGRAMME DE COMMUNICATION
Notre programme de communication est en fait un cadre de gestion des principaux volets de notre stratégie et de nos pratiques. Par le truchement de ce programme, le CEPMB communique aux ministères, aux intervenants et au secteur pharmaceutique de l'information pertinente dans l'espoir de les amener à prendre les mesures les plus appropriées possible, selon les circonstances. Il fournit à l'interne des conseils en matière de communication et d'élaboration des stratégies et éclaire les décisions qui doivent être prises. Le Conseil cherche à maximiser l'efficacité de ses communications par l'échange de données et par le réseautage.
Le Programme de communication s'occupe entre autres de l'élaboration et de l'application des politiques, des plans et des activités du CEPMB. Il est axé sur le rendement de manière à ce que l'information communiquée soit complète, bien ciblée, claire et logique. Comme le prévoit la politique de communication du gouvernement du Canada et ses lignes directrices, le CEPMB répond aux demandes d'information du grand public et rend compte de la gestion de ses activités de communication, y compris de ses relations avec les médias.
Notre programme de communication est constamment appelé à s'adapter aux nouvelles exigences de l'environnement dans lequel évolue le CEPMB. À cette fin, il est constamment à l'affût de nouvelles façons de communiquer l'information sur différents sujets qui intéressent la population canadienne. De fait, le CEPMB ne ménage aucun effort pour que ses activités de communication à valeur ajoutée permettent au CEPMB d'atteindre ses objectifs.
En 2006, afin d'améliorer nos communications avec les intervenants, nous avons complètement révisé notre site Web pour le rendre conforme aux normes du gouvernement, mais surtout plus informatif et plus convivial.
Au titre de son programme de communication, le CEPMB publie le feuillet d'information trimestriel La Nouvelle, coordonne la publication des rapports d'étude préparés au titre du SNIUMP, compile des statistiques sur la fréquentation de notre site Web afin de mieux évaluer les besoins d'information des visiteurs et répond aux demandes de renseignements de ses intervenants. Le CEPMB se rend également plus facilement accessible au moyen de sa ligne d'interurbains sans frais.
Le CEPMB se fait un devoir de donner suite à l'engagement qu'il a pris auprès de ses intervenants en facilitant la communication et l'échange d'informations. Les éléments fondamentaux de notre Programme de communication demeurent la transparence, l'intégrité et l'accessibilité.
PUBLICATIONS
Le CEPMB tient ses intervenants informés à l'aide de ses publications. Certaines publications, entre autres le rapport annuel et La Nouvelle, sont publiées à intervalles réguliers alors que d'autres sont publiées aux fins d'un programme ou pour les besoins de l'organisation.
| Publications |
|
Janvier 2006 – Mai 2007
|
Date de publication
|
|
Rapport annuel
|
Juin
|
| La Nouvelle |
Publication trimestrielle |
| Études |
| |
SNIUMP
Rapport sommaire sur les tendances des prix des médicaments – 1997-1998 à 2003-2004
|
Juin 2006
|
| Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes d'assurance-médicaments |
Mai 2007 |
| L'Observateur des médicaments émergents (Rapport publié exclusivement sur notre site Web) |
Juin 2007 |
| Rapports sur les médicaments non brevetés distribués sous ordonnance |
| |
Tendances des prix pratiqués au Canada et dans les pays de comparaison |
Juin 2006 |
| Tendances de la valeur des ventes au Canada et structure du marché |
Octobre 2006 |
| Marché des médicaments dont le brevet est récemment arrivé à échéance |
Juin 2007 |
| Audiences |
| |
Nicoderm – Hoechst Marion Roussel Canada Inc.
|
1999
|
| Adderall XR, Shire BioChem Inc. |
2006 (en cours) 18 déc. 2006 : Décision rendue relativement à la requête de Shire concernant un brevet en instance |
| Airomir, 3M Canada Company |
2006 (voir Engagements, page 15) |
| Concerta, Janssen-Ortho Inc. |
2006 (en cours) |
| Copaxone, Teva Neuroscience G.P.-S.E.N.C. |
2006 (en cours) |
| Dovobet, LEO Pharma Inc. |
2006 (en cours) |
| Penlac Nail Lacquer, sanofi-aventis Canada Inc. |
2007 (en cours) |
| Pentacel and Quadracel, sanofi pasteur Limited |
2007 (en cours) |
| Risperdal Consta, Janssen-Ortho Inc. |
2006 (en cours) |
| Strattera, Eli Lilly Canada Inc. |
2007 (en cours) |
| Médicaments brevetés |
| |
Médicaments brevetés ayant fait l'objet d'un rapport au CEPMB en 2006 (avec mention du statut de l'examen) |
Mise à jour mensuelle sur notre site Web |
| Rapports sur les nouveaux médicaments brevetés |
| |
Agenerase, GlaxoSmithKline Inc. |
Février 2006 |
| Angiomax, Oryx Pharmaceuticals |
Mars 2006 |
| Avastin, Hoffmann-La Roche Limited, Canada |
Janvier 2006 |
| Cancidas, Merck Frosst Canada |
Mai 2006 |
| Cipralex, Lundbeck Canada Inc. |
Juillet 2006 |
| Elidel, Novaris Pharmaceuticals Canada Inc. |
Juin 2006 |
| Erbitux, Bristol-Myers Squibb Canada Inc |
Juillet 2006 |
| Fuzeon, Hoffman-La Roche Limited, Canada |
Octobre 2006 |
| Invanz, Merck Frosst Canada & Co. |
Octobre 2006 |
| Keppra, Lundbeck Canada Inc. |
Mars 2006 |
| Ketek, sanofi-aventis Canada Inc. |
Octobre 2006 |
| Levitra, Bayer Inc. |
Mars 2006 |
| Lyrica, Pfizer Canada Inc. |
Janvier 2007 |
| Macugen, Pfizer Canada Inc. |
Avril 2007 |
| Remodulin, Northern Therapeutics Inc. |
Juin 2006 |
| Reyataz, Bristol-Myers Squibb Canada Inc. |
Septembre 2006 |
| Sativex, Bayer Inc. |
Novembre 2006 |
| Sensipar, Amgen Canada Inc. |
Janvier 2006 |
| Solagé, Barrier Therapeutics Canada Inc. |
Mars 2006 |
| Somavert, Pfizer Canada Inc. |
Novembre 2006 |
| Sutent, Pfizer Canada Inc. |
Avril 2007 |
| Tarceva, Hoffman-La Roche Limited, Canada |
Juillet 2006 |
| TNKase, Hoffman-La Roche Limited, Canada |
Octobre 2006 |
| Tramacet, Janssen-Ortho Inc. |
Février 2006 |
| Vfend, Pfizer Canada Inc. |
Octobre 2006 |
| Xolair, Novartis Pharmaceuticals Canada Inc. |
Février 2006 |
| Zelnorm, Novartis Pharma Canada Inc. |
Mars 2006 |
| Discours |
| |
L'envers du décor : innocuité et accessibilité financière des médicaments
par Barbara Ouellet, au Drug Safety Summit 2006, Toronto |
Février 2006 |
Gestion des produits pharmaceutiques et contrôle de leurs prix au Canada
par Barbara Ouellet, au North American Pharma Summit, Toronto |
Mars 2006 |
Summit on Pharmaceutical & Biotech Regulatory Compliance
par Barbara Ouellet |
Mars 2007 |
Comité permanent de la santé – Budget principal des dépenses
par le président du Conseil |
Mars 2007 |
| Engagements de conformité volontaire |
| |
NuvaRingTM , Organon Canada Ltée |
Juin 2006 |
| Eloxatin, sanofi-aventis Canada Inc. |
Juillet 2006 |
| Hextend, Hospira Healthcare Corporation |
Juillet 2006 |
| Airomir, 3M Canada Company |
Mars 2007 |
Le glossaire qui suit a été préparé dans le but de faciliter votre compréhension. Vous pourrez obtenir de plus amples explications et des définitions dans les documents suivants : Loi sur les brevets, Règlement sur les médicaments brevetés, Compendium des Lignes directrices, politiques et procédures du CEPMB et Règlement sur les aliments et drogues ou, encore, en communiquant directement avec le CEPMB.
ATC
Système de classification Anatomique, Thérapeutique, Chimique (ATC) conçu et tenu à jour par le Collaborating Centre for Drug Statistics Methodology de l'Organisation mondiale de la santé (OMS). Ce système distingue les médicaments selon leur site d'action et leurs caractéristiques thérapeutiques et chimiques. Le CEPMB utilise ce système pour sélectionner les médicaments de comparaison aux fins de l'examen du prix.
Avis de conformité
Avis donné par la Direction générale des produits de santé et des aliments de Santé Canada en vertu de l'article C.08.004 du Règlement sur les aliments et drogues. Cet avis confirme que le médicament respecte les normes prescrites par Santé Canada pour une administration à des humains ou à des animaux et que sa vente est autorisée au Canada.
Brevet
Instrument émis par le Commissaire aux brevets sous forme de lettres patentes conférant à son titulaire un monopole pour une période limitée pour les allégations formulées. Le brevet donne à son titulaire et à ses représentants légaux le droit exclusif de fabriquer, de construire, d'exploiter ou de vendre son invention.
Brevet en instance
Demande pour un brevet qui n'a pas encore été attribué.
Nota : En ce qui concerne les médicaments vendus avant d'avoir obtenu un brevet, la politique du Conseil est d'attendre que le médicament soit breveté avant de faire l'examen de son prix. L'examen est alors rétroactif à la date à laquelle la demande de brevet a été portée à la connaissance du public pour inspection. (Voir Bulletin du CEPMB no 15, page 7.)
Breveté
Aux termes du paragraphe 79(1) de la Loi sur les brevets, le mot « breveté » désigne « la personne ayant droit aux retombées d'un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d'un brevet pour une telle invention ou qui exerce ou a exercé les droits d'un titulaire dans un cadre autre qu'une licence prorogée en vertu du paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur le brevets ».
Certificat de décision préalable
Certificat révocable émis à la demande du breveté en vertu de l'article 98(4) de la Loi sur les brevets lorsque le Conseil estime que le prix pratiqué ou proposé du médicament n'est pas supérieur au prix maximal non excessif qu'autorisent ses Lignes directrices.
Cession de brevet
Avis donné par le breveté au Commissaire aux brevets l'informant qu'il renonce irrévocablement à ses droits de propriété à l'égard du brevet en cause et qu'il les cède au domaine public.
Nota : Depuis le 30 janvier 1995, le Conseil ne reconnaît pas la cession d'un brevet lorsque le breveté utilise cette mesure pour se soustraire à sa compétence. (Voir le Bulletin no 17 du CEPMB, à la page 3)
Dépenses courantes de recherche et développement
Désigne les dépenses autres qu'en capital directement liées à la recherche, dont : (a) salaires, (b) matériel direct, (c) entrepreneurs et sous-traitants, (d) coûts directement associés aux frais indirects de production, (e) paiements aux institutions désignées, (f) paiements aux organismes subventionnaires et (g) paiements aux autres organismes. Ces éléments sont décrits plus amplement dans le formulaire 3 du Guide du breveté disponible sur notre site Web sous « Loi, Règlement et Lignes directrices ».
Dépenses de recherchedéveloppement
Aux termes du Règlement sur les médicaments brevetés, 1994, et plus particulièrement de ses articles 5 et 6, la recherche-développement s'entend des activités qui auraient été considérées admissibles au crédit d'impôt à l'investissement pour la recherche scientifique et le développement expérimental en vertu de la Loi de l'impôt sur le revenu dans sa version du 1er décembre 1987.
Drogue de recherche
Médicament dont l'utilisation a été autorisée par Santé Canada aux fins d'une évaluation clinique (à savoir des essais sur les humains), mais dont la vente pour l'indication sous examen n'est pas encore autorisée.
Engagement de conformité volontaire
Engagement écrit pris par le breveté de baisser le prix de son médicament pour le rendre conforme aux Lignes directrices du CEPMB sur les prix excessifs (voir chapitre 1 du Compendium des Lignes directrices, Politiques et procédures). La politique de conformité et d'application (voir chapitre 2, section 7) prévoit que le Président peut, plutôt que d'émettre un avis d'audience, approuver un engagement conforme aux exigences de la Loi sur les brevets et aux politiques du Conseil et servant les intérêts du grand public. La politique du Conseil sur la conformité et l'application autorise la présentation d'un engagement de conformité après la publication d'un avis d'audience. L'engagement soumis à ce point requiert l'aval du Conseil dans son ensemble. Le Conseil publie tous les engagements approuvés par le Président ou par le Conseil.
Indice des prix des médicaments brevetés (IPMB)
Indice établi par le CEPMB pour mesurer la variation annuelle des prix de transaction des médicaments brevetés vendus au Canada. Cet indice est établi à partir des données sur les prix et sur les ventes déclarées par les brevetés.
Ingrédient actif
Substance chimique ou biologique responsable de l'effet pharmacologique d'un produit médicamenteux.
Licence obligatoire
Licence émise avant le 20 décembre 1991 par le Commissaire aux brevets et qui permet à son titulaire d'importer, de fabriquer, d'utiliser ou de vendre une invention brevetée liée à un médicament. La licence, dont il est fait mention au paragraphe 79(1) de la Loi sur les brevets, est accordée en vertu du paragraphe 39(4) de la Loi sur les brevets, S.R., 1985 c. P-4 repris dans le paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets. Le montant des redevances que le titulaire de la licence doit verser au breveté est déterminé par le Commissaire aux brevets qui établit les conditions des licences en vertu du paragraphe 39(5) de la Loi sur les brevets.
Licence volontaire
Engagement contractuel entre un breveté et un titulaire de licence permettant à ce dernier de bénéficier des retombées d'un brevet ou d'exercer des droits à l'égard de celui-ci moyennant une contrepartie financière (comme, par ex., redevances sous forme de pourcentage des recettes tirées de ses ventes).
Médicament
Toute substance ou tout mélange de substances produites biologiquement, chimiquement ou autrement qui est appliqué ou administré in vivo pour faciliter le diagnostic, le traitement, l'atténuation ou la prévention d'une maladie, de symptômes, de troubles ou d'états physiques anormaux ou, encore, pour modifier des fonctions organiques chez les humains et chez les animaux. Cette définition comprend les vaccins, les préparations topiques, les anesthésiques et les produits diagnostics in vivo quel que soit le mode d'administration (par ex. préparations transdermiques, gélules, solutions injectables, solutions pour inhalation, etc.). Cette définition exclut les appareils médicaux, les produits diagnostiques in vitro et les désinfectants qui ne sont pas utilisés in vivo. (Voir le Compendium des Lignes directrices, politiques et procédures, Introduction, paragraphe 1.5.)
Numéro d'identification de drogue (DIN)
Numéro d'identification que la Direction générale de la protection de la santé de Santé Canada attribue à chaque médicament vendu sous ou sans ordonnance et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN est assigné en tenant compte des éléments suivants : le fabricant du produit, le ou les ingrédients actifs, la concentration de ou des ingrédients actifs, la forme posologique, le nom de marque du produit et son mode d'administration.
Produit générique
Produit médicamenteux contenant le même ingrédient actif, la même concentration et la même forme posologique que son équivalent de marque.
Produit médicamenteux
Présentation d'un médicament qui se distingue par sa forme pharmaceutique et la concentration de son ingrédient actif.
Produit médicamenteux existant
Tout médicament breveté (DIN) pour lequel un prix de référence a été fixé conformément aux Lignes directrices du Conseil. (Voir le chapitre 1, paragraphe 3.3 du Compendium des Lignes directrices, politiques et procédures).
Produit médicamenteux nouveau
Nouveau médicament dont le prix de lancement est sous examen. Les médicaments brevetés sont considérés nouveaux l'année au cours de laquelle ils sont lancés sur le marché canadien ou, encore, l'année où leur premier brevet leur a été attribué s'ils étaient déjà offerts sur le marché canadien. Aux fins de l'examen du prix, les produits médicamenteux nouveaux pour une année donnée sont ceux qui ont été lancés sur le marché entre le 1er décembre de l'année précédant l'année de rapport et le 30 novembre suivant. En raison des dates limites de présentation des rapports en vertu du Règlement sur les médicaments brevetés et le mode de calcul des prix de référence, les produits médicamenteux lancés sur le marché canadien en décembre d'une année sont comptabilisés dans l'année suivante. (Voir le chapitre 1, paragraphe 3.2 du Compendium des Lignes directrices, politiques et procédures).
Programme de médicaments d'urgence
Voir ci-après « Programme spécial d'accès ».
Programme spécial d'accès
Programme en vertu duquel Santé Canada autorise la vente à des médecins de médicaments n'ayant pas encore reçu l'avis de conformité et qui ne seraient autrement pas disponibles sur le marché canadien. (Auparavant appelé Programme de médicaments d'urgence)
Recherche et développement (R-D)
Recherche fondamentale ou appliquée visant à créer de nouveaux matériaux, dispositifs, produits ou procédés ou à améliorer ceux qui existent (par ex. procédés de fabrication).
Recherche et développement - recherche appliquée
Travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris avec une application pratique en vue. Ils peuvent viser à créer de nouveaux produits ou procédés, à améliorer ceux qui existent à l'aide de procédés de fabrication ou, encore, d'études précliniques et cliniques.
Recherche et développement - recherche fondamentale
Travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris sans aucune application pratique en vue.
Recherche et développement - recherche clinique
Évaluation des effets d'un nouveau médicament sur les humains. Cette évaluation comporte généralement trois phases successives, commençant par des test limités d'innocuité du médicament chez les humains en santé suivis de tests plus poussés portant sur l'innocuité et l'efficacité chez les sujets atteints de la maladie correspondant à l'indication principale du médicament.
Recherche et développement - recherche préclinique
Tests menés sur des animaux afin d'évaluer les effets pharmacologiques et toxicologiques des médicaments.
Recherche et développement - autres R-D admissibles
Comprend les dépenses de recherchedéveloppement qui ne correspondent à aucune des catégories de R-D susmentionnées. Elle comprend les présentations sur la réglementation des médicaments, les études de biodisponibilité ainsi que les essais cliniques de Phase IV.
Un prix est considéré conforme aux Lignes directrices dans la mesure où aucun critère ne justifie une enquête. Les critères correspondent aux normes qu'applique le Conseil pour utiliser de la façon la plus efficiente possible les ressources dont il dispose pour les enquêtes. L'existence de ces critères ne sous-tend pas que le Conseil tolère les écarts à ses Lignes directrices. Le Conseil estime que ses critères permettent de reconnaître et de soumettre à une enquête tous les cas importants de prix non conformes à ses Lignes directrices. Dans la plupart des cas, lorsque le prix d'un médicament dépasse le prix maximal autorisé d'un montant trop minime pour justifier une enquête, le breveté est appelé à remettre les recettes excessives encaissées en offrant l'année suivante son médicament à un prix inférieur au montant maximal autorisé. Le Conseil s'attend à ce que les prix de tous les médicaments brevetés soient conformes à ses Lignes directrices et tout élément de preuve démontrant que le prix d'un médicament se maintient au-delà de ce que permettent ses Lignes directrices, ne serait-ce que d'un petit montant, peut justifier la tenue d'une enquête.
Le personnel du Conseil ouvre une enquête sur le prix d'un médicament breveté lorsque l'une ou l'autre des conditions suivantes est remplie :
Nouveaux médicaments brevetés
- le prix de lancement dépasse d'au moins 5 % le prix maximal jugé non excessif
- les recettes excessives tirées de la vente du médicament à un prix excessif au cours de la période de lancement totalisent 25 000 $ ou plus
- la réception de plaintes fondées.
Médicaments brevetés existants
- le prix dépasse d'au moins 5 % le prix maximal jugé non excessif et les recettes excessives tirées de la vente du médicament à un prix excessif au cours de toute la durée du brevet à compter du 1er janvier 1992 sont égales ou supérieures à 25 000 $
- les recettes excessives encaissées tout au cours de la durée du brevet à compter du 1er janvier 1992 sont égales ou supérieures à 50 000 $
- la réception de plaintes fondées.
Vous trouverez de plus amples renseignements sur les critères qui justifient la tenue d'une enquête à l'appendice 5 du Compendium des Lignes directrices, politiques et procédures. Le Compendium est affiché sur le site Web du CEPMB sous la rubrique « Loi, Règlement et Lignes directrices ».
| NOM DE MARQUE |
BREVETÉ |
DIN |
NSA1/PBA2 |
ATC3 |
STATUT |
CATÉGORIE |
| Actonel Plus Calcium, comprimé de 35 mg/500 mg |
Proctor & Gamble Pharmaceuticals Canada Inc. |
02279657 |
|
M |
Conforme aux Lignes directrices |
3 |
| Advate 250 unit/vial |
Baxter Corporation |
02284138 |
|
B |
Conforme aux Lignes directrices |
1 |
| Advate 500 unit/vial |
Baxter Corporation |
02284146 |
|
B |
Conforme aux Lignes directrices |
1 |
| Advate 1000 unit/vial |
Baxter Corporation |
02284154 |
|
B |
Conforme aux Lignes directrices |
1 |
| Advate 1500 unit/vial |
Baxter Corporation |
02284162 |
|
B |
Conforme aux Lignes directrices |
1 |
| Advicor 500/20, comprimé de 520 mg |
Oryx Pharmaceuticals Inc. |
02270439 |
|
C |
Conforme aux Lignes directrices |
3 |
| Advicor 1000/20, comprimé de 1020 mg |
Oryx Pharmaceuticals Inc. |
02270447 |
|
C |
Conforme aux Lignes directrices |
3 |
| Altace, gélule de 15 mg |
sanofi-aventis Canada Inc. |
02281112 |
|
C |
Conforme aux Lignes directrices |
1 |
| Altace HCT, comprimé de 15 mg |
sanofi-aventis Canada Inc. |
02283131 |
|
C |
Conforme aux Lignes directrices |
3 |
| Altace HCT, comprimé de 17,5 mg |
sanofi-aventis Canada Inc. |
02283158 |
|
C |
Conforme aux Lignes directrices |
3 |
| Altace HCT, comprimé de 22,5 mg |
sanofi-aventis Canada Inc. |
02283166 |
|
C |
Conforme aux Lignes directrices |
3 |
| Altace HCT, comprimé de 30 mg |
sanofi-aventis Canada Inc. |
02283174 |
|
C |
Conforme aux Lignes directrices |
3 |
| Altace HCT, comprimé de 35 mg |
sanofi-aventis Canada Inc. |
02283182 |
|
C |
Conforme aux Lignes directrices |
3 |
| Alvesco, dose de 100 mcg |
Altana Pharma Inc. |
02285606 |
NSA |
R |
Sous examen |
|
| Alvesco, dose de 200 mcg |
Altana Pharma Inc. |
02285614 |
NSA |
R |
Sous examen |
|
| Andriol, gélule de 40 mg |
Organon Canada Ltée (AKZO) |
00782327 |
PBA |
G |
Sous examen |
|
| Aptivus, gélule de 250 mg |
Boehringer Ingelheim (Canada) Ltd. |
02273322 |
NSA/PBA |
J |
Conforme aux Lignes directrices |
3 |
| Arava, comprimé de 10 mg |
sanofi-aventis Canada Inc. |
02241888 |
NSA/PBA |
L |
Sous examen |
|
| Arava, comprimé de 20 mg |
sanofi-aventis Canada Inc. |
02241889 |
NSA/PBA |
L |
Sous examen |
|
| Aricept RDT, comprimé de 5 mg |
Pfizer Canada Inc. |
02269457 |
|
N |
Conforme aux Lignes directrices |
1 |
| Aricept RDT, comprimé de 10 mg |
Pfizer Canada Inc. |
02269465 |
|
N |
Conforme aux Lignes directrices |
1 |
| Avalide 300/25, comprimé de 325 mg |
Bristol-Myers Squibb Canada Co. |
02280213 |
|
C |
Conforme aux Lignes directrices |
1 |
| Avandaryl 4/1, comprimé de 5 mg |
GlaxoSmithKline Inc. |
02258781 |
|
A |
Sous examen |
|
| Avandaryl 4/2, comprimé de 6 mg |
GlaxoSmithKline Inc. |
02258803 |
|
A |
Sous examen |
|
| Avandaryl 4/4, comprimé de 8 mg |
GlaxoSmithKline Inc. |
02258811 |
|
A |
Sous examen |
|
| Azilect, comprimé de 0,5 mg |
Teva Neuroscience |
02284642 |
NSA |
N |
Sous enquête |
|
| Azilect, comprimé de 1 mg |
Teva Neuroscience |
02284650 |
NSA |
N |
Sous enquête |
|
| Baraclude, 0,05 mg/ml |
Bristol-Myers Squibb Canada Co. |
02282232 |
NSA |
J |
Conforme aux Lignes directrices |
3 |
| Baraclude, comprimé de 0,5 mg |
Bristol-Myers Squibb Canada Co. |
02282224 |
NSA |
J |
Conforme aux Lignes directrices |
3 |
| Caduet 10/10, comprimé de 20 mg |
Pfizer Canada Inc. |
02273284 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 10/20, comprimé de 30 mg |
Pfizer Canada Inc. |
02273292 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 10/40, comprimé de 50 mg |
Pfizer Canada Inc. |
02273306 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 10/80, comprimé de 90 mg |
Pfizer Canada Inc. |
02273314 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 10/20, comprimé de 30 mg |
Pfizer Canada Inc. |
02273233 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 5/20, comprimé de 25 mg |
Pfizer Canada Inc. |
02273241 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 5/40, comprimé de 45 mg |
Pfizer Canada Inc. |
02273268 |
|
C |
Conforme aux Lignes directrices |
3 |
| Caduet 5/80, comprimé de 85 mg |
Pfizer Canada Inc. |
02273276 |
|
C |
Conforme aux Lignes directrices |
3 |
| Clobex Lotion, 0,5 mg/ml |
Galderma Canada Inc. |
02256398 |
|
D |
Conforme aux Lignes directrices |
1 |
| Cubicin, fiole de 500 mg |
Oryx Pharmaceuticals Inc. |
|
NSA |
J |
Sous examen |
|
| DDAVP Melt, comprimé de 60 mcg |
Ferring Pharmaceuticals Inc. |
02284995 |
|
H |
Sous enquête |
|
| DDAVP Melt, comprimé de 120 mcg |
Ferring Pharmaceuticals Inc. |
02285002 |
|
H |
Sous enquête |
|
| Denavir, 10 mg/gm |
Barrier Therapeutics Canada Inc. |
02238848 |
NSA |
D |
Sous examen |
|
| Diastat, 5 mg/ml |
Shire BioChem Inc. |
02238162 |
PBA |
N |
Sous examen |
|
| Duo Trav, .04/5 5.04 mg/ml |
Alcon Canada Inc. |
02278251 |
|
S |
Conforme aux Lignes directrices |
3 |
| Enablex, comprimé de 7,5 mg |
Novartis Pharma Canada Ltd. |
02273217 |
NSA |
G |
Conforme aux Lignes directrices |
3 |
| Enablex, comprimé de 15 mg |
Novartis Pharma Canada Ltd. |
02273225 |
NSA |
G |
Conforme aux Lignes directrices |
3 |
| Enbrel, seringue de 50 mg |
Amgen Canada Inc. |
02274728 |
|
L |
Sous enquête |
|
| Exjade, comprimé de 125 mg |
Novartis Pharma Canada Ltd. |
02287420 |
NSA |
V |
Sous examen |
|
| Exjade, comprimé de 250 mg |
Novartis Pharma Canada Ltd. |
02287439 |
NSA |
V |
Sous examen |
|
| Exjade, comprimé de 500 mg |
Novartis Pharma Canada Ltd. |
02287447 |
NSA |
V |
Sous examen |
|
Les Lignes directrices du Conseil établissement trois catégories de nouveaux produits médicamenteux brevetés aux fins de l'examen du prix de lancement.
- Catégorie 1 – nouveau DIN d'une forme pharmaceutique existante d'un médicament existant ou un nouveau DIN d'une autre forme pharmaceutique du médicament comparable à la forme pharmaceutique existante, habituellement une nouvelle concentration d'un médicament existant (extension d'une gamme de produits pharmaceutiques)
- Catégorie 2 – premier produit médicamenteux mis au point pour traiter une condition ou qui constitue une amélioration importante par rapport aux médicaments existants. Les médicaments de cette catégorie sont souvent qualifiés de « découverte » ou d' « amélioration importante ».
- Catégorie 3 – nouveau DIN, nouveau médicament ou nouvelle forme pharmaceutique d'un médicament existant qui procure tout au plus des bienfaits modestes ou minimes par rapport aux médicaments existants.
Vous trouverez les définitions complètes de ces catégories dans le Compendium des Lignes directrices, politiques et procédures du CEPMB (chapitre 3, section 3).
- NSA : Nouvelle substance active
- PBA : Premier brevet attribué
- ATC : Classification anatomique, thérapeutique, chimique
| NOM DE MARQUE |
BREVETÉ |
DIN |
NSA1/PBA2 |
ATC3 |
STATUT |
CATÉGORIE |
| Faslodex, seringue de 250 mg |
AstraZeneca Canada Inc. |
02248624 |
NSA |
L |
Sous enquête |
|
| Flomax CR, comprimé de 0,4 mg |
Boehringer Ingelheim (Canada) Ltée |
02270102 |
|
G |
Conforme aux Lignes directrices |
1 |
| Fosavance, comprimé de 70 mg |
Merck Frosst Canada Ltd. |
02276429 |
|
M |
Conforme aux Lignes directrices |
3 |
| Fuzeon, fiole de 108 mg |
Hoffmann-La Roche Ltd. Canada |
02247725 |
NSA/ PBA |
J |
Conforme aux Lignes directrices |
2 |
| Gardasil, comprimé de 0.5 ml |
Merck Frosst Canada Ltd. |
02283190 |
NSA |
J |
Conforme aux Lignes directrices |
1 |
| Glumetza, comprimé de 500 mg |
Biovail Pharmaceuticals Canada |
02268493 |
PBA |
A |
Sous enquête |
|
| Hepsera, comprimé de 10 mg |
Gilead Sciences Inc. |
02247823 |
NSA |
J |
Conforme aux Lignes directrices |
3 |
| Idamycin PFS, 1 mg/ml |
Pfizer Canada Inc. |
02282496 |
|
L |
Conforme aux Lignes directrices |
1 |
| Invirase, comprimé de 500 mg |
Hoffmann-La Roche Ltd. Canada |
02279320 |
|
J |
Conforme aux Lignes directrices |
1 |
| Kaletra 200/50, comprimé de 250 mg |
Abbott Laboratories Ltd. |
02285533 |
|
J |
Conforme aux Lignes directrices |
1 |
| Kogenate FS Bioset 250 |
Bayer Inc. |
02254476 |
|
B |
Conforme aux Lignes directrices |
1 |
| Lantus, 100 unit/ml |
sanofi-aventis Canada Inc. |
02251930 |
|
A |
Sous enquête |
|
| Levemir Penfill 100 unit/ml |
Novo Nordisk Canada Inc. |
02271842 |
NSA |
A |
Sous enquête |
|
| Macugen, fiole de 0,3 mg |
Pfizer Canada Inc. |
02267225 |
NSA/ PBA |
S |
Conforme aux Lignes directrices |
2 |
| Myfortic, comprimé de 180 mg |
Novartis Pharma Canada Ltd. |
02264560 |
PBA |
L |
Conforme aux Lignes directrices |
1 |
| Myfortic, comprimé de 360 mg |
Novartis Pharma Canada Ltd. |
02264579 |
PBA |
L |
Conforme aux Lignes directrices |
1 |
| Niaspan, comprimé de 500 mg |
Oryx Pharmaceuticals Inc. |
02262347 |
PBA |
C |
Conforme aux Lignes directrices |
3 |
| Niaspan, comprimé de 750 mg |
Oryx Pharmaceuticals Inc. |
02262355 |
PBA |
C |
Conforme aux Lignes directrices |
3 |
| Niaspan, comprimé de 1000 mg |
Oryx Pharmaceuticals Inc. |
02262339 |
PBA |
C |
Conforme aux Lignes directrices |
3 |
| Nutrineal PD4 11 mg/m |
Baxter Corporation |
02230810 |
NSA/ PBA |
B |
Sous examen |
|
| Pantoloc M, comprimé de 40 mg |
Altana Pharma Inc. |
02267233 |
|
A |
Conforme aux Lignes directrices |
1 |
| Prevacid Fastab, comprimé de 30 mg |
Abbott Laboratories Ltd. |
02249472 |
|
A |
Sous enquête |
|
| Prezista, comprimé de 300 |
Janssen-Ortho Inc. |
02284057 |
NSA |
J |
Conforme aux Lignes directrices |
3 |
| Revatio, comprimé de 20 mg |
Pfizer Canada Inc. |
02279401 |
|
G |
Conforme aux Lignes directrices |
1 |
| Risperdal M-Tab, comprimé de 3 mg |
Janssen-Ortho Inc. |
02268086 |
|
N |
Conforme aux Lignes directrices |
1 |
| Risperdal M-Tab, comprimé de 4 mg |
Janssen-Ortho Inc. |
02268094 |
|
N |
Conforme aux Lignes directrices |
1 |
| Rotateq, dose de 2 ml |
Merck Frosst Canada Ltd. |
02284413 |
NSA |
J |
Conforme aux Lignes directrices |
2 |
| Sativex 27/25, 52 mg/ml |
Bayer Inc. |
02266121 |
NSA/ PBA |
N |
Conforme aux Lignes directrices |
3 |
| Somavert, fiole de 10 mg |
Pfizer Canada Inc. |
02272199 |
NSA |
H |
Conforme aux Lignes directrices |
3 |
| Somavert, fiole de 15 mg |
Pfizer Canada Inc. |
02272202 |
NSA |
H |
Conforme aux Lignes directrices |
3 |
| Somavert, fiole de 20 mg |
Pfizer Canada Inc. |
02272210 |
NSA |
H |
Conforme aux Lignes directrices |
3 |
| Sutent, gélule de 12,5 mg |
Pfizer Canada Inc. |
02280795 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Sutent, gélule de 25 mg |
Pfizer Canada Inc. |
02280809 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Sutent, gélule de 50 mg |
Pfizer Canada Inc. |
02280817 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Thalomid, gélule de 50 mg |
Celegene Corporation |
|
NSA/ PBA |
L |
Sous examen |
|
| Trelstar, fiole de 3,75 mg |
Paladin Labs Inc. |
02240000 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Trelstar LA, fiole de 11,25 mg |
Paladin Labs Inc. |
02243856 |
NSA |
L |
Conforme aux Lignes directrices |
3 |
| Trileptal, comprimé de 150 mg |
Novartis Pharma Canada Ltd. |
02242067 |
NSA/ PBA |
N |
Sous examen |
|
| Trileptal, comprimé de 300 mg |
Novartis Pharma Canada Ltd. |
02242068 |
NSA/ PBA |
N |
Sous examen |
|
| Trileptal, comprimé de 600 mg |
Novartis Pharma Canada Ltd. |
02242069 |
NSA/ PBA |
N |
Sous examen |
|
| Trusopt PF, 20 mg/ml |
Merck Frosst Canada Ltd. |
02269090 |
|
S |
Conforme aux Lignes directrices |
1 |
| Truvada 200/300, comprimé de 500 mg |
Gilead Sciences Inc. |
0227490 |
|
J |
Conforme aux Lignes directrices |
3 |
| Tygacil, fiole de 50 mg |
Wyeth Pharmaceuticals |
02285401 |
NSA |
J |
Sous examen |
|
| Tysabri, 20 mg/ml |
Biogen Idec Canada Inc. |
02286386 |
NSA |
L |
Sous enquête |
|
| Vantas, 50 mg/imp |
Paladin Labs Inc. |
02278383 |
NSA |
H |
Conforme aux Lignes directrices |
3 |
| Vesicare, comprimé de 5 mg |
Astellas Pharma Canada Inc. |
02277263 |
NSA |
G |
Conforme aux Lignes directrices |
3 |
| Vesicare, comprimé de 10 mg |
Astellas Pharma Canada Inc. |
02277271 |
NSA |
G |
Conforme aux Lignes directrices |
3 |
| Wellbutrin XL, comprimé de 150 mg |
Biovail Pharmaceuticals Canada |
02275090 |
|
N |
Conforme aux Lignes directrices |
1 |
| Wellbutrin XL, comprimé de 300 mg |
Biovail Pharmaceuticals Canada |
02275104 |
|
N |
Conforme aux Lignes directrices |
1 |
Les Lignes directrices du Conseil établissement trois catégories de nouveaux produits médicamenteux brevetés aux fins de l'examen du prix de lancement.
- Catégorie 1 – nouveau DIN d'une forme pharmaceutique existante d'un médicament existant ou un nouveau DIN d'une autre forme pharmaceutique du médicament comparable à la forme pharmaceutique existante, habituellement une nouvelle concentration d'un médicament existant (extension d'une gamme de produits pharmaceutiques)
- Catégorie 2 – premier produit médicamenteux mis au point pour traiter une condition ou qui constitue une amélioration importante par rapport aux médicaments existants. Les médicaments de cette catégorie sont souvent qualifiés de « découverte » ou d' « amélioration importante ».
- Catégorie 3 – nouveau DIN, nouveau médicament ou nouvelle forme pharmaceutique d'un médicament existant qui procure tout au plus des bienfaits modestes ou minimes par rapport aux médicaments existants.
Vous trouverez les définitions complètes de ces catégories dans le Compendium des Lignes directrices, politiques et procédures du CEPMB (chapitre 3, section 3).
- NSA : Nouvelle substance active
- PBA : Premier brevet attribué
- ATC : Classification anatomique, thérapeutique, chimique