L'Observateur des médicaments émergents – Juillet 2011
Le CEPMB
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987.
Le CEPMB est investi d'un double rôle : veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs et faire rapport des tendances des prix de vente de tous les médicaments ainsi que des dépenses de recherche et développement (R D) des brevetés.
Le CEPMB rend annuellement compte au Parlement, par l'intermédiaire du ministre de la Santé, de ses activités, des tendances des prix de tous les médicaments et des dépenses de R-D des brevetés.
L'initiative du SNIUMP
Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) fournit des analyses critiques des tendances des prix des médicaments d'ordonnance, de l'utilisation faite de ces médicaments et des coûts en médicaments au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux participants.
L'initiative du SNIUMP est un partenariat entre le CEPMB et l'Institut canadien d'information sur la santé (ICIS). Elle a vu le jour en 2001 à la suite d'une entente entre les ministres fédéral, provinciaux et territoriaux de la Santé.
Remerciements
Le présent rapport a été rédigé par le Conseil d'examen du prix des médicaments brevetés (CEPMB) au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP).
Le CEPMB reconnaît les contributions des membres du Comité directeur du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport.
1. Introduction
Voici la troisième livraison de L'Observateur des médicaments émergents (l'OMÉ), une publication qui présente des renseignements sur les médicaments en cours de développement qui peuvent avoir une incidence sur les dépenses des régimes fédéral, provinciaux et territoriaux (F-P-T) d'assurance-médicaments. Chaque rapport comprend une liste de « médicaments émergents » trouvés à la suite d'une recherche dans une base de données spécialisée1 qui présente des renseignements sur plus de 20 000 médicaments ayant atteint la phase des essais cliniques. Cette recherche est appuyée par des documents pharmaceutiques publiés, tout particulièrement des études canadiennes.
Seuls les médicaments qui répondent à un ensemble de critères de sélection pourraient intéresser l'OMÉ. Les critères de sélection, préparés pour le CEPMB en 2006, sont les suivants : la phase du développement; l'indication; le mécanisme d'action; et l'incidence sur la pratique clinique. Un algorithme sous forme d'arbre décisionnel a été élaboré afin que les critères soient appliqués de façon uniforme, une étape à la fois. Une fois qu'une liste préliminaire est sélectionnée, on s'emploie à y inclure les médicaments émergents tirés d'un ensemble varié de catégories thérapeutiques dont les médicaments sont admissibles à un remboursement par les régimes publics d'assurance-médicaments. Une attention particulière est accordée aux nouveaux médicaments à coût élevé qui pourraient avoir une incidence financière, aux catégories auxquelles appartiennent ces médicaments ainsi qu'aux catégories comprenant une part élevée de médicaments génériques.
Puisqu'il s'agit de la troisième livraison de l'OMÉ, on y donne une mise à jour sur des médicaments émergents identifiés dans les deux rapports précédents. Certains médicaments ont été retirés de la liste, soit parce qu'ils ont été introduits sur le marché canadien, soit parce que leur fabricant n'effectue plus d'essais cliniques. Réciproquement, les médicaments ont été conservés dans la liste si les essais en cours soutiennent l'évaluation initiale qui a justifié l'ajout à la liste.
La présente livraison comporte cinq sections. Suivant l'introduction, la section 2 donne un aperçu des critères de sélection des médicaments, tandis que la section 3 décrit l'algorithme qui a servi à appliquer les critères. La section 4 porte sur la recherche dans la base de données BioPharm InsightMD ainsi que sur l'examen des documents publiés, et elle présente un tableau des médicaments identifiés aux fins de L'Observateur des médicaments émergents de 2011. La section 5 donne des mises à jour sur les médicaments émergents identifiés dans les rapports précédents.
2. Critères de sélection des médicaments
La présente section décrit brièvement les critères ayant servi à sélectionner les médicaments émergents.
2.1 Phase du développement
L'OMÉ ne traitera que des médicaments ayant atteint la phase III des essais cliniques. Les médicaments qui atteignent ce niveau sont plus susceptibles d'être soumis à l'approbation réglementaire et d'être commercialisés dans un avenir prochain. D'autre part, les médicaments se trouvant à des stades de développement moins avancés ne passent pas nécessairement toute la filière de l'approbation.
2.2 Indication et domaine thérapeutique
Les médicaments sont jugés des candidats potentiels de l'OMÉ s'ils peuvent servir à traiter des conditions virtuellement mortelles, des conditions pour lesquelles il n'existe aucun traitement, des maladies rares ou, encore, s'ils sont susceptibles de faire changer la pratique clinique à l'intérieur d'un domaine thérapeutique.
2.3 Description du médicament
Parmi les éléments descriptifs des médicaments qui indiquent qu'un nouveau médicament pourrait donner lieu à un changement de la pratique clinique, citons les suivants : premier médicament de sa catégorie; mécanisme d'action différent; technologie nouvelle; thérapie d'appoint; médicament-niche; médicament existant administré pour une indication nouvelle.
2.4 Incidence clinique et autre
Les médicaments doivent être susceptibles d'avoir une incidence clinique importante ou une incidence marquée sur d'autres secteurs du régime de soins de santé. Mentionnons, entre autres, une efficacité plus grande que celle des médicaments existants, des bienfaits pour la santé des patients comme une plus grande espérance de vie ou une meilleure qualité de vie, des résultats nouveaux ou redéfinis et un profil d'innocuité amélioré.
3. Méthode d'application des critères
L'OMÉ tire surtout son information de la base de données BioPharm Insight. Cette base de données fait le suivi des médicaments depuis leur découverte préclinique jusqu'aux données sur leurs ventes, en passant par les essais cliniques et leur commercialisation. Cette base de données contient de vastes renseignements sur plus de 20 000 drogues de recherche. Son moteur de recherche permet de sélectionner les médicaments selon différents critères, notamment la phase de développement, le domaine thérapeutique, le mécanisme du médicament, les médicaments orphelins, la filière d'approbation rapide et le type de molécule.
Vous trouverez dans la figure 1 l'algorithme établi pour faire la sélection des médicaments pour l'OMÉ. Il combine la capacité de recherche de la base de données BioPharm Insight avec le critère clé utilisé pour identifier les médicaments susceptibles d'avoir une grande incidence. Étant donné que les sources d'information de cette base de données sont en large partie américaines, des sources supplémentaires sont utilisées pour vérifier si les nouveaux médicaments sont en développement au Canada.
Figure 1. Algorithme de sélection des médicaments pour l'OMÉ
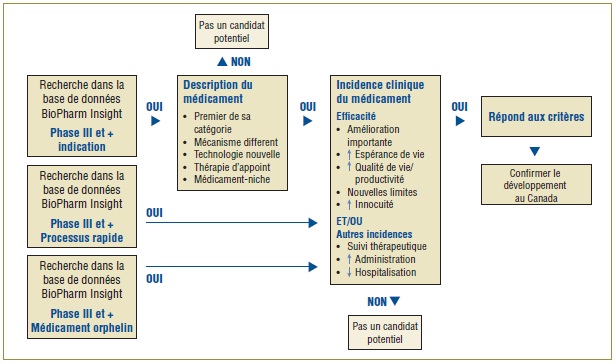
La première étape est l'identification des médicaments auxquels pourrait s'intéresser l'OMÉ. À cette fin, une recherche est faite dans la base de données BioPharm Insight pour trouver les médicaments en phase III du développement. Dans certains cas, les essais en phase III peuvent être à leurs tout débuts et dans d'autres, des résultats seront disponibles. Les médicaments en phase III du développement sont soumis à une procédure de sélection selon le domaine thérapeutique sur lequel agit le médicament et selon l'indication. Un médicament est considéré un candidat potentiel pour l'OMÉ si la Food and Drug Administration (FDA) des États-Unis l'inscrit comme médicament orphelin, qui traite une maladie rare, si son processus d'approbation est accéléré étant donné qu'il doit traiter une maladie grave ou une maladie virtuellement mortelle ou, encore, si le médicament semble pouvoir traiter des maladies ou des conditions pour lesquelles il n'existe encore aucun médicament.
Pour les médicaments dont le processus de développement n'est pas accéléré ou qui ne sont pas désignés orphelins, la recherche de leur profil est faite à l'aide de mots clés se rapportant à un descripteur précis, comme premier de sa catégorie thérapeutique, mécanisme différent, technologie nouvelle, thérapie d'appoint, médicament-niche, ou médicament existant avec une nouvelle indication. Par la suite, les résultats de la phase III de ces médicaments sont analysés pour valider les caractéristiques du médicament identifiées dans le profil, comme l'efficacité beaucoup plus grande ou l'innocuité améliorée. À ce point-ci, les médicaments arrivant au stade des essais cliniques de la phase III sont rejetés du fait que l'information n'est pas suffisante pour l'évaluation scientifique.
Ensuite, les sources canadiennes sont consultées pour déterminer si le médicament est en cours de développement au Canada. La principale source d'information est le Pharmacy Practice, qui publie une liste annuelle de nouveaux médicaments prometteurs ayant atteint les derniers stades de développement (Phase III ou plus) au Canada. La prochaine étape d'identification des médicaments dont pourrait traiter l'OMÉ est l'évaluation scientifique des médicaments dont les résultats préliminaires de la Phase III révèlent une incidence au niveau de l'efficacité ou de l'innocuité.
Enfin, pour confirmer l'ajout d'un nouveau médicament à l'OMÉ, on vérifie si le médicament est susceptible d'être inscrit sur la liste des médicaments admissibles à un remboursement par les régimes F-P-T d'assurance-médicaments, à la lumière de l'indication du médicament et de sa forme posologique.
4. Identification des médicaments auxquels pourrait s'intéresser l'OMÉ
4.1. Recherche dans la base de données BioPharm Insight
La première étape de l'identification des médicaments auxquels pourrait s'intéresser l'OMÉ consistait en une recherche dans la base de données BioPharm Insight. Comme lors des analyses précédentes, seuls les médicaments qui étaient en phase III du développement ou qui faisaient l'objet d'un examen par la FDA (c.-à-d. une présentation de drogue nouvelle (NDA) ou une demande de licence biologique (BLA)) ont été sélectionnés à la première étape. La recherche a été effectuée au cours de la semaine du 7 mars 2011 et est donc à jour pour cette période.
Le tableau 1 résume les résultats de la recherche par domaine thérapeutique. On a examiné le profil de chacun de ces médicaments dans la base de données, en accordant une attention particulière au champ drug description (description du médicament). La recherche a porté sur des mots clés précis comme « premier de sa catégorie » et « mécanisme différent ».
Tableau 1. Résultats de la recherche dans BioPharm Insight par catégorie thérapeutique
| Domaine thérapeutique |
Nombre de résultats pertinents |
| En phase III |
Présentation NDA/BLA |
| Cancer |
261 |
30 |
| Cardiovasculaire |
101 |
14 |
| Système nerveux central |
112 |
16 |
| Dermatologie |
33 |
5 |
| Yeux et oreilles |
27 |
4 |
| Système gastro-intestinal |
56 |
16 |
| Système génito-urinaire |
37 |
7 |
| Hématologique |
51 |
7 |
| Infections au VIH |
27 |
2 |
| Système hormonal |
82 |
14 |
| Système immunitaire |
50 |
2 |
| Maladies infectieuses |
106 |
27 |
| Système musculosquelettique |
44 |
7 |
| Douleurs |
53 |
19 |
| Système respiratoire |
28 |
4 |
| TOTAL |
1 068 |
174 |
Si ces mots clés étaient trouvés, l'étape suivante consistait à déterminer les résultats des essais cliniques en phase III, le cas échéant. Sous le critère development history (historique du développement) du profil du médicament, les détails concernant les résultats de la phase III de ces médicaments ont été analysés pour valider les caractéristiques du médicament, p. ex. l'efficacité beaucoup plus grande et l'innocuité plus grande. Si cette analyse révélait une efficacité insuffisante ou un problème d'innocuité, le médicament était rejeté de la sélection.
Le tableau 2 présente une liste fonctionnelle des médicaments qui ont été sélectionnés à cette étape. Tous ces médicaments ont été vérifiés par rapport à la plus récente liste des médicaments émergents publiée dans Pharmacy Practice2 afin de vérifier s'il s'y trouvait des renseignements relatifs à des développements sur le marché canadien. À partir de cette liste fonctionnelle, tous les médicaments dont les résultats préliminaires de la Phase III révèlent une incidence au point de vue de l'efficacité ou de l'innocuité sur le traitement de la maladie ont été ajoutés au tableau provisoire des candidats potentiels.
L'étape suivante consistait en l'évaluation scientifique de cette liste préliminaire. À la suite de l'évaluation, on a passé en revue les détails concernant les résultats de la phase III tirés des profils de médicaments dans BioPharm, en cherchant tout particulièrement d'importantes améliorations aux résultats en matière d'efficacité et d'innocuité. De plus, on a effectué une recherche dans la base de données MEDLINEMD afin d'avoir une idée de la façon dont le médicament était perçu dans les documents publiés.
Tableau 2. Médicaments en particulier sélectionnés par domaine thérapeutique
| Domaine thérapeutique |
Nombre de résultats pertinents |
| En phase III |
Présentation NDA/BLA |
| Cancer |
21 |
6 |
| Cardiovasculaire |
19 |
13 |
| Système nerveux central |
22 |
18 |
| Dermatologie |
3 |
4 |
| Yeux et oreilles |
7 |
1 |
| Système gastro-intestinal |
8 |
10 |
| Système génito-urinaire |
6 |
0 |
| Hématologique |
1 |
1 |
| Infections au VIH |
2 |
2 |
| Système hormonal |
6 |
1 |
| Système immunitaire |
5 |
0 |
| Maladies infectieuses |
8 |
7 |
| Système musculosquelettique |
1 |
3 |
| Douleurs |
1 |
4 |
| Système respiratoire |
5 |
0 |
| Total |
115 |
70 |
À la dernière étape du processus de sélection, on s'est employé à inclure les médicaments émergents tirés d'un ensemble varié de catégories thérapeutiques dont les médicaments sont admissibles à un remboursement par les régimes publics d'assurance-médicaments. On a aussi tenu compte de l'incidence financière potentielle sur les régimes publics d'assurance médicaments. On peut s'attendre à ce que les nouveaux médicaments introduits dans une catégorie à utilisation élevée (p. ex. cardiovasculaire) ou comportant des médicaments coûteux (p. ex. cancer) augmentent l'ensemble des dépenses associées à un régime d'assurance médicaments. La même logique s'applique aux médicaments introduits dans des catégories thérapeutiques comprenant une part élevée de médicaments génériques. Par exemple, bon nombre de médicaments coûteux conçus pour traiter le taux élevé de cholestérol (atorvastatine, simvastatine et pravastatine) se sont récemment vu retirer leur protection associée au brevet et ont été remplacés par des médicaments génériques moins coûteux. Si un nouveau médicament est introduit sur ce marché, il peut être un important facteur de coût.
4.2 Médicaments ajoutés à L'Observateur des médicaments émergents
Le tableau 3 présente une liste de nouveaux médicaments ajoutés à l'OMÉ. Chaque médicament a satisfait aux critères de sélection dont il a été question dans la section 3. La liste comprend le nom de marque du médicament, l'entreprise, le domaine thérapeutique et la justification de son ajout à l'OMÉ.
Tableau 3. Médicaments ajoutés à L'Observateur des médicaments émergents
| Médicament (nom de marque, entreprise) |
Domaine thérapeutique (ATC) –Indication |
Justification de l'ajout à l'OMÉ |
| Cardiovasculaire |
|
Darapladib (GlaxoSmithKline)
|
Thérapie cardiaque (C01)
|
- En essais de phase III
- Population importante (cardiovasculaire)
- Nouvelle catégorie : inhibiteur de lipase de phosphor A2 associée aux lipoprotéines (Lp-PLA2)
- Risque cardiovasculaire réduit; entrave la formation de plaques d'athérosclérose; peut affecter les résultats pour le patient (infarctus du myocarde, accident vasculaire cérébral, décès cardiovasculaire)3
- Différent mécanisme d'action sur l'athérosclérose comparativement aux statines
- Thérapie d'appoint
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
|
|
Ticagrélor (AZD6140;
Brilinta; AstraZeneca)
|
Agents antithrombotiques (B01)
|
- En essais de phase III
- En cours d'examen par la FDA; approuvé par l'EMA
- Population importante (cardiovasculaire/accident vasculaire cérébral)
- Nouvelle catégorie d'inhibiteur de l'agrégation plaquettaire : antagoniste du récepteur P2Y12 administré par voie orale
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
- Plus grande efficacité et plus constant que le clopidogrel4
|
|
Arthrite
|
|
Tofacitinib, tasocitinib (Pfizer Inc./Takeda Pharmaceutical)
|
Immunosuppresseurs (L04)
|
- En essais de phase III
- Population importante (polyarthrite rhumatoïde)
- Dose orale; les produits injectables sont actuellement la pratique standard
- Nouveau mécanisme d'action : antagoniste de la JAK-1/JAK-3
- Multiples indications : polyarthrite rhumatoïde, rejet aigu d'une greffe de rein
|
|
Hépatite
|
|
Telaprevir (Tibotec/Janssen‑Ortho)
|
Antiviraux pour usage systémique (J05)
|
- Approuvé par la FDA
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
- Population importante (hépatite C)
- Efficace chez les patients chez qui les autres traitements ont été inefficaces, p. ex. le peginterféron alfa et la ribavirine5
- Thérapie d'appoint; la triple thérapie pourrait avoir une incidence sur le coût du traitement
|
|
Épilepsie
|
|
Pérampanel
(Eisai Co., Ltd.)
|
Antiépileptiques (N03)
|
- En essais de phase III
- Premier de sa catégorie thérapeutique : antagoniste de récepteur de glutamate non-compétitif de type AMPA
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
- Thérapie d'appoint
|
|
Rétigabine (ézogabine; Valeant Pharmaceuticals)
|
Antiépileptiques (N03)
|
- Approuvé par la FDA et l'EMA
- Nouveau mécanisme d'action : ouvreur de canal potatique et potentialisateur du GABA
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
- Thérapie d'appoint
- Réduction d'environ 23 à 44 % de la fréquence des crises dans l'ensemble de l'intervalle des doses6
|
|
Maladie de Parkinson
|
|
Safinamide (EMD Serono)
|
Antiparkinsoniens (N04)
|
- En essais de phase III
- Multiples mécanismes d'action et multiples indications : maladie de Parkinson, épilepsie, syndrome des jambes sans repos
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
- Population importante
- Si ce médicament s'avérait plus efficace que les agents existants, il pourrait remplacer des médicaments de rechange peu coûteux comme la quinine pour traiter le syndrome des jambes sans repos.
|
|
Douleurs
|
|
Oxycodone, Niacin et ingrédients supplémentaires
(Oxecta/Acura Pharmaceuticals, Pfizer Inc.)
|
Analgésiques
(N02)
|
§ L'oxycodone et une combinaison unique d'ingrédients destinés à soulager efficacement la douleur tout en décourageant les trois méthodes les plus courantes d'abus des médicaments sur ordonnance, qui sont (i) l'injection intraveineuse de comprimés dissous, (ii) le reniflement de comprimés écrasés et
(iii) la déglutition intentionnelle d'un nombre excessif de comprimés (BioPharm Insight).
§ Approuvé par la FDA et l'EMA (BioPharm Insight).
§ Chaque ingrédient de cette combinaison est un ingrédient actif existant.
§ Bien qu'il ne réponde pas aux critères nécessaires pour être considéré comme un nouveau médicament émergent, ce produit représente une nouvelle présentation de médicaments couramment prescrits.
|
|
Alzheimer
|
|
Bapineuzumab (Pfizer Inc.)
|
Anticorps monoclonal (L01)
|
- En essais de phase III
- Population importante : patients atteints d'alzheimer
- Différent mécanisme d'action : anticorps monoclonal amyloïde contre les cellules bêta
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
|
|
Cancer
|
|
Ipilimumab (Bristol-Myers Squibb)
|
Anticorps monoclonal (L01)
|
- Récemment approuvé par la FDA pour le traitement du mélanome métastatique, commercialisé sous le nom de Yervoy
- Multiples indications (mélanome, cancer de la prostate, autres cancers)
- Population importante (cancer)
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
- Taux de survie accru chez les patients ayant déjà subi des traitements contre le mélanome métastatique7
|
|
Vandetanib (Zactima; AstraZeneca)
|
Inhibiteurs de la protéine kinase (L01XE)
|
- En cours d'examen par la FDA; classifié à titre d'examen prioritaire
- Population importante (cancer)
- Différent mécanisme d'action
- Efficacité accrue contre le cancer médullaire de la thyroïde évolué8
|
|
Abréviations : EMA, Agence européenne des médicaments; FDA, Food and Drug Administration; JAK, Janus kinase.
* Un code ATC de niveau 4 a été indiqué pour les médicaments qui sont énumérés dans l'index de l'ATC. Puisque ces médicaments ont pour la plupart le statut de drogue expérimentale, bon nombre d'entre eux n'ont pas encore été classifiés dans l'index de l'ATC; toutefois, selon leur mécanisme d'action, un code ATC probable de niveau 2 a été proposé.
|
5. Mises à jour
5.1. Médicaments conservés dans la liste des médicaments émergents
Le tableau 4 présente la liste des médicaments inclus dans la première et la deuxième livraison de L'Observateur des médicaments émergents qui demeurent des candidats aux fins de la liste des médicaments émergents. On y trouve des mises à jour fondées sur les documents scientifiques récemment publiés ainsi que la raison pour laquelle on a conservé les médicaments dans la liste des médicaments émergents.
Tableau 4. Médicaments conservés dans la liste des médicaments émergents
|
Médicament (nom de marque, entreprise)
|
Domaine thérapeutique (ATC) – Indication
|
Mise à jour et justification de la conservation dans la liste des médicaments émergents
|
|
Agomélatine
(Valdoxan, Servier)
|
Système nerveux central (N06AX)
Troubles dépressifs majeurs
|
Description précédente :
- Premier médicament d'une nouvelle catégorie d'antidépresseurs
- Efficacité comparable et bienfaits cliniques supplémentaires, p. ex. régulation du sommeil
- Décrit comme un « antidépresseur idéal » dans les documents publiés
Mise à jour :
- Approuvé par la FDA et l'EMA (BioPharm Insight)
- Bonne efficacité et tolérabilité; moins d'effets secondaires sur la santé sexuelle que les antidépresseurs sous forme d'inhibiteurs spécifiques du recaptage de la sérotonine9
- L'agomélatine a présenté un effet antidépressif supérieur à celui de la fluoxétine pour le traitement des patients ayant subi un épisode grave de trouble dépressif majeur après huit semaines de traitement, ainsi qu'un bon profil de tolérabilité10.
- L'amélioration des troubles du sommeil, la tolérabilité des effets secondaires sur la santé sexuelle et l'absence de symptômes d'abstinence après une brusque interruption du traitement peuvent représenter d'importants bienfaits cliniques par rapport aux antidépresseurs établis.
- Statut de drogue expérimentale au Canada (Pharmacy Practice, 2010-2011)
Justification : Les documents publiés continuent d'indiquer que l'agomélatine constitue une importante nouvelle approche en matière de lutte contre la dépression : son efficacité est à tout le moins comparable, voire supérieure, et elle a moins d'effets secondaires. À conserver dans la liste des médicaments émergents.
|
|
Ecallantide (DX-88; Dyax Corp., Genzyme Corp.)
|
Antihémorragiques (B02)
Angio-œdème héréditaire (AOH)
|
Description précédente :
- Nouvel inhibiteur de la kallicréine plasmatique
- Besoin médical non satisfait : première thérapie propre aux épisodes aigus – l'AOH est une maladie débilitante et potentiellement fatale.
Mise à jour :
- Approuvé par la FDA
- Au cours des essais cliniques, l'ecallantide a apaisé les symptômes de l'AOH aigu, la rapidité de la réaction était proportionnée aux besoins thérapeutiques relatifs à l'emplacement des épisodes d'AOH11.
Justification : Les documents publiés continuent d'indiquer que l'ecallantide est un traitement efficace de l'AOH aigu et satisfait à un besoin médical. On note un risque d'anaphylaxie qui doit être géré. Cela touche une petite partie de la population. À conserver dans la liste des médicaments émergents.
|
|
Istradefylline (KW‑6002, Kyowa Hakko Kogyo Co. Ltd.)
|
Système nerveux central (N04)
Maladie de Parkinson
|
Description précédente :
- Premier médicament d'une nouvelle catégorie thérapeutique
- Incidences sur la progression de la maladie plutôt que sur le traitement des symptômes
- Études de phase III en cours (BioPharm Insight)
Mise à jour :
- Thérapie d'appoint s'ajoutant à la lévodopa
- L'essai clinique a révélé que des doses quotidiennes de 20 mg et de 40 mg d'Istradefylline sont efficaces pour soulager les symptômes des fluctuations par perte d'efficacité chez les patients atteints de la maladie de Parkinson. Par ailleurs, ces doses ont été bien tolérées12.
- Efficacité à long terme démontrée13
Justification : Les documents publiés continuent d'indiquer que l'istradefylline est un traitement efficace de la maladie de Parkinson. À conserver dans la liste des médicaments émergents.
|
|
Phenoxodiol (Marshall Edwards Inc.)
|
Cancer (L01)
Cancer ovarien
|
Description précédente :
- Taux de survie accru chez les patients atteints d'un cancer difficile à traiter
Mise à jour :
- Les résultats de la phase III ne sont pas encore disponibles.
- La FDA a autorisé le développement rapide du phenoxodiol en tant que radiosensibilisateur destiné aux médicaments au platine et au taxane utilisés pour traiter le cancer ovarien récurrent.
Justification : Bien qu'il existe peu de documents publiés à ce sujet, ce médicament pourrait éventuellement améliorer le taux de survie. À conserver dans la liste des médicaments émergents.
|
|
Pirfenidone (Intermune Inc.)
[médicament orphelin]
|
Système respiratoire (R07)
Fibrose pulmonaire idiopathique
|
Description précédente :
- Maladie rare et évolutive présentant un pronostic sombre
- Les traitements actuels (p. ex. anti-inflammatoire, immunosuppresseurs) ont une efficacité éprouvée limitée.
- Désignation de médicament orphelin
- Peut prévenir la fibrose chez les patients atteints de dystrophie musculaire
Mise à jour :
- Approuvé par la FDA et l'EMA
- Trois essais réalisés auprès de 1 046 patients ont fourni des données sur le taux de survie sans progression : le pirfenidone a réduit de façon considérable le risque de progression de la maladie, soit de 30 % (HR 0,70, 95 % CI 0,56 à 0,88, P = 0,002)14.
Justification : Les documents publiés continuent d'indiquer que le Pirfenidone est un traitement efficacement de la fibrose pulmonaire. À conserver dans la liste des médicaments émergents.
|
|
Plerixafor (Mozobil; Genzyme Corp.)
|
Immunostimulants (L03)
Myélome multiple, lymphome non hodgkinien
|
Description précédente :
- Nouvelle petite molécule antagoniste du récepteur de chimiokine CXCR4
- Approuvé par la FDA et l'EMA
Mise à jour :
- Médicament orphelin aux États-Unis et en Europe
- Schéma posologique de mobilisation bien toléré et possibilité de collecte de cellules souches chez les patients chez qui la mobilisation a été inefficace
- Les résultats des essais cliniques ont indiqué que l'effet combiné du plerixafor et d'un facteur de stimulation des granulocytes permet la collecte de cellules souches hématopoïétiques à rendement élevé, avec moins de séances d'aphérèse, chez les patients atteints de lymphome non hodgkinien et de myélome multiple. Le plerixafor a aussi produit des résultats prometteurs au cours de petites études réalisées auprès de patients atteints de lymphome hodgkinien. En outre, chez les patients chez qui le facteur de stimulation des granulocytes est inefficace, l'effet combiné du plerixafor et du facteur de stimulation des granulocytes peut être utile à titre de stratégie de mobilisation de sauvetage15.
Justification : Les documents publiés continuent d'indiquer que le plexifor est un traitement efficace de la collecte de cellules souches par mobilisation, surtout chez les patients chez qui les stratégies actuelles ont été inefficaces. À conserver dans la liste des médicaments émergents.
|
|
Satraplatin (LA 12, GPB Biotech AG; Spectrum Pharma-ceuticals Inc.; Pharmion Corp.)
|
Cancer (L01)
Divers (cancer de la prostate androgéno‑indépendant, cancer ovarien et cancer pulmonaire à petites cellules)
|
Description précédente :
- Premier composé de platine administré par voie orale
- Désignation de processus rapide aux États‑Unis à titre de traitement chimiothérapeutique en seconde intervention du cancer de la prostate androgéno‑indépendant
Mise à jour :
- En cours d'examen par la FDA
- L'un des quatre composés de platine administrés par voie orale faisant l'objet d'une enquête
- Le satraplatin administré par voie orale a retardé la progression de la maladie et de la douleur chez les patients atteints de cancer métastatique de la prostate androgéno‑indépendant en progression après la première chimiothérapie, mais il n'a pas présenté de bienfait important sur le plan du taux de survie16.
Justification : Bien que les documents publiés indiquent que le satraplatin peut ne pas augmenter le taux de survie, s'il est le premier composé de platine administré par voie orale approuvé, il aura une incidence sur la pratique clinique. À conserver dans la liste des médicaments émergents.
|
|
Sipuleucel-T (Provenge, Dendrion Corporation)
|
Cancer (L01)
Cancer de la prostate
|
Description précédente :
- Nouvelle approche immunothérapeutique en matière de gestion du cancer de la prostate à un stade précoce
- Désignation de processus rapide aux États-Unis
Mise à jour :
- Approuvé par la FDA
- Dans l'étude randomisée, à double insu et contrôlée réalisée auprès de patients atteints de cancer métastatique de la prostate androgéno‑indépendant, le Sipuleucel-T a été associé à une réduction relative de 22 % du risque de décès (HR 0,78; p = 0,03), qui était le paramètre primaire de l'essai17.
Justification : Les documents publiés continuent d'indiquer que le sipuleucel-T représente une nouvelle approche en matière de traitement du cancer de la prostate et qu'il diminue le risque de décès. À conserver dans la liste des médicaments émergents.
|
|
Abréviations : EMA, Agence européenne des médicaments; FDA, Food and Drug Administration.
|
5.2 Médicaments retirés de la liste des médicaments émergents
Les tableaux 5 et 6 présentent la liste des médicaments inclus dans la première et la deuxième livraison de L'Observateur des médicaments émergents qui ont été retirés de la liste des médicaments émergents. Les médicaments présentés dans le tableau 5 ont été retirés de la liste parce que leur fabricant a été autorisé à les commercialiser sur le marché canadien. Santé Canada donne cette autorisation dans un avis de conformité. Le tableau 5 présente également des renseignements relatifs aux recommandations faites par le Comité consultatif canadien d'expertise sur les médicaments de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) quant à la question de savoir si les régimes publics d'assurance médicaments devraient énumérer le médicament, accompagné des décisions rendues par le Conseil d'examen du prix des médicaments brevetés (CEPMB) quant à la question de savoir si le prix d'un médicament respectait ses lignes directrices sur les prix excessifs . Le tableau 6 comprend les médicaments qui ont été retirés de la liste des médicaments émergents parce que leur maintien sur cette liste n'est plus soutenu par une évaluation scientifique. Les raisons citées comprennent l'insuffisance d'information et des essais cliniques ultérieurs qui ont révélé une insuffisance d'efficacité ou d'innocuité.
Tableau 5. Médicaments retirés de la liste des médicaments émergents : autorisation de commercialisation donnée par Santé Canada
| Médicament (nom de marque, entreprise) |
Domaine thérapeutique (ATC) – Indication |
Date de délivrance de l'avis de conformité* |
Recommandations et décisions de l'ACMTS et du CEPMB** |
|
Eculizumab (Soliris; Alexion Pharmaceuticals Inc.)
|
Agents immunosuppresseurs (L04)
|
Janvier 2009
|
L'ACMTS a recommandé (en février 2010) que l'eculizumab soit retiré de la liste. Raison : sans une réduction importante de son prix, il ne sera pas économique.
|
|
Lapatinib (Tykerb; GSK)
|
Agents antinéoplasiques (L01)
|
Mai 2009
|
—
|
|
Raltegravir (Isentress; Merck Frosst Canada Ltd.)
|
Antiviraux pour usage systémique, VIH
(J05)
|
Novembre 2007
|
L'ACMTS a recommandé (en juin 2010) que le raltegravir nsoit retiré de la liste au prix soumis. Le CEPMB a conclu que le prix de lancement (de novembre à décembre 2007) respectait ses lignes directrices sur les prix excessifs.
|
|
Rivaroxaban (Xarelto; Bayer Inc.)
|
Agents antithrombotiques (B01)
|
Septembre 2008
|
L'ACMTS a recommandé (en décembre 2008) que le rivaroxaban fasse partie de la liste à titre de remplacement des héparines à la suite d'une chirurgie de remplacement du genou ou de la hanche. En janvier 2010, le CEPMB a accepté un engagement de conformité volontaire pour le Xarelto. Le prix du Xarelto était excessif en vertu des lignes directricesdu CEPMB au moment du lancement du médicament sur le marché, en septembre 2008.
|
|
Saproptérine (Kuvan; Biomarin Pharmaceutical Inc.)
|
Autres produits liés au tractus digestif et au métabolisme
(A16)
|
Avril 2010
|
L'ACMTS a recommandé (en janvier 2011) que la saproptérine soit retiré de la liste. Raison : les détails concernant les patients ne suffisent pas à cerner un bienfait clinique économique.
|
|
* Un avis de conformité est accordé lorsqu'un produit médicamenteux satisfait aux exigences réglementaires de Santé Canada concernant l'innocuité, l'efficacité et la qualité.
**Les recommandations de l'ACMTS sont faites par le Comité consultatif canadien d'expertise sur les médicaments (CCCEM), un organisme consultatif indépendant formé de spécialistes de la pharmacothérapie et de l'évaluation de médicaments.
|
Tableau 6. Médicaments retirés de la liste des médicaments émergents : évaluation scientifique
|
Médicament (nom de marque, entreprise)
|
Justification du retrait
|
|
Efaproxiral (Efaproxyn, Revaproxyn, Allos Therapeutics)
|
- Depuis 2008, on dispose de très peu de renseignements sur ce médicament.
- Dans un examen, on ne recommande pas son utilisation pour traiter les tumeurs cérébrales métastatiques, compte tenu de l'insuffisance de preuves de son efficacité19.
|
|
Tolvaptan (Otsuka Maryland Research Institute (OMRI); Otsuka Pharmaceutical Co., Ltd.)
|
- Un examen décrit le tolvaptan comme favorisant l'excrétion rapide d'excès fluide corporel et améliorant les signes et les symptômes de l'insuffisance cardiaque, mais on n'a observé aucun effet sur la mortalité à long terme ou la morbidité liée à l'insuffisance cardiaque20.
- Ce médicament sera probablement destiné uniquement à des patients choisis plutôt que d'être utilisé de façon générale pour remplacer les diurétiques.
|
|
Tramiprosate (Alzhemed, Neurochem Inc.)
|
- Depuis 2008, on dispose de très peu de renseignements sur ce médicament
- Les résultats de la phase III n'ont pas été publiés.
|
6. Références
1 La base de données BioPharm InsightMD a été consultée au cours de la semaine du 7 mars aux fins du présent rapport. Son adresse Web est la suivante : http://www.infinata5.com/biopharm/AccessPoint.aspx?action=Login.ShowLogin&datakey=biopharm.
2 MURDOCH, L.A. « Promising drugs in the late stages of development in Canada », Pharmacy Practice, décembre 2010- janvier 2011. Sur Internet : www.CanadianHealthcareNetwork.ca.
3 WHITE, H. « Editorial: why inhibition of lipoprotein-associated phospholipase A2 has the potential to improve patient outcomes », Curr Opin Cardiol, vol. 25, no 4, (2010), p. 299-301.
4 STEG, P.G., S. JAMES, R.A. HARRINGTON, D. ARDISSINO et coll. « Ticagrelor versus clopidogrel in patients with ST-elevation acute coronary syndromes intended for reperfusion with primary percutaneous coronary intervention: A Platelet Inhibition and Patient Outcomes (PLATO) trial subgroup analysis », Circulation, vol. 122, no 21 (2010), p. 2131-2141.
5 McHUTCHISON, J.G., M.P. MANNS, A.J. MUIR et coll.; PROVE3 Study Team. « Telaprevir for previously treated chronic HCV infection », N Engl J Med, vol. 362, no 14 (2010), p. 1292-1303.
6 BRODIE, M.J., H. LERCHE, A. GIL-NAGEL et coll.; pour RESTORE 2 Study Group. « Efficacy and safety of adjunctive ezogabine (retigabine) in refractory partial epilepsy », Neurology, vol. 75, no 20 (2010), p. 1817-1824.
7 HODI, F.S., S.J. O'DAY, D.F. McDERMOTT et coll. « Improved survival with ipilimumab in patients with metastatic melanoma », N Engl J Med, vol. 363, no 8 (2010), p. 711-723.
8 ROBINSON, B.G., L. PAZ-ARES, A. KREBS, J. VASSELLI, R. HADDAD. « Vandetanib (100 mg) in patients with locally advanced or metastatic hereditary medullary thyroid cancer », Clin Endocrinol Metab., vol. 95, no 6 (2010), p. 2664 2671.
9 GREEN, B. « Focus on agomelatine », Curr Med Res Opin., vol. 27, no 4 (2011), p. 745-749.
10 HALE, A., R.M. CORRAL, C. MENCACCI, J.S. RUIZ, C.A. SEVERO, V. GENTIL. « Superior antidepressant efficacy results of agomelatine versus fluoxetine in severe MDD patients: a randomized, double-blind study », Int Clin Psychopharmacol, vol. 25, no 6 (2010), p. 305-314.
11 RIEDL, M., M. CAMPION, P.T. HORN, W.E. PULLMAN. « Response time for ecallantide treatment of acute hereditary angioedema attacks », Ann Allergy Asthma Immunol, vol. 105, no 6 (2010), p. 430-436.
12 MIZUNO, Y., K. HASEGAWA, T. KONDO, S. KUNO, M. YAMAMOTO; Japanese Istradefylline Study Group. « Clinical efficacy of istradefylline (KW-6002) in Parkinson's disease: a randomized, controlled study », Mov Disord, vol. 25, no 10 (2010), p. 1437-1443.
13 FACTOR, S., M.H. MARK, R. WATTS, L. STRUCK, A. MORI, R. BALLERINI, N.M. SUSSMAN; Istradefylline 6002-US-007 Study Group. « A long-term study of istradefylline in subjects with fluctuating Parkinson's disease », Parkinsonism Relat Disord, vol. 16, no 6 (2010), p. 423-426.
14 SPAGNOLO, P, C. DEL GIOVANE, F. LUPPI et coll. « Non-steroid agents for idiopathic fibrose pulmonaire », Cochrane Database Syst Rev., no 9 (2010), CD003134.
15 KESSANS, M.R., M.L. GATESMAN, D.R. KOCKLER. « Plerixafor: a peripheral blood stem cell mobilizer », Pharmacotherapy, vol. 30, no. 5 (2010), p. 485-492.
16 STERNBERG, C.N., D.P. PETRYLAK, O. SARTOR et coll. « Multinational, double-blind, phase III study of prednisone and either satraplatin or placebo in patients with castrate-refractory prostate cancer progressing after prior chemotherapy: the SPARC trial », J Clin Oncol., vol. 27, no. 32 (2009), p. 5431-5438.
17 KANTOFF, P.W., C.S. HIGANO, N.D. SHORE et coll.; pour IMPACT Study Investigators. « Sipuleucel-T immunotherapy for castration-resistant prostate cancer », N Engl J Med., vol. 363, no. 5 (2010), p 411-422.
18 Les recommandations de l'ACMTS peuvent être consultées dans la base de données en ligne du Programme commun d'évaluation des médicaments de l'Agence à l'adresse suivante : http://www.cadth.ca/fr/products/cdr/search. Les décisions du CEPMB peuvent être consultées à l'adresse suivante : http://www.pmprb-cepmb.gc.ca/francais/home.asp?x=1. Seules les recommandations et les décisions qui ont été rendues publiques y sont mentionnées.
19 OLSON, J.J., N.A. PALEOLOGOS, L.E. GASPAR et coll. « The role of emerging and investigational therapies for metastatic brain tumors: a systematic review and evidence-based clinical practice guideline of selected topics », J Neurooncol., vol. 96, no 1 (2010), p. 115-142.
20 FERRER, E. « Tolvaptan for the treatment of hyponatremia and congestive heart failure », Drugs Today (Barc), vol. 46, no 3 (2010), p. 163-171.