Rapport ministériel sur le rendement
2012-2013
Rapport ministériel sur le rendement
Conseil d'examen du prix des médicaments brevetés
L'honorable Rona Ambrose
Ministre de la Santé
Table des matières
Message de la présidente
Section I : Survol de l'organisation
Section II : Analyse des programmes et des sous-programmes par résultat stratégique
Section III : Renseignements supplémentaires
Section IV : Autres sujets d'intérêt
Notes de fin de document
Message de la présidente
C'est avec plaisir que je vous présente le Rapport ministériel sur le rendement 2012-2013 du Conseil d'examen du prix des médicaments brevetés (CEPMB).
L'objectif du CEPMB de s'assurer que les Canadiens ne paient pas un prix trop élevé pour des médicaments brevetés est d'une grande importance qui contribue au but général du gouvernement du maintien de la santé des Canadiens.
En 2012, après une évaluation approfondie des programmes pour vérifier le rendement et la pertinence du CEPMB, nous avons entrepris un plan d'action fondé sur les résultats. Les principaux objectifs de l'évaluation consistaient à déterminer si nous atteignons nos résultats et si les ressources qui nous ont été affectées sont appropriées pour la réalisation efficace de notre mandat.
Le Rapport d'évaluation des programmes a conclu que les programmes du CEPMB peuvent être exécutés par un organisme fédéral et cadrent bien avec les priorités gouvernementales et notre résultat stratégique. Il a également conclu que nous réalisons nos résultats escomptés. Selon l'évaluation, le financement par reconduction qui a été reçu en 2008-2009 a été efficacement utilisé pour obtenir les résultats pour lesquels il a été autorisé.
Dans notre Plan d'action de la gestion, nous avons donné suite aux recommandations mises en évidence dans le rapport d'évaluation au moyen de l'examen de façons pour (i) accélérer nos processus et simplifier davantage les Lignes directrices, (ii) alléger le fardeau réglementaire et (iii) utiliser efficacement nos ressources, le tout sans compromettre le rôle de protection du consommateur du CEPMB.
En 2012-2013, nos priorités ont consisté à accroître la conformité, à examiner des façons possibles de réduire le fardeau réglementaire des brevetés et d'utiliser efficacement nos ressources. À cette fin, nous avons entrepris une consultation avec les intervenants au sujet des initiatives proposées de réduction du fardeau réglementaire. De plus, notre Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices donne des occasions de poursuivre le dialogue avec les intervenants et de permettre des modifications opportunes à nos Lignes directrices. La deuxième évaluation annuelle dans le cadre du Plan a été présentée au Conseil en décembre 2012, et un tableau résumant les résultats a été publié en janvier 2013. Notre intention est que les Lignes directrices soient adaptées aux changements dans la distribution de médicaments et l'environnement d'établissement des prix, et ce, dans un délai approprié.
Nous nous sommes également engagés à nous assurer que nos études et rapports sont à la disposition des décideurs en temps opportun. Au moyen du programme du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), nous avons élargi nos échanges avec les intervenants et accru notre participation aux discussions et aux conférences. De plus, en consultation avec le Comité directeur du SNIUMP, l'Institut canadien d'information sur la santé (ICIS) et Santé Canada, le CEPMB s'est concentré sur la mise à jour des documents‑cadres essentiels du SNIUMP (l'entente de partage de données entre l'ICIS et le CEPMB, le mandat du Comité consultatif du SNIUMP et le protocole d'entente entre Santé Canada et le CEPMB) afin de mieux positionner l'initiative du SNIUMP à l'avenir. De plus, en 2013, nous avons publié les études suivantes :
- L'utilisation de bandelettes de test glycémique dans certains régimes publics d'assurance-médicaments, 2008 (révisée en avril 2013)
- L'Observateur des médicaments émergents – avril 2013
- Analyse éclair – Comparaisons des prix internationaux des médicaments génériques, début 2011, août 2013
En tant que présidente du CEPMB, mon objectif est de m'assurer que notre cadre continue d'avoir une incidence positive sur les consommateurs tout en reconnaissant la valeur qu'offrent les médicaments novateurs aux patients. Le CEPMB est toujours aussi résolu à relever efficacement les défis, à servir les Canadiens et à contribuer à la solidité du système de soins de santé.
Mary Catherine Lindberg
Chairperson
Section I : Survol de l'organisation
Raison d'être
Créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi), le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il est investi d'un double mandat :
- Réglementation – Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs.
- Rapport – Faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des brevetés dans la recherche et le développement au Canada.
Dans l'exécution de son mandat, le CEPMB s'efforce de veiller à la protection des intérêts de la population canadienne en s'assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs et que les principaux intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques.
Responsabilités
Le CEPMB a deux responsabilités :
Responsabilité en matière de réglementation
Le CEPMB vérifie les prix départ–usine auxquels les brevetés vendent leurs produits médicamenteux brevetés distribués sous ordonnance ou en vente libre au Canada afin de s'assurer qu'ils ne sont pas excessifs. Cela comprend les ventes pour usage humain et pour usage vétérinaire aux grossistes, aux hôpitaux, aux pharmacies et à d'autres clients. Le CEPMB réglemente le prix de chaque médicament breveté. Cela comprend chaque concentration de chaque forme posologique finale de chaque produit médicamenteux. C'est généralement à ce niveau que Santé Canada attribue le numéro d'identification du médicament (DIN) en vertu du processus d'attribution de l'Avis de conformité. Le mandat du CEPMB couvre également les produits médicamenteux qui sont distribués au titre du Programme d'accès spécial, par suite d'une demande d'essai clinique et en tant que drogues nouvelles de recherche.
La compétence du CEPMB n'est pas limitée aux produits médicamenteux dont le brevet porte sur l'ingrédient actif. Elle couvre également les produits médicamenteux dont le brevet est lié, mais non de manière exhaustive, au procédé de fabrication, au mode d'administration, à la forme posologique, à l'indication ou à l'utilisation thérapeutique ou autre. Les médicaments brevetés ne sont pas nécessairement non plus des produits de marque.
En effet, nombre de sociétés productrices de produits génériques sont assujetties à la compétence du CEPMB du fait qu'elles vendent, par l'intermédiaire de titulaires d'une licence d'exploitation, le même produit que le produit de marque ou, encore, parce que diverses sociétés productrices de produits génériques sont titulaires d'un brevet visant le procédé de conditionnement ou de traitement de produits.
Il n'a aucun droit de regard sur les prix de vente en gros ou des pharmacies des médicaments non brevetés ni sur les honoraires des pharmaciens. Des questions telles que le remboursement des médicaments par les régimes publics d'assurance–médicaments, les canaux de distribution et les habitudes d'ordonnance ne relèvent pas non plus de sa compétence.
En vertu de la Loi, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau médicament breveté. Après leur première vente, les brevetés doivent, conformément au Règlement sur les médicaments brevetés (le Règlement), faire rapport du prix de vente de leur médicament et de la quantité vendue. Par la suite, pour chaque semestre (de janvier à juin et de juillet à décembre), ils doivent faire rapport des prix et des ventes de chaque concentration de chaque forme posologique de chaque médicament breveté offert sur le marché canadien aux fins de l'examen du prix, et ce, tant qu'un brevet est lié au produit médicamenteux.
Même s'ils ne sont pas tenus de faire approuver au préalable par le CEPMB les prix de leurs médicaments avant qu'ils soient vendus, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs médicaments brevetés ne soient pas jugés excessifs. Lorsque, à l'issue d'une audience publique, il apparaît que le prix d'un médicament vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu'il a tirées de la vente de son médicament à un prix excessif.
Responsabilité en matière de rapport
Chaque année, le CEPMB rend compte de ses activités au Parlement par le truchement de la ministre de la Santé. Le rapport annuel présente une analyse des tendances relatives aux produits médicamenteux brevetés ainsi que des dépenses des brevetés dans la R–D.
Au moyen du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP)i, le CEPMB effectue des analyses critiques des tendances relatives aux prix, à l'utilisation et aux coûts des médicaments brevetés et non brevetés vendus sous ordonnance au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d'assurance‑médicaments fédéraux, provinciaux et territoriaux participants.
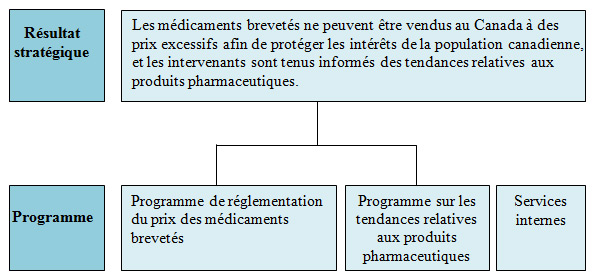
Résultat stratégique et Architecture d'alignement des programmes1
[D]
Priorités organisationnelles
| Priorité |
Type2 |
Résultat stratégique et/ou programmes |
| Accroître la conformité aux Lignes directrices du Conseil |
Nouvelle |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat.
- Priorité liée au programme 1
|
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l'égard de cette priorité?
Les Lignes directrices visent à aider les titulaires de brevets pharmaceutiques à établir des prix non excessifs en fournissant des renseignements transparents et prévisibles sur la façon dont l'examen du prix sera effectué. La conformité accrue aux Lignes directrices permettra de veiller à la protection des intérêts de la population canadienne en s'assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs.
- En juin 2012, le CEPMB a publié le Plan de surveillance et d'évaluation des principales modifications aux Lignes directricesii sur son site Web. Le personnel du Conseil a présenté la deuxième évaluation annuelle dans le cadre du Plan au Conseil en décembre 2012. Les résultats indiquent que les brevetés examinent les nouvelles Lignes directrices au moment de déterminer le prix approprié auquel ils vendent leurs médicaments brevetés au Canada. On peut trouver les résultats des LDSPE de deux ans sur le site Web du CEPMB sous Loi, Règlement et Lignes directrices.
- Dans le numéro d'avril 2012 de La Nouvelle, le Conseil a fourni une clarification relative aux examens du prix « sur un marché »iii. La Ligne directrice sur les examens du prix « sur un marché » a pour objet de s'assurer qu'aucune catégorie de clients dans un marché canadien ne se verra facturer un prix plus élevé que le prix moyen maximal potentiel (PMMP) pour tout médicament breveté lancé après le 1er janvier 2010.
- En septembre 2012, la présidente a accepté le rapport sur les conclusions du programme d'évaluation de 2011‑2012. En réaction au rapport d'évaluation iv, une réponse de la direction et un plan d'action v ont été rédigés. La réponse de la direction et le plan d'action abordent les quatre considérations établies dans le rapport d'évaluation. Le plan d'action fournit des détails sur les initiatives et les activités que le CEPMB a entreprises, qu'il entreprendra ou qu'il a terminées afin d'aborder ses considérations. Il est prévu que ces activités et initiatives aborderont les préoccupations soulevées par les brevetés, ce qui à son tour mènera à une conformité accrue aux Lignes directrices et à des prix non excessifs pour les médicaments brevetés vendus au Canada. Le rapport d'évaluation ainsi que la réponse de la direction et le plan d'action sont affichés sur le site Web du CEPMB sous Responsabilisation.
- À la réunion du Conseil du 27 mars 2013, le personnel du Conseil a présenté des options et une recommandation de changements à la méthodologie de rajustement du prix selon l'indice des prix à la consommation (IPC) vi. La recommandation a pour but de fournir une plus grande transparence et prévisibilité à la méthodologie de rajustement du prix selon l'IPC. On prévoit que cela entraînera une conformité accrue aux Lignes directrices, ce qui mènera à des prix non excessifs pour les médicaments brevetés vendus au Canada. Le Conseil a commencé à consulter les intervenants sur les modifications proposées au moyen d'un Avis et commentaires affiché sur le site Web du CEPMB en mai 2013.
- En avril 2012, le Groupe de travail technique sur la méthodologie de la majoration a terminé son évaluation de l'application pilote de la méthodologie de la majoration, a proposé des options pour aplanir les difficultés relatives à l'application et a recommandé que le Conseil adopte la méthodologie de la majoration de façon permanente.
|
| Priority |
Type |
Résultat stratégique et/ou programmes |
| Réduire le fardeau réglementaire et utiliser efficacement les ressources du personnel du Conseil |
Nouvelle |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat.
- Priorité liée au programme 1 et aux services internes.
|
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l'égard de cette priorité?
Bien que les irritants déterminés par l'industrie pharmaceutique dans le cadre de la Commission sur la réduction de la paperasse l'aient été en fin de compte en dehors de cette initiative, le CEPMB a cerné des moyens possibles de réduire le fardeau réglementaire imposé aux brevetés sans porter atteinte à son mandat visant à protéger les consommateurs contre les prix excessifs des médicaments brevetés vendus au Canada.
- Le Conseil a approuvé la poursuite des consultations avec les intervenants pour deux initiatives visant à réduire le fardeau réglementaire imposé aux brevetés :
- la méthodologie de rajustement du prix selon l'indice des prix à la consommation (IPC) qui remplacerait l'utilisation de l'IPC publiée par celle de l'IPC réel dans le calcul du facteur de rajustement du prix selon l'IPC pour la période prévue;
- le Règlement en faisant passer de deux à une déclaration annuelle des renseignements sur le prix et les ventes pour les médicaments brevetés actuels par les brevetés et en modifiant l'exigence selon laquelle les brevetés doivent présenter les renseignements le premier jour de la vente des nouveaux médicaments brevetés.
- L'Avis et commentairesvii a été affiché sur le site Web du CEPMB en mai 2013. Les soumissions des intervenants sont publiées sur le site Web sous Consultations et Avis et commentaires. En fonction des commentaires formulés par les intervenants, d'autres consultations seront entreprises concernant, dans un premier temps, le texte proposé du Compendium des politiques, des Lignes directrices et des procédures et celui du Règlement sur les médicaments brevetés et, dans un deuxième temps, les détails opérationnels et transitoires, et ce, avant l'adoption et la mise en œuvre définitives. De plus, les modifications proposées au Règlement succéderont à une consultation officielle (processus d'élaboration des règlements fédéraux) par l'intermédiaire du Cabinet et par voie de la publication dans la Gazette du Canada.
- En avril 2012, le Conseil a confirmé que les examens du prix « sur un marché » s'appliqueront en général uniquement aux produits médicamenteux brevetés nouveaux et existants vendus pour la première fois le 1er janvier 2010 ou après cette date. Le Conseil croit que l'application rétroactive de cette nouvelle politique à tous les médicaments existants représenterait un fardeau administratif considérable pour les brevetés et le personnel du Conseil.
- En mars 2013, le CEPMB a publié les normes de serviceviii suivantes sur son site Web :
- Norme de service pour l'examen scientifique des nouveaux produits médicamenteux brevetés;
- Norme de service pour l'examen du prix des nouveaux produits médicamenteux brevetés;
- Norme de service pour l'examen du prix des produits médicamenteux brevetés existants.
- En 2012‑2013, le CEPMB a créé une nouvelle base de données électronique Web capable de recevoir une saisie directe et sécurisée de données à partir des formulaires 1 et 2. Ce système permet au CEPMB de traiter de façon plus efficace les rapports présentés et mène de plus près les brevetés à présenter leurs rapports directement par Internet.
|
| Priority |
Type |
Résultat stratégique et/ou programmes |
| Transparence et communications |
Nouvelle |
Le CEPMB n'a qu'un résultat stratégique. Ainsi, toutes les priorités sont associées à ce résultat.
– Priorité liée aux programmes 1 et 2.
|
| Sommaire des progrès |
|
Quels progrès ont été réalisés à l'égard de cette priorité?
Les intervenants doivent comprendre et apprécier le rôle du CEPMB dans l'amélioration du système de soins de santé. Le CEPMB a entreprise l'initiative suivante afin de s'assurer que les intervenants sont informés et mobilisés.
- Le CEPMB a annoncé le lancement d'un compte Twitter afin d'améliorer la communication avec ses intervenants.
- Le Guide du brevetéix a été mis à jour et affiché sur le site Web du CEPMB. Les mises à jour précisent le processus afin de remplir et de produire les formulaires 1 et 2 en format électronique, ce qui est devenu obligatoire en vertu du Règlement modifié. Le Guide du breveté modifié tient également compte des changements dans la déclaration des produits médicamenteux en vente libre et vétérinaires ainsi que du nouveau calendrier de déclaration de la première date des ventes.
- Dans le numéro d'octobre 2012 de La Nouvelle, le CEPMB a annoncé que les formules pour la vérification des prix internationaux remontent à 2002. Chaque liste annuelle donne un aperçu des sources et de la méthodologie dont se sert le personnel du Conseil pour calculer, s'il y a lieu, les prix départ–usine à partir des prix inscrits sur la liste nationale des médicaments.
- Le 6 décembre 2012, la Direction des affaires réglementaires et de la liaison auprès des brevetés a tenu sa toute première séance CEPMB 101. La séance a été créée à l'intention de participants provenant de sociétés pharmaceutiques qui avaient peu d'expérience du travail avec le CEPMB.
- Les résultats du Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices (2012) ont été publiés sur le site Web du CEPMB sous Loi, Règlement et Lignes directrices.
- En avril 2013, deux nouveaux rapports d'analyse sont été publiés par le CEPMB : L'utilisation de bandelettes de test glycémique dans certains régimes publics d'assurance-médicaments, 2008 x et la dernière édition de L'Observateur des médicaments émergentsxi.
- En mai 2013, le CEPMB a commencé des consultations sur des initiatives afin de modifier ce qui suit :
- la méthodologie de rajustement du prix selon l'indice des prix à la consommation (IPC);
- le Règlement sur les médicaments brevetés en faisant passer de deux à une déclaration annuelle des renseignements sur le prix et les ventes pour les médicaments brevetés actuels par les brevetés et en modifiant l'exigence selon laquelle les brevetés doivent présenter les renseignements le premier jour de la vente des nouveaux médicaments brevetés.
|
Analyse des risques
| Risque |
Stratégie de réaction au risque |
Lien vers l'architecture d'alignement des programmes |
Lien vers les priorités organisationnelles |
| Non‑conformité aux nouvelles Lignes directrices du Conseil |
- Le CEPMB a approuvé un Plan de surveillance et d'évaluation des lignes directrices
- le Conseil continue de relever les défis posés par l'opérationnalisation des nouvelles Lignes directrices. Le Conseil a tôt fait de clarifier l'interprétation et l'application de ses Lignes directrices et d'adopter des approches destinées à faciliter la mise en œuvre efficiente des nouveaux éléments. Ce processus en est cours.
|
Le CEPMB n'a qu'un résultat stratégique. Ainsi, tous les risques sont associés à ce résultat. |
Ce risque est lié à la priorité 1 – Accroître la conformité aux Lignes directrices |
| L'évolution de la nature et de la distribution de médicaments brevetés dans des domaines plus complexes et innovateurs peut faire obstacle à la capacité du CEPMB à réaliser son mandat |
- Le Conseil s'engage dans son travail à évaluer et à examiner les modifications qu'il pourrait apporter à ses Lignes directrices pour qu'elles demeurent efficaces tant pour ce qui est de faciliter l'examen du prix des médicaments brevetés par le personnel du Conseil que de promouvoir la conformité volontaire de la part des brevetés.
- Le Conseil continue de se concentrer sur la transparence et les communications.
- Les fonds du CEPMB continuent d'être affectés à la tenue de séances d'information en personne à l'intention des brevetés et à l'amélioration de l'accessibilité et de l'utilité des documents sur le site Web du Conseil.
|
Le CEPMB n'a qu'un résultat stratégique. Ainsi, tous les risques sont associés à ce résultat.. |
Ce risque est lié à la priorité 1 – Accroître la conformité aux Lignes directrices
et à la priorité 3 – Transparence et communications |
| Les modifications touchant l'établissement des prix et le remboursement des médicaments brevetés dans les sept pays de comparaison énumérés dans le Règlement peuvent avoir une incidence sur le cadre législatif et réglementaire du CEPMB |
- Le CEPMB continue de surveiller et d'évaluer les modifications touchant l'établissement des prix et le remboursement des médicaments brevetés dans les sept pays de comparaison dont il tient compte pour examiner ses prix.
- Le CEPMB surveille les nouveaux prix départ–usine publics et l'incidence des remboursements sur l'exactitude de ces prix.
|
Le CEPMB n'a qu'un résultat stratégique. Ainsi, tous les risques sont associés à ce résultat. |
Ce risque est lié à la priorité 1 – Accroître la conformité aux Lignes directrices |
| Une plus grande utilisation d'ententes, relatives à l'inscription des produits par les payeurs publics et, à l'avenir peut–être les payeurs privés, pourrait remettre en question l'incidence et la pertinence du CEPMB |
- Le CEPMB surveille et évalue les modifications touchant l'établissement des prix et le remboursement des médicaments brevetés aux payeurs publics.
|
Le CEPMB n'a qu'un résultat stratégique. Ainsi, tous les risques sont associés à ce résultat. |
Ce risque est lié à la priorité 1 – Accroître la conformité aux Lignes directrices |
Le CEPMB veille à ce que les prix départ–usine que facturent les brevetés pour les médicaments brevetés pour usage humain ou pour usage vétérinaire ne sont pas excessifs. Comme de nombreux organismes de réglementation, le CEPMB promeut et encourage la conformité volontaire comme façon efficace d'utiliser les ressources et de contrôler ses coûts ainsi que les coûts pour les brevetés. Le CEMPB a réussi à exercer son mandat en tenant un nombre restreint d'audiences publiques grâce, du moins en partie, au taux de conformité avec les Lignes directrices sur les prix excessifs du Conseil (Lignes directrices) et au recours à des Engagements de conformité volontaire.
En 2012‑2013, les prix de 1 328 médicaments brevetés nouveaux et existants ont été déclarés au CEPMB. De ce nombre, les prix de 1 090 médicaments brevetés (82,1 %) ont été établis selon les Lignes directrices, ceux de 139 médicaments brevetés (10,5 %) l'ont été à des prix qui ne justifiaient pas la tenue d'une enquête et les prix de 31 médicaments brevetés (2,3 %) ont été considérés comme non excessifs après l'approbation d'un Engagement de conformité volontaire. En conséquence, le taux de conformité globale pour 2012-2013 était de 94,9 %.
Le Conseil continue de relever les défis posés par l'opérationnalisation des nouvelles Lignes directrices. En 2012‑2013, le Conseil a fourni une clarification relative aux examens du prix « sur un marché ». En 2013‑2014, le Conseil songera à des options de modifications à apporter à la méthodologie de rajustement du prix selon l'indice des prix à la consommation (IPC). Les modifications ont pour but de fournir une plus grande transparence et prévisibilité à la méthodologie de rajustement du prix selon l'IPC.
D'après les premières indications, deux des modifications les plus importantes aux Lignes directrices sont la reconnaissance a) de l'innovation progressive et b) de la pratique des brevetés consistant à offrir des avantages aux consommateurs et aux payeurs dans le cadre de leurs modèles d'affaires et de distribution, éléments qui ont renforcé la conformité et ont aidé à gérer efficacement les ressources du CEPMB.
Depuis l'entrée en vigueur des nouvelles Lignes directrices, le CEPMB surveille et évalue de façon continue l'application et l'incidence des modifications apportées aux Lignes directrices. En juin 2011, le CEPMB a publié le Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices. La deuxième évaluation annuelle dans le cadre du Plan a été présentée au Conseil en décembre 2012, et un tableau résumant les résultats a été publié en janvier 2013.
À mesure que les brevetés et le personnel du Conseil acquièrent l'expérience de l'application des nouvelles Lignes directrices et que le processus de surveillance et d'évaluation avance, de nouvelles questions continuent d'être cernées. Dans de tels cas, les précisions seront rapidement communiquées au moyen de La Nouvelle trimestrielle, et les intervenants seront consultés sur les modifications proposées aux Lignes directrices grâce au processus Avis et commentaires. Une version à jour des Lignes directrices, qui tient compte des changements et des précisions, est publiée chaque année en juin.
Au Canada, le contexte de l'établissement des prix et du remboursement évolue au fil du temps et s'est passablement transformé au cours de l'année qui vient de s'écouler. Le CEPMB continue de se pencher sur son processus d'examen du prix afin de trouver des façons d'améliorer son efficacité et de veiller à ce que le processus demeure pertinent dans un contexte en changement. Le Conseil tient en ce moment des consultations sur une proposition de remplacement de la présentation des rapports réglementaires semestriels du formulaire 2 – Renseignements identifiant les médicaments brevetés existants et renseignements sur leur prix par une présentation annuelle.
Afin de répondre aux besoins de l'environnement changeant, le Conseil continue de se concentrer sur la transparence et les communications. À cette fin, le CEPMB a annoncé le lancement d'un compte Twitter afin d'améliorer la communication avec ses intervenants. De plus, en décembre 2012, la Direction des affaires réglementaires et de la liaison auprès des brevetés a tenu sa toute première séance CEPMB 101. La séance a été créée à l'intention de participants provenant de sociétés pharmaceutiques qui ont peu d'expérience du travail avec le CEPMB.
À l'échelle internationale, le CEPMB continue de surveiller et d'évaluer les modifications touchant l'établissement des prix et le remboursement des médicaments brevetés dans les sept pays de comparaison dont il tient compte pour examiner ses prix3. En particulier, les changements en Allemagne et au Royaume–Uni sont étroitement surveillés afin d'évaluer toute incidence éventuelle qu'ils peuvent avoir sur l'application par le CEPMB de son cadre législatif et réglementaire et de ses Lignes directrices.
Une réponse de la direction et un plan d'action ont été élaborés en réponse au rapport d'évaluation et ont été affiché sur le site Web du CEPMB en février 2013. La réponse de la direction et le plan d'action abordent les considérations mises en évidence dans le rapport d'évaluation au moyen de l'examen de façons pour (i) accélérer ses processus et simplifier davantage les Lignes directrices, (ii) alléger le fardeau réglementaire et (iii) utiliser efficacement ses ressources, le tout sans compromettre son rôle de protection. À cette fin, le CEPMB a récemment terminé un Avis et commentaires et il prévoit de consulter davantage ses intervenants à l'automne 2013 au sujet d'initiatives proposées de réduction du fardeau réglementaire.
En avril 2013, au moyen de l'initiative du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB a publié deux rapports d'analyse : L'utilisation de bandelettes de test glycémique dans certains régimes publics d'assurance–médicaments, 2008 et la dernière édition de L'Observateur des médicaments émergents. D'autres études sont prévues pour 2013‑2014, comme l'indique le Programme de recherche du SNIUMP disponible sur le site Web du CEPMB, sous SNIUMP.
Le CEPMB continue également de travailler à son modèle de planification intégrée des ressources humaines et des activités. Une séance de planification stratégique se tiendra en septembre.
Sommaire du rendement
Ressources financières – Total pour le Conseil (en milliers de dollars)
Total des dépenses budgétaires
(Budget principal desdépenses)
2012-2013 |
Dépenses prévues
2012-2013 |
Total des autorisations
(disponibles)
2012-2013 |
Dépenses réelles
(crédits autorisés utilisés)
2012-2013 |
Différence
(dépenses prévues par rapport aux dépenses réelles) |
|
La différence entre les dépenses prévues et le total des autorisations est d'environ 888,4 k$, montant qui est composé d'un remboursement de 464 k$ en salaires et traitements non contrôlables, de modifications à la convention collective de 39,9 k$ et d'un report prospectif de 384 k$. Le total des autorisations comprend une affectation à but spécial (ABS) qui est utilisée afin de mener des audiences publiques pour un montant de 3 100 k$. L'ABS peut uniquement être utilisée pour couvrir les coûts associés aux audiences publiques, comme le recours à des conseillers juridiques externes, à des témoins experts, entre autres. Tout montant non utilisé pour la fin prévue doit être retourné au Trésor. En raison de la difficulté à prévoir le nombre d'audiences et leur complexité, aux fins de la prévision des dépenses prévues, on suppose que toute l'ABS sera dépensée au cours d'un exercice donné. En 2012‑2013, la différence entre les dépenses prévues et les dépenses réelles découle principalement d'une péremption d'environ trois millions de dollars dans l'ABS et de 774 k$ d'économies découlant des processus d'efficience et de rationalisation des opérations.
|
| 11 832,4 |
11 832,4 |
12 720,7 |
8 056,8 |
3 775,6 |
Ressources humaines (équivalent temps plein – ETP)
Prévues
2012-2013 |
Réelles
2012-2013 |
Différence
2012-2013 |
|
Le CEPMB a déterminé qu'en conséquence des gains en efficience découlant d'autres initiatives, il était en mesure de ne pas doter de huit à dix postes vacants, sans que cela n'ait d'incidence importante sur ses activités.
|
| 76,0 |
60,4 |
15,6 |
| Résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs afin de protéger les intérêts de la population canadienne, et les intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques. |
| Programme |
Total des dépenses budgétaires (Budget principal des dépenses 2012-2013) |
Dépenses prévues |
Autorisations totales (disponibles) 2012-2013 |
Dépenses réelles (crédits autorisés utilisés) |
Alignment to Government of Canada Outcomes |
| 2012-2013 |
2013–2014 |
2014–2015 |
2012-20134 |
2011-2012 |
2010-2011 |
|
* En 2011-2012, la Cour fédérale a annulé une ordonnance du Conseil émise en 2008-2009 et a ordonné que la somme de 2 512 878 $ soit remise au breveté dans les plus brefs délais, majorée des intérêts appropriés et des frais déterminés totalisant 46,9 milliers de dollars. Les dépenses réelles pour 2011-2012 comprennent le montant de 2 559,8 milliers de dollars remboursé au breveté.
|
Programme 1
Réglementation du prix des médicaments brevetés |
7 508,1 |
7 508,1 |
6 781,3 |
6 781,3 |
7 837,1 |
3 888,8 |
7 346,7 |
4 357,3 |
Healthy Canadians |
Programme 2
Tendances relatives aux produits pharmaceutiques |
1 265,4 |
1 265,4 |
1 328,8 |
1 287,4 |
1 325,1 |
983,3 |
1 010,5 |
890,4 |
Healthy Canadians |
Résultat stratégique 1
Total partiel |
8 773,5 |
8 773,5 |
8 110,1 |
8 068,7 |
9 162,2 |
4 872,1 |
*8 357,3 |
5 122,4 |
|
Tableau récapitulatif du rendement pour les services internes (en milliers de dollars)
| Services internes |
Total des dépenses budgétaires
(Budget principal des dépenses 2012–2013) |
Dépenses prévues |
Autorisations totales (disponibles)
2012–2013 |
Dépenses réelles (crédits autorisés utilisés) |
| 2012-2013 |
2013–2014 |
2014–2015 |
2012-2013 |
2011-2012 |
2010-2011 |
| |
3 058,9 |
3 058,9 |
3 068,4 |
2 833,9 |
3 558,5 |
3 184,7 |
3 397,1 |
4 348,3 |
| Total partiel |
3 058,9 |
3 058,9 |
3 068,4 |
2 833,9 |
3 558,5 |
3 184,7 |
3 397,1 |
4 348,3 |
Tableau récapitulatif du rendement total (en milliers de dollars)
| Résultat stratégique, programmes et services internes |
Total des dépenses budgétaires
(Budget principal des dépenses
2012–2013) |
Dépenses prévues |
Autorisations totales (disponibles)
2012-2013 |
Dépenses réelles (crédits autorisés utilisés) |
| 2012-2013 |
2013–2014 |
2014–2015 |
2012-2013 |
2011-2012 |
2010-2011 |
| |
11 832,4 |
11 832,4 |
11 178,6 |
10 902,6 |
12 720,7 |
8 056,8 |
11 754,4 |
9 470,7 |
| Total |
11 832,4 |
11 832,4 |
11 178,6 |
10 902,6 |
12 720,7 |
8 056,8 |
11 754,4 |
9 470,7 |
Les dépenses prévues pour 2012-2013 sont fondées sur l'hypothèse selon laquelle le CEPMB dépensera le montant total de 3,1 millions de dollars de l'affectation à but spécial (ABS), dont les fonds sont réservés pour la tenue d'audiences publiques. Cela est fait puisque ces frais dépendent entièrement du nombre d'audiences tenues de même que de la durée et de la complexité de chaque audience, ce qui est très difficile à prévoir. Pour cette raison, les fonds de l'ABS qui ne sont pas requis pour la tenue d'audiences sont retournés au Trésor. De plus, les dépenses prévues pour 2012-2013 n'ont pas été réduites pour tenir compte des économies que le CEPMB a réalisées au moyen de processus d'efficience et de rationalisation des opérations. Cependant, les économies réalisées ont été déduites des dépenses prévues au cours des années futures.
Les dépenses prévues pour 2013-2014 comprennent un report estimatif d'environ 234,5 milliers de dollars.
Les dépenses réelles pour 2012-2013 sont grandement inférieures aux dépenses prévues en raison d'un écart d'environ trois millions de dollars des fonds de l'ABS et de 776 milliers de dollars des fonds de fonctionnement. Ces écarts comprennent les 774 milliers de dollars en économies réalisées au moyen de processus d'efficience et de rationalisation des opérations.
Les dépenses réelles pour 2011-2012 comprennent un remboursement à un breveté de 2 559,8 milliers de dollars5.
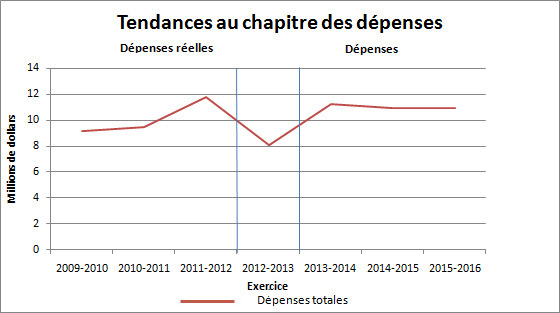
Profil des dépenses
Tendances au chapitre des dépenses ministérielles
[D]
Budget des dépenses par crédit voté
En septembre 2008, le CEPMB a reçu 4,7 millions de dollars (sans le RASE), qui s'ajoutent aux 5,8 millions de dollars du budget de services votés, ce qui lui permet de répondre aux pressions de sa charge de travail et de poursuivre ses initiatives continues liées à la prestation de son mandat. Le crédit 40 (Dépenses de programme) a été augmenté de 5,6 millions de dollars pour 2009-2010, de 6,2 millions de dollars pour 2010-2011 et de 5,8 millions de dollars pour 2011‑2012 et les années ultérieures (dont le RASE, exception faite des frais des locaux de Travaux publics et Services gouvernementaux Canada).
Le financement total du CEPMB comprend une affectation à but spécial (ABS) de 3,1 millions de dollars, utilisée pour la tenue d'audiences publiques. L'ABS peut uniquement être utilisée pour couvrir les coûts associés aux audiences publiques, comme le recours à des conseillers juridiques externes, à des témoins experts, entre autres. Tout montant non utilisé pour la fin prévue doit être retourné au Trésor.
En 2011-2012, le CEPMB a déclaré une augmentation des dépenses réelles en raison du remboursement à un breveté en conséquence d'une ordonnance de la Cour fédérale de 2 559,8 milliers de dollars.
En 2012-2013, le CEPMB comptait des fonds non utilisés d'environ trois millions de dollars pour l'ABS et de 776 milliers de dollars pour son budget de fonctionnement.
Les dépenses prévues des années subséquentes sont fondées sur l'hypothèse selon laquelle l'ensemble des fonds de l'ABS seront dépensés à tous les exercices.
Pour plus de renseignements sur les crédits organisationnels du CEPMB et/ou les dépenses prévues par règlement, veuillez consulter les Comptes publics du Canada de 2013 (Volume II)xii. Une version électronique des Comptes publics du Canada de 2013 est accessible sur le site Web de Travaux publics et Services gouvernementaux Canada.
Évaluation environnementale stratégique [ministères non assujettis à la SFDD]
Au cours de 2012–2013 les membres du Conseil d'examen du prix des médicaments brevetés se sont penchés sur les répercussions environnementales des initiatives assujetties à la Directive du Cabinet sur l'évaluation environnementale des projets de politiques, de plans et de programmes. Aucune des initiatives entreprises par le CEPMB n'est assujettie à cette directive.
Section II : Analyse des programmes et des sous programmes par résultat stratégique
Résultat stratégique
Le CEPMB n'a qu'un résultat stratégique :
Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs afin de protéger les intérêts de la population canadienne, et les intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques.
Deux programmes, en plus des services internes, appuient ce résultat stratégique.
| Résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs afin de protéger les intérêts de la population canadienne, et les intervenants sont tenus informés des tendances relatives aux produits pharmaceutiques. |
| Indicateurs de rendement |
Cibles |
Résultats réels |
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette des prix pratiqués dans les sept pays de comparaison nommés dans le Règlement. |
Au Canada, les prix des médicaments brevetés se situent au niveau ou sous la médiane des prix internationaux. |
Comme pour les années précédentes, les prix canadiens étaient habituellement dans la fourchette des prix des pays de comparaison. |
Le Rapport annuel du CEPMB présente des statistiques détaillées pour la comparaison des prix étrangers des prix des médicaments brevetés et de leur prix au Canada. Durant de nombreuses années, le CEPMB a rapporté le ratio des prix moyens des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada en convertissant les prix pratiqués dans les pays de comparaison à un montant équivalent en dollars canadiens, au moyen du taux de change du marché. (Plus précisément, la moyenne sur 36 mois du taux de change du marché habituellement utilisé par le CEPMB lorsqu'il applique ses lignes directrices.) L'examen des résultats obtenus au moyen de la conversion des devises au taux de change du marché permet de constater que les prix canadiens, comme les années précédentes, étaient habituellement dans la fourchette des prix observés des pays de comparaison. Les prix canadiens correspondaient à peu près aux prix en Suisse. Les prix en France, en Italie, au Royaume–Uni et en Suède étaient sensiblement plus bas que les prix canadiens, alors que les prix en Allemagne étaient substantiellement plus élevés. Comme pour les années précédentes, les prix reportés des États–Unis étaient bien plus élevés que les prix au Canada ou dans n'importe quel autre pays de comparaison.
Programmes
Le Programme de réglementation du prix des médicaments brevetés
Le CEPMB exerce un contrôle sur les prix moyens non excessifs des produits médicamenteux brevetés pour usage humain et pour usage vétérinaire vendus au Canada. Par cette activité de programme, le CEPMB examine les prix demandés par les brevetés pour leurs médicaments brevetés en fonction des facteurs d'examen du prix prévus dans la Loi, afin de s'assurer que ces prix ne sont pas excessifs. Lorsque le Conseil constate, à l'issue d'une audience publique, qu'un prix est excessif sur un marché, il peut ordonner au breveté de réduire ce prix et de prendre des mesures pour rembourser les recettes excessives qu'il a tirées de la vente de son médicament à des prix excessifs.
Ressources financières – À l'échelon de programme (milliers de dollars)
Total des dépenses budgétaires
(Budget principal des dépenses
2012-2013 |
Dépenses prévues
2012-2013 |
Autorisations totales
(disponibles)
2012-2013 |
Dépenses réelles
(crédits autorisés utilisés)
2012-2013 |
Différence
2012-2013 |
| 7 508,1 |
7 508,1 |
7 837,1 |
3 888,8 |
3 619,3 |
Human Resources (FTEs) – For Program
Ressources prévues
2012-2013 |
Ressources réelles
2012-2013 |
Différence
2012-2013 |
| 44,0 |
30,3 |
13,7 |
Résultats du rendement – À l'échelon de programme
| Résultats attendus |
Indicateurs de rendement |
Objectifs |
Résultats réels |
| La conformité des brevetés à la Loi sur les brevets, à la réglementation et aux Lignes directrices |
Pourcentage de médicaments brevetés dont les prix sont fixés en conséquence de la conformité volontaire, suivant les Lignes directrices ou ne justifient pas la tenue d'une enquête |
Les prix de 95 % des médicaments brevetés sont volontairement fixés suivant les Lignes directrices ou ne justifient pas la tenue d'une enquête |
Les prix de 92,5 % des médicaments brevetés sont volontairement fixés suivant les Lignes directrices ou ne justifient pas la tenue d'une enquête
|
| Pourcentage de médicaments brevetés faisant l'objet d'une ordonnance du Conseil |
Les ordonnances du Conseil sont intégralement respectées |
L'intégralité des Engagements de conformité volontaire et des ordonnances du Conseil ont été respectés |
Analyse du rendement et leçons retenues
En 2012, le personnel du Conseil a effectué un examen du prix de 1 321 des 1 328 médicaments brevetés nouveaux ou existants vendus au Canada pour usage humain déclarés au CEPMB. Au 31 mars 2013, sept médicaments brevetés faisaient toujours l'objet d'un examen. Le prix de 1 090 médicaments ayant fait l'objet d'un examen était fixé suivant les Lignes directrices et le prix de 139 autres ne justifiait pas la tenue d'une enquête – le prix de 92,5 % des médicaments brevetés était volontairement fixé suivant les Lignes directrices ou ne justifie pas la tenue d'une enquête. Cela est légèrement en dessous du 94,6 % déclaré l'an dernier dans le RMR.
Depuis la mise en œuvre des nouvelles Lignes directrices en janvier 2010, le pourcentage de médicaments brevetés dont le prix est volontairement fixé suivant les Lignes directrices ou ne justifient pas la tenue d'une enquête était de plus de 90 %, soit : 91,1 % en 2010, 94,6 % en 2011 et 92,5% en 2012.
Par sa surveillance des répercussions à court terme et à long terme des principaux changements aux Lignes directrices, le Conseil a pu fournir des précisions sur les Lignes directrices et, au besoin, apporter rapidement des corrections. Par le Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices, le Conseil continue de surveiller les répercussions de ses Lignes directrices. Le Conseil consulte actuellement ses intervenants sur deux initiatives, soit la méthodologie de rajustement du prix selon l'IPC et le nombre de rapports réglementaires sur les prix et les ventes annuels par les brevetés.
L'élimination de l'utilisation de l'IPC projeté et l'engagement relatif à l'utilisation de l'IPC réel des brevetés permettraient d'examiner les augmentations de prix de manière plus prévisible et avec plus d'assurance. Cela devrait entraîner un plus grand respect. De plus, l'ajout proposé au formulaire 1 et la suppression du formulaire 2 pour le premier jour de ventes réduiront le fardeau réglementaire des brevetés. Le Conseil prévoit que des exigences de déclaration moins lourdes soutiendront et, peut–être, amélioreront le respect par les brevetés.
Le programme des tendances relatives aux produits pharmaceutiques
Le CEPMB effectue des recherches et des analyses sur les tendances relatives aux produits pharmaceutiques et fait rapport, chaque année, au Parlement des tendances observées et des dépenses des brevetés dans la recherche et le développement par l'intermédiaire de la ministre de la Santé. Au moyen du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB effectue également des recherches et des analyses critiques des tendances relatives aux prix, à l'utilisation et aux coûts des médicaments brevetés et non brevetés vendus sous ordonnance.
Ressources financières – À l'échelon du programme (milliers de dollars)
Total des dépenses budgétaires
(Budget principal des dépenses
2012-2013 |
Dépenses prévues
2012-2013 |
Autorisations totales
(disponibles)
2012-2013 |
Dépenses réelles
(crédits autorisés utilisés)
2012-2013 |
Différence
2012-2013 |
| 1 265,4 |
1 265,4 |
1 325,1 |
983,3 |
282,1 |
Ressources humaines (ETP) – À l'échelon du programme
Ressources prévues
2012-2013 |
Ressources réelles
2012-2013 |
Différence
2012-2013 |
| 13,0 |
7,8 |
5,2 |
Résultats en matière de rendement – À l'échelon du programme
| Résultats attendus |
Indicateurs de rendement |
Objectifs |
Résultats réels |
| Les intervenants sont plus conscients des tendances relatives aux produits pharmaceutiques de même que des facteurs de coût. |
Nombre d'appels de fichier dans le site Web |
Augmentation de 5 % du nombre de demandes par rapport à l'année précédente |
|
| Nombre de présentations organisées par le CEPMB dans le cadre de réunions externes. |
10 événements par année |
11 événements |
Analyse du rendement et leçons retenues
Toutes les publications du CEPMB, y compris les études, les décisions du Conseil et les documents de référence, sont accessibles sur le site Web du CEPMB. Le CEPMB poursuit le travail commencé en 2011 d'amélioration du contenu afin d'y ajouter plus de contexte et d'améliorer la convivialité de l'environnement. Le site Web retravaillé améliorera les activités de communication externe du CEPMB, en plus d'accroître la sensibilisation du public envers son rôle et ses activités générales, notamment en ce qui concerne les tendances de l'industrie pharmaceutique et les facteurs à l'origine des coûts en médicaments.
En 2012‑2013, en plus de nombreuses réunions avec divers intervenants, le CEPMB a pris part à onze événements externes et des membres de son personnel se sont exprimés à diverses audiences, y compris auprès des principaux intervenants : brevetés, provinces, payeurs tiers et groupes de défense des droits des patients. Le CEPMB continue d'utiliser les nouveaux médias, tels les vidéoconférences et les webinaires, pour atteindre un plus grand nombre d'intervenants.
En 2012-2013, par l'initiative du SNIUP6 le CEPMB a effectué deux nouvelles études analytiques, soit :
- L'utilisation de bandelettes de test glycémique dans certains régimes publics d'assurance–médicaments, 2008 (révisée en avril 2013)
- L'Observateur des médicaments émergents – avril 2013
Ces rapports ont été publiés et affichés sur le site Web du CEPMB en avril 2013.
Services internes
Les services internes sont des groupes d'activités et de ressources connexes qui sont gérés de façon à répondre aux besoins des programmes et des autres obligations générales d'une organisation. Ces groupes sont les suivants : services de gestion et de surveillance, services des communications, services juridiques, services de gestion des ressources humaines, services de gestion financière, services de gestion de l'information, services des technologies de l'information, services des biens immobiliers, services du matériel, services des acquisitions, et services de voyages et autres services administratifs. Les Services internes comprennent uniquement les activités et les ressources destinées à l'ensemble d'une organisation et non celles fournies à un programme particulier.
Ressources financières – À l'échelon du programme (milliers de dollars)
Total des dépenses budgétaires
(Budget principal des dépenses
2012-2013 |
Dépenses prévues
2012-2013 |
Autorisations totales
(disponibles)
2012-2013 |
Dépenses réelles
(crédits autorisés utilisés)
2012-2013 |
Différence
2012-2013 |
| 3 058,9 |
3 058,9 |
3 558,5 |
3 397,1 |
(125,8) |
Ressources humaines (ETP) – À l'échelon du programme
Ressources prévues
2012-2013 |
Ressources réelles
2012-2013 |
Différence
2012-2013 |
|
* Deux ressources ont été réaffectées des activités de programme pour soutenir la mise en œuvre de la base de données essentielle.
|
| 19,0 |
22,3 |
(3,3)* |
Section III : Renseignements supplémentaires
Faits saillants des états financiers
État condensé des opérations et de la situation financière nette ministérielle
|
Conseil d'examen du prix des médicaments brevetés
État condensé des opérations et de la situation financière nette ministérielle (non audité)
Pour l'exercice terminé le 31 mars 2013
(en milliers de dollars)
|
| |
Résultats
prévus*
2012–2013 |
Résultats réels
2012–2013 |
Résultats réelss
2011–2012 |
Variation en dollars (résultats réels contre résultats prévus 2012–2013) |
Variation en dollars (résultats réels 2012–2013 par rapport à ceux de 2011–2012) |
|
* Les recettes non disponibles ne peuvent être utilisées pour compenser les obligations du Conseil. Les recettes non disponibles sont obtenues au nom du Gouvernement du Canada. Les recettes non disponibles recueillies par le CEPMB le sont en raison de paiements versés par les brevetés au gouvernement du Canada au moyen d'Engagements de conformité volontaire ou d'ordonnances du Conseil pour compenser les recettes excessives. En 2012-2013, le CEPMB a recueilli des recettes non disponibles à raison de 19 670,4 milliers de dollars. Au cours de 2011-2012, les recettes non disponibles étaient de 11 195,5 milliers de dollars. Cependant, ce montant a été compensé par la mise en place du passif éventuel à verser au nom du Gouvernement du Canada d'un montant de 2 801,3 milliers de dollars; le montant des recettes non remboursable était de 8 394,2 milliers de dollars.
|
| Total des charges |
13 138,5 |
8 338,8 |
10 506,7 |
(4 799,7) |
(2 167,8) |
| Total des revenus |
|
|
|
|
|
| Coût de fonctionnement net avant le financement du gouvernement et les transferts |
13 138,5 |
8 338,8 |
10 506,7 |
(4 799,7) |
(2 167,8) |
| Situation financière nette du ministère |
|
(636,8) |
(1 505,1) |
|
868,3 |
État condensé de la situation financière
|
Conseil d'examen du prix des médicaments brevetés
État condensé de la situation financière (non audité)
Au 31 mars 2013
(en milliers de dollars)
|
| |
2012-2013 |
2011-2012 |
Différence en dollars |
| Total net liabilities |
1 228,6 |
2 120,2 |
(891,6) |
| Total net financial assets |
525,9 |
615,1 |
(89,2) |
| Departmental net debt |
702,7 |
1 505,1 |
(802,4) |
| Total non–financial assets |
65,9 |
0 |
65,9 |
| Departmental net financial position |
(636,8) |
(1 505,1) |
868,3 |
Passifs nets
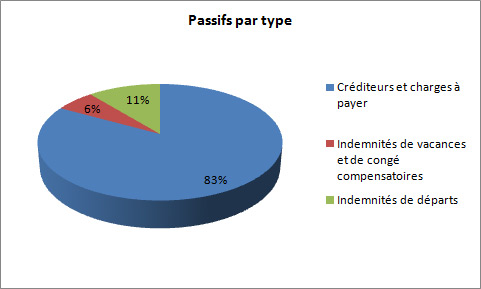
Le total des passifs étaient de 1 228,6 milliers de dollars à la fin de 2012-2013, une baisse de 891,6 milliers de dollars par rapport à l'année précédente. La diminution des passifs est répartie de la manière suivante :
- Diminution de 404,2 milliers de dollars pour les créditeurs et charges à payer.
- Diminution de 1,3 millier de dollars pour les indemnités de vacances et de congés compensatoires.
- Diminution de 486,0 milliers de dollars pour les indemnités de départs.
[D]
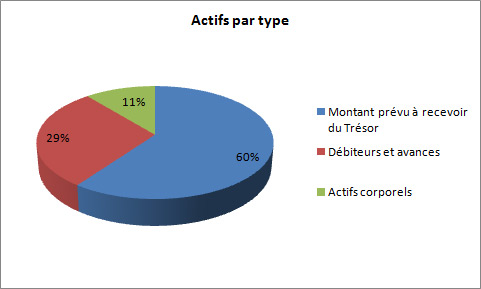
Actifs financiers nets
Le total des actifs était de 591,8 milliers de dollars à la fin de 2012-2013, une baisse de 10,0 milliers de dollars par rapport à l'année précédente. Les écarts des actifs étaient les suivants :
- Diminution de 107,5 milliers de dollars du montant prévu à recevoir du Trésor.
- Hausse de 18,3 milliers de dollars pour les débiteurs et avances.
- Hausse de 66 milliers de dollars pour les actifs corporels.
[D]
États financiers
Les principales données financières présentées dans le présent Rapport ministériel sur le rendement ont pour but de fournir un aperçu général de la position financière et des opérations du CEPMB. Les États financiersxiii du CEPMB sont accessibles sur son site Web.
Tableaux de renseignements supplémentaires
- Écologisation des opérations gouvernementales
- Vérifications internes et évaluations à venir
- Sources des revenus disponibles et des revenus non disponibles
La version électronique de tous les tableaux de renseignements supplémentaires qui figurent dans le Rapport sur les plans et les priorités de 2013-2014 est affichée sur le site Web du CEPMBxiv.
Rapport Dépenses fiscales et évaluations
Il est possible de recourir au régime fiscal pour atteindre des objectifs de la politique publique en appliquant des mesures spéciales, comme de faibles taux d'impôt, des exemptions, des déductions, des reports et des crédits. Le ministère des Finances Canada publie annuellement des estimations et des projections du coût de ces mesures dans son rapport intitulé Dépenses fiscales et évaluations. Les mesures fiscales présentées dans le rapport Dépenses fiscales et évaluations relèvent de la seule responsabilité du ministre des Finances Canada.
Section IV : Autres sujets d'intérêt
Coordonnées de la personne–ressource de l'organisation
Le Conseil d'examen du prix des médicaments brevetés
Case L40
Centre Standard Life
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 613-952-7360
Sans frais : 1-877-861-2350
Télécopieur : 613-952-7626
ATS : 613-957-4373
Courriel : pmprb@pmprb-cepmb.gc.ca
Site Web : www.pmprb-cepmb.gc.ca
Renseignements supplémentaires
Rapport annuel 2012 du CEPMB – http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=91
Publication trimestrielle La Nouvelle – http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=287
Guide du breveté – http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1731
Compendium des politiques, des Lignes directrices et des procédures – Réédition : juin 2012
http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1733
Loi sur les brevets (http://laws-lois.justice.gc.ca/fr/P-4/index.html)
Règlement sur les médicaments brevetés (http://laws.justice.gc.ca/fr/P-4/DORS-94-688/index.html
Notes de fin de document
1 La Politique sur la SGRR a récemment subi des modifications qui sont entrées en vigueur le 1er avril 2013. En conséquence, des mises à jour ont été apportées à la nomenclature de la SGRR. En particulier, l'Architecture des activités de programmes est maintenant l'Architecture d'alignement des programmes et les activités de programmes sont maintenant simplement le programme.
2 Les différents types de priorités sont définis comme suit : priorité déjà établie – établie au cours du premier ou du deuxième exercice précédant l'exercice visé par le rapport; priorité permanente – établie au moins trois exercices avant l'exercice visé par le rapport; priorité nouvelle – établie au cours de l'exercice visé par le RPP ou le RMR.
3 France, Allemagne, Italie, Suède, Suisse, Royaume‑Uni et États‑Unis.
4 Pour assurer la concordance avec les autorisations ministérielles par programme, telles qu'elles sont présentées dans le volume II des Comptes publics, les services à l'égard desquels aucun montant n'est imputé au titre de la cotisation de l'employeur à des régimes d'assurance pour les employés, comme le Régime de soins de santé de la fonction publique et le Régime des soins dentaires de la fonction publique fournis par le Secrétariat du Conseil du Trésor du Canada, les locaux fournis par Travaux publics et Services gouvernementaux Canada, l'indemnisation des accidents du travail fournies par Ressources humaines et Développement des compétences Canada et les services juridiques fournis par le ministère de la Justice Canada, ne sont pas compris dans ce montant. Ces renseignements sont uniquement présentés dans les états financiers ministériels.
5 En 2011-2012, le CEPMB fait rapport d'une augmentation du total des autorisations entraînées par un financement supplémentaire reçu de 2 559,8 milliers de dollars visant à couvrir un remboursement d'une ordonnance du Conseil ordonné par un tribunal. Après une audience du Conseil qui a eu lieu en 2008-2009 conformément à la Loi sur les brevets, le Conseil a jugé que le breveté avait vendu deux médicaments brevetés au Canada à des prix excessifs. Le Conseil lui avait ordonné de verser 2 512 878 $ à la Couronne. En 2011-2012, la Cour fédérale a annulé l'ordonnance du Conseil et a ordonné que la somme de 2 512 878 $ soit rapidement remboursée au breveté, avec des intérêts appropriés et les frais déclarés, qui s'élevaient à 46,9 milliers de dollars.
6 Le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) est une initiative de recherche mise en œuvre conjointement par les ministres de la Santé fédéral, provinciaux et territoriaux en septembre 2001. Le CEPMB est autorisé à réaliser des activités en vertu de l'initiative du SNIUMP suite à une demande officielle du ministre fédéral de la Santé en vertu de l'article 90 de la Loi sur les brevets, et conformément au mandat du CEPMB qui consiste à faire rapport sur les tendances relatives aux produits pharmaceutiques. Des renseignements supplémentaires sur cette initiative sont accessibles sur le site Web du CEPMB à www.pmprb-cepmb.gc.ca, sous SNIUMP.
i On peut trouver le programme du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/SNIUMP.
ii On peut trouver le Plan de surveillance et d'évaluation des principales modifications aux Lignes directrices 2012 sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Loi, Règlement et Lignes directrices/Lignes directrices.
iii Pour une clarification relative aux examens du prix « sur un marché », consultez le numéro d'avril 2012 de La Nouvelle sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Publications/La Nouvelle.
iv On peut trouver le rapport d'évaluation intitulé Évaluation du Conseil d'examen du prix des médicaments brevetés – Rapport final – Le 30 juin 2012 sur le site Web du CEPMB :
www.pmprb-cepmb.gc.ca/Responsabilisation/Évaluation de programme.
v On peut trouver la Réponse de la direction à l'Évaluation des programmes du CEPMB de 2011-2012 sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Responsabilisation/Évaluation de programme.
vi On peut trouver les options et une recommandation de changements à la méthodologie de rajustement du prix selon l'indice des prix à la consommation (IPC) – Rapport final – Recommandations de suivi sur la mise en œuvre de la méthodologie de la majoration sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Consultations/Groupe de travail technique sur la méthodologie de la majoration.
vii On peut trouver l'Avis et commentaires sur les modifications proposées à la méthodologie selon l'indice des prix à la consommation (IPC) et les exigences en matière de rapport sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/ Consultation/Avis et commentaires/Réduction du fardeau réglementaire.
viii On peut trouver les normes de service du CEPMB sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Loi, Règlement et Lignes directrices/Gestion de la réglementation/Normes de service.
ix On peut trouver le Guide du breveté – Mise à jour : février 2012 sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Publications/Guides et Lignes directrices.
x On peut trouver le rapport analytique intitulé L'utilisation de bandelettes de test glycémique dans certains régimes publics d'assurance–médicaments, 2008 sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Publications/Études analytiques.
xi On peut trouver le rapport analytique intitulé, L'Observateur des médicaments émergents sur le site Web du CEPMB : http://www.pmprb-cepmb.gc.ca/Publications/Études analytiques.
xii On peut trouver les Comptes publics du Canada 2013 (Volume II) sur le site Web de Travaux publics et Services gouvernementaux Canada : http://www.tpsgc-pwgsc.gc.ca/recgen/cpc-pac/index-fra.html
xiii On peut trouver les États financiers sous Rapports au parlement sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca/Rapports au parlement.
xv On peut trouver la version électronique de tous les tableaux de renseignements supplémentaires qui figurent dans le Rapport ministériel sur le rendement de 2013-2014 sur le site Web du CEPMB: www.pmprb-cepmb.gc.ca/Rapports au parlement sous Rapport ministériel sur le rendement.