La Nouvelle Juillet 2006
Volume 10, No 3
Table des matières
- Un nouveau président et une nouvelle vice-présidente
- Depuis notre dernier numéro...
- Semaine nationale de la fonction publique 2006
- Aurevoir et bienvenue
- Message du Président
- Avis d'audience publiés depuis la parution de la livraison d'avril 2006 de La Nouvelle
- Engagements de conformité volontaire :
- Suivi des prix des médicaments non brevetés distribués sous ordonnance et rapport sur les tendances observées
- Modifications proposées au Règlement sur les médicaments brevetés, 1994 – Publication dans la Partie II de la Gazette du Canada
- DIN existants vendus par d'autres brevetés : pratiques du personnel du Conseil
- ERBITUX, Bristol-Myers Squibb Canada Inc.
- Compétence du CEPMB : Quand un brevet est-il lié à un médicament ?
- Consultations publiques sur les Lignes directrices sur les prix excessifs
- SNIUMP - Mise à jour
- Tendances des dépenses nationales de santé (ICIS)
- Rapport de l'OCDE sur les dépenses en médicaments
- Liste des nouveaux médicaments lancés sur le marché canadien depuis la publication de notre numéro d'avril 2006
- Rapport sur un nouveau médicament breveté - Tarceva
- Réunion des 17-18 mai 2006 du Conseil d'examen du prix des médicaments brevetés
- Questions et commentaires
- À l'agenda
Nominations au Conseil
Le ministre de la Santé a récemment nommé le Dr Brien G. Benoit à la présidence du Conseil. Il a également nommé Mme Mary Catherine Lindberg à la vice-présidence.
Le Dr Benoit a été nommé membre du Conseil en mai 2005 et vice-président en octobre 2005. Le poste de président étant sans titulaire, il exerçait également les fonctions de la présidence du Conseil.
Mme Mary Catherine Lindberg, qui est actuellement directrice exécutive du Conseil des hôpitaux universitaires de l'Ontario, était auparavant sous-ministre adjointe au ministère de la Santé de l'Ontario.
Vous trouverez les notes biographiques des différents membres du Conseil sur notre site Web sous la rubrique « Le CEPMB; Membres du Conseil ».
Voici les principales activités qui ont retenu l'attention du CEPMB depuis la fin d'avril 2006.
- 24-26 avril : Première séance de l'audience publique dans l'affaire Shire BioChem Inc. et son médicament Adderall XR.
- 27-28 avril : Ria Mykoo, avocate-conseil, a participé à Toronto à la conférence « Fundamentals of Administrative Law & Practice, An In-Depth, Practical Guide for Lawyers, Arbitrators and Tribunal Members », tenue à Toronto.
- 4 mai : Sylvie Dupont, Secrétaire du Conseil, a fait une présentation sur le rôle du CEPMB dans le cadre de la Conférence sur la pharmacothérapie tenue au Centre de santé de l'université McGill de Montréal.
- 8 mai : Publication de l'Avis d'audience dans l'affaire de Teva Neuroscience G.P.-S.E.N.C. et de son médicament Copaxone.
- 11-12 mai : Catherine Lombardo, gestionnaire à la direction de la Conformité, a assisté à la réunion du Comité consultatif sur les produits pharmaceutiques tenue à Ottawa.
- 16 mai : Brigitte Joly, agente de conformité, a donné une présentation sur le rôle du Conseil à la Conférence sur les tendances pharmaceutiques 2006, tenue à Montréal.
- 18 mai : Andrew MacDonald, économiste principal, a fait une présentation sur le rôle du Conseil à la Conférence sur les tendances pharmaceutiques 2006, tenue à Mississauga.
- 17-18 mai : Réunion trimestrielle du Conseil. Vous trouverez à la page 15 un sommaire du procès-verbal de cette réunion.
- 19 mai : Le Conseil a tenu à Ottawa une conférence préparatoire dans l'affaire de 3M Canada et du prix de son médicament Airomir. L'audience sur le fond aura lieu du 16 au 19 octobre 2006. Vous trouverez de plus amples renseignements sur les audiences du Conseil sur notre site Web sous la rubrique « Mandat de réglementation, Audiences ».
- 31 mai : Le CEPMB a présenté au ministre de la Santé son rapport annuel pour l'année 2005.
- 2 juin : Barbara Ouellet et Paul De Civita ont présenté aux cadres supérieurs de Santé Canada les points saillants du rapport annuel du CEPMB pour 2005.
- 6 juin : Barbara Ouellet a assisté à Ottawa à la comparution du ministre de la Santé devant le Comité permanent de la Santé réuni pour discuter du budget principal des dépenses.
- 7-9 juin : Le Conseil a tenu à Ottawa la première séance d'une audience publique dans l'affaire Janssen-Ortho Inc. concernant le prix de son médicament Risperdal Consta. L'audience a été reprise les 27 et 28 juin et reprendra à nouveau le 28 septembre prochain. Pour de plus amples renseignements, consultez notre site Web sous la rubrique « Mandat de réglementation; Audiences; Risperdal Consta ».
- 11-13 juin : Barbara Ouellet et Ria Mykoo ont assisté à Ottawa à la 22e conférence annuelle du Conseil des tribunaux administratifs canadiens qui avait pour thème Un tribunal administratif intégré : du concept à la réalité. Sylvie Dupont y a animé l'atlier Préparation de l'instance.
- 21 juin : Dépôt au Parlement du Rapport annuel du CEPMB pour l'exercice 2005.
- 22-23 juin : Réunion du Comité directeur du SNIUMP. Publication du rapport « Sommaire des tendances des prix des produits pharmaceutiques ».
- 26-27 juin : Greg McComb, économiste principal, a assisté à Toronto à l'atelier Improving Drug
Accessibility in Canada.
- 4 juillet : Publication du premier rapport trimestriel « Prix des médicaments non brevetés distribués sous ordonnance : Tendances des prix pratiqués au Canada et dans les pays de comparaison ».
Semaine nationale de la fonction publique 2006
La Semaine nationale de la fonction publique, qui souligne l'apport des fonctionnaires fédéraux des quatre coins du pays, a eu lieu du 12 au 16 juin 2006. Elle avait pour thème « Nos gens, notre diversité, notre avenir! ».
Pour rendre hommage à ses dévoués employés, le CEPMB les a reçus le 15 juin à un déjeuner.
- Bienvenue à Murray Suchorab qui a récemment joint le groupe de l'informatique.
- Robert Sauvé, directeur depuis 1997 des Services généraux, a pris sa retraite après 32 années de carrière dans la fonction publique fédérale. Merci Robert pour ta contribution au CEPMB et heureuse retraite!
- Bonne chance à Richard McAteer qui a nous a quittés pour relever de nouveaux défis à Santé Canada.

Félicitations Robert!
Rapport annuel du CEPMB pour l'année 2005

Dr. Brien G. Benoit, Président du CEPMB
Le 21 juin dernier, le ministre de la Santé, l'honorable Tony Clement, a déposé au Parlement notre rapport annuel 2005.
Le rapport présente une analyse détaillée de différents sujets, nommément : les tendances des prix et des ventes de tous les médicaments au Canada, incluant des comparaisons avec les prix pratiqués dans d'autres pays, la conformité des brevetés aux Lignes directrices sur les prix excessifs, les activités d'application, les dépenses des brevetés en R-D au Canada et différentes études. En 2005, la valeur des ventes de tous les médicaments au Canada a totalisé 16,1 milliards de dollars, ce qui représente une hausse de 1,3 % par rapport à 2004. Cette hausse est la plus faible hausse des quinze dernières années.
Les prix pratiqués par les fabricants de médicaments brevetés, mesurés au moyen de l'Indice des prix des médicaments brevetés (IPMB), ont par contre enregistré une augmentation moyenne de 0,8 % en 2005. Le ratio des prix pratiqués au Canada par rapport à la médiane des prix pratiqués dans les pays de comparaison était cette année encore sous la parité. Les prix des différents médicaments brevetés pratiqués au Canada représentaient environ 92 % de la médiane des prix pratiqués dans les pays de comparaison.
Toujours en 2005, 66 nouveaux médicaments brevetés ont fait l'objet d'un rapport au CEPMB dont 16 étaient de nouvelles substances actives. Le nombre total de médicaments brevetés assujettis à l'examen du prix du CEPMB est ainsi passé à 1 109 en 2005. Les activités d'application ont également été en croissance avec huit engagements de conformité volontaire. Le Conseil a également clos son audience dans l'affaire de LEO Pharma et le prix de son médicament Dovobet. Enfin, le Conseil a déjà émis cinq Avis d'audience en 2006.
Les brevetés ont déclaré en 2005 des dépenses de R-D totalisant 1,23 milliard de dollars. Les ratios des dépenses de R-D par rapport aux recettes tirées des ventes ont légèrement augmenté par rapport à 2004 passant à 8,7 % pour l'ensemble des brevetés et à 8,8 % pour les brevetés membres de Rx&D. Les brevetés ont déclaré des dépenses de 215,1 millions de dollars dans la recherche fondamentale. Même si ce montant représente 18,2 % des dépenses courantes de R-D, la proportion des dépenses dans ce type de recherche a reculé de 3 % par rapport à 2004.
Les consultations sur les changements proposés au Règlement sur les médicaments brevetés, 1994 ont été engagées dans un effort pour simplifier le processus d'examen du prix des médicaments et d'en accroître l'efficience. Les modifications proposées au Règlement ont été publiées le 31 décembre 2005 dans la partie I de la Gazette du Canada. Le Conseil s'est aussi penché sur la question des augmentations des prix des médicaments brevetés. Dans le cadre de cet examen, les intervenants ont soulevé des questions plus pressantes dont, entre autres, l'examen des prix de lancement des médicaments brevetés qui font actuellement l'objet de plus amples consultations.
En novembre 2005, le CEPMB a été chargé par le ministre de Santé Canada de faire un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Le premier rapport d'une série de rapports trimestriels a été rendu public le 4 juillet dernier. Ce rapport est intitulé Tendances des prix pratiqués au Canada et dans les pays de comparaison. Le CEPMB a également publié au cours des dix-huit derniers mois quatre rapports au titre du Système national d'information sur les médicaments prescrits (SNIUMP) dont le tout dernier, rendu public en juin, porte l'intitulé Sommaire des tendances des prix des produits pharmaceutiques 1997-1998 à 2003-2004.
Enfin, le CEPMB continue d'exercer son mandat avec le même souci d'efficacité, de transparence et de protection des intérêts des consommateurs canadiens qui l'a toujours animé.

Brien G. Benoit, M.D.
Président du CEPMB
Copaxone1, Teva Neuroscience G.P.-S.E.N.C.
Le 8 mai 2006, le vice-président du Conseil a publié un Avis d'audience dans l'affaire de Teva Neuroscience G.P.-S.E.N.C. (« Teva ») et le prix de son médicament Copaxone. Une conférence préparatoire aura lieu le 20 septembre 2006.
L'objet de cette audience est d'établir si, en vertu des articles 83 et 85 de la Loi sur les brevets, Teva vend ou a vendu le médicament Copaxone sur tout marché canadien à un prix que le Conseil juge excessif et, le cas échéant, de déterminer l'ordonnance qu'il y a lieu de rendre.
Concerta2, Janssen-Ortho Inc.
Le 21 juillet, le président du Conseil a publié un Avis d'audience dans l'affaire de Janssen-Ortho Inc. (« Janssen-Ortho ») et le prix de son médicament Concerta. Une conférence préparatoire aura lieu le 15 septembre 2006.
L'objet de cette audience est d'établir si, en vertu des articles 83 et 85 de la Loi sur les brevets, Janssen-Ortho vend ou a vendu le médicament Concerta sur tout marché canadien à un prix que le Conseil juge excessif et, le cas échéant, de déterminer l'ordonnance qu'il y a lieu de rendre.
Pour toute demande d'information, communiquez avec la Secrétaire du Conseil :
Sylvie Dupont
Secrétaire du Conseil d'examen du prix des médicaments brevetés
Centre Standard Life, 333, avenue Laurier ouest, Bureau 1400
Ottawa (Ontario) K1P 1C1
Interurbains sans frais : 1 877 861-2350
Téléphone : (613) 954-8299
Télécopieur : (613) 952-7626
Courriel : sdupont@pmprb-cepmb.gc.ca
- Le Copaxone est indiqué pour réduire la fréquence des poussées chez les patients ambulatoires atteints de sclérose en plaques évoluant par poussée de type récurrence/rémittente.
- Le Concerta est indiqué pour le traitement des troubles d'hyperactivité avec déficit de l'attention (THADA).
NuvaRingMD 1, Organon Canada Ltd.
Le 20 juin 2006, le vice-président du Conseil a accepté l'engagement de conformité volontaire que lui a soumis Organon Canada Ltd. (« Organon ») pour son médicament NuvaRing.
Organon s'est engagé à porter le prix de transaction moyen du NuvaRing au niveau ou sous le niveau du prix maximum non excessif (MNE) de 2006 établi à 13,6791 $ et au plus tard le 31 juillet 2006 à faire parvenir au personnel du Conseil des preuves qu'il a appliqué cette réduction.4
En guise de remboursement des recettes excessives tirées entre le 17 janvier et le 30 juin 2005 de la vente de son médicament à un prix excessif, Organon remettra la somme de 115 584,93 $ au gouvernement du Canada au plus tard le 31 juillet 2006. Organon réduira de plus le prix de son médicament Remeron RD 15 mg, 30 mg et 45 mg dans la mesure requise pour rembourser les recettes excessives tirées de la vente du NuvaRing à des prix excessifs entre le 1er juillet 2005 et le 30 juin 2006. Dans l'éventualité où les recettes excessives n'auraient pas été totalement remboursées, Organon remettra au plus tard le 30 janvier 2007 au gouvernement du Canada la somme non remboursée, laquelle sera calculée par le personnel du Conseil.
Organon veillera à maintenir le prix de son médicament NuvaRing dans les limites autorisées par les Lignes directrices et ce, jusqu' à ce que le brevet arrive à échéance, soit jusqu'en 2018.
Eloxatin2, sanofi-aventis Canada Inc.
Le 14 juillet 2006, le président du Conseil a accepté l'engagement de conformité volontaire que lui a soumis sanofi-aventis Canada Inc. (« Sanofi- Aventis ») pour son médicament Eloxatin.
En vertu de cet engagement, Sanofi-Aventis a reconnu que, au moment du lancement de son médicament sur le marché canadien, les prix MNE des comprimés de 50 mg et de 100 mg de son médicament étaient respectivement de 430,9208 $ et de 922,6750 $ et que, pour 2006, ils sont respectivement de 490,5901 $ et de 1 030,0175 $. En lieu d'une réduction du prix de la fiole de 50 mg et pour éviter une distorsion de la relation entre le prix de la fiole de 50 mg et le prix de la fiole de 100 mg, Sanofi-Aventis maintiendra à 1 000 $ le prix de la fiole de 100 mg tant et aussi longtemps que le prix MNE de la fiole de 50 mg du médicament Eloxatin n'aura pas atteint 500 $.
Pour rembourser les recettes excessives tirées de la vente de son médicament à un prix excessif, Sanofi-Aventis remettra la somme de 1 767 078,84 $ aux hôpitaux, centres anticancéreux et organismes de lutte contre le cancer qui ont acheté son médicament à des prix excessifs. Le montant des remises sera établi au prorata des achats du médicament Eloxatin effectués aux quatre coins du pays jusqu'en date du 31 mars 2006. Sanofi-Aventis informera ses clients ayant droit à la remise que celle-ci leur est faite en vertu d'un engagement de conformité volontaire et les invitera à prendre connaissance de son libellé sur le site Web du CEPMB. Il transmettra également au personnel du CEPMB copie de toute correspondance liée à l'engagement.
Enfin, Sanofi-Aventis veillera à ce que le prix du médicament Eloxatin au Canada demeure conforme aux Lignes directrices jusqu'en juin 2019.
Hextend3, Hospira Healthcare Corporation
Le 14 juillet 2006, le président du Conseil a accepté l'engagement de conformité volontaire que lui a soumis Hospira Healthcare Corporation (« Hospira ») pour son médicament Hextend.
Au titre de cet engagement, Hospira reconnaît que le prix MNE d'un millilitre (mL) du médicament Hextend est 0,0858 $ pour 2004 et 2005. Hospira veillera à ce que le prix de transaction moyen de son médicament pour 2006 se situe dans les limites du prix MNE. Ainsi, si le prix du médicament Hextend aux États-Unis exprimé dans la monnaie du pays ne change pas ou augmente, le prix MNE sera le moindre prix entre le prix rajusté pour tenir comtpe de l'IPC et 0,0858 $ le mL. Par contre, si le prix du médicament Hextend aux États-Unis exprimé dans la monnaie du pays diminue, une comparaison des prix internationaux utilisant le nouveau prix pratiqué aux États-Unis sera effectuée pour établir un nouveau prix MNE.
Hospira versera au gouvernement du Canada un paiement de 8 823,60 $ en guise de remboursement des recettes excessives tirées entre le 15 mars et le 31 décembre 2004 de la vente de son médicament à un prix excessif.
Hospira veillera à ce que le prix du médicament Hextend au Canada demeure conforme aux Lignes directrices, tant et aussi longtemps que le prix du médicament sera assujetti à la compétence du CEPMB.
- Le médicament NuvaRing, un concept nouveau en matière de contraception, est un anneau vaginal souple, doux et transparent qui libère progressivement son ingrédient actif.
- L'Eloxatin est indiqué pour traiter les patients souffrant d'un cancer métastatique du colon ou du rectum qui a resurgi ou qui a progressé durant la thérapie de première ligne en association avec le bolus 5-FU/LV et l'irinotécan ou dans les six mois suivant celle-ci.
- Le médicament Hextend est indiqué pour le traitement de l'hypovolémie lorsque le volume plasmatique doit être augmenté.
- Les engagements de conformité volontaire sont des documents publics et sont affichés sur notre site Web sous la rubrique « Mandat de réglementation, Engagements de conformité volontaire ».
Le 4 juillet 2006, le CEPMB a rendu public un premier rapport sur les prix des médicaments non brevetés distribués sous ordonnance préparé au titre de la Stratégie nationale sur les produits pharmaceutiques. Ce rapport porte l'intitulé « Tendances des prix des médicaments pratiqués au Canada et dans les pays de comparaison ». En septembre 2004, les premiers ministres du pays réunis en conférence se sont engagés à élaborer et à mettre en œuvre la Stratégie nationale sur les produits pharmaceutiques dans un effort concerté pour mieux relever les défis que les coûts des médicaments posent au régime canadien de soins de santé. La Stratégie cherche à atteindre la parité internationale des prix des médicaments non brevetés.
Le premier rapport de cette série de rapports trimestriels que le CEPMB produira dans le cadre de cette fonction donne un aperçu des tendances des prix et des ventes des médicaments d'ordonnance, des résultats des comparaisons de prix internationaux et des variations de prix importantes. Le rapport s'intéresse exclusivement aux prix auxquels les fabricants et les grossistes vendent aux pharmacies les médicaments non brevetés distribués sous ordonnance. Autrement dit, les tendances font référence aux prix que paient les pharmacies aux fabricants et aux grossistes et non aux prix que paient les consommateurs et les régimes d'assurance-médicaments.
Les prix des médicaments au Canada ont été comparés aux prix des mêmes médicaments pratiqués dans onze pays convertis à l'aide des taux de change du marché et des parités des pouvoirs d'achat. La liste des pays de comparaison (l'Australie, la Finlande, la France, l'Allemagne, l'Italie, les Pays-Bas, la Nouvelle-Zélande, l'Espagne, la Suisse, le Royaume Uni et les États-Unis) a été établie par les gouvernements F-P-T. Les données sont présentées par segment de marché, par pays et par groupe thérapeutique principal. Les segments du marché couverts dans l'étude sont les médicaments génériques et non brevetés distribués sous ordonnance. Cette étude présente également des données sur les médicaments brevetés distribués sous ordonnance offrant ainsi une vue d'ensemble des tendances des prix des médicaments distribués sous ordonnance.
Le CEPMB a fait preuve de transparence aux diverses étapes de son processus d'analyse. Il a notamment donné aux représentants du secteur pharmaceutique et aux intervenants la possibilité de formuler leurs commentaires concernant la table des matières et la méthodologie de l'étude. De plus, l'ébauche du rapport ainsi que les méthodologies suivies ont été soumises à l'examen d'un comité d'experts constitué par le CEPMB.
Le deuxième rapport de cette nouvelle série de rapports trimestriels devrait être publié au cours de l'automne 2006. Il fournira de plus amples renseignements sur les tendances des prix des médicaments pratiqués au Canada et dans d'autres pays, et plus particulièrement aux niveaux de la structure du marché et de la concurrence sur les marchés des médicaments distribués sous ordonnance.
Le processus de modification du Règlement sur les médicaments brevetés, 1994 suit son cours depuis la publication des modifications proposées dans la partie I de la Gazette du Canada le 31 décembre 2005. En effet, depuis cette date, le CEPMB a reçu les commentaires des intervenants, rencontré les représentants de Rx&D, l'association des sociétés de recherche pharmaceutique du Canada, et proposé d'autres révisions à la lumière des commentaires reçus.
La version révisée des modifications au Règlement, incluant le résumé de l'étude d'impact de la réglementation (RÉIR), a été récemment soumise à l'approbation du ministre de la Santé. Lorsque le ministre aura donné son aval, le document sera soumis à l'approbation finale du Comité du Cabinet du Conseil du Trésor pour sa publication dans la Partie II de la Gazette du Canada. Le règlement révisé entrera en vigueur le jour de son enregistrement.
Le paragraphe 9.5 du chapitre 1 des Lignes directrices du CEPMB sur les prix excessifs (Lignes directrices) portant l'intitulé « Produits médicamenteux existants vendus par un autre breveté » prévoit ce qui suit : « Lorsqu'un produit médicamenteux est vendu au Canada par d'autres personnes que le premier titulaire du brevet visant le médicament, les Lignes directrices du CEPMB continuent de s'appliquer aux DIN vendus par ces personnes au même titre qu'elles s'appliquaient pour le premier breveté. Par exemple, si un breveté cesse de vendre un produit médicamenteux breveté et cède ses droits de commercialisation à un autre breveté, le nouveau DIN sera considéré comme la continuation du DIN original aux fins de l'application des Lignes directrices. »
Le personnel du Conseil a depuis toujours interprété et appliqué cette disposition des Lignes directrices de manière à assujettir le titulaire subséquent d'un brevet lié à un DIN au prix maximal non excessif (MNE) qui limite le prix que pouvait pratiquer le premier titulaire du brevet lié au DIN. Ainsi, le personnel du Conseil a systématiquement considéré cette situation comme une « seconde attribution d'un DIN existant ». Par conséquent, aux fins du rajustement du prix pour tenir compte de l'Indice des prix à la consommation (IPC), lorsque le prix de transaction moyen (PTM) pratiqué par le deuxième breveté est moins élevé que le prix MNE du premier breveté, le personnel du Conseil considère comme prix de référence le PTM que pratique le deuxième breveté la première année qu'il devient titulaire du brevet.
Cette application des Lignes directrices repose sur le principe que le prix du DIN vendu par le breveté subséquent ne peut être plus élevé que le prix MNE autorisé avant que le DIN passe à un autre breveté. Ainsi, le prix de référence pour le nouveau titulaire du brevet lié au DIN correspondra au plus bas prix entre le prix MNE du premier breveté et le prix de transaction moyen du nouveau breveté. Dans un tel contexte, les Lignes directrices sont appliquées de la façon suivante : lorsque le prix de référence est établi de cette manière pour le nouveau breveté, la méthodologie de rajustement du prix tenant compte de l'IPC est appliquée même s'il s'agit de la première année de vente du médicament. On présume alors que le nouveau breveté n'a pas accès à l'information du premier breveté concernant le prix de transaction moyen.
Le personnel du Conseil reconnaît toutefois qu'il peut exister des circonstances où le nouveau breveté, qui a acheté les droits de commercialisation d'un DIN donné a accès à l'information sur les ventes et la valeur de ventes du premier breveté pour le DIN dont il a acquis les droits de commercialisation.
Dans le cas où le nouveau breveté démontre à la satisfaction du personnel du Conseil qu'il a eu accès à l'information sur le prix et sur la valeur des ventes du DIN du premier breveté, le personnel du Conseil estime approprié de permettre l'application de la même méthodologie de rajustement du prix pour tenir compte de l'IPC que le premier breveté aurait pu appliquer.
Par conséquent, le personnel du Conseil appliquera de cette manière les Lignes directrices lorsque le nouveau breveté démontrera qu'il a accès à l'information historique du prix et de la valeur des ventes du DIN du premier breveté.
Le CEPMB a affiché sur son site Web le rapport sommaire de l'examen du prix du médicament breveté Erbitux1.
La première vente au Canada du médicament Erbitux date de juin 2005 en vertu du Programme spécial d'accès de Santé Canada. L'Erbitux a obtenu son Avis de conformité le 9 septembre 2005. Le prix du médicament Erbitux est assujetti à l'examen du prix du CEPMB jusqu'à l'échéance du brevet.
Vous trouverez de plus amples renseignements sur le médicament breveté Erbitux sur notre site Web sous la rubrique « Mandat de réglementation, Médicaments brevetés, Rapports sur les nouveaux médicaments brevetés pour usage humain, Erbitux ».
- Administré en association avec l'irinotécane, l'Erbitux est indiqué pour le traitement du carcinome colorectal métastatique exprimant l'EGFR chez les patients réfractaires à d'autres schémas thérapeutiques à base d'irinotécane.
En vertu de la Loi sur les brevets, les « titulaires d'un brevet lié à un médicament » sont assujettis à la compétence du CEPMB en matière d'examen du prix des médicaments. Plus précisément, l'alinéa 79(2) de la Loi sur les brevets définit comme suit une « invention liée à un médicament » :
« (…) une invention est liée à un médicament si elle est destinée à des médicaments ou à la préparation ou la production de médicaments, ou susceptible d'être utilisée à de telles fins.»
Selon l'alinéa 1 du Préambule du Compendium des Lignes directrices, politiques et procédures et des articles 80 à 101 de la Loi, une invention est liée à un médicament lorsqu'elle est destinée à un médicament, à sa préparation ou à sa production ou qu'elle est susceptible d'être utilisée à de telles fins. La section 1 du préambule du Compendium des Lignes directrices, politiques et procédures définit comme suit le mot « médicament » :
1.5 Un médicament désigne toute substance ou mélange de substances fabriqué par quelque moyen biologique, chimique ou autre et qui est appliqué ou administré in vivo pour faciliter le diagnostic, le traitement, l'atténuation ou la prévention d'une maladie, de symptômes, de troubles ou d'états physiques anormaux ou, encore, qui modifie les fonctions organiques chez les humains ou chez les animaux, sans égard pour son mode d'administration.
1.6 Pour plus de certitude, cette définition comprend les vaccins, les préparations topiques, les anesthésiques et les produits de diagnostic utilisés in vivo, sans égard pour le mode d'administration (par ex. transdermique, gélule, injection, inhalation, etc.). Cette définition exclut les appareils médicaux, les produits diagnostiques in vitro et les désinfectants qui ne sont pas utilisés in vivo.
On peut également lire dans le préambule du Compendium que, « aux fins de la détermination de sa compétence, le CEPMB considère comme un brevet tout brevet d'invention canadien associé à un médicament. Sans être limitative, cette définition inclut les brevets accordés pour une substance active ainsi que les brevets des catégories suivantes :
- Brevet de produit
- Brevet portant sur un procédé de fabrication
- Brevet portant sur une forme posologique ou sur un mode d'administration faisant partie intégrante de l'administration du médicament
- Brevet portant sur des indications
- Brevet pouvant être utilisé, qu'il le soit ou non. »
Dans ICN Pharmaceuticals Inc. c. Canada (Personnel du Conseil d'examen du prix des médicaments brevetés) (C.A.) (1997) 1 C. F. 32, la Cour d'appel fédérale analyse quand un brevet est ou non lié à un médicament. Dans son jugement, la Cour d'appel fédérale a établi que les trois conditions préalables suivantes doivent être remplies pour que le CEPMB ait compétence sur le prix d'un médicament :
- Le breveté doit être le titulaire du brevet concernant l'invention
- l'invention doit être liée au médicament :
- Le produit pharmaceutique résultant de l'invention doit correspondre à la définition d'un « médicament » - interprétée dans son sens large
- Il doit exister un lien rationnel entre l'invention décrite dans le brevet et le médicament
- Le lien exigé n'exige aucune interprétation
- Le lien peut être ténu
- L'invention doit servir ou pouvoir servir au médicament, à sa préparation ou à sa production
- l'invention décrite dans le brevet ne doit pas obligatoirement être utilisée pour le médicament, pour sa préparation ou pour sa production
- le breveté vend le médicament au Canada.
L'application de la deuxième condition, et plus particulièrement de ses sous-conditions (b) et (c), pose souvent des problèmes d'interprétation.
Dans ICN, la Cour a rejeté les arguments cherchant à limiter ou à restreindre la compétence du Conseil. Elle a conclu que, dans leur sens large, les alinéas 79(2) et 83(1) de la Loi sur les brevets (l'alinéa 83(1) porte sur l'ordonnance que le Conseil peut rendre lorsqu'il arrive à la conclusion que le « titulaire du brevet d'une invention liée à un médicament » vend son médicament au Canada à un prix excessif) témoignent de l'intention du législateur de permettre que le lien requis soit prouvé sans qu'il soit nécessaire d'interpréter le brevet et le médicament. Le législateur a également prévu que le lien pouvait être ténu. La Cour d'appel fédérale a expliqué en ces termes les raisons pour lesquelles ce seuil est si bas :
« … aux fins du paragraphe 83(1) de la Loi, ce n'est que l'existence d'un brevet lié qui est en cause et non l'effet possible ou réel de celui-ci sur la capacité de concurrents éventuels d'accéder à un marché ou, en fait, la capacité du titulaire de brevet d'exercer une puissance commerciale… la phrase «... une invention liée à un médicament... » (Emphase ajoutée), et en particulier le terme « liée », font ressortir la volonté du législateur que le lien entre le brevet et le médicament revête un caractère général. Par exemple, il n'est pas nécessaire que le brevet serve effectivement à la production du médicament. Le paragraphe 83(1) ne saurait raisonnablement être interprété en ce sens. En outre, le Conseil a compétence à l'égard non seulement des brevets qui renferment une revendication de produit (une revendication du médicament en soi), mais également de ceux qui renferment une revendication de « procédé » et d'« utilisation ». Le droit applicable aurait pu être différent si le législateur avait employé les mots « une invention en vue d'un médicament... ». L'interprétation extensive du mot « liée » se justifie en outre par le libellé du paragraphe 79(2) qui élargit la notion de brevet lié à un médicament. »1
« Rien n'indique que cette disposition [paragraphe 79(2) ] doive être interprétée restrictivement… Il ne doit y avoir qu'un lien, aussi ténu soit-il, entre l'invention brevetée et le médicament vendu au Canada pour que le critère soit respecté. La raison d'ordre législatif en est simple. Exiger un lien plus étroit offrirait aux sociétés pharmaceutiques une ouverture à se soustraire à la compétence du Conseil et compromettrait le pouvoir de ce dernier de protéger les consommateurs canadiens contre l'établissement de prix excessifs. »2
« … les termes généraux employés aux paragraphes 83(1) et 79(2) de la Loi traduisent clairement l'intention du législateur de faire en sorte que l'existence du lien requis puisse être prouvée sans qu'il soit nécessaire d'interpréter le brevet. À l'appui de cette thèse, mentionnons que le mandat légal du Conseil n'a pour objet que l'établissement du prix des médicaments brevetés. Les membres du Conseil n'ont ni l'expérience ni l'expertise voulues pour se livrer à l'interprétation de brevets. De plus, l'argument d'ICN ne tient pas compte du fait que l'interprétation d'un brevet ou d'une revendication est une question de droit qui doit être tranchée par la Cour. Il ne serait tout simplement pas réaliste de s'attendre à ce que le Conseil retienne les services de témoins experts afin d'évaluer la preuve offerte par des parties comme ICN, puis évalue lui-même la preuve d'expert divergente. Comme il incombe au Conseil de mener à bien la poursuite (par l'entremise de son personnel) et de rendre une décision dans chacun des cas, par opposition à un rôle neutre d'arbitre vis-à-vis de la preuve présentée par les deux parties en présence, le critère du lien logique proposé par ICN (fondé sur l'interprétation des brevets) est irréaliste… »3
Pour établir le lien requis ou logique entre l'invention décrite dans un brevet et un médicament, il faut en premier lieu lire en totalité le brevet en portant une attention particulière aux revendications pour déterminer l'invention décrite dans le brevet. Considérant le fait qu'il peut être « ténu », le lien entre le médicament et l'invention décrite dans le brevet est facilement établi. Par exemple, dans de nombreux cas, le brevet décrit l'invention en faisant référence à l'ingrédient actif du médicament. Cet ingrédient actif constitue le lien logique entre le médicament et l'invention décrite dans le document du brevet et ce, même si tous les éléments de l'invention ne se retrouvent pas dans le médicament existant. Dans le jugement ICN, la Cour d'appel fédérale a noté que la formulation chimique d'un ingrédient actif contenu dans un médicament, le nom générique de cet ingrédient et le nom commercial ou de marque du médicament contenant cet ingrédient sont plus souvent qu'autrement synonymes et interchangeables et qu'ils peuvent tous servir à établir le lien logique entre le médicament et l'invention décrite dans le brevet :
« Le brevet '756, qui a expiré le 28 septembre 1993, décrit plusieurs procédés chimiques permettant de produire une substance dont la formule chimique est 1-8-D-ribofuranosyl-1,2,4- triazole-3-carboxamide. Il indique également que cette formule correspond au nucléoside privilégié de l'invention en cause. Le brevet '264 décrit une méthode permettant la synthèse enzymatique de la même formule et renvoie explicitement au brevet '756. Cependant, ni l'un ni l'autre des brevets n'emploient le mot «ribavirine ». Toutefois, le brevet '265 fait état de plusieurs utilisations de la même formule chimique, qu'il appelle «ribavirine (appellation non exclusive adoptée par le United States Adopted Names Council) » (voir le dossier d'appel, vol. 1, à la p. 81). Examinons maintenant l'avis de conformité et la monographie de produit. Les deux mentionnent le Virazole comme la marque déposée pour la ribavirine. De toute évidence, il n'est pas difficile d'établir un lien entre les deux brevets et le médicament vendu au Canada. À toutes fins utiles, la formule chimique décrite dans les brevets et les noms ribavirine et Virazole sont synonymes et interchangeables. »4
Après avoir établi l'existence d'un lien logique entre le médicament et l'invention décrite dans le brevet, le CEPMB doit vérifier si l'invention décrite dans le brevet est destinée à un médicament, à sa préparation ou à sa production ou si elle est susceptible d'être utilisée à de telles fins (Emphase ajoutée). Aucune importance ne doit être accordée au fait que le brevet soit ou non utilisé pour le médicament (Emphase ajoutée).
Dans ICN, la Cour d'appel fédérale a, concernant le brevet '264, décrit une méthode de production de la ribavirine, l'ingrédient actif du médicament breveté Virazole. Même si l'invention décrite dans le brevet '264 ne pouvait produire l'ingrédient ribavirine en quantité suffisante pour une application pharmaceutique, il n'en demeure pas moins que l'invention « visait » à produire de la ribavirine et, de ce fait, le brevet '264 est lié au médicament Virazole. La Cour a notamment mentionné :
« De prime abord, le brevet '264 n'indique pas qu'il est destiné à servir uniquement de procédé de recherche et de développement ou qu'il est seulement susceptible de permettre la production d'infimes quantités de ribavirine.
De prime abord, le brevet '264 décrit un procédé enzymatique qui est «destiné» à la production de ribavirine. Suivant le paragraphe 79(2), il n'est pas nécessaire qu'un brevet soit « apte » à être utilisé pour la production de cette substance chimique, pourvu qu'il s'agisse du résultat recherché. »5
Même si l'invention décrite dans le document du brevet n'est pas utilisée ou n'a pas été conçue pour la préparation ou pour la production du médicament, il n'en demeure pas moins qu'elle est susceptible de l'être (Emphase ajoutée). Dans l'affaire ICN, la Cour fédérale a noté que dans le contexte de la Loi sur les brevets l'expression « susceptible de l'être » ne doit pas être interprétée dans un sens s'apparentant aux expressions « susceptible d'être mis en marché» ou « raisonnablement praticable »6. De même, dans le cas plus récent de Hoechst Marion Roussel Canada Inc. c. Canada (Ministre de la Justice) [2005] C.F. No 1928 (Division de première instance) (« Hoechst »), où la Cour fédérale a appliqué les trois conditions mentionnées dans le jugement ICN, la Cour a rejeté l'argument du breveté selon lequel le brevet, en l'occurrence un système d'administration de nicotine au moyen d'un timbre transdermique, n'était pas lié au médicament Nicoderm étant donné que la structure du système d'administration de la nicotine, laquelle était protégée par le brevet, n'était pas utilisée pour le médicament Nicoderm. La Cour a affirmé :
« …Dans ICN précité, le Conseil et le juge de première instance ont tous deux conclu que la questions de savoir si le breveté utilisait le brevet en cause n'était pas pertinente pour déterminer, sur le plan juridique, si le brevet « est lié » à un médicament au sens de la Loi. »7
« Il ressort clairement du brevet '689 qu'il s'agit d'un brevet portant sur un timbre transdermique de nicotine, soit le même type de médicament que le Nicoderm, il est destiné à être utilisé ou peut être utilisé dans un médicament tel que le Nicoderm. »8
« … comme le brevet '689 porte sur un timbre transdermique de nicotine pouvant être utilisé dans le produit pharmaceutique Nicoderm, cela constitue un lien suffisant pour conclure que le brevet '689 est lié au Nicoderm. Il importe peu que le brevet '689 soit effectivement utilisé relativement au médicament Nicoderm. »9
Ceci dit, les brevetés devraient savoir que tout brevet lié à des formules modifiées de libération d'un médicament peut également être lié à des formules régulières du même médicament. Les brevetés devraient donc s'abstenir de prendre unilatéralement des décisions à savoir si un brevet est ou non lié à leur médicament. Plutôt que de taire l'existence d'un brevet qu'ils considèrent non lié à leur médicament, les brevetés auraient avantage à consulter le CEPMB concernant toute décision prise à cet égard et concernant également les motifs de cette décision. Sur ce point, la Cour d'appel fédérale a, dans son jugement concernant ICN, rappelé qu'il est important que l'industrie pharmaceutique respecte ses obligations en matière de rapport que lui imputent la Loi sur les brevets et son règlement d'application. Elle a mis en garde les brevetés que toute décision unilatérale de ne révéler l'existence d'un brevet sur la base que le breveté estime que le brevet n'est pas lié à son médicament risque de miner sa crédibilité et celle de ses témoins devant le Conseil en plus d'empêcher le Conseil de s'acquitter du mandat dont l'investit la Loi.10
- ICN Pharmaceuticals Inc. c. Canada (Personnel du Conseil d'examen du prix des médicaments brevetés) (C.A.) (1997) 1 C.F. 32 (ICN), par. 57
- ICN, par. 60
- ICN, par. 61
- ICN, par. 67
- ICN, par. 63
- [1996] C.F. No 206 (Division de première instance), par. 23
- Hoechst Marion Roussel Canada Inc. c. Canada (Ministre de la Justice) [2005] C.F. no 1928 (Division de première instance) (« Hoechst»), par. 118
- Hoechst, par. 119
- Hoechst, par. 120
- ICN, par. 78
Annoncée dans La Nouvelle d'avril dernier, la consultation sur les Lignes directrices du Conseil sur les prix excessifs (Lignes directrices) porte sur des points clés de l'examen des prix de lancement des médicaments brevetés, à savoir le classement des nouveaux médicaments, les tests appliqués aux prix de lancement des nouveaux médicaments ainsi que l'application dans le processus d'examen du prix de la clause de la Loi sur les brevets concernant « un marché canadien ». Le coup d'envoi de cette consultation a été donné le 23 mai avec la publication d'un guide de discussion expliquant ces sujets. Le guide de discussion a été distribué à des intervenants. Il est également affiché sur notre site Web. Le CEPMB sollicite les commentaires écrits des intervenants qui doivent lui être transmis au plus tard le 25 août 2006.
La prochaine étape de la consultation prendra la forme de rencontres qui seront organisées aux quatre coins du Canada ainsi que d'une rencontre en novembre réunissant des intervenants clés. Les rencontres auront lieu à Edmonton, à Toronto, à Montréal, à Halifax et à Ottawa et leur objectif sera de mieux renseigner les intervenants sur les problèmes que posent les Lignes directrices dans leur forme actuelle et d'explorer avec eux les changements imminents. Une dernière rencontre sera organisée au printemps 2007 pour discuter des changements possibles aux Lignes directrices.
Le Comité directeur du SNIUMP s'est réuni à Ottawa les 22 et 23 juin derniers. Le Comité se réunit deux fois par année pour passer en revue les projets en cours et pour discuter de nouveaux sujets de recherche et d'autres questions. Au cours de cette réunion, Kevin Wilson, directeur exécutif du Drug Plan & Extended Benefits Branch de Saskatchewan Health a quitté la présidence du Comité après deux mandats consécutifs de deux ans. Le CEPMB profite de l'occasion pour remercier Kevin pour l'excellent leadership dont il a fait preuve à la présidence du Comité. Le Comité s'est choisi un nouveau président en la personne d'Olaf Koester, Directeur, Drug Management Policy Unit, Healthy Living and Health Programs, Manitoba Health.
Nous avons publié le rapport Sommaire des tendances des prix des produits pharmaceutiques, 1997-1998 à 2003-2004 qui est affiché sur notre site Web. Par ailleurs, la première phase du prochain rapport, qui portera sur la méthodologie de prévision des dépenses du Programme, est actuellement à l'étape de l'approbation.
Les projets suivants sont actuellement en cours :
- Sommaire des tendances des prix des produits pharmaceutiques, 1997-1998 à 2004-2005
- Lignes directrices concernant l'analyse de l'incidence des prix des médicaments sur les budgets des régimes d'assurance-médicaments
- Méthodologie de prévision des dépenses de programme - Phase deux
- Processus d'établissement des prix des nouveaux médicaments
Le 10 mai 2006, l'Institut canadien d'information sur la santé (ICIS) a rendu publique la toute dernière édition de son rapport Dépenses en santé au Canada. Les données présentées dans cette publication annuelle, qui constitue la référence sur la valeur des achats au prix de détail de médicaments au Canada, sont établies à partir de la base de données sur les dépenses nationales de santé (BDDNS) de l'ICIS. Les données de la BDDNS sont des estimés de la consommation de produits pharmaceutiques par la population canadienne excluant la consommation en milieu institutionnel. Elles correspondent au prix réellement payé par les Canadiens, incluant les marges bénéficiaires du grossiste et du détaillant, les honoraires du pharmacien et les taxes. Ce rapport, qui donne des estimés annuels de la valeur des médicaments achetés par les Canadiens et par les Canadiennes entre 1985 et 2005, présente des données à jour des dépenses nationales en santé, des dépenses provinciales et territoriales en santé, des comparaisons internationales et des facteurs ayant une incidence sur les dépenses en médicaments au Canada. Il contient également une analyse des dépenses en médicaments des hôpitaux. Cette dernière analyse a été établie à partir de la Base de données canadiennes SIG.
Selon les estimés de l'ICIS, la valeur totale des dépenses en médicaments au Canada, couvrant les médicaments distribués sous ordonnance et les médicaments en vente libre, a augmenté de 10,9 % par rapport à 2004 pour atteindre 24,8 milliards de dollars en 2005. La valeur totale des dépenses en médicaments en 2005 représente environ six fois et demi celle estimée en 1985 (3,8 milliards de dollars). Par rapport à l'ensemble des dépenses en santé, la valeur des dépenses en médicaments a augmenté, passant de 9,5 % qu'elle était en 1985 à un taux estimé de 17,5 % pour 2005. Depuis 1997, les dépenses en médicaments sont une fois de plus supérieures aux dépenses engagées pour la rémunération des médecins, le deuxième poste de dépenses le plus élevé après celui des hôpitaux.
Par rapport à l'ensemble des dépenses en médicaments, les médicaments distribués sous ordonnance accaparent une part toujours plus grande des dépenses, passant de 67,5 % en 1985 à environ 83,2 % en 2005. Le secteur public devrait avoir engagé 46,0 % de ces dépenses. L'ICIS estime que les dépenses en médicaments distribués sous ordonnance engagées par le secteur public ont varié entre 32,3 % (Nouveau-Brunswick) et 50,9 % (Manitoba). Ces chiffres ne couvrent pas les dépenses en médicaments des hôpitaux, lesquelles se sont élevées à 1,5 milliard de dollars en 2003, dernière année pour laquelle des données étaient disponibles.
En ce qui concerne le montant que chaque Canadien ou Canadienne consacre personnellement à l'achat de médicaments, l'ICIS estime que le Canadien moyen a consacré 698 $ en 2004 et 770 $ en 2005 à l'achat de médicaments, ce qui représente une augmentation de 9,9 % pour 2004 et de 10,2 % pour 2005. Au niveau des provinces, les dépenses en médicaments par personne ont varié en 2005 entre 837 $ (Ontario) et 652 $ (Colombie-Britannique).
Au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP), le CEPMB a collaboré avec l'ICIS à l'évaluation de l'utilisation faite des médicaments par le secteur public et des dépenses engagées. L'information publiée dans le rapport Dépenses en médicaments au Canada constitue un complément à cette collaboration.
En juin 2006, l'Organisation de coopération et de développement économiques (OCDE) a publié sa mise à jour annuelle des statistiques relatives aux systèmes de santé des pays industrialisés. Cette mise à jour couvre les statistiques jusqu'à l'année 2004 inclusivement.
Voici un bref aperçu des statistiques de l'OCDE sur le secteur pharmaceutique. Il se limite aux résultats présentés pour le Canada et pour les sept pays auxquels le CEPMB se réfère pour les comparaisons des prix internationaux.
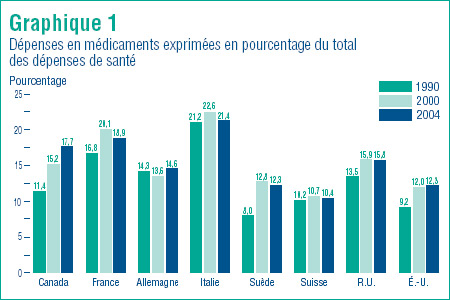
Le graphique 1, à la page 13, présente les dépenses en médicaments exprimées en pourcentage de l'ensemble des dépenses en santé pour les années 1990, 2000 et 2004.
En 2004, les dépenses en médicaments ont accaparé 17,7 % de l'ensemble des dépenses en santé au Canada. En 2000, ce pourcentage était de 15,2 % et de 11,4 % en 1990.
Des augmentations d'une même ampleur ont été enregistrées en Allemagne et aux États-Unis. Fait intéressant, dans tous les autres pays, les parts des dépenses en médicaments ont diminué entre les années 2000 et 2004.
Le graphique 1 montre également que la part des dépenses en médicaments par rapport à l'ensemble des dépenses en santé varie beaucoup d'un pays à un autre, allant de 10,4 % en Suisse à 21,4 % en Italie. La part du Canada, qui est de 17,7 %, se situe près de la moyenne.
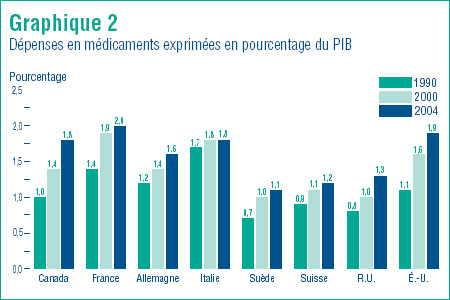
Le graphique 2 présente les dépenses en médicaments sous forme de pourcentage du revenu national mesuré à l'aide du PIB (Produit intérieur brut). Par rapport à 1990, tous les pays ont en 2004 consacré une part beaucoup plus grande de leur PIB aux dépenses en médicaments. Dans tous les cas, le ratio dépenses en médicaments par rapport au PIB a augmenté par rapport aux résultats de l'année 2000. La France (2,0 %), les États-Unis (1,9 %) et l'Italie (1,8 %) ont affiché les ratios les plus élevés. Par ailleurs, la Suède, la Suisse et le Royaume Uni ont enregistré des ratios respectifs de 1,1 %, 1,2 % et 1,3 %. Le ratio du Canada, qui est de 1,8 %, se maintient dans la fourchette des valeurs rapportées pour les autres pays.
Les critiques de la politique pharmaceutique du Canada accusent souvent notre pays de « profiter indûment » de la R-D effectuée ailleurs dans le monde, et plus particulièrement aux États-Unis. Les résultats présentés dans le graphique 2 montrent que telle accusation n'est pas justifiée. Proportionnellement, la population canadienne consacre à l'achat de médicaments un pourcentage presque aussi grand de son PIB que la population des États-Unis.
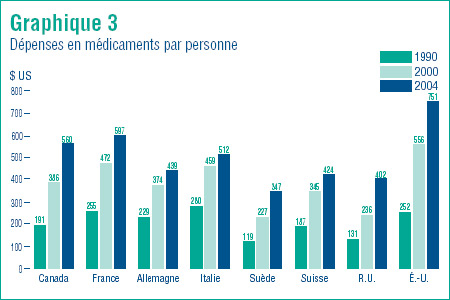
Le graphique 3 établit que le Canada continue de payer sa juste part. Il présente pour les années 1990, 2000 et 2004 les dépenses en médicament par personne. En 2004, seuls les résidents des États-Unis et de la France ont dépensé davantage par personne pour les médicaments que les résidents du Canada. Les dépenses en médicaments par personne étaient moins élevées dans tous les autres pays et ce, dans une mesure considérable en Suède, au Royaume Uni et en Suisse.
En date du 30 juin 2006, 33 nouveaux DIN pour usage humain (représentant 18 médicaments) ont fait l'objet d'un rapport au CEPMB pour l'exercice 2006. De ce nombre, 10 DIN (représentant 7 médicaments) étaient de nouvelles substances actives.
Le tableau qui suit présente les nouvelles substances actives ayant fait l'objet d'un rapport au CEPMB entre janvier et juin 2006.
En date du 30 juin 2006
| Nom de marque |
Nom générique |
Breveté |
| Faslodex (seringue de 50 mg) |
fulvestrant |
AstraZeneca Canada Inc. |
| Sativex 27/25 (52 mg/ml) |
delta-9-téthydrocannabinol/cannabidiol |
Bayer Inc. |
| Thalomid (gélule de 50 mg) |
thalidomide |
Celegene Corporation |
| Enablex (comprimés de 7,5 mg et de15 mg) |
darifénacine |
Novartis Pharma Canada Inc. |
| Levemir Penfill (100 unités/ml) |
detemir d'insuline |
Novo Nordisk Canada Inc. |
| Macugen (fiole de 0,3 mg) |
pégaptanib sodique |
Pfizer Canada Inc. |
| Somavert (fioles de 10 mg, de 15 mg et de 20 mg) |
pegvisomant |
Pfizer Canada Inc. |
Nom de marque : Tarceva
Nom générique : erlotinib
DIN:
02269023 150 mg/comprimé
02269015 100 mg/ comprimé
Breveté : Hoffmann-La Roche Canada Limitée
Indication - selon la monographie du médicament :
Le Tarceva est indiqué dans le traitement des formes localement avancées ou métastatiques du cancer brochitique non à petites cellules (CBNPC) après échec d'au moins une chimiothérapie et dont le statut du R-EGF est positif ou inconnu.
Date d'attribution du premier brevet lié au médicament : 17 février 2004
Date de l'Avis de conformité :7 juillet 2005
Date de la première vente :
19 juillet 2005 (comprimé de 150 mg)
20 juillet 2005 (comprimé de 100 mg)
Classification ATC :
L01XX34
Agents antinéoplasiques et immunomodulateurs, Agents antinéoplasiques, Autres agents antinéoplasiques
Application des Lignes directrices
Sommaire
Le prix de lancement du comprimé de 150 mg du médicament breveté Tarceva a été jugé conforme aux Lignes directrices du CEPMB. En effet, le coût d'une thérapie utilisant le Tarceva n'est pas supérieur aux coûts des thérapies utilisant les médicaments utilisés pour la comparaison selon la catégorie thérapeutique. Le prix pratiqué au Canada du comprimé de 150 mg du médicament Tarceva n'est pas non plus supérieur aux prix pratiqués dans les pays de comparaison où le médicament était vendu en date de son lancement sur le marché canadien.
Le prix de lancement du comprimé de 100 mg du médicament Tarceva a été lui aussi été jugé conforme aux Lignes directrices, la relation du prix de ce comprimé ayant été jugé raisonnable par rapport au prix du comprimé de 150 mg du même médicament. Par ailleurs, le prix du comprimé de 100 mg du médicament Tarceva n'est pas supérieur aux prix pratiqués dans les pays de comparaison où le comprimé de 100 mg de Tarceva était vendu en date de son lancement sur le marché canadien.
Examen scientifique
Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) a recommandé de classer le médicament Tarceva dans la troisième catégorie des nouveaux médicaments (à savoir les médicaments offrant à tout le plus un avantage moyen par rapport aux médicaments utilisés pour la comparaison selon la catégorie thérapeutique). Aux termes de la comparaison selon la catégorie thérapeutique, le prix d'un médicament de la troisième catégorie ne peut être supérieur au prix le plus élevé des médicaments utilisés pour traiter la même maladie ou condition. Les médicaments de comparaison sont généralement choisis parmi les médicaments existants utilisés pour traiter la même indication et appartenant au même niveau de la Classification Anatomique Thérapeutique Chimique (ATC) que le médicament sous examen, soit dans le présent cas le 4e niveau. Vous trouverez dans le Compendium des Lignes directrices, politiques et procédures de plus amples renseignements sur les Lignes directrices du Conseil et sur les politiques relatives à la comparaison selon la catégorie thérapeutique.
Pour la comparaison selon la classification thérapeutique, le GCMUH a recommandé comme médicaments de comparaison le Taxotere (docetaxel), l'Alimta (pemetrexed) et leTaxol (paclitaxel). Selon les résultats des études cliniques et des lignes directrices disponibles, ces agents ont des taux d'efficacité démontrée pour le traitement en deuxième ligne d'un cancer du poumon avancé après l'échec d'une thérapie de première ligne à base de platine. Selon les Lignes directrices, la posologie recommandée pour la comparaison ne doit pas être supérieure à la posologie maximale habituellement recommandée. Les posologies recommandées pour le médicament Tarceva et pour les médicaments utilisés pour la comparaison thérapeutique sont celles spécifiées dans les monographies, dans l'information sur les essais cliniques comparatifs et dans les Lignes directrices pertinentes. Le comprimé de 100 mg de Tarceva étant un ajustement du titrage d'une dose, la comparaison selon la catégorie thérapeutique n'a pu être faite faute de médicaments de comparaison cliniquement équivalents. Le GCMUH a donc recommandé de comparer le prix d'un mg d'un comprimé de 100 mg de Tarceva au prix d'un mg du comprimé de 150 mg.
Examen du prix
Aux termes des Lignes directrices, le prix de lancement d'un nouveau médicament de la catégorie 3 est considéré excessif s'il est supérieur aux prix de tous les médicaments utilisés dans la comparaison selon la catégorie thérapeutique ou, encore, s'il est supérieur aux prix de vente du même médicament dans les sept pays de comparaison nommés dans le Règlement. Le prix du comprimé de 150 mg du médicament breveté Tarceva a été jugé conforme aux Lignes directrices étant donné que le coût d'une thérapie à l'aide de ce médicament ne dépasse pas les coûts des thérapies utilisant les médicaments utilisés pour la comparaison selon la catégorie thérapeutique. Le prix du comprimé de 100 mg de Tarceva, qui est de 53.3333 $1, a également été jugé conforme aux Lignes directrices étant donné que son prix au milligramme n'est pas supérieur au prix au milligramme du comprimé de 150 mg du même médicament.
Période de lancement (Juillet à décembre 2005)
| Médicament |
Concentration |
Régime posologique |
Coût/traitement |
| Tarceva (erlotinib) |
150 mg/comprimé |
150 mg/jour PO |
1 680,0000 $1 |
| Taxotere (docetaxel) |
80 mg/fiole +20 mg/fiole |
100 mg/m2 aux trois semaines |
1 804,2525 $2 |
| Alimta (pemetrexed) |
500 mg/fiole |
500 mg/m2 aux trois semaines |
3 617,0000 $2 |
| Taxol (paclitaxel) |
6 mg/ml |
175 mg/m2 aux trois semaines |
904,3415 $2 |
- Association québécoise des pharmaciens propriétaires (AQPP), Octobre 2005
- IMS, Décembre 2005
En 2005, les comprimés de 150 mg et de 100 mg de Tarceva étaient vendus dans deux des sept pays de comparaison nommés dans le Règlement, à savoir en Suisse et aux États-Unis. Conformément aux Lignes directrices, les prix des comprimés de Tarceva au Canada se situaient dans la fourchette des prix pratiqués dans les deux pays de comparaison. De fait, les prix du médicament Tarceva pratiqués au Canada étaient moins élevés que les prix pratiqués dans les deux pays de comparaison et inférieurs à la médiane des prix internationaux.
Les médicaments de comparaison et les posologies recommandés dans les rapports sommaires sont ceux retenus par le personnel du Conseil et par le GCMUH dans l'exercice du mandat de réglementation du CEPMB qui est de vérifier les prix au Canada des médicaments brevetés pour qu'ils ne soient pas excessifs. La publication des rapports sommaires fait suite à l'engagement pris par le CEPMB de donner encore plus de transparence à son processus d'examen du prix des médicaments.
L'information présentée dans les rapports sommaires du CEPMB ne doit pas être utilisée à d'autres fins que celle mentionnée et ne doit pas non plus être considérée comme une acceptation, une recommandation ou une approbation de tout médicament. Elle ne peut non plus remplacer les conseils d'un professionnel de la santé qualifié.
À sa réunion du 17-18 mai, le Conseil
a approuvé :
- Le rapport annuel 2005 du CEPMB et son plan de communication
- Le premier rapport trimestriel sur les prix des médicaments non brevetés distribués sous ordonnance : Tendances des prix pratiqués au Canada et dans les pays de comparaison
- Révisions apportées aux modifications proposées au Règlement sur les médicaments brevetés, 1994
- Guide de discussion pour les consultations sur les Lignes directrices du Conseil sur les prix excessifs
a entendu des breffages sur les sujets suivants :
- mandat et activités du Comité consultatif canadien d'expertise sur les médicaments. Ce breffage a été donné par le président du Comité, M. Andreas Laupacis.
- activités courantes du CEPMB :
- Stratégie nationale sur les produits pharmaceutiques
- SNIUMP
Pour commander des publications ou pour faire inscrire votre nom sur notre liste d'envoi par courriel ou par la poste, veuillez communiquer avec Elaine McGillivray (Elaine@pmprb-cepmb.gc.ca). Pour de plus amples renseignements sur notre site Web, communiquez avec notre agente de communications à l'adresse pmprb@pmprb-cepmb.gc.ca.
L'agenda est affiché sur notre site Web sous la rubrique « Consultations; Événements ».
- 8-10 août
Audience – Adderall XR
- 21 août
Téléconférence du GCMUH
- 25 août 25
Date limite de réception des réponses aux questions posées dans le Guide de discussion sur les Lignes directrices du Conseil sur les prix excessifs
- 15 septembre
Conférence préparatoire - Concerta
- 20 septembre
Conférence préparatoire - Copaxone
- 27 septembre
Réunion du Conseil
- 28-29 septembre
Audience - Risperdal Consta
- 14 octobre
National Oncology Pharmacy Symposium - Dollars and Sense of Quality Cancer Care, Montréal
- 16-19 octobre
Audience - Airomir
- 20 november
Téléconférence du GCMUH
- 27-29 novembre
Audience - Risperdal Consta
- 2006 Consultations du Conseil sur ses Lignes directrices sur les prix excessifs
2 novembre: Edmonton
2 novembre 8: Montréal
2 novembre 16: Toronto
2 novembre 28: Halifax
2 novembre 30: Ottawa
- 6-8 décembre
Audience - Concerta
- 13-14 décembre
Réunion du Conseil, Ottawa