La Nouvelle Juillet 2005
volume 9, numéro 3
Table des matières
- Depuis notre dernier numéro …
- Aurevoir et bienvenue
- Message du Vice-président
- Questions et commentaires
- Rapport sur les dépenses pharmaceutiques (OCDE)
- ECVs acceptés au cours du dernier trimestre : Ceretec, Starlix
- Avis et commentaires (mise à jour)
- Liste des nouveaux médicaments lancés sur le marché canadien depuis la publication de La Nouvelle d’avril 2005
- Rapports sur les nouveaux médicaments brevetés – Humira
- Sommaire du procès-verbal de la réunion de mai du Conseil
- À notre agenda
Voici les principales activités ayant retenu l´attention du CEPMB depuis la fin d´avril 2005 :
- 28 avril : Réal Sureau a participé à Ottawa au Forum 2005 des membres des tribunaux administratifs dont le thème était – Développements récents en droit administratif et nouvelles approches envisagées pour l´avenir.
- 14 juin : Dépôt au Parlement de notre rapport annuel pour l´exercice 2004.
- 15-19 juin : Célébration de la Semaine nationale de la Fonction publique 2005.
- 19-21 juin : Réal Sureau, Barbara Ouellet, Martine Richard et Sylvie Dupont ont assisté à Ottawa à la conférence annuelle du Conseil des tribunaux administratifs canadiens (CTAC).
- Dr Brien Benoit nommé au Conseil en mai dernier pour un mandat de cinq ans. Il sera vice-président du Conseil à compter du 3 octobre prochain. Vous trouverez les notes biographiques du Dr Benoit sur notre site Web sous la rubrique « Le CEPMB; Membres du Conseil ».
- Orlando Manti, de Santé Canada, a joint le CEPMB à titre d´économiste principal, Direction des politiques et de l´analyse économique. Bienvenue à nouveau dans l´équipe!
- Meilleurs voeux de succès à Louis-Philippe Dubrule qui s´en va relever de nouveaux défis au Secrétariat du Conseil du Trésor.
- Nos meilleurs voeux de succès accompagnent Gina Charos qui a accepté un poste à Santé Canada.
Semaine nationale de la Fonction publique 2005
Le CEPMB a réservé la journée du 15 juin pour souligner la Semaine nationale de la Fonction publique 2005. Il a profité de l´occasion pour reconnaître l´excellence de ses employés.
Les célébrations ont pris la forme d´un « Marchez d´un bon pas » et d´un déjeuner!
Retour sur 2004 !
Le 14 juin dernier, le ministre de la Santé a présenté au Parlement notre rapport annuel pour l´exercice 2004. Les lecteurs ont constaté que nous avons modifié cette année la présentation de notre rapport annuel pour accorder une attention plus grande aux principales tendances des prix des produits pharmaceutiques. Nous avons réorganisé cette section du rapport pour fournir une analyse plus approfondie des principaux indices et ainsi permettre à nos lecteurs de mieux comprendre la conjoncture actuelle des prix.
Selon le rapport, la valeur totale des ventes au prix départ-usine de tous les médicaments pour usage humain au Canada a augmenté de 5,3 % par rapport à l´exercice précédent, pour se situer à 15,9 milliards de dollars. La valeur des ventes de médicaments brevetés a pour sa part augmenté de 7,9 % au cours de la période et totalisé 10,9 milliards de dollars. Ces deux taux de croissance de la valeur des ventes sont les plus bas enregistrés depuis 1997 dans le cas de l´ensemble des médicaments pour usage humain et depuis 1996 dans le cas des médicaments brevetés. La valeur des ventes des médicaments brevetés a représenté 68,6 % de la valeur de l´ensemble des ventes de médicaments, soit un peu plus qu´en 2003.
Les prix des médicaments brevetés existants ont reculé de 0,2 % par rapport à 2003. L´analyse des prix selon la catégorie thérapeutique a révélé une importante fluctuation des prix. Les comparaisons des prix pratiqués au Canada aux prix pratiqués dans les pays de comparaison révèle que les prix canadiens correspondent à 91 % de la médiane des prix pratiqués dans les sept pays de comparaison nommés dans le Règlement. Depuis 1995, exception faite de l´année 2002, les prix canadiens se situent en moyenne de 5 à 12 % sous la médiane des prix internationaux.
En 2004, 94 nouveaux médicaments sont devenus assujettis à la compétence du CEPMB, dont 25 nouvelles substances actives. Au moment d´aller sous presses, 19 médicaments brevetés étaient sous enquête. De janvier 2004 à aujourd´hui, dix brevetés ont conclu des engagements de conformité volontaire en vertu desquels ils se sont engagés à pratiquer des prix conformes aux Lignes directrices. L´audience concernant le prix du médicament breveté Dovobet qui a débuté avec la publication d´un avis d´audience en novembre 2004 doit reprendre le 12 septembre prochain.
Les brevetés ont fait rapport de dépenses de R-D totalisant en 2004 1,17 milliard de dollars, soit 2 % de moins que le 1,19 milliard de dollars déclaré pour 2003. Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes a continué de baisser, passant de 8,8 % qu´il était en 2003 à 8,3 % en 2004. Quant aux membres de Rx&D, le ratio de leurs dépenses dans la R-D a lui aussi reculé, passant de 9,1 % à 8,5 %. Les dépenses dans la recherche
fondamentale ont augmenté de 23 % pour atteindre les 221,7 millions de dollars et représenter 19,7 % de la valeur des dépenses courantes de R-D.

Réal Sureau Vice-président
Notre rapport annuel 2004 fait également état des dernières consultations publiques que nous avons tenues sur les modifications proposées au Règlement sur les médicaments brevetés, 1994, ainsi que de notre document de discussion concernant l´augmentation des prix des médicaments brevetés. Nous prenons actuellement connaissance des deux séries de mémoires reçus. Au cours de sa réunion de septembre prochain, le Conseil se prononcera sur le suivi à donner à ces consultations. Vous trouverez à la page 5 du présent numéro un sommaire des consultations. Nous vous communiquerons de plus amples renseignements sur l´évolution de ces initiatives dans La Nouvelle d´octobre prochain.
Nous espérons que l´analyse plus approfondie des principaux indices présentée dans notre rapport annuel 2004 vous aidera à mieux comprendre le contexte pharmaceutique actuel et de constater que le CEPMB ne ménage aucun effort pour que le système protège les meilleurs intérêts de la population canadienne.
Enfin, étant donné que mon deuxième et dernier mandat à titre de vice-président du Conseil d´examen du prix des médicaments brevetés prendra fin en octobre prochain, je profite de l´occasion pour remercier mes collègues membres du Conseil ainsi que les membres du personnel du CEPMB pour leur contribution à l´organisation. J´apprécie la chance qui m´a été donnée d´avoir été appelé à servir à titre de vice-président du CEPMB. Je souhaite au CEPMB et à chacun d´entre vous beaucoup de succès dans tout ce que vous entreprendrez.

Réal Sureau
Vice-président
Pour commander des publications ou pour faire inscrire votre nom sur notre liste d´envoi par courriel ou par la poste, veuillez communiquer avec Elaine McGillivray (Elaine@pmprbcepmb.gc.ca). Pour de plus amples renseignements sur notre site Web, communiquer avec notre agente des communications à l´adresse pmprb@pmprb-cepmb.gc.ca.
En juin 2005, l´Organisation pour la coopération et le développement économique (OCDE) a publié la mise à jour annuelle de ses statistiques sur les régimes de santé des pays industrialisés. La nouvelle édition ajoute l´année 2003.
Les graphiques qui suivent présentent les principaux résultats de l´OCDE pour le secteur pharmaceutique. Le présent sommaire ne porte que sur les données du Canada et des sept pays qu´utilise le CEPMB pour ses comparaisons des prix internationaux1.
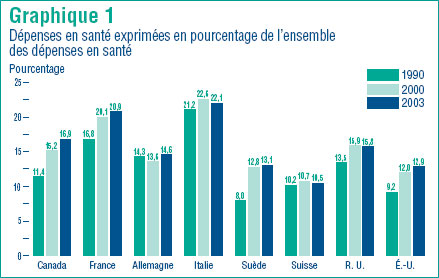
Le graphique 1 présente les dépenses pharmaceutiques2 sous la forme de proportion des dépenses totales en santé pour les années 1990, 2000 et 2003. Au Canada en 2003, les dépenses pharmaceutiques représentent 16,9 % de l´ensemble des dépenses en soins de santé, soit plus qu´en 2000 et en 1990 où elles représentaient respectivement 15,2 % et 11,4 %.3 Des augmentations semblables ont été enregistrées en France, en Allemagne et aux États-Unis. Par ailleurs, dans les autres pays industrialisés, la part des dépenses consacrées à l´achat de produits pharmaceutiques a peu ou pas augmenté. Le graphique 1 montre que la part des dépenses pharmaceutiques varie grandement d´un pays à l´autre, allant de 10,5 % en Suisse à 22,1 % en Italie. À 16,9 %, la part du Canada se situe dans le milieu de cette fourchette.
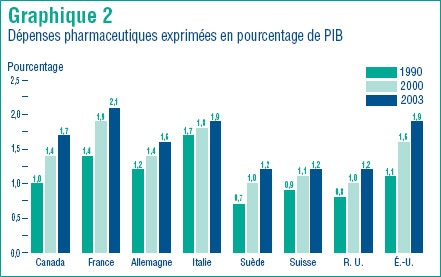
Le graphique 2 présente les dépenses pharmaceutiques sous forme de pourcentage du Produit intérieur brut (PIB). Par rapport à 1990 et à 2000, tous les pays ont investi dans les produits pharmaceutiques en 2003 une plus large part de leur PIB. À la limite supérieure, l´Italie, les États-Unis et la France ont respectivement fait rapport de ratios de 1,9 %, 1,9 % et 2,1 % de leur PIB. À l´autre limite, la Suède, la Suisse et le R. U. ont fait rapport de ratios d´environ 1,2 %. Le ratio du Canada, qui est de 1,7 %, se situe dans la juste moyenne des valeurs rapportées pour les autres pays et n´est que légèrement inférieur à celui des États-Unis. Les critiques de la politique pharmaceutique du Canada accusent notre pays de « profiter » de la recherche financée par les consommateurs d´autres pays. Si l´on en juge par les résultats présentés au graphique 2, cette accusation n´est pas justifiée. En effet, en 2003, les Canadiens et les Canadiennes ont consacré à l´industrie pharmaceutique mondiale une proportion de leur revenu national presque aussi importante que celle de nos voisins du Sud.
Comme le montre le graphique 3, le Canada n´est pas en reste des États-Unis en ce qui a trait à la valeur de ses dépenses en médicaments. Ce graphique montre en dollars US la valeur des dépenses en médicaments par habitant aux États-Unis pour les années 1990, 200 et 2003.4
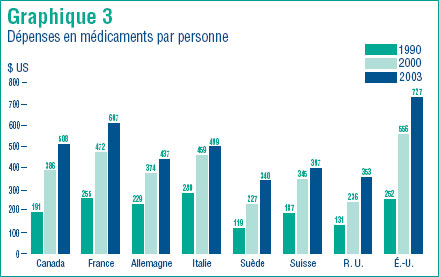
En 2003, seuls les résidents des États-Unis et de la France ont consacré plus d´argent par personne à l´achat de produits pharmaceutiques que le Canadiens. Les résidents de tous les autres pays ont consacré des sommes moins importantes par personne, et plus particulièrement les résidents de la Suède, de la Suisse et du Royaume Uni.
1. Les pays de comparaison nommés dans le Règlement sur les médicaments brevetés, 1994 sont la France, l´Allemagne, l´Italie, la Suède, le Royaume Uni et les États-Unis.
2. L´OCDE définit les dépenses pharmaceutiques comme suit : « total des dépenses en médicaments et en produits pharmaceutiques non durables ». Cette définition englobe les « préparations médicales, les médicaments de marque, les médicaments génériques, les médicaments brevetés, les sérums, les vaccins, les vitamines, les minéraux et les contraceptifs oraux ». Elle comprend également les produits non pharmaceutiques tels que la pâte dentifrice et les condoms. Les statistiques couvrent les dépenses engagées par les secteurs public et privé. Selon le pays, les dépenses pharmaceutiques ne comprennent pas nécessairement la valeur des médicaments administrés dans les hôpitaux.
3. Pour le Canada, l´OCDE a utilisé les estimés de l´Institut canadien d´information sur la santé (ICIS) pour les dépenses pharmaceutiques et pour le total des dépenses en soins de santé. La part attribuée au Canada dans le graphique 1 est différente de celle rapportée dans des publications de l´ICIS et ce, en raison des différences des définitions de l´expression « ensemble des dépenses en santé ».
4. Les dépenses ici rapportées ont été converties en dollars US aux taux de parité des pouvoirs d´achat de l´OCDE. Cette méthode de conversion corrige implicitement les variations internationales du coût de la vie, ce qui facilite les comparaisons des dépenses internationales en termes de coût réel (consommation prochaine) plutôt que d´unités monétaires.
Ceretec
Le 14 juillet 2005, le vice-président du Conseil a accepté l´ECV que lui a présenté Amersham Health Inc. pour son médicament Ceretec. Selon les modalités de cette entente, Amersham Health Inc. a reconnu que le prix maximal non excessif du Ceretec était de 173,1935 $ pour 2004 et de 177,7475 $ pour 2005. Amersham Health s´est également engagé à veiller à ce que le prix de transaction moyen de son médicament se situe dans les limites du prix maximal non excessif établi à 177,7475 $ pour 2005. En guise de remboursement des 278 1122,65 $ de recettes excessives encaissées entre le 1er janvier 2002 et le 31 décembre 2004, Amersham Health Inc. doit offrir jusqu´au 31 décembre 2005 son médicament à un prix inférieur au prix maximal non excessif établi pour 2005.
Si la totalité des recettes excessives n´ont pas été totalement remboursées en date du 31 décembre 2005, Amersham Health remboursera le montant non remboursé aux hôpitaux et centres de santé ayant acheté son médicament entre le 1er décembre 2002 et le 31 décembre 2004. Chaque paiement correspondra entre la différence entre le prix payé pour le médicament et le prix maximal non excessif multiplié par le nombre d´emballage acheté entre le 1er janvier 2002 et le 31 décembre 2004. Tous ces remboursements devront avoir été faits au plus tard le 31 janvier 2006.
Le prix du Ceretec demeurera assujetti à la compétence du CEPMB jusqu´à l´échéance de son brevet soit jusqu´en avril 2006.
Le Ceretec (technetium TC-99M exametazine) est un agent radiopharmaceutique utilisé pour diagnostiquer les tumeurs et les maladies cérébrales.
Les détails concernant l´Engagement de conformité volontaire (ECV) sont disponibles sur notre site Web sous la rubrique Publications; Engagements de conformité volontaire; Ceretec
Starlix
Le 25 juillet, le vice-président du Conseil a approuvé l´ECV que lui a soumis Novartis Pharmaceuticals Canada Inc. pour son médicament breveté Starlix.
En vertu de cet ECV, Novartis doit réduire le prix des comprimés de 60 mg et de 120 mg de son médicament Starlix afin que le prix de transaction moyen d´un comprimé ne soit pas supérieur à 0,5044 $, le prix maximal non excessif établi pour 2005. Dans les 30 jours suivant l´acceptation de l´ECV ou au plus tard le 25 août 2005, Novartis remettra la somme de 174 306,20 $ au gouvernement du Canada en guise de remboursement des recettes excessives encaissées entre mars 2002 et juin 2005.
Conformément aux Lignes directrices, Novartis devra également veiller à ce que les prix de transaction moyen de son médicament demeurent dans les limites du prix maximal non excessif établi pour l´année et ce, tant et aussi longtemps que le brevet du médicament sera en vigueur. Le prix du Starlix demeure assujetti à la compétence du CEPMB jusqu´en février 2014, date d´échéance du brevet.
Starlix est indiqué pour réduire le taux de sucre chez les personnes atteintes du diabète sucré de type 2 non contrôlé à l´aide d´une diète et d´exercices physiques. La monothérapie doit être conjuguée à une diète alimentaire et à des exercices physiques.
Les détails concernant l´Engagement de conformité volontaire (ECV) sont disponibles sur notre site Web sous la rubrique Publications; Engagements de conformité volontaire; Starlix.
Consultations en 2005
Au début de la présente année, le CEPMB a engagé deux consultations auprès de ses intervenants dans le but de connaître leurs points de vue concernant différents volets du travail du CEPMB. En janvier 2005, le CEPMB a publié un Avis et Commentaires dans lequel il proposait des modifications au Règlement sur les médicaments brevetés, 1994. Ce règlement pose les exigences relativement aux rapports que doivent présenter les brevetés. En mars 2005, le CEPMB a publié un deuxième Avis et Commentaires dans lequel il sollicitait l´opinion des intervenants concernant l´examen des augmentations des prix des médicaments brevetés. Le CEPMB a reçu différents mémoires exprimant différents points de vue. Le personnel du CEPMB prend actuellement connaissance du contenu des différents mémoires qui lui ont été soumis et évalue des moyens d´intégrer dans ses processus certaines suggestions formulées.
Modifications au Règlement sur les médicaments brevetés, 1994
Dans la foulée du Projet d´examen des échéanciers qui visait à améliorer les délais d´examen du prix des médicaments brevetés, des modifications ont été proposées au Règlement sur les médicaments brevetés, 1994, dans le but de modifier le type de renseignements que les brevetés doivent soumettre aux fins du processus d´examen du prix ainsi que le moment et le mode de présentation.
Deux propositions prévoient que les brevetés auront à présenter au CEPMB un préavis du prix auquel ils entendent vendre leur nouveau médicament ou, encore, de l´augmentation du prix d´un médicament existant. Grâce à un tel préavis, les membres du Conseil pourraient commencer plus tôt le processus d´examen du prix et, par ricochet, informer plus tôt au breveté sur la conformité de son prix aux Lignes directrices. Même si ces changements ont été largement bien accueillis par les intervenants en général, les brevetés craignent qu´ils leur soient défavorables face à la concurrence. En ce qui concerne les renseignements qui pourraient être exigés, bon nombre d´intervenants considèrent que le CEPMB obtiendrait ainsi des données plus complètes sur le marché et sur les prix pratiqués. Les brevetés pour leur part ont exprimé des réserves parce qu´il s´ensuivrait pour eux une augmentation du temps de préparation des rapports. Le mécanisme de rapport ne semblait pas non plus très bien compris. Les autres modifications, notamment celles relatives à l´acceptation des signatures électroniques, à l´obligation imposée aux détenteurs de brevets vétérinaires de fournir des renseignements plus précis et à la possibilité de corriger les rapports présentés, ont été accueillies favorablement par les intervenants.
Augmentations des prix des médicaments brevetés
Suite aux rapports sur les augmentations des prix des médicaments brevetés publiés au début de 2004, le CEPMB a par le truchement d´un document de discussion sollicité les points de vue des intervenants concernant les augmentations des prix des médicaments existants. Le document de discussion a décrit la mécanique actuelle de ce processus et passé en revue les tendances des prix. Le CEPMB s´étant abstenu de formuler des propositions, les intervenants ont dans leurs mémoires traité essentiellement de deux grandes questions, à savoir la mise en place d´un système d´autorisation préalable de l´augmentation du prix d´un médicament et la modification des facteurs utilisés pour évaluer la conformité des augmentations des prix. Certains intervenants se sont dits en faveur d´un système d´autorisation préalable des augmentations des prix alors que d´autres, non convaincus que la situation actuelle pose un problème, ont mis en doute la pertinence d´un changement. La majorité des mémoires reçus privilégiaient la méthode actuelle d´examen des augmentations des prix. Les intervenants ont recommandé une application plus rigoureuse des différents facteurs mentionnés dans la Loi sur les brevets alors que d´autres proposaient un examen des augmentations des prix à la lumière d´une nouvelle série de facteurs tels que les investissements du breveté dans la R-D et les dépenses de commercialisation du médicament.
Pour ces deux consultations, le CEPMB a reçu des mémoires volumineux et bien documentés. Fidèle à l´esprit de transparence qui l´anime, le CEPMB a affiché sur son site Web les mémoires reçus pour les deux consultations.
En ce qui concerne le suivi qui sera donné, le Conseil se penchera au cours de sa prochaine réunion sur les changements proposés aux modifications proposées au Règlement. Il discutera également des options stratégiques en matière d´examen des augmentations des prix. La Nouvelle vous tiendra informé de l´évolution du suivi à ces deux consultations.
Cette consultation se veut une première étape du processus de réglementation fédérale.
Nouveaux médicaments brevetés ayant fait l´objet d´un rapport au CEPMB
En date du 30 juin 2005, 23 nouveaux DIN pour usage humain (représentant 14 médicaments) ont fait l´objet d´un rapport au CEPMB au cours de l´année 2005. De ces 23 DIN, 14 (représentant 7 médicaments) sont de nouvelles substances actives.
Le tableau qui suit présente les nouvelles substances actives ayant fait l´objet d´un rapport au CEPMB entre janvier et juin 2005.
En date du 30 juin 2005
| Nom de marque |
Nom générique |
Breveté |
| Yasmin 21, Yasmin 28 (3/0.03) |
drospirenone/ethinylestradiol |
Berlex Canada Inc. |
| Strattera (comprimés de 10 mg, de 18 mg, de 25 mg, de 40 mg et de 60 mg) |
atomoxetine hydrochloride |
Eli Lilly Canada Inc. |
| Telzir (comprimé de 700 mg; 50 mg/ml) |
fosamprenavir calcium |
GlaxoSmithKline Inc. |
| Cipralex (comprimés de 10mg et de 20 mg) |
escitalopram oxalate |
Lundbeck Canada Inc. |
| Xolair (fiole de 150 mg) |
omalizumab |
Novartis Pharma Canada Inc. |
| Zelnorm (comprimé de 6 mg) |
tegaserod maleate |
Novartis Pharma Canada Inc. |
| Nuvaring (0,12/0,015) |
etonogestrel/ethinyl estradiol |
Organon Canada Ltd. |
Nom de marque : Humira
Nom générique : (adalimumab)
DIN : 02258595 40 mg syringe
Breveté : Abbott Laboratories Limited
Indication – selon monographie du médicament : la Pour atténuer les symptômes de polyarthrite rhumatoïde et ralentir la progression des dommages structuraux chez les patients adultes dont la maladie a atteint un stade moyen ou grave et pour lesquels un traitement utilisant un ou plusieurs médicaments anti-arthritiques (DMARD) n´a pas donné les résultats escomptés.
Date de l´Avis de conformité : 24 septembre 2004
Date de la première vente : 29 septembre 2004
Catégorie ATC : L04AA17
Agents antinéoplasiques et agents immunosuppresseurs, Agents immunosuppresseurs, Agents immunosuppresseurs sélectifs.
Application des lignes directrices
Sommaire :
Le prix de lancement du Humira a été jugé conforme aux Lignes directrices du CEPMB puisque le coût d´une thérapie utilisant ce médicament n´est pas supérieur aux coûts des thérapies utilisant les médicaments de comparaison. Le prix du Humira se situe également dans les limites des prix pratiqués dans les pays de comparaison où le médicament était commercialisé au moment de son lancement sur le marché canadien.
Examen scientifique :
Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) du CEPMB a recommandé que le médicament Humira, une nouvelle substance active, soit classé dans la 3e catégorie des nouveaux médicaments (médicaments qui offrent à tout le plus un avantage thérapeutique moyen par rapport aux médicaments de comparaison).
Aux fins de la comparaison selon la catégorie thérapeutique, le GCMUH a recommandé le Enbrel (etanercept), le Remicade (infliximab) et le Kineret (anakinra). Tout comme le Humira, ces médicaments appartiennent au 4e niveau de la classification ATC, sont des agents biologiques et sont indiqués pour le traitement de l´arthrite rhumatoïde de niveau moyen à grave chez les patients pour lesquels une thérapie utilisant un ou plusieurs médicaments anti-arthritiques n´a pas donné les résultats escomptés.
L´AR étant considérée une condition chronique, le GCMUH a recommandé que les doses d´entretien du Enbrel, du Remicade et du Kineret soient comparées à celle du Humira. Étant donné que la fréquence d´administration de ces différents médicaments varie grandement d´un médicament à l´autre, le GCMUH a recommandé de fonder la comparaison sur la quantité des différents médicaments de comparaison administrée sur une base annuelle.
En vertu des Lignes directrices, le prix d´un médicament de la catégorie 3 ne peut être supérieur au prix le plus élevé des autres médicaments utilisés pour traiter la même maladie ou condition. Les médicaments de comparaison sont généralement choisis parmi les médicaments existants et cliniquement équivalents utilisés pour traiter l´indication approuvée et appartenant au même niveau de la Classification anatomique, thérapeutique, chimique (ATC) que le médicament sous examen, soit dans le présent cas le 4e niveau. Vous trouverez dans le Compendium des Lignes directrices, des politiques et des procédures de plus amples renseignements sur les Lignes directrices du Conseil et sur les politiques relatives aux comparaisons selon la catégorie thérapeutique.
Examen du prix :
Aux termes des Lignes directrices, le prix de lancement d´un nouveau médicament de la 3e catégorie sera présumé excessif s´il est supérieur aux prix des médicaments utilisés pour la comparaison selon la catégorie thérapeutique ou aux prix pratiqués dans les sept pays nommés dans le Règlement sur les médicaments brevetés. Le prix du médicament Humira a été jugé conforme aux Lignes directrices étant donné que le coût quotidien d´une thérapie utilisant ce médicament se situe dans les limites des coûts des thérapies utilisant les différents médicaments de comparaison.
| Médicament |
Régime posologique/par année |
Coût/année |
| Humira (adalimumab) |
40 mg aux deux semaines (26 seringues) |
20 186,66 $1 |
| Enbrel (etanercept) |
25 mg deux fois la semaine (104 fioles) |
17 160,00 $2 |
| Remicade (infliximab) |
5 mg/kg à toutes les huit semaines (22,75 fioles) |
21 385,00 $2 |
| Kineret (anakinra) |
100 mg par jour (365 seringues) |
15 001,50 $3 |
1. PPS Pharma, Janvier 2005
2. Régie de l´assurance-maladie du Québec, Février 2005
3. Le Guide du pharmacien propriétaire, Liste de l´AQPP, Octobre 2004
En 2004, le médicament Humira était offert sur les marchés des sept pays de comparaison nommés dans le Règlement sur les médicaments brevetés. Ces pays sont la France, l´Allemagne, l´Italie, la Suède, la Suisse, le Royaume Uni, et les Etats-Unis. Conformément aux Lignes directrices, le prix canadien du Humira se situe dans la fourchette des prix pratiqués dans ces différents pays. Pour être plus précis, le prix canadien du Humira est le moins élevé de tous les prix pratiqués dans ces pays et se situe sous la médiane des prix qui y sont pratiqués.
Le choix des médicaments de comparaison et des régimes posologiques mentionnés dans les rapports sommaires a été fait par le personnel du CEPMB et par le GCMUH aux fins de l´exercice du volet réglementation du mandat du CEPMB qui est de passer en revue les prix des médicaments brevetés pour s´assurer qu´ils ne sont pas excessifs. La publication de ces rapports fait suite à l´engagement pris par le CEPMB de rendre son processus d´examen du prix plus transparent.
L´information présentée dans les rapports sommaires du CEPMB ne doit pas être utilisée à d´autres fins que celle prévue et ne doit pas non plus être considérée comme une acceptation, une recommandation ou une approbation de tout médicament. Elle ne peut non plus remplacer les conseils d´un professionnel de la santé qualifié.
Dans le cadre de sa réunion, le Conseil a :
- approuvé le Rapport annuel pour l´exercice 2004 ainsi que le plan de communications préparé aux fins de sa publication
- entendu des exposés sur les sujets suivants :
- Stratégie nationale sur les médicaments
- Consultations entreprises en début d´année par le Conseil. Ces consultations ont porté sur les modifications proposées au Règlement sur les médicaments brevetés, 1994, ainsi que sur les augmentations des prix des médicaments brevetés.
- Activités mensuelles de vérification de la conformité et d´enquête
- Projets menés au titre du SNIUMP.Conseil d´examen du prix des médicaments brevetés – Réunion du 17-18 mai 2005
La prochaine réunion du Conseil aura lieu le 23 septembre 2005. Pour de plus amples renseignements, communiquer avec la Secrétaire du Conseil :
1 877 861-2350 ou
(613) 954-8299 ou,
encore, à l´adresse
sdupont@pmprb-cepmb.gc.ca.
- Août 16
Réunion du GCMUH, Ottawa
- 29 août - 2 septembre
Conférence internationale sur les produits pharmaceutiques, Montréal
- Septembre 12 - 16
Audience publique relative au Dovobet, Ottawa
- Septembre 23
Réunion du Conseil, Ottawa
- Octobre 18 - 19
Quatrième forum annuel sur les brevets pharmaceutiques de l´Institut canadien, Toronto
- Octobre 20 - 21
Cinquième conférence annuelle sur ‘Advanced Law and Practice´– Fundamentals of Administrative Law Practice de l´Institut canadien,Toronto
- Octobre 31
La Nouvelle, livraison d´octobre
- Novembre 17
Réunion du GCMUH, Ottawa
- Novembre 21 - 22
PHARMAC Sales & Marketing Summit 2005 – “What does the future hold for drug price controls in Canada?”, Toronto
- 29 novembre - 2 décembre
Audience publique relative au Dovobet, Ottawa
- Décembre 16
Réunion du Conseil, Ottawa