ISSN 2369-4912
Préambule
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) souhaite rendre son processus d’examen du prix des médicaments encore plus ouvert et plus transparent afin de continuer à bien servir les meilleurs intérêts de ses intervenants.
Le Compendium des politiques, des Lignes directrices et des procédures (le Compendium) a pour objectif principal d’informer les brevetés sur ses politiques, ses Lignes directrices et ses procédures qui régissent les examens des prix des produits médicamenteux brevetés vendus au Canada ainsi que sur ses procédures d’examen scientifique et d’examen des prix qui semblent excessifs.
Le CEPMB estime parfois nécessaire de mettre à jour ses Lignes directrices afin qu’elles demeurent pertinentes et qu’elles facilitent l’application de ses principes d’équité, de transparence, d’ouverture et de prévisibilité. Dans un tel cas, le CEPMB consulte ses intervenants au moyen de son processus d’Avis et de commentaires.
Le Compendium est organisé comme suit :
Partie A – Le cadre juridique
A.1 Origine du CEPMB
A.1.1 Le CEPMB a été créé en application des modifications apportées à la Loi sur les brevets (la Loi) entrées en vigueur le 7 décembre 1987. Avant 1987, le Canada a cherché à réduire les prix des médicaments brevetés en favorisant la concurrence au moyen de licences obligatoires. Les modifications de 1987 ont amélioré la protection qu’un brevet confère aux médicaments afin que les brevetés investissent davantage dans la recherche-développement (R-D) au Canada.
A.1.2 Les modifications de 1987 apportées à la Loi sur les brevets ont aussi établi le CEPMB comme le pilier de la protection du consommateur de la réforme du droit des brevets pharmaceutiques afin de s’assurer que les prix des médicaments brevetés ne sont pas excessifsNote de bas de page 1. Le CEPMB a également comme rôle la présentation de rapports, ce qui contribue à guider les décisions et l’élaboration des politiques en matière de soins de santé.
A.1.3 D’autres modifications à la Loi, celles-là en vigueur depuis le 15 février 1993, ont aboli le régime de licences obligatoires pour les médicaments brevetés, accordant ainsi aux brevetés un monopole sur le marché canadien pendant toute la durée du brevet. Pour combler le vide créé par l’abolition des licences obligatoires, les modifications de 1993 ont aussi élargi les pouvoirs correcteurs du CEPMB. Depuis, le Conseil peut, lorsque les circonstances l’exigent, obliger les brevetés à rembourser les recettes excessives qu’ils ont tirées de la vente de leur produit médicamenteux à un prix excessif et ce, en plus de baisser le prix de leur médicament, protégeant ainsi davantage les intérêts des consommateursNote de bas de page 2.
A.2 Mandat du CEPMB
A.2.1 La Loi sur les brevets précise un double rôle pour le CEPMB :
- Réglementation – Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs ;
- Rapport – Faire rapport sur les tendances pharmaceutiques et sur les dépenses de R-D des brevetésNote de bas de page 3.
A.3 Structure et fonctionnement du CEPMB
A.3.1 Le CEPMB est un organisme indépendant et autonome qui détient des pouvoirs quasi-judiciaires. Afin de garantir l’indépendance et l’autonomie du Conseil, la Loi ne confère au gouvernement aucun pouvoir explicite ou implicite qui lui permettrait d’avoir un droit de regard sur les activités du Conseil ou, encore, de réviser ses décisions et ses ordonnances.
A.3.2 Comme le prévoient les principes du droit administratif, les décisions rendues par le Conseil peuvent être soumises à la révision judiciaire de la Cour fédérale du Canada sur toute question de fond ou d’ordre procédural.
A.3.3 Le CEPMB est régi par un Conseil formé de cinq membres nommés en vertu du paragraphe 91(1) de la Loi. Par ailleurs, les membres du personnel sont nommés en vertu du paragraphe 94(1) de la Loi.
A.3.4 Le CEPMB est habilité à se doter de politiques et de procédures qui régissent la façon dont il s’acquitte de ses obligations réglementaires. À cette fin, pour lui permettre de s’acquitter de ses obligations d’une façon juste et équitable, le CEPMB a opté pour une séparation administrative des fonctions d’examen et des fonctions de poursuite. Les fonctions d’examen et de poursuite sont menées par le personnel du Conseil tandis que la compétence des membres du Conseil est de décider d’une affaire portée à leur attention.
A.3.5 Le personnel du Conseil vaque aux activités courantes du CEPMB, dont l’administration du Règlement sur les médicaments brevetés (le Règlement) en s’assurant que les brevetés soumettent dans les délais impartis les rapports exigés. Il effectue également l’examen des prix des médicaments brevetés de la façon prescrite dans les Lignes directrices approuvées par le Conseil.
A.3.6 S’il arrive à la conclusion qu’il est dans l’intérêt public de tenir une audience en vertu du paragraphe 83(6) de la Loi aux fins de décider si un médicament breveté est ou a été vendu sur un marché au Canada à un prix réputé excessif, le président du Conseil émet un Avis d’audience et forme un panel d’audience constitué de membres du Conseil.
A.3.7 Afin d’assurer l’impartialité du panel d’audience, aucun membre du Conseil autre que le président n’est informé des résultats des vérifications de prix effectuées par le personnel du Conseil avant que l’affaire ne soit entendue dans le cadre d’une audience publique. Seul le président est informé de ces résultats en sa capacité de chef de la direction du CEPMB puisqu’il lui appartient de décider, en application du paragraphe 93(2) de la Loi, s’il est dans l’intérêt public de tenir une audience.
A.4 Compétence du CEPMB en matière de réglementation des prix
A.4.1 La Loi investit le CEPMB du pouvoir de déterminer si le breveté ou l’ancien breveté d’une invention liée à un médicament, vend ou a vendu sur un marché au Canada son médicament à un prix jugé excessif et ce, lorsque les critères suivants s’appliquentNote de bas de page 4 :
A.4.1.1 Breveté ou ancien breveté
- Aux termes du paragraphe 79(1) de la Loi, le mot « breveté » désigne la personne ayant pour le moment droit à l’avantage d’un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d’un brevet pour telle invention ou exerce ou a exercé les droits d’un titulaire dans un cadre autre qu’une licence accordée avant le 20 décembre 1991 par le Commissaire aux brevets et qui n’était pas arrivée à échéance le 15 février 1993, date de l’entrée en vigueur de la Loi de 1992 modifiant la Loi sur les brevets.
- Le CEPMB a également compétence sur l’ancien breveté d’une invention pour la période durant laquelle il était détenteur du brevet.
A.4.1.2 Brevet lié au médicament
Médicament
- Le mot « médicament » n’est pas définit dans la Loi sur les brevets. Veuillez consulter la politique du Conseil à l’égard du sens donné au mot « médicament » (voir la section B.3).
Brevet
- Le paragraphe 79(2) de la Loi prévoit qu’un brevet pour une invention est lié à un médicament si l’invention est destinée à des médicaments ou à la préparation ou à la production de médicaments ou est susceptible d’être utilisée à de telles fins.
- Le CEPMB désigne par le mot « brevet » tout brevet canadien pour une invention liée à un médicament. Sans être limitatif, cette définition couvre les brevets suivants :
- Brevets pour des ingrédients actifs ;
- Brevets pour des procédés de fabrication ;
- Brevets pour un procédé d’administration ou pour une forme posologique faisant partie intégrante du procédé d’administration du médicament ;
- Brevets pour des indications/utilisations ; et
- Brevets pour des formulations médicinales.
- Un brevet est lié à un médicament s’il peut être utilisé pour la préparation ou la production de médicaments, qu’il le soit ou non.
- À priori, il doit exister un rapport ou un lien logique, même tenu, entre l’invention décrite dans le brevet et le médicamentNote de bas de page 5.
A.4.1.3 Vente sur un marché au Canada
- Le breveté ou l’ancien breveté doit vendre ou avoir vendu son médicament breveté sur un marché au Canada.
- Exception faite des médicaments vendus en vertu d’une licence obligatoire accordée par le Commissaire aux brevets avant le 20 décembre 1991, qui n’était pas arrivée à échéance en date du 15 février 1993, date d’entrée en vigueur de la Loi de 1992 modifiant la Loi sur les brevets, tous les médicaments brevetés vendus sur un marché au Canada pour usage humain ou pour usage vétérinaire sont assujettis à la compétence du CEPMB en matière d’examen du prix, incluant les médicaments brevetés ayant reçu leur Avis de conformité ou vendus en vertu du Programme d’accès spécial, faisant l’objet d’une Demande d’essai clinique ou, encore, comme Drogue nouvelle de recherche.
- Le CEPMB fait l’examen du prix du premier médicament que le breveté a vendu directement à une catégorie de clients (grossiste, hôpital, pharmacie ou autres) au Canada. Le CEPMB n’a pas droit de regard sur les prix auxquels les grossistes ou les détaillants vendent les médicaments brevetés ni sur les honoraires que chargent les pharmaciens.
- Le breveté n’est pas tenu de faire approuver par le CEPMB le prix de vente au Canada de son médicament breveté avant de l’offrir sur le marché canadien. Toutefois, le breveté peut demander au personnel du Conseil de vérifier le prix de son médicament avant de le lancer sur le marché canadien et/ou avant l’attribution d’un brevet afin de s’assurer qu’il n’est pas excessif.
- Le CEPMB ne fixe pas les prix de vente au Canada des médicaments brevetés. Toutefois, il appartient au Conseil de déterminer le prix moyen maximal auquel le breveté peut vendre son médicament (prix moyen maximal possible) au Canada ainsi que le prix moyen considéré non excessif.
A.5 Facteurs de réglementation des prix
A.5.1 Le paragraphe 85(1) de la Loi présente les facteurs dont le Conseil doit tenir compte dans le cadre d’une audience où il est appelé à déterminer si le breveté ou l’ancien breveté vend ou a vendu sur un marché au Canada son médicament breveté à un prix excessif. Ces facteurs sont les suivants :
- le prix de vente du médicament sur un tel marché ;
- le prix de vente d’autres médicaments de la même catégorie thérapeutique sur un tel marché ;
- le prix de vente à l’étranger du médicament et d’autres médicaments de la même catégorie thérapeutique ;
- les variations de l’indice du prix à la consommation ;
- tous les autres facteurs mentionnés dans le règlement d’application.
A.5.2 Si, après avoir considéré les facteurs susmentionnés, le Conseil n’est pas en mesure de déterminer si le prix de vente du médicament sous examen est ou non excessif, il peut, en vertu du paragraphe 85(2) tenir compte des coûts de réalisation et de mise en marché du médicament ainsi que d’autres facteurs précisés dans le règlement d’application ou qu’il estime pertinents.
A.5.3 En application du paragraphe 96(5) de la Loi, le Conseil a consulté tous ses intervenants avant de formuler ses Lignes directrices en vertu du paragraphe 96(4). Même si le Conseil et les brevetés ne sont pas strictement assujettis à ces Lignes directrices, elles proposent néanmoins une approche et une méthode d’application des facteurs de prix énumérés dans le paragraphe 85(1) de la Loi.
A.6 Recours
A.6.1 Si le Conseil estime que le breveté vend son médicament breveté sur un marché au Canada à un prix excessif, il peut rendre une ordonnance pour obliger le breveté à réduire le prix maximal auquel il vend son produit sur ce marché.
A.6.2 De plus, si le Conseil arrive à la conclusion que le breveté ou l’ancien breveté a vendu un médicament breveté sur un marché au Canada à un prix excessif, le Conseil peut rendre une ordonnance pour obliger le breveté à rembourser la valeur estimée des recettes excessives qu’il a tirées de la vente de son produit à un prix excessif.
A.6.3 Si le Conseil arrive à la conclusion que le breveté ou l’ancien breveté s’est livré à une politique de vente du médicament à un prix excessif, le Conseil peut rendre une ordonnance pour obliger le breveté ou l’ancien breveté à rembourser le double de la valeur estimée des recettes excessives qu’il a tirées de la vente de son médicament à un prix excessif.
A.6.4 Aux fins du remboursement des recettes excessives, le Conseil peut obliger le breveté ou l’ancien breveté :
- à réduire le prix auquel il vend son médicament sur un marché canadien ;
- à réduire le prix de vente d’un autre de ses médicaments brevetés sur un marché canadien ; ou
- à faire un paiement à Sa Majesté du chef du Canada.
A.7 Rapports que les brevetés doivent soumettre aux fins de la réglementation du prix
A.7.1 Pour arriver à bien s’acquitter de son mandat, le CEPMB doit avoir accès à des renseignements fiables et à jour sur les médicaments brevetés.
A.7.2 La Loi et le Règlement précisent les rapports que les brevetés et les anciens brevetés pour une invention liée à un médicament breveté assujetti à la compétence du CEPMB en matière d’examen du prix doivent soumettre au CEPMB. Vous trouverez dans le Guide du breveté de plus amples renseignements concernant les différents éléments d’information dont il faut faire rapport au Conseil ainsi que sur la façon de les soumettre et les dates auxquelles ils doivent être soumis (renseignements disponibles dans le site Web du CEPMBNote de bas de page 6).
Notification de l’intention de vendre un médicament breveté
- L’article 82 de la Loi prévoit que le breveté doit, dans les meilleurs délais, notifier le CEPMB de son intention de vendre un médicament breveté sur un nouveau marché canadien et de la date à laquelle il compte le faire.
- Le Conseil peut, au moyen d’une ordonnance, obliger un breveté à lui fournir des renseignements concernant le prix auquel il prévoit vendre son médicament breveté au Canada. Ces renseignements ne sont exigibles que 60 jours avant la date à laquelle le médicament devrait être lancé sur le marché canadien.
Formulaire 1 (Renseignements identifiant le médicament)
- En vertu du paragraphe 3(1) du Règlement, le breveté ou l’ancien breveté d’une invention liée à un médicament doit faire rapport au CEPMB des renseignements permettant d’identifier son médicament (formulaire 1). Le formulaire 1 doit être rempli pour tous les médicaments brevetés pour usage humain ou pour usage vétérinaire et être soumis au CEPMB en même temps que la monographie du médicament breveté faisant l’objet du rapport. Toutefois, si le médicament n’a pas encore obtenu son Avis de conformité, le breveté doit soumettre les renseignements que contiendrait normalement la monographie du médicament.
- En vertu des paragraphes 3(2) et 3(3) du Règlement, le breveté doit soumettre au Conseil les données demandées sur le formulaire 1 lorsque son médicament a reçu son premier Avis de conformité ou lorsque son médicament est offert en vente au Canada. Ces renseignements doivent être soumis au Conseil dans les sept jours qui suivent la réception du premier Avis de conformité ou de la première vente du médicament au Canada, soit la première de ces deux éventualités.
- Si le breveté ou l’ancien breveté a commencé à vendre le médicament au Canada avant d’avoir obtenu son brevet, il doit remplir le formulaire 1 et le soumettre au CEPMB dans les meilleurs délais après l’émission du brevet.
Formulaire 2 (Renseignements identifiant le médicament et renseignements sur son prix)
- En vertu du paragraphe 4(1) du Règlement, le breveté ou l’ancien breveté pour une invention liée à un médicament qui vend ou qui a vendu son médicament sur un marché au Canada doit faire rapport au CEPMB des renseignements identifiant son médicament ainsi que des renseignements sur son prix (formulaire 2). Ces renseignements doivent nommément faire état de la date de la première vente du médicament au Canada, de la quantité vendue dans sa forme posologique finale, du prix de vente moyen par emballage ou, encore, des recettes nettes tirées des ventes de chaque forme posologique, concentration et emballage du médicament et ce, pour chaque catégorie de clients de chaque province et territoire.
- En vertu du paragraphe 4(4) du Règlement, c’est le prix réel ou les recettes réelles après déduction de la taxe de vente fédérale et des réductions accordées à titre de promotion ou sous forme de rabais, escomptes, remboursements, biens ou services gratuits, cadeaux et autres avantages semblables qui doit être utilisé pour le calcul du prix moyen de l’emballage ou des revenus nets.
- Le paragraphe 4(2) du Règlement prévoit que lorsque le médicament pour usage humain contient une substance contrôlée au sens qu’en donne la Loi réglementant certaines drogues et autres substances comme, par exemple, des opioïdes, des amphétamines, des barbituriques et des benzodiazépines, que le médicament figure sur la liste des substances décrites dans les appendices C ou D de la Loi sur les aliments et drogues telles que des produits radiopharmaceutiques, des vaccins, des produits sanguins et des insulines ou, encore, dans l’appendice F du Règlement sur les aliments et les drogues tels que des médicaments d’ordonnance, le breveté doit fournir les renseignements demandés sur le formulaire 2 dans les 30 jours qui suivront la date de la première vente au Canada (ventes de la première journée de vente). Par la suite, le breveté ou l’ancien breveté devra présenter les mêmes renseignements au CEPMB dans les 30 jours qui suivront la fin de chaque semestre, commençant le 1er janvier et le 1er juillet de chaque année, y compris la dernière période partielle.
- Le paragraphe 4(3) du Règlement prévoit que, dans le cas des médicaments pour usage humain qui ne contiennent aucune substance contrôlée ni aucune substance nommée ou décrites dans les annexes citées dans le paragraphe 4(2), incluant les médicaments pour usage humain en vente libre ou tous les médicaments pour usage vétérinaire, le breveté doit faire rapport des renseignements demandés sur le formulaire 2 pour toutes les périodes de vente. Ces renseignements doivent être fournis dans les 30 jours qui suivront la date à laquelle le CEPMB lui enverra une demande suite à la réception d’une plainte puis, pour les deux prochaines années, dans les 30 jours suivant la fin du semestre de rapport. Il devra également tenir à jour les renseignements exigés sur le formulaire 2 depuis la date de la première vente de son médicament au Canada au cas où le CEPMB recevrait une plainte et lui demanderait les mêmes renseignements pour ces périodes.
- Le breveté ou l’ancien breveté qui choisit de ne pas soumettre au CEPMB les renseignements exigés sur le formulaire 2 pour un médicament qu’il vend entre la date à laquelle la demande de brevet est devenue accessible au public et l’octroi du brevet, doit garder ses données à jour en prévision du jour où il devra soumettre son rapport, soit suivant l’octroi du brevet.
A.7.3 Tous les renseignements énumérés dans la section A.7.2 doivent être soumis au CEPMB sur les formulaires électroniques Note de bas de page 7 pouvant être téléchargés depuis le site Web du CEPMB. Le rapport rempli doit être transmis par courriel au CEPMB à l’adresse spécifiée dans son site Web Note de bas de page 8.
A.7.4 Les rapports électroniques soumis au CEPMB doivent porter la signature numérique de la personne dûment autorisée à certifier l’exactitude des renseignements fournis.
A.8 Sanctions pour défaut de présenter les rapports exigés aux fins de la réglementation des prix
A.8.1 Tout élément de preuve établissant que le breveté n’a pas signifié son « Avis d’intention de vendre un médicament breveté sur le marché canadien » en application du paragraphe 82(1) de la Loi sera porté à l’attention du président du Conseil qui décidera s’il y a lieu d’émettre une ordonnance à l’encontre du breveté pour l’obliger à soumettre au Conseil son « Avis d’intention ».
A.8.2 À défaut du breveté ou de l’ancien breveté de soumettre dans les délais impartis un rapport ou tous ses rapports sur le formulaire 1 ou sur le formulaire 2 pour une ou pour plusieurs périodes de rapport, le personnel du Conseil lui fera savoir par écrit qu’il est en défaut de soumettre son ou ses rapports et lui accordera un délai de grâce de sept jours commençant à la date d’envoi de la lettre du personnel du Conseil. Si le breveté ou l’ancien breveté néglige de fournir les renseignements demandés dans les délais impartis, le personnel du Conseil recommandera au président du Conseil sans autre préavis de rendre une ordonnance en vertu de l’article 81 de la Loi afin d’obliger le breveté ou l’ancien breveté de lui fournir les renseignements demandés dans le délai dicté dans l’ordonnance.
A.8.3 Si le président du Conseil ou si le Conseil arrive à la conclusion que le breveté a sciemment omis de présenter les rapports exigés en vertu des articles 80, 81 ou 82 de la Loi, ou suivant l’émission d’une ordonnance du Conseil, le président ou le Conseil saisira le procureur général du Canada de la situation afin qu’il engage s’il y a lieu des poursuites judiciaires en vertu de l’alinéa 76.1(1) de la Loi.
A.8.4 En application de l’article 99 de la Loi, les ordonnances rendues par le Conseil peuvent être assimilées à des ordonnances de la Cour fédérale ou d’une cour supérieure et, le cas échéant, leur exécution sera effectuée suivant les mêmes modalités.
A.9 Protection du caractère confidentiel des renseignements fournis dans le cadre du processus de réglementation du prix
A.9.1 En vertu du paragraphe 87(1) de la Loi, tous les renseignements ou documents fournis au Conseil en application des articles 80, 81 ou 82 de la Loi ou dans le cadre d’une audience tenue en vertu de l’article 83 sont protégés et ne peuvent être communiqués sans l’autorisation de la personne qui les a fournis, sauf s’ils ont été divulgués dans le cadre d’une audience publique tenue en vertu de l’article 83.
Partie B – Les politiques
Introduction
Le Conseil adopte de temps à autre des politiques afin que ses intervenants connaissent les principes qu’il applique dans l’exercice de son mandat. Nous vous présentons ci-après les principales politiques du Conseil. Les politiques suivantes lui permettent de faire preuve de transparence et de cohésion auprès de ses intervenants.
B.1 Politique à l’égard du brevet en instance
B.1.1 Lorsqu’un médicament en instance d’être breveté est vendu sur un marché canadien, le CEPMB fera l’examen du prix au moment de l’octroi du brevet. Le prix faisant alors l’objet de l’examen est le prix à la date de la première vente du médicament ou la date à laquelle la demande de brevet est devenue accessible au public, soit la dernière de ces deux éventualités. Lorsque le brevet a été octroyé, la compétence du Conseil est rétroactive au prix auquel le médicament a été vendu alors que la demande de brevet était devenu accessible au public du fait que la partie qui vend le médicament a tiré un avantage du brevet au cours de cette période au même titre que le ferait un « breveté » en vertu du paragraphe 79(1) de la LoiNote de bas de page 9.
B.2 Politique à l’égard du brevet cédé au domaine public
B.2.1 Le CEPMB continue d’exercer sa compétence sur le prix de vente d’un médicament breveté sur un marché canadien dont le brevet a été cédé au domaine public et ce, tant que le brevet n’a pas été annulé ou cédé de la façon dont le prévoit la Loi sinon tant que le brevet ne sera pas arrivé à échéance. La Loi, qui constitue le mécanisme en vertu duquel l’État attribue des brevets et confère aux brevetés des droits et des avantages pendant la durée du brevet, ne reconnaît pas expressément la cession des brevets au domaine public comme mécanisme pour mettre fin aux droits que confère un brevet avant sa date d’échéance.
B.3 Politique concernant le sens donné au mot « médicament »
B.3.1 Un médicament s’entend de toute substance ou mélange de substances fabriqué par quelque moyen biologique, chimique ou autre et qui est appliqué ou administré in vivo à des humains ou à des animaux pour faciliter le diagnostic, le traitement, l’atténuation ou la prévention d’une maladie, de symptômes, de troubles ou d’états physiques anormaux ou, encore, qui modifie des fonctions organiques chez les humains ou chez les animaux, sans égard à son mode d’administration.
B.3.2 Il est entendu que la définition du mot « médicament » vise également les vaccins, les préparations topiques, les anesthésiques et les produits de diagnostic utilisés in vitro, sans égard au mode d´administration (par ex. administration transdermique, gélule, solution injectable, inhalation, etc.). Cette définition exclut les appareils médicaux, les produits diagnostiques et les désinfectants non utilisés in vivoNote de bas de page 10.
B.4 Politique à l’égard de l’unité d’examen du prix
B.4.1 Le CEPMB fait l’examen du prix moyen de chaque concentration de chaque forme posologique finale de chaque produit médicamenteux breveté vendu au Canada, nommément :
- des médicaments auxquels Santé Canada a attribué un numéro d’identification de drogue (DIN);
- des médicaments vendus au titre du Programme d’accès spécial ;
- des médicaments distribués en vertu d’une demande de participation à des essais cliniques ;
- des drogues nouvelles de recherche.
B.4.2 Dans le présent document, l’expression « produit médicamenteux breveté» désigne chaque concentration de chaque forme posologique finale de chaque médicament breveté.
B.4.3 Le prix moyen d’un produit médicamenteux correspond généralement au prix de l’unité dans laquelle le médicament est vendu (par ex. comprimé, millilitre, inhalateur, etc.) arrondi à la quatrième décimale.
B.5 Politique appliquée lorsque le prix semble excessif
B.5.1 Le prix d’un produit médicamenteux semble excessif dans les situations suivantes :
- lorsque, pour la période de lancement, le Prix de transaction moyen national du produit ou le Prix de transaction moyen du marché respectif est plus élevé que le Prix moyen maximal potentiel ;
- après quoi, si le Prix de transaction moyen national est plus élevé que le Prix moyen non excessif national, les Prix de transaction moyen du marché respectif seront examinés et considérés comme étant excessifs s’ils sont plus élevés que les Prix moyens non excessifs de leur marché respectif.
B.5.2 Lorsque le prix de transaction moyen national est plus élevé que le prix moyen maximal potentiel ou que le prix moyen non excessif national, mais dans une mesure trop minime pour justifier une enquête (appendice 11), le personnel du Conseil informera le breveté de la situation et mention sera faite dans le site Web du CEPMB que le prix du produit médicamenteux breveté « Ne justifie pas la tenue d’une enquête ». Le breveté devra alors réduire le prix de son produit et rembourser les recettes excessives qu’il a tirées de la vente de son produit à un prix excessif (voir dans la section B.7 la Politique à l’égard du remboursement des recettes excessives).
B.5.3 Lorsque le Prix de transaction moyen national dépasse le Prix moyen maximal potentiel ou le Prix moyen non excessif national dans une mesure qui justifie la tenue d’une enquête, le personnel du Conseil informera le breveté qu’il a engagé une enquête sur le prix de son produit et le produit sera classé « Sous enquête » (voir la section C.13).
B.6 Politique sur l’utilisation des produits médicamenteux brevetés et non brevetés dans les tests appliqués aux prix
B.6.1 Le personnel du Conseil peut exclure des comparaisons tout produit médicamenteux breveté ou non breveté retenu pour la comparaison s’il a des raisons de croire que le produit est vendu au Canada à un prix excessif.
B.6.2 Les produits clés utilisés pour les comparaisons seront soumis aux tests appliqués aux prix décrit dans les Lignes directrices.
B.6.3i On inclura le prix d’un produit médicamenteux non breveté pertinent aux tests appliqués aux prix, sauf si le personnel du Conseil est d’avis que le prix du médicament est excessif en l’absence de concurrence ou d’autres conditions du marché.
B.7 Politique à l’égard du remboursement des recettes excessives
B.7.1 Le Conseil peut permettre au breveté de rembourser le montant estimé des recettes excessives qu’il a tirées de la vente de son médicament à un prix excessif et ce, de l’une ou l’autre des façons suivantes : (i) en réduisant le prix de son médicament ou, encore, le prix d’un autre médicament breveté qu’il vend au Canada, ou (ii) en remettant à Sa Majesté du chef du Canada le montant estimé des recettes excessives qu’il a encaissées.
B.7.2 Lorsque les recettes excessives sont remboursées au moyen d’une réduction de prix, le Prix moyen du produit médicamenteux breveté faisant l’objet du remboursement ne sera considéré avoir été réduit que s’il est moins élevé que le prix moyen non excessif de l’année précédente. Le renoncement à l’augmentation autorisée du prix du produit ne sera pas une mesure de remboursement des recettes excessives acceptable.
B.7.3 Le remboursement en trop des recettes excessives ne peut créer un compte déficitaire.
B.8 Politique sur les médicaments génériquesii
B.8.1 Dans le présent énoncé de politique, un « médicament générique breveté » s’entend de tout médicament visé par un brevet pour une « invention liée à un médicament », conformément à l’article 79(2) de la Loi sur les brevets, et vendu par le « titulaire d’un brevet », comme défini à l’article 79(1) de la Loi sur les brevets, qui : a été autorisé pour la vente au Canada par Santé Canada à la lumière d’une évaluation de ce médicament par rapport à un produit de référence canadien défini à l’article C.08.001.1, ou autrement autorisé conformément à l’article C.08.002.1 du Règlement sur les aliments et drogues; a été déclaré interchangeable avec un produit de référence canadien par un régime de remboursement des médicaments provincial ou territorial; ou est une version homologuée d’un produit de marque de référence existant commercialisé au Canada (p. ex. un produit pharmaceutique autorisé par Santé Canada en vertu d’un renvoi à une présentation de drogue initiale).
B.8.2 Le CEPMB a compétence sur le prix de tous les médicaments brevetés, y compris les médicaments génériques brevetés. Le CEPMB sait que les médicaments génériques brevetés présentent un risque moins élevé que les médicaments brevetés et qu’ils constituent une priorité moins grande pour ses enquêtes réglementaires.
B.8.3 Au début d’une enquête, le personnel du Conseil examinera seulement les renseignements concernant l’identité du médicament et/ou son prix.
B.8.4 Le personnel du Conseil lancera une enquête sur le prix d’un médicament générique breveté si les trois conditions ci-dessous sont remplies :
- Une plainte a été reçue au sujet du médicament générique breveté.
- Le titulaire du brevet du médicament générique breveté est la seule entreprise canadienne à vendre une version générique du médicament au Canada.
- Le médicament générique breveté ne fait pas l’objet d’un accord de fixation des prix avec l’Alliance pancanadienne pharmaceutique (APP). Il incombe au titulaire du brevet du médicament générique breveté de prouver au comité que le médicament est assujetti à un accord de fixation des prix avec l’APP et que cet accord est respecté.
B.8.5 Tout médicament générique breveté visé par une enquête sera évalué par le personnel du Conseil selon les lignes directrices et les politiques applicables. Pour comparer les prix des médicaments génériques brevetés à l’échelle nationale et internationale, le personnel du Conseil s’appuiera notamment, sans s’y limiter, sur les prix intérieurs et internationaux du produit de marque de référence. Si le produit de marque de référence n’est plus commercialisé au Canada ou à l’étranger, le personnel du Conseil s’appuiera notamment, sans s’y limiter, sur l’ancien prix du produit de marque de référence (ajusté en fonction de l’indice des prix à la consommation) pour établir une comparaison.
Partie C – Les Lignes directrices et procédures
Préface
Les Lignes directrices et les procédures sont les directives que le Conseil donne aux brevetés et au personnel du Conseil afin que les prix des produits médicamenteux brevetés soient conformes à la Loi sur les brevets et au Règlement sur les médicaments brevetés. Il importe de noter que les brevetés et le Conseil ne sont pas liés par les Lignes directrices dans le cadre d’une audience.
Les Lignes directrices sont présentées de la façon suivante :
Le processus d’examen scientifique : Processus fondé sur les données cliniques qui évalue la mesure dans laquelle un nouveau produit médicamenteux breveté offre des bienfaits thérapeutiques par rapport aux produits médicamenteux existants. À la lumière des résultats obtenus, une recommandation est formulée concernant les produits médicamenteux qui se prêtent à une comparaison ainsi que leurs régimes posologiques comparables.
Le processus d’examen du prix : C’est à la lumière du niveau d’amélioration thérapeutique du produit médicamenteux breveté qu’est déterminé le Prix moyen maximal potentiel pour la période de lancement. Pour les périodes de rapport subséquentes, le prix d’un produit médicamenteux breveté existant est soumis aux tests de prix pertinents aux fins de déterminer son Prix moyen non excessif national et ses Prix moyens non excessifs du marché.
Les enquêtes : L’approche utilisée et les procédures suivies lorsque le prix d’un produit médicamenteux semble être excessif dans une mesure qui justifie la tenue d’une enquête (appendice 11).
Appendices : Tous les appendices constituent une partie intégrante des Lignes directrices.
Le processus d’examen scientifique
C.1 Introduction
C.1.1 Le processus d’examen scientifique du CEPMB se fonde sur la preuve clinique. C’est en fonction des résultats de l’examen scientifique qu’est recommandé le niveau d’amélioration thérapeutique du produit médicamenteux breveté.
C.1.2 Tous les nouveaux produits médicamenteux brevetés (incluant les produits ayant obtenu leur Avis de conformité, les produits distribués par le truchement du Programme d’accès spécial, les produits faisant l’objet d’une demande d’essai clinique et les nouvelles drogues de recherche) sont soumis à l’examen scientifique conformément aux Lignes directrices et aux procédures ci-après.
C.2 Sources des données scientifiques
C.2.1 Pour l’évaluation scientifique d’un nouveau produit médicamenteux breveté, le personnel du Conseil utilise les renseignements provenant des sources suivantes :
- Présentation du breveté – Le breveté est invité à soumettre au personnel du Conseil une brève présentation (voir l’appendice 1) dans laquelle il motive sa proposition quant au niveau d’amélioration thérapeutique de son produit médicamenteux, la sélection des produits médicamenteux qui se prêtent à la comparaison avec son produit et des régimes posologiques comparables.
- Rapports de recherches effectuées par un Centre d’information sur le médicament (CIM) – Le personnel du Conseil obtient des données scientifiques auprès de CIM, entre autres des rapports sur les essais cliniques, les lignes directrices pour la pratique clinique, etc. La base de l’examen qu’effectue le CIM est la monographie du médicament ou, si l’Avis de conformité n’a pas encore été attribué au produit, les renseignements que contient généralement une monographie du médicament.
- Recherche effectuée par le personnel du Conseil – Le personnel du Conseil peut également mettre à jour ses recherches et consulter d’autres sources pour compléter ses données ainsi que les éléments de preuve fournis par le breveté ou par le CIM.
- Résultats des recherches des membres du Groupe consultatif sur les médicaments pour usage humain (GCMUH) – Les membres du GCMUH peuvent également effectuer leur propre recherche et ainsi compléter les éléments de preuve fournis par les brevetés, par le CIM et par le personnel.
C.3 Groupe consultatif sur les médicaments pour usage humain
C.3.1 Le GCMUH met son expertise au service du personnel du Conseil en effectuant des examens scientifiques. Le GCMUH est chargé des fonctions suivantes :
- il évalue les renseignements scientifiques obtenus auprès des sources mentionnées dans la section C.2 ;
- lorsque nécessaire, il sollicite l’opinion d’autres experts ;
- il recommande le niveau d’amélioration thérapeutique et identifie les produits médicamenteux qui se prêtent aux comparaisons ainsi que, lorsque possible, les régimes posologiques ;
- dans les éléments de preuve, il relève les incertitudes qui sont susceptibles d’avoir une incidence sur l’analyse et, par ricochet, sur les recommandations qui en découleront.
C.3.2 En règle générale, les nouveaux produits médicamenteux brevetés sont soumis à l’examen du GCMUH. Toutefois, les nouveaux produits médicamenteux brevetés nommés ci-après ne sont pas soumis à l’examen du GCMUH à moins que le breveté n’allègue dans sa présentation que son produit offre de plus grands bienfaits thérapeutiques que les médicaments existants :
- le nouveau produit médicamenteux breveté représente un nouveau DIN d’une forme posologique d’un produit médicamenteux existant ou, encore, un nouveau DIN d’une autre forme posologique du produit médicamenteux comparable à la forme posologique existante (selon la description donnée à l’appendice 2) qui a la même indication ou la même utilisation que le DIN existant, ou
- le nouveau produit médicamenteux breveté est une combinaison de produits médicamenteux dont les différentes composantes sont vendues au Canada pour la même indication ou pour la même utilisation, ou
- Santé Canada considère le nouveau médicament générique breveté bioéquivalent au produit médicamenteux de marque de référence vendu au Canada, ou
- Le nouveau produit médicamenteux générique breveté est une version d’un médicament de marque existant vendu au Canada produite sous licence.
Procédures
C.3.3 Les membres du GCMUH ont une expertise reconnue en pharmacothérapie ainsi qu’une solide expérience en méthodologie de recherche scientifique, en analyse statistique et en évaluation de nouveaux produits médicamenteux.
C.3.4 Le GCMUH et ses membres ne rencontrent pas les brevetés.
C.3.5 L’identité des membres du GCMUH est divulguée dans le site Web du CEPMB.
C.3.6 Les dates des réunions du GCMUH sont annoncées dans le site Web du CEPMB.
C.3.7 À la demande d’un breveté, un nouveau produit médicamenteux breveté est soumis à la consultation du GCMUH aux fins d’obtenir ses conseils avant que le produit ne soit offert en vente au Canada et (ou) avant l’octroi d’un brevet.
C.3.8 Pour que le nouveau produit médicamenteux breveté puisse être soumis à l’examen du GCMUH, la présentation du breveté doit contenir les différents éléments mentionnés dans l’appendice 1 et être soumise au GCMUH au moins deux mois avant la réunion où le Groupe doit faire l’évaluation du produit.
C.3.9 Si le GCMUH est appelé à se pencher sur un nombre important de soumissions au cours d’une de ses réunions, les présentations seront évalués suivant l’ordre de priorité suivant :
- produits médicamenteux brevetés et vendus au Canada ;
- produits médicamenteux brevetés et devant être vendus au Canada à brève échéance ;
- produits médicamenteux brevetés, mais pas encore vendus sur le marché canadien ;
- produits médicamenteux qui ne sont pas brevetés, mais qui sont vendus au Canada ;
- produits médicamenteux qui ne sont pas brevetés et qui ne sont pas non plus vendus au Canada.
C.3.10 Le breveté sera informé de la date de la réunion du GCMUH au cours de laquelle sa soumission sera évaluée.
C.3.11 Dans son rapport, le GCMUH formulera ses recommandations quant à la mesure dans laquelle le produit médicamenteux offre de plus grands bienfaits thérapeutiques par rapport aux produits médicamenteux existants et proposera sa sélection de produits médicamenteux et des régimes posologiques qui se prêtent à la comparaison. Le GCMUH décrira également dans son rapport la façon dont il a appliqué les facteurs primaires et secondaires (voir la section C.6) ainsi que les éléments de preuve (voir la section C.7) sur lesquels il fonde sa recommandation.
C.3.12 Le breveté recevra un exemplaire du rapport du GCMUH.
C.4 Détermination de l’indication/utilisation principale du nouveau produit médicamenteux breveté
C.4.1 L’indication principale approuvée (ou l’indication proposée lorsque le produit n’a pas encore obtenu son Avis de conformité) doit être déterminée pour que puisse être évalué le niveau d’amélioration des bienfaits thérapeutiques d’un nouveau produit médicamenteux breveté utilisé pour de multiples indications approuvées/utilisations multiples.
Procédures
C.4.2 Le niveau d’amélioration des bienfaits thérapeutiques d’un nouveau produit médicamenteux breveté utilisé pour différentes indications approuvées est déterminé à l’aide de l’indication ou de l’utilisation approuvée, soit l’indication ou l’utilisation qui offre les plus grands bienfaits thérapeutiques par rapport aux autres thérapies administrées pour la même indication/utilisation à un segment assez important de patients. Ainsi, les conditions médicales rares ou les maladies peu courantes (qui ont une faible incidence ou une faible prévalence au Canada) ne sont pas prises en compte.
C.4.3 L’indication approuvée ou l’utilisation sera considérée « l’indication principale » aux fins de la sélection des produits médicamenteux pour les différentes comparaisons.
C.4.4 S’il n’existe aucune indication approuvée ou utilisation pour laquelle le nouveau produit médicamenteux breveté offre une amélioration marquée des bienfaits thérapeutiques par rapport aux produits existants, c’est l’indication approuvée ou l’utilisation présentant le plus grand potentiel de ventes qui déterminera le niveau d’amélioration des bienfaits thérapeutiques par rapport aux produits existants ainsi que la sélection des produits qui seront utilisés pour les différentes comparaisons de prix.
C.4.5 Le potentiel des ventes peut être évalué à l’aide de différents facteurs, dont les habitudes d’ordonnance des médecins (lorsque celles-ci sont connues), les données épidémiologiques (incidence et prévalence de la condition au Canada) et les habitudes d’ordonnance dans les autres pays.
C.5 Niveau d’amélioration des bienfaits thérapeutiques
C.5.1 Dans ses recommandations concernant le niveau d’amélioration des bienfaits thérapeutiques, le GCMUH utilise les définitions suivantes :
Médicaments constituant une découverte : Premier médicament de sa catégorie disponible sur le marché canadien qui traite avec efficacité une maladie ou une condition particulière.
Médicaments constituant une amélioration importante : Produit médicamenteux qui offre des bienfaits thérapeutiques largement plus importants à ceux des produits existants offerts sur le marché canadien.
Médicaments constituant une amélioration modeste : Produit médicamenteux qui, par rapport aux produits existants vendus sur le marché canadien, offre des bienfaits thérapeutiques modestement meilleurs.
Médicaments constituant une amélioration minime ou nulle : Produit médicamenteux qui par rapport aux produits existants vendus sur le marché canadien offre peu ou aucun bienfait thérapeutique supplémentaire.
C.6 Facteurs à l’appui de la recommandation du niveau d’amélioration thérapeutique
C.6.1 Les facteurs sous-mentionnés justifient la recommandation du niveau d’amélioration des bienfaits thérapeutiques d’un produit médicamenteux :
Facteurs principaux :
- plus grande efficacité
- moins grande incidence ou intensité des effets indésirables
Facteurs secondaires :
- voie d’administration
- facilité d’utilisation pour le patient
- plus grande conformité donnant lieu à une plus grande efficacité thérapeutique
- facilité au niveau de la prestation des soins
- temps nécessaire pour obtenir l’effet thérapeutique optimal
- durée du traitement habituel
- taux de succès
- pourcentage d’efficacité sur la population visée
- prévention d’une incapacité/économies
C.6.2 Les facteurs principaux ont une plus grande incidence sur la recommandation après quoi sont prises en compte les améliorations attribuables aux facteurs secondaires.
C.6.3 La recommandation concernant le niveau d’amélioration des bienfaits thérapeutiques d’un nouveau produit médicamenteux breveté ne tiendra pas compte des facteurs sous-mentionnés à moins qu’ils ne favorisent une plus grande efficacité et/ou une réduction de l’incidence ou de l’intensité des effets indésirables :
- mécanisme d’action du produit médicamenteux
- nouvelle entité chimique
- autre profil pharmacocinétique
Procédures
C.6.4 Les facteurs principaux seront pris en compte pour déterminer si le nouveau produit médicamenteux breveté constitue une découverte ou s’il constitue une amélioration importante, modeste ou minime/nulle par rapport aux autres produits médicamenteux vendus sur le marché canadien.
C.6.5 Les facteurs secondaires seront considérés en deuxième lieu. Le GCMUH pondérera ces facteurs selon les éléments de preuve qui lui sont soumis et selon également un jugement clinique raisonnable. Ces facteurs peuvent mener au classement du produit dans une catégorie constituant tout au plus une amélioration modeste.
C.7 Méthodologie d’évaluation du niveau d’amélioration des bienfaits thérapeutiques
C.7.1 Une approche qui se fonde sur la preuve clinique sera utilisée pour évaluer le nouveau produit médicamenteux breveté sous examen selon la hiérarchie de la preuve établie par le Oxford Centre for Evidence-Based Medicine (appendice 1).
Procédures
C.7.2 Le GCMUH évalue d’une façon critique les éléments de preuve sous les angles de leur validité, de leur incidence et de leur facilité d’application. Les éléments de preuve du niveau 1 auront préséance sur ceux des autres niveaux dans la recommandation du niveau d’amélioration des bienfaits thérapeutiques et des médicaments qui se prêtent aux comparaisons.
C.7.3 L’efficacité relative d’un nouveau produit médicamenteux breveté étant souvent incertaine, le GCMUH utilise autant que possible les éléments de preuve du premier niveau lorsqu’il évalue de nouveaux produits médicamenteux brevetés constituant une découverte ou une amélioration thérapeutique importante par rapport aux autres produits médicamenteux vendus au Canada.
C.7.4 Selon le cas, le GCMUH peut considérer des éléments de preuve d’autres niveaux lorsqu’il évalue les facteurs secondaires qui sont susceptibles d’avoir une incidence sur le classement selon le niveau d’amélioration des bienfaits thérapeutiques.
C.8 Sélection des produits médicamenteux et des régimes posologiques aux fins de comparaisons
Produits médicamenteux aux fins de comparaisons du prix
C.8.1 Pour la sélection des produits médicamenteux aux fins de comparaisons, le GCMUH utilise le système de classification Anatomique Thérapeutique Chimique (ATC) du Centre collaborateur de l’Organisation mondiale de la santé (OMS) pour la méthodologie sur l’établissement des statistiques concernant les produits médicamenteux.
C.8.2 Pour la comparaison, les substances chimiques dans le sous-groupe de la classification ATC qui précède la substance active simple, soit généralement le 4e sous-groupe. Le GCMUH peut également sélectionner les substances dans le sous-groupe qui précède immédiatement le quatrième sous-groupe ou dans un autre sous-groupe. Dans certains cas, il pourra sélectionner la substance chimique dans le sous-groupe qui correspond à la substance chimique simple, soit le cinquième sous-groupe.
C.8.3 Le GCMUH peut exclure de sa comparaison une substance chimique du même groupe ATC que le nouveau produit médicamenteux breveté sous examen s’il estime que ce produit ne se prête pas à la comparaison. Par exemple, les produits médicamenteux dont l’indication principale/l’utilisation n’est pas la même que celle de l’indication principale/l’utilisation du nouveau produit médicamenteux sous examen peuvent être exclus de la comparaison.
Procédures
C.8.4 Le GCMUH fait la sélection des différents produits médicamenteux qui seront utilisés pour la comparaison parmi les produits qui ont la même indication approuvée/utilisation que le nouveau produit médicamenteux breveté sous examen.
Produit médicamenteux constituant une découverte
C.8.5 Lorsque le nouveau produit médicamenteux breveté constitue une découverte, le GCMUH ne recommande aucun produit pour la comparaison puisqu’il n’existe en toute logique aucun produit semblable sur le marché. En effet, le nouveau produit est par définition le premier produit de sa catégorie qui réussit à traiter avec efficacité une maladie ou une condition donnée.
Produit médicamenteux constituant une amélioration importante
C.8.6 Lorsque le nouveau produit médicamenteux breveté constitue une amélioration importante des bienfaits thérapeutiques par rapport aux produits existants, le GCMUH identifiera les produits médicamenteux ayant la même indication approuvée ou la même utilisation que le produit par rapport auquel le produit sous examen constitue une amélioration importante.
Produit médicamenteux constituant une amélioration modeste
C.8.7 Lorsque le nouveau produit médicamenteux breveté constitue une amélioration modeste des bienfaits thérapeutiques par rapport aux produits existants, le GCMUH identifiera les produits ayant la même indication approuvée ou la même utilisation que le produit sous examen et par rapport auxquels le nouveau produit médicamenteux breveté constitue une amélioration modeste.
Produit médicamenteux constituant une amélioration minime ou nulle
C.8.8 Tout produit médicamenteux qui n’est pas considéré comme une découverte, une amélioration importante ou une amélioration modeste sera automatiquement classé dans la catégorie des produits médicamenteux qui constituent une amélioration minime ou nulle par rapport aux produits existants.
C.8.9 Pour qu’un nouveau produit médicamenteux breveté soit classé dans la catégorie des produits médicamenteux constituant une amélioration minime ou nulle, le GCMUH tentera en premier lieu d’identifier les médicaments qui se prêtent à la comparaison à l’aide des facteurs primaires et secondaires présentés dans la section C.6.1. Ces médicaments devront avoir la même indication approuvée/utilisation que le nouveau produit médicamenteux sous examen.
C.8.10 Si le GCMUH n’arrive pas à identifier de produits qui se prêtent à une comparaison avec le produit médicamenteux sous examen, il identifiera les produits qui sont réputés le mieux traiter l’indication approuvée ou l’utilisation en référence aux facteurs primaires et secondaires.
C.8.11 Pour un nouveau produit médicamenteux breveté qui est une nouvelle présentation de la même entité chimique qu’un ou plusieurs produits médicamenteux existants, ses produits de comparaison seront les produits médicamenteux existants ayant la même forme posologique ou une forme posologique comparable, ainsi que la même indication ou utilisation, à moins que le breveté n’ait soumis une présentation dans laquelle il allègue une amélioration thérapeutique et que cette allégation soit confirmée par le GCMUH. Cela s’appliquera peu importe si les régimes posologiques des produits médicamenteux nouveaux et existants sont les mêmes ou sont différents de façon appréciable.
C.8.12 La sélection des produits médicamenteux qui se prêtent à une comparaison avec un nouveau produit médicamenteux combiné où chaque élément du produit est vendu au Canada pour la même indication ou pour la même utilisation sera limitée aux différents éléments constituant le produit médicamenteux à moins que le breveté ne soumette une présentation selon laquelle son nouveau produit offre de plus grands bienfaits thérapeutiques que les médicaments existants et que le GCMUH confirme que le produit médicamenteux breveté sous examen offre une telle amélioration.
C.8.13 La sélection des produits médicamenteux qui se prêtent à une comparaison avec un nouveau produit médicamenteux breveté générique bioéquivalent au produit de marque vendu au Canada ou fabriqué sous licence sera limitée au produit médicamenteux de marque.
Régimes posologiques comparables
C.8.14 Le régime posologique recommandé pour la comparaison ne doit pas être plus généreux que le régime posologique le plus généreux recommandé dans la monographie du médicament (ou renseignements de semblable nature lorsque l’Avis de conformité n’a pas été attribué au produit médicamenteux) et tiendra compte des variables cliniques pertinentes. La concentration la plus appropriée du produit médicamenteux sera également choisie pour le régime posologique recommandé.
C.8.15 En règle générale, un régime posologique pour un traitement sera recommandé lorsque l’indication vise une maladie ou une condition grave alors que pour des conditions chroniques, c’est un régime posologique quotidien (dose de maintien) qui sera recommandé.
C.9 Dispositions visant les produits médicamenteux en vente libre et les produits médicamenteux pour usage vétérinaire
C.9.1 Conformément au Règlement et aux dispositions concernant la présentation de rapport présentées dans la Partie A – Le cadre juridique, le CEPMB n’effectuera un examen scientifique des produits médicamenteux en vente libre et des produits médicamenteux pour usage vétérinaire que suite à la réception d’une plainte concernant le prix du produit médicamenteux breveté.
Procédures
C.9.2 Sur réception d’une plainte, le CEPMB effectuera l’examen scientifique du produit médicamenteux breveté en vente libre ou du produit médicamenteux breveté pour usage vétérinaire de la même façon qu’il effectue l’examen scientifique de tous les autres produits médicamenteux brevetés.
C.9.3 Sur réception d’une plainte concernant le prix d’un produit médicamenteux breveté en vente libre, les données scientifiques pertinentes seront examinées par le GCMUH afin qu’il recommande le classement du produit médicamenteux selon la mesure dans laquelle il offre de plus grands bienfaits thérapeutiques, les produits médicamenteux et les régimes posologiques comparables.
C.9.4 S’il reçoit une plainte concernant le prix d’un produit médicamenteux breveté pour usage vétérinaire, le CEPMB constituera un Groupe consultatif sur les médicaments pour usage vétérinaire aux fins qu’il formule des recommandations concernant le classement du produit selon la mesure dans laquelle il offre de plus grands bienfaits thérapeutiques, les produits médicamenteux et les régimes posologiques qui se prêtent à une comparaison.
Le processus d’examen du prix
C.10 Introduction
C.10.1 Les objectifs de l’examen du prix sont comme suit :
- Déterminer le Prix moyen maximal potentiel auquel le nouveau produit médicamenteux breveté peut être vendu au cours de sa période de lancement ; et
- Déterminer si le prix d’un produit médicamenteux breveté existant semble être ou non excessif.
C.11 Examen des prix auxquels les nouveaux produits médicamenteux brevetés sont vendus durant la période de lancement
Introduction
C.11.1 Le choix du test qui sera appliqué au prix de lancement d’un nouveau produit médicamenteux breveté varie selon le classement du produit selon le niveau d’amélioration thérapeutique recommandé à la lumière des résultats de l’examen scientifique. Vous trouverez dans l’appendice 8 une description détaillée de la façon dont les tests seront appliqués aux prix selon le niveau d’amélioration thérapeutique.
C.11.2 Aux fins des sections ci-après, les prix de transaction moyens du marché se réfèrent aux prix des catégories de clients (hôpital, pharmacie et grossiste) et pour chaque province et territoire.
Produits médicamenteux constituant une découverte
C.11.3 Le prix de lancement d’un nouveau produit médicamenteux constituant une découverte sera jugé excessif si son Prix de transaction moyen national ou son Prix de transaction moyen du marché est plus élevé que le Prix moyen maximal potentiel pour la période de lancement établi au moyen du Test de la médiane des prix internationaux (appendice 5).
Produits médicamenteux constituant une amélioration importante
C.11.4 Les prix de lancement d’un nouveau produit médicamenteux breveté qui constitue une amélioration importante sera présumé excessif si son Prix de transaction moyen national ou son prix de transaction moyen du marché est plus élevé que le Prix moyen maximal potentiel pour la période de lancement, lequel correspondra au plus élevé des prix calculés comme suit :
- le prix non excessif le plus élevé calculé de la façon expliquée dans la section C.8.6, soit avec le Test de la comparaison du prix selon la catégorie thérapeutique (appendice 3), et
- la médiane des prix auxquels le produit est vendu dans les différents pays de comparaison, soit le Test de la médiane des prix internationaux (appendice 5).
Produits médicamenteux constituant une amélioration modeste
C.11.5 Le prix de lancement d’un nouveau produit médicamenteux qui constitue une amélioration modeste sera présumé excessif si son Prix de transaction moyen national ou son Prix de transaction moyen du marché est plus élevé que son Prix moyen maximal potentiel pour la période de lancement. Ce dernier prix correspondra au plus élevé des prix obtenus avec les tests suivants :
- Le point médian entre le prix obtenu dans l’alinéa (b) ci-dessous et le Prix médian international obtenu selon le Test de la médiane des prix internationaux (appendice 5); et
- Le prix non excessif le plus élevé de tous les produits médicamenteux identifiés calculé de la façon expliquée dans la section C.8.7, soit le Test selon la catégorie thérapeutique (appendice 3).
C.11.6 Lorsqu’il n’est pas possible d’effectuer le Test selon la catégorie thérapeutique, le Prix de lancement d’un nouveau produit médicamenteux constituant une amélioration modeste sera présumé excessif si le Prix de transaction moyen national ou le Prix de transaction moyen du marché est plus élevé que le Prix médian international obtenu avec le Test de la médiane des prix internationaux (appendice 5). Telle situation peut se produire lorsque le GCMUH n’arrive pas à trouver des régimes posologiques comparables pour tous les produits identifiés conformément à la section C.8.7 ou lorsque les prix de ces produits médicamenteux semblent excessifs.
Produit médicamenteux constituant une amélioration minime ou nulle
C.11.7 Le prix de lancement d’un nouveau produit médicamenteux breveté qui constitue une amélioration minime ou nulle par rapport aux produits médicamenteux existants sera présumé excessif si son Prix de transaction moyen national ou son Prix de transaction moyen du marché est plus élevé que son Prix moyen maximal potentiel. Ce dernier prix correspond au prix non excessif le plus élevé de tous les produits médicamenteux retenus pour le Test de la comparaison selon la catégorie thérapeutique (appendice 3), ces produits médicamenteux ayant été identifiés de la façon décrite dans la section C.8.9.
C.11.8 Le GCMUH peut arriver à la conclusion que le nouveau produit médicamenteux qui constitue une amélioration minime ou nulle ne compte aucun produit médicamenteux qui se prête à une comparaison. Dans un tel cas aussi exceptionnel, le prix de lancement du nouveau produit médicamenteux breveté sera présumé excessif si son Prix de transaction moyen national ou son Prix de transaction moyen du marché est plus élevé que le moindre des prix suivants :
- le prix non excessif le plus bas des produits médicamenteux offrant de plus grands bienfaits thérapeutiques identifiés au moyen d’une comparaison selon la catégorie thérapeutique (appendice 3) de la façon décrite dans la section C.8.10.
- le Prix médian international calculé à l’aide du Test de la médiane des prix internationaux (appendice 5).
C.11.9 S’il n’est pas possible d’effectuer une comparaison selon la catégorie thérapeutique, le prix de lancement du nouveau produit médicamenteux qui constitue une amélioration minime ou nulle par rapport aux produits existants sera présumé excessif si son Prix de transaction moyen national ou un de ses Prix de transaction moyens du marché est plus élevé que le Prix international médian calculé à l’aide du Test de la médiane des prix internationaux (appendice 5). Telle situation peut se produire lorsque le GCMUH n’arrive pas à trouver des régimes posologiques comparables pour tous les produits identifiés conformément à la section C.8.10 ou lorsque les prix de ces produits médicamenteux semblent excessifs.
C.11.10 À moins que le breveté ne fasse valoir dans sa présentation que son produit médicamenteux offre de plus grands bienfaits thérapeutiques que les produits médicamenteux existants et que le GCMUH arrive à la conclusion que le nouveau produit médicamenteux breveté constitue une amélioration modeste ou importante :
- Le Prix de lancement d’un nouveau produit médicamenteux générique breveté bioéquivalent au produit médicamenteux de marque de référence vendu au Canada, ou qui est une version produit sous licence d’un produit médicamenteux de marque breveté vendu au Canada, sera présumé excessif si son Prix de transaction moyen national ou si l’un de ses Prix de transaction moyens du marché est plus élevé que le Prix du produit médicamenteux de marque de référence.
- Sous réserve de l’alinéa (c) ci-dessous, le prix de lancement d’un nouveau produit médicamenteux breveté qui est une nouvelle présentation de la même entité chimique, dans une forme posologique identique ou comparable (appendice 2), un régime posologique identique ou comparable et la même indication ou utilisation sera considéré excessif si son Prix de transaction moyen national ou l’un de ses Prix de transaction moyens du marché est plus élevé que le prix obtenu avec le Test de la relation raisonnable (appendice 4).
- Lorsque le régime posologique comparable est très différent, le Prix de lancement du nouveau produit médicamenteux breveté sera présumé excessif si son Prix de transaction moyen national ou l’un de ses Prix de transaction moyens du marché est plus élevé que le plus élevé des prix des produits médicamenteux identifiés de la façon expliquée dans la section C.8.11 aux fins d’une comparaison du prix selon la catégorie thérapeutique (appendice 3).
- Lorsque le nouveau produit médicamenteux breveté est un produit mixte selon la définition qui en est donnée dans la section C.8.13, son Prix de lancement sera considéré excessif si son Prix de transaction moyen national ou l’un de ses Prix de transaction moyens du marché est plus élevé que la somme des prix des différentes substances qui le composent.
Test du prix international le plus élevé
C.11.11 Nonobstant les sections C.11.3 à C.11.10, le Prix moyen maximal potentiel d’un nouveau produit médicamenteux breveté à l’échelle nationale, pour les catégories de clients, pharmacie et hôpital, ainsi que dans chaque province et territoire, ne doit pas être plus élevé que le prix obtenu en vertu du Test du prix international le plus élevé (appendice 6).
C.11.12 Le CEPMB peut examiner le prix des nouveaux produits médicamenteux brevetés dans un marché au Canada (p. ex. selon la catégorie de clients dans une province/un territoire).
Procédures
C.11.13 Le personnel du Conseil consultera les sources de prix publiques pour établir les prix des médicaments de comparaison. Les sources de prix que consultera le personnel du Conseil sont les suivantes (en ordre alphabétique) : Association québécoise des pharmaciens propriétaires (AQPP); IMS Health; McKesson Canada; Le Programme de médicaments de l’Ontario; PPS Pharma; Régie de l’assurance maladie du Québec (RAMQ). Le personnel du Conseil choisira le prix public le moins élevé à partir de ces sources pour chacun des produits médicamenteux utilisés pour la comparaison. Si aucun prix de ces sources n’est fourni aux fins de comparaison, le personnel du Conseil examinera d’autres sources jusqu’à ce qu’il trouve un prix public.
C.11.14iii Nonobstant les autres éléments de la section C.11, les prix indiqués dans les sources énumérées à la section C.11.13 pour un nouveau produit médicamenteux breveté ne doivent pas excéder le Prix moyen maximal potentiel (PMMP) établi en vertu du (des) test(s) approprié(s) appliqué(s) au prix de lancement. Si l’une de ces sources proposait un prix plus élevé que le PMMP, le personnel du Conseil pourrait déclencher une enquête; il s’agirait d’abord de confirmer auprès des brevetés si des ventes ont été consenties au prix courant en question. Si le personnel du Conseil conclut que des ventes du genre ont eu lieu, une enquête serait lancée conformément aux Lignes directrices.
C.11.15 À la lumière des résultats du test appliqué au prix des ventes de la première journée de vente du produit au Canada et aux données sur ses ventes, le personnel du Conseil communiquera au breveté une opinion provisoire à savoir si le prix de son nouveau produit médicamenteux breveté semble ou non excessif.
C.11.16 Le Prix de lancement d’un nouveau produit médicamenteux breveté sera établi en calculant le Prix de transaction moyen national du produit médicamenteux ainsi que les Prix de transaction moyens du marché pour les trois catégories de clients (hôpital, pharmacie et grossiste) et pour chaque province et chaque territoire.
C.11.17 Le Prix de transaction moyen national sera déterminé à l’aide de la moyenne pondérée du total des revenus nets divisé par le total des quantités vendues sur tous les marchés.
C.11.18 Les Prix de transaction moyens du marché seront déterminés à l’aide des revenus nets du marché divisé par le total des quantités vendues sur ce marché (p. ex. le Prix de transaction moyen du marché dans la catégorie du client « pharmacie » sera déterminé à l’aide du total des revenus nets des pharmacies dans toutes les provinces et tous les territoires divisé par la quantité vendue à ces pharmacies. Le Prix de transaction moyen du marché dans une province ou un territoire particulier sera déterminé à l’aide du total des revenus nets dans toutes les catégories de clients, divisé par le total des quantités vendues dans une province ou un territoire.
C.11.19 La période de lancement est la période qui va de la date de la première vente au Canada du nouveau produit médicamenteux jusqu’à la fin du semestre de rapport (30 juin ou 31 décembre de chaque année) si cette période couvre plus d’un mois. Autrement, si la période entre la date de la première vente et la fin du semestre de rapport ne couvre pas un mois, la période de lancement ira de la date de la première vente à la fin du semestre de rapport suivant.
C.11.20 Les prix de tous les produits médicamenteux essentiels utilisés dans les comparaisons seront évalués conformément aux tests de prix décrits dans les Lignes directrices. Le personnel du Conseil peut exclure de ses comparaisons tout produit médicamenteux breveté ou non breveté lorsqu’il a des motifs de croire que le prix de vente du produit est excessif.
C.11.21iv On inclura le prix d’un produit médicamenteux non breveté pertinent aux tests appliqués aux prix, sauf si le personnel du Conseil est d’avis que le prix du médicament est excessif en l’absence de concurrence ou d’autres conditions du marché.
C.12 Examen des prix des produits médicamenteux brevetés existants
C.12.1 Le Prix d’un produit médicamenteux breveté existant sera présumé excessif lorsque le Prix de transaction moyen national dépassera le prix moyen non excessif national comme il est déterminé par le prix le moins élevé :
- du taux de variation de l’indice des prix à la consommation (IPC) après application de la méthodologie de rajustement du prix selon l’IPC (appendice 9); ou,
- du résultat du test du prix international le plus élevé (appendice 6).
C.12.2 Si le Prix de transaction moyen national dépasse le Prix moyen non excessif national par un montant qui justifie les critères d’enquête (appendice 11), le personnel du Conseil devra examiner les Prix de transaction moyens du marché. Le personnel du Conseil devra aussi examiner les prix dans ces marchés lorsqu’une plainte justifie le commencement d’une enquête.
- Le prix de chacune des trois catégories de clients (hôpital, grossiste et pharmacie) et chaque province et territoire sera jugé excessif si le prix de transaction moyen du marché dépasse le prix moyen non excessif du marché tel qu’il est déterminé par le taux de variation de l’IPC en fonction de la méthodologie de rajustement du prix selon l’IPC (appendice 9).
- En outre, le prix de chacune des deux catégories de clients (hôpital et pharmacie) et dans chaque province et territoire sera présumé excessif si le Prix de transaction moyen du marché dépasse le Prix moyen non excessif du marché tel qu’il est déterminé par le Test selon la comparaison du prix au Canada avec le prix international le plus élevé (appendice 6).
C.12.3v Annulé.
C.12.4 Par ailleurs, lorsque le breveté peut démontrer que l’augmentation du Prix de transaction moyen national de son produit est exclusivement attribuable à un changement au niveau des ventes et non à une augmentation des Prix de transaction moyens du marché pour chaque catégorie de clients et pour chaque province/territoire ne dépasse pas leurs Prix de transaction moyens non excessifs calculés à l’aide de la méthodologie du rajustement du prix selon l’IPC, le Prix de transaction moyen national ne sera alors pas considéré excessif.
C.12.5 Lorsque le Prix de transaction moyen national ou le Prix de transaction moyen d’un marché d’un produit médicamenteux augmente par rapport à l’exercice précédent par suite de la réduction ou de l’élimination d’un avantage et que le breveté démontre, preuves à l’appui, que l’augmentation du prix de son produit est exclusivement attribuable à la réduction ou à l’élimination des avantages, il peut dans un tel cas être approprié de rajuster les Prix moyens non excessifs (prix national et prix du marché) à l’aide de la méthodologie de la majoration (appendice 10).
C.12.6 Le Conseil est conscient que le breveté peut invoquer les coûts de réalisation et de mise en marché pour justifier un rajustement du Prix moyen non excessif de son produit médicamenteux breveté (c.-à-d. lorsque l’Avis de conformité a été attribué au produit médicamenteux et que ce produit a été initialement vendu pour des motifs humanitaires à titre de nouvelle drogue de recherche, par le truchement d’une demande d’essai clinique ou, encore, au titre du Programme d’accès spécial).
C.12.7 Le CEPMB se réserve le droit de faire l’examen du prix de tout produit médicamenteux breveté existant disponible sur un marché au Canada (par ex. selon la catégorie de clients, dans une province ou dans un territoire).
C.12.8vi/vii Lorsqu’un produit médicamenteux existant est vendu au Canada par des personnes autres que le breveté initial à la suite d’un accord de fusion ou d’acquisition, les Lignes directrices du CEPMB s’appliqueront au numéro d’identification du médicament (DIN) vendu par ces personnes tout comme s’il s’agissait du DIN du breveté initial (connue aussi sous le nom de « politique de continuation du
DIN »). Par exemple, si dans le cadre d’une fusion ou d’une acquisition, un breveté cesse de vendre un produit médicamenteux breveté et les droits de commercialisation du produit sont transférés à un autre breveté, le DIN vendu par le nouveau breveté sera considéré comme une continuation du DIN original aux fins d’application des Lignes directrices, y compris la méthodologie de majoration et la méthodologie de rajustement du prix selon l’IPC.
Le personnel du Conseil inclura dans son interprétation du terme « acquisition » tout transfert individuel de DIN autre que dans les cas spécifiques de fusions d’entreprises ou d’acquisitions d’entreprises dans leur intégralité, tant que cette interprétation sera conforme à l’article 87 de la Loi sur les brevets et à la section A.9.1 des Lignes directrices.
Les enquêtes
C.13 Introduction
C.13.1 Lorsque le prix d’un produit médicamenteux breveté semble plus élevé que le prix autorisé en vertu des Lignes directrices, mais dans une mesure qui ne justifie pas une enquête (appendice 11), le breveté sera informé de la situation et mention sera faite dans le site Web du CEPMB que le prix du produit médicamenteux breveté ne justifie pas la tenue d’une enquête. En principe, le breveté devrait alors réduire le Prix de transaction moyen national de son produit médicamenteux ainsi que les Prix de transaction moyens du marché pour qu’ils ne soient pas excessifs et rembourser les recettes excessives qu’il a tirées de la vente de son produit à un prix excessif (appendice 13) mais le personnel du Conseil ne prendra aucune mesure dans l’immédiat.
C.13.2 Lorsque le Prix de transaction moyen national d’un produit médicamenteux breveté semble plus élevé que le Prix moyen non excessif national et que les circonstances justifient la tenue d’une enquête selon le critère établi par le Conseil (appendice 11), le breveté sera informé que le prix de son produit est sous enquête et que mention sera faite dans le site Web du CEPMB que le prix de son produit est « sous enquête ».
C.13.3 L’examen comportera une analyse de l’évolution du prix depuis le lancement du produit sur le marché canadien, de son Prix de transaction moyen national et de ses Prix de transaction moyen du marché et ce, pour chaque catégorie de clients (hôpital, pharmacie, grossiste) et de chaque province et de chaque territoire.
C.13.4 La comparaison du prix selon la catégorie thérapeutique internationale permet de comparer le prix du produit médicamenteux breveté avec les prix départ-usine des médicaments identifiés selon le Test de la relation raisonnable ou de la comparaison de la classe thérapeutique, lesquels prix sont disponibles au grand public et pratiqués dans les pays de comparaison nommés dans le Règlement. La comparaison du Prix selon la catégorie thérapeutique internationale ne sera effectuée que lorsqu’il semble qu’elle pourrait fournir des renseignements utiles en cas d’enquête à savoir si le prix du produit médicamenteux sous examen semble excessif à la lumière des résultats des autres tests (test de la relation raisonnable, comparaison selon la catégorie thérapeutique). Ce test, qui est décrit dans l’appendice 7, n’est pas utilisé comme test primaire.
C.13.5 Habituellement, le breveté ne dispose que d’un bref délai pour donner suite à l’avis que lui a signifié le personnel du Conseil l’informant que le prix de son produit faisait l’objet d’une enquête. Par exemple, si le breveté aurait dû savoir à la lumière des rapports qu’il a soumis au Conseil (par ex. prix rajusté selon l’IPC) que le prix de son produit semblait plus élevé que ne l’autorisent les Lignes directrices (par ex. lorsque le prix a été majoré d’un taux plus élevé que celui autorisé avec la méthodologie du prix rajusté selon l’IPC), le personnel du Conseil peut lui accorder un délai aussi court que sept jours civils. Le délai peut aller jusqu’à 30 jours civils lorsqu’il semble que le breveté n’était pas conscient que le Prix de transaction moyen national ou les Prix de transaction moyens du marché de son produit médicamenteux étaient excessifs (par ex. lorsque le GCMUH a recommandé pour la comparaison de produits médicamenteux différents ou d’autres régimes posologiques que ceux proposés et escomptés par le breveté).
C.13.6 L’enquête peut mener à l’un ou l’autre des trois résultats suivants :
- Le Prix de transaction moyen national et (ou) les Prix de transaction moyen du marché ne semblent pas excessifs ; ou
- Le Prix de transaction moyen national et (ou) les Prix de transaction moyens du marché semblent excessifs et le breveté soumet un Engagement de conformité volontaire satisfaisant aux exigences du Conseil ; ou
- Le Prix de transaction moyen national et (ou) les Prix de transaction moyens du marché semblent excessifs et le breveté n’a soumis aucun Engagement de conformité volontaire satisfaisant aux exigences du Conseil. Dans un tel cas, le personnel du Conseil soumet l’affaire à l’attention du président du Conseil et lui recommande d’émettre un Avis d’audience.
C.14 Prix qui ne semblent pas excessifs
C.14.1 Si l’enquête révèle que le Prix de transaction moyen national et (ou) les Prix de transaction moyens du marché ne semblent pas excessifs, l’enquête sera close et le breveté en sera informé.
C.15 Engagement de conformité volontaire
C.15.1 Si l’enquête confirme que le Prix de transaction moyen national et (ou) les Prix de transaction moyens du marché semblent excessifs, le breveté sera invité à soumettre un Engagement de conformité volontaire écrit prévoyant la réduction du prix de son produit médicamenteux et le remboursement des recettes excessives qu’il a tirées de la vente de son produit médicamenteux à un prix qui semble excessif (appendice 13).
C.15.2 L’Engagement de conformité volontaire que soumet le breveté ne constitue pas une admission de sa part que le Prix de transaction moyen national et (ou) que les Prix de transaction moyens du marché de son produit médicamenteux breveté sont ou ont été excessifs.
C.15.3 Le personnel du Conseil aidera le breveté à préparer son Engagement de conformité volontaire. À cette fin, il lui fournira un document type d’engagement de conformité volontaire ainsi que des conseils adaptés à sa situation.
C.15.4 Lorsque l’Engagement de conformité volontaire du breveté est jugé conforme aux Lignes directrices, la politique du Conseil dicte que l’approbation de l’Engagement n’appartient qu’au président du Conseil (ou au Panel d’audience lorsque l’Engagement de conformité volontaire est soumis au Conseil après l’émission de l’Avis d’audience).
C.15.5 Le président du Conseil n’est pas autorisé à négocier avec le breveté les modalités de son Engagement de conformité volontaire.
C.15.6 Dans sa proposition d’Engagement de conformité volontaire, le breveté doit confirmer le Prix moyen maximum potentiel de son produit médicamenteux pour la période de lancement, le Prix de transaction moyen national et les Prix moyens non excessifs du marché pour les autres périodes et s’engager à les respecter. Il doit également mentionner dans son Engagement la façon dont il remboursera les recettes excessives qu’il a tirées de la vente de son produit médicamenteux.
C.15.7 Dans la plupart des cas, l’Engagement de conformité volontaire contiendra une clause prévoyant le versement d’un montant à Sa majesté du chef du Canada aux fins de rembourser les recettes excessives tirées de la vente de son produit à un prix excessif.
C.15.8 Le président du Conseil (ou le Panel d’audience du Conseil) prendra la décision d’accepter ou non l’Engagement de conformité volontaire à la lumière de l’article 83 de la Loi.
C.15.9 Le CEPMB fera rapport au public de tous les Engagements de conformité volontaire acceptés par le président du Conseil ou par un panel d’audience du Conseil. Il fera nommément rapport du nom du produit médicamenteux breveté et (ou) du breveté et de tout autre élément d’information pertinent. Mention de ces éléments d’information sera également faite dans le rapport annuel ainsi que dans le site Web du CEPMB. Ces éléments d’information peuvent également être rapportés dans La Nouvelle ou dans d’autres publications.
Appendice 1 – Proposition du breveté sur le niveau d’amélioration thérapeutique
Dans sa présentation, le breveté doit justifier sa proposition concernant le niveau d’amélioration des bienfaits thérapeutiques qui devrait être attribué à son produit médicamenteux, la sélection des produits médicamenteux pour les différentes comparaisons et les régimes posologiques comparables.
Le breveté doit soumettre sa proposition et ses documents de référence conformément aux exigences en matière de rapport du CEPMB Note de bas de page 11, viii/ix. Le personnel du Conseil vérifiera l’ensemble de la proposition du breveté afin de s’assurer que tous les documents de référence mentionnés ou listés dans le document ont été joints à la proposition. Advenant que certains documents soient manquants, le personnel du Conseil communiquera avec le breveté pour les obtenir.
1. Données cliniques à l’appui
1.1 Médicament : nom, catégorie, brève description de son mécanisme d’action, indications approuvées ou utilisations, dose approuvée ou proposée.
1.2 Monographie du médicament (ou, si l’avis de conformité n’a pas encore été attribué au produit médicamenteux, les renseignements que contient normalement une monographie du médicament) : présentée en même temps que le formulaire 1 « Renseignements identifiant le médicament ».
1.3 Essais individuels/études :
- Éléments de preuve de niveau 1 : Rapports publiés d’essais cliniques randomisés menés sur le nouveau produit médicamenteux breveté sous examen versus les médicaments de comparaison actifs, s’il y en a; rapports publiés d’essais cliniques randomisés portant sur le nouveau produit médicamenteux breveté sous examen versus un placébo; rapports d’essais cliniques randomisés de grande qualité non publiés, lorsque disponibles.
- Rapports publiés d’essais cliniques utilisant des éléments de preuve de moindre niveau (par ex. études des résultats, examens systématiques des cohortes et des essais cas-témoins) lorsque les éléments de preuve de niveau 1 ne sont pas disponibles. Nota : En ce qui concerne les éléments de preuve de niveau 1 et d’autres niveaux, le breveté est encouragé à axer sa présentation sur les principaux essais cliniques qui ouvrent la voie à l’Avis de conformité ou à un changement de la pratique clinique ou qui pourraient constituer les meilleurs éléments de preuve du breveté.
- Éditoriaux et erratum se rapportant à des rapports d’essais cliniques publiés
- Autres éléments de preuve clinique, tels que études écologiques, cas et sondages sur le nouveau produit médicamenteux breveté sous examen lorsque le breveté allègue que son produit apporte de plus grands bienfaits thérapeutiques associés aux facteurs secondaires.
1.4 Sommaire des essais mentionnés dans un tableau de la présentation :
- Études à consulter (Abrégés et publications publiés) et bibliographie fournie par le breveté.
- Brève description de l’étude ainsi que des indicateurs des résultats.
- Phase d’essai (Phase II, III ou IV); les essais de phase I ne feront pas l’objet d’une révision.
1.5 Brève description des normes de thérapie ou de la pratique clinique acceptée pour lesquelles le nouveau produit médicamenteux breveté sous examen est indiqué ou utilisé :
- Par exemple, examens de classe, analyses systématiques/méta-analyses.
1.6 Lignes directrices pour la pratique clinique publiées qui portent sur l’indication ou sur l’utilisation du nouveau produit médicamenteux breveté sous examen si disponibles :
- De préférence, les lignes directrices canadiennes révisées par des pairs; les lignes directrices des États-Unis, du Royaume-Uni, de l’Australie et de l’Europe seront également prises en compte.
2. Proposition du breveté
2.1 Résumé :
- Brève description du nouveau produit médicamenteux breveté et de la place qu’il occupe dans la thérapie ainsi que le sommaire des éléments de preuve clinique.
2.2 Niveau proposé sous l’angle de l’amélioration des bienfaits thérapeutiques.
2.3 Produits médicamenteux proposés pour la comparaison :
- Éléments prouvant la même indication approuvée ou la même utilisation que le nouveau produit médicamenteux breveté sous examen.
2.4 Régimes posologiques proposés pour la comparaison avec le nouveau produit médicamenteux breveté sous examen :
- Doses approuvées ou proposées.
- Doses utilisées dans les essais cliniques.
- Doses recommandées dans les lignes directrices pour la pratique clinique.
3. Niveaux de preuve pour la détermination de l’amélioration des bienfaits thérapeutiques
3.1 Le tableau 1, ci-dessous, présente la hiérarchie des éléments de preuve que considère le GCMUH au moment de formuler sa recommandation quant au niveau d’amélioration des bienfaits thérapeutiques que représente un nouveau produit médicamenteux breveté.
Tableau 1Note de bas de page 12 – Niveaux de preuve pour la détermination de l’amélioration des bienfaits thérapeutiques
| Niveau |
Thérapie / Prévention |
Analyses économiques et analyses des décisions |
| 1a |
RM (avec homogénéité*) d’ECR |
RM (avec homogénéité*) d’études économiques de niveau 1 |
| 1b |
ECR individuel (avec intervalle de confiance étroit) |
Analyse fondée sur des coûts ou des alternatives cliniquement sensibles; revue(s) méthodiques(s) des preuves; inclusion d’analyses de sensibilité multidirectionnelles |
| 1c |
Série de cas de type « tous ou aucun »§ |
Analyse de « meilleure valeur » ou de
« pire valeur » absolue
† |
| 2a |
RM (avec homogénéité*) d’études de cohortes |
RM (avec homogénéité*) d’études économiques de niveau >2 |
| 2b |
Étude de cohortes isolée (y compris ECR de faible qualité; par exemple avec un suivi de <80 %) |
Analyse basée sur des coûts ou des alternatives cliniquement sensibles : revue(s) limitée(s) des preuves ou études isolées; et inclusion d’analyses de sensibilité multidirectionnelles |
| 2c |
Études de « morbi-mortalité »; Études écologiques |
Audit ou études de « morbi-mortalité » |
| 3a |
RM (avec homogénéité*) d’études cas-témoins |
M (avec homogénéité*) d’études de niveau 3b ou meilleures |
| 3b |
Étude cas-témoins individuelle |
Analyse fondée sur des alternatives ou des coûts limités, des estimations de mauvaise qualité des données, mais avec des analyses de sensibilité incorporant des variations cliniquement sensibles |
| 4 |
Série de cas (et études de cohortes et cas-témoins de mauvaise qualité §§) |
Analyse sans analyse de sensibilité |
| 5 |
Opinion d’expert sans évaluation critique explicite ou basée sur la physiologie, des travaux expérimentaux ou des « principes physiopathologiques primaires » |
Opinion d’expert sans évaluation critique explicite ou basée sur la physiologie des travaux expérimentaux ou des « principes physiopathologiques primaires » |
* Homogénéité désigne une revue méthodique sans variation préoccupante (hétérogénéité) des directions et des degrés des résultats des différentes études. Les revues méthodiques ayant une hétérogénéité statistique importante ne sont pas nécessairement préoccupantes et, inversement, les revues ayant une hétérogénéité préoccupante ne sont pas toutes statistiquement importantes. Tel que mentionné précédemment, les études ayant une hétérogénéité préoccupante doivent être identifiées au moyen de « - » suivi de leur niveau désigné.
§ Cas rencontrés lorsque tous les patients sont décédés avant que la thérapie ne soit disponible, mais certaines patients vivent encore grâce à ce médicament; d’autres sont décédés avant que la thérapie ne soit disponible. Aucun patient sous traitement ne décède.
§§ Une étude de cohorte de mauvaise qualité ne définit pas clairement les groupes de comparaison et (ou) ne mesure pas les expositions et la morbidité d’une façon objective (de préférence à l’aveugle) chez les patients exposés et non exposés et (ou) n’identifie pas ou ne contrôle pas d’une façon appropriée les variables confusionnelles connues.
†Traitements de meilleure valeur sont aussi bons, mais moins coûteux ou, encore, plus efficaces pour un même coût ou pour un coût moindre. Les traitements de pire valeur sont aussi bons et plus chers ou, encore, pires et aussi chers sinon plus chers.
RM : Revue systématique de la littérature ECR : Essai clinique randomisé
Appendice 2 – Formes posologiques comparables
Le présent appendice présente les formes posologiques qui peuvent être utilisées pour le test de la relation raisonnable auquel sont soumis les nouveaux produits médicamenteux brevetés. Les formulations d’un même groupe sont considérées comparables, mais les formes posologiques de groupes différents ne le sont pas.
Le CEPMB vérifie de temps à autre la liste des formes posologiques comparables afin de s’assurer qu’elle contient toutes les formes posologiques utilisées.
Formes posologiques comparablesx
| Topique (T) |
Nasale (N) / Pulmonaire (P) |
Solide administré par voie
orale (S) |
|
Aérosol
Applicateur
Atomiseur
Atomiseur (ballon-valve)
Atomiseur à dose mesurée
Bandelette
Bâtonnet
Compresse
Crayon
Crème
Disque
Disque à libération prolongée
Emplâtre
Éponge
Gel
Gel à libération contrôlée
Liposomes
Liquide
Lotion
Mousse aérosol
Onguent
Pansement
Pâte
Peinture
Poudre
Savon en pain
Shampoing
Solution
Teinture
Timbre
Timbre à libération prolongée
|
Aérosol
Aérosol à dose mesurée
Atomiseur
Atomiseur à dose mesurée
Bâtonnet
Gaz
Gouttes
Poudre
Poudre en doses mesurées
Préparation en doses mesurées
Solution
Solution à libération prolongée
|
Bandelette
Barre à croquer
Cachet
Caplet
Caplet à libération modifiée
Comprimé
Comprimé à croquer
Comprimé à dissolution orale
Comprimé effervescent
Comprimé à libération modifiée
Comprimé pour suspension
Gélule
Gélule à libération modifiée
Globules
Gomme à mâcher
Granules
Granules effervescents
Morceau à croquer
Pastille
Pellet
Pellicule soluble
Poudre à libération prolongée
Poudre effervescente
|
blank
| Liquide administré par voie orale (L) |
Vaginale (V) |
Parentérale (J) |
|
Atomiseur
Émulsion
Gel
Gouttes
Granules pour solution
Granules pour suspension
Granules pour suspension à libération prolongée
Granules pour suspension à libération retardée
Liquide
Liquide à libération modifiée
Poudre à libération prolongée
Poudre pour solution
Poudre pour suspension
Sirop
Sirop à libération prolongée
Solution
Solution à libération prolongée
Solution buvable
Suspension
Suspension à libération prolongée
Teinture
Thé à base d’herbes
|
Anneau à libération lente
Comprimé vaginal
Comprimé vaginal effervescent
Cône
Crème
Douche
Éponge
Gel
Gel à libération contrôlée
Implant
Insert
Insert à libération prolongée
Mousse
Ovule
Pellet
Suppositoire
Suppositoire à libération soutenue
Tampon
|
Bolus
Implant
Injection à libération modifiée
Liposomes
Pellet implantable
Poudre pour solution
Poudre pour suspension à libération soutenue
Solution
Solution à libération prolongée
Suspension à libération prolongée
Suspension pour émulsion
Trousse
|
blank
| Otique (E)/Ophtalmique (Y) |
Rectale (R) |
Dentaire / Sublinguale
Buccale (M) |
|
Dispositif oculaire à libération modifiée
Gel
Gel à libération contrôlée
Gouttes
Implant
Insert
Insert à libération prolongée
Liquide
Onguent
Poudre pour solution
Solution
Solution à libération prolongée
Suspension
|
Bâtonnet
Crème
Insert
Lavement
Mousse
Onguent
Ovule
Suppositoire
Suppositoire à libération soutenue
Suspension
Suspension à libération prolongée
|
Applicateur
Atomiseur buccal
Atomiseur sublingual
Bandelette
Bâtonnet
Cachet
Comprimé
Comprimé à dissolution orale
Comprimé buccal à libération modifiée
Comprimé sublingual
Dentifrice
Émulsion
Gel
Gel à libération contrôlée
Gomme à mâcher
Pastille
Pâte
Pellicule, soluble
Pompe à dose mesurée
Poudre dentifrice
Poudre effervescente
Poudre pour suspension
Rince-bouche (gargarisme)
Soie dentaire
Solution
Solution à libération prolongée
Suspension
Suspension à libération prolongée
|
Appendice 3 – Comparaison selon la catégorie thérapeutique
1. Approche
La comparaison selon la catégorie thérapeutique permet de comparer le Prix de transaction moyen national et les Prix de transaction moyens du marché pour chaque catégorie de clients – hôpital, pharmacie, grossiste et chaque province/territoire – avec les prix au Canada des produits médicamenteux retenus pour la comparaison que le CEPMB ne considère pas excessifs. Les prix des produits médicamenteux retenus pour la comparaison conformément aux sections C.8.1 à C.8.13, sont comparés avec ceux du nouveau produit médicamenteux breveté sous examen.
2. Mesure du prix
Le CEPMB considère qu’il est approprié de comparer les prix des produits médicamenteux utilisés pour les comparaisons de prix en tenant compte des régimes posologiques comparables déterminés conformément aux sections C.8.14 et C.8.15. Selon le cas, le CEPMB effectuera les comparaisons de prix selon le coût/traitement ou le coût/jour. En règle générale, la comparaison sera faite selon le coût/traitement pour des maladies graves et selon le prix/jour (sur la base d’une dose d’entretien) pour les conditions chroniques.
Le personnel du Conseil consultera les sources de prix publiques pour établir les prix des médicaments de comparaison. Les sources de prix que consultera le personnel du Conseil sont les suivantes (en ordre alphabétique) : Association québécoise des pharmaciens propriétaires (AQPP); IMS Health; McKesson Canada; Le Programme de médicaments de l’Ontario; PPS Pharma; Régie de l’assurance maladie du Québec (RAMQ). Le personnel du Conseil choisira le prix public le moins élevé à partir de ces sources pour chacun des produits médicamenteux utilisés pour la comparaison. Si aucun prix de ces sources n’est fourni aux fins de comparaison, le personnel du Conseil examinera d’autres sources jusqu’à ce qu’il trouve un prix public.
Le personnel du CEPMB peut exclure de sa comparaison de prix selon la catégorie thérapeutique tout produit médicamenteux lorsqu’il a des motifs de croire que ce produit est vendu à un prix excessif (voir la politique du CEPMB sur l’utilisation des produits médicamenteux brevetés et non brevetés dans les tests appliqués aux prix présentée dans la section B.6).
Appendice 4 – Test de la relation raisonnable
Pour que puisse être appliqué le test de la relation raisonnable, le nouveau produit médicamenteux breveté sous examen doit satisfaire les quatre exigences suivantes :
- Il doit avoir la même entité chimique que le produit médicamenteux retenu pour la
comparaison ;
- Il doit avoir la même indication ou la même utilisation que le produit médicamenteux retenu pour la comparaison ;
- Il doit avoir la même forme posologique ou une forme posologique comparable que le produit médicamenteux retenu pour la comparaison (voir l’appendice 2) ; et
- Il doit également avoir le même régime posologique.
Le test de la relation raisonnable ne sera appliqué que si les quatre exigences susmentionnées sont satisfaites à moins que le breveté soumette une présentation dans laquelle il allègue que son produit offre de plus grands bienfaits thérapeutiques que les produits existants et que le GCMUH reconnaisse que le nouveau produit médicamenteux constitue une amélioration modeste ou importante des bienfaits thérapeutiques.
La relation raisonnable est le rapport entre la concentration de l’unité du produit médicamenteux (section B.4) et son prix. Le test de la relation raisonnable définit le prix moyen maximal potentiel pour la nouvelle concentration du produit médicamenteux breveté.
Le présent appendice décrit en termes généraux le processus par lequel la relation raisonnable peut être vérifiée.
Le personnel du Conseil consultera les sources de prix publiques pour établir les prix des médicaments de comparaison. Les sources de prix que consultera le personnel du Conseil sont les suivantes (en ordre alphabétique) : Association québécoise des pharmaciens propriétaires (AQPP); IMS Health; McKesson Canada; Le Programme de médicaments de l’Ontario; PPS Pharma ; Régie de l’assurance maladie du Québec (RAMQ). Le personnel du Conseil choisira le prix public le moins élevé à partir de ces sources pour chacun des produits médicamenteux utilisés pour la comparaison. Si aucun prix de ces sources n’est disponible pour fins de comparaison, le personnel du Conseil examinera d’autres sources jusqu’à ce qu’il trouve un prix public.
Le personnel du Conseil se réserve le droit d’exclure de ses tests sur la relation raisonnable tout produit médicamenteux s’il a des raisons de croire que le produit médicamenteux est vendu au Canada à un prix excessif (voir la politique du CEPMB sur l’utilisation des produits médicamenteux brevetés et non brevetés dans les tests appliqués au prix à la section B.6).
La relation raisonnable peut être déterminée à l’aide d’un de trois tests possibles, dans l’ordre qui suit :
Test 1: Lorsque les produits médicamenteux ont la même concentration
Lorsqu’un ou plusieurs produits médicamenteux retenus pour la comparaison du prix ont la même concentration que le nouveau produit médicamenteux breveté, c’est le produit médicamenteux de comparaison dont le prix est le plus élevé qui établit le Prix moyen maximal potentiel du nouveau produit médicamenteux breveté. Tout prix supérieur au Prix moyen maximal potentiel sera jugé excessif. Le résultat de ce test aura préséance sur ceux des deux autres tests sans égard aux résultats qu’ils produiront.
Dans le graphique 1 qui suit, étant donné que les trois produits médicamenteux retenus pour la comparaison ont la même concentration, mais des prix différents (P1, P2 et P3), le Prix moyen maximal potentiel (PMMP) du nouveau produit médicamenteux breveté sera celui du produit médicamenteux dont le prix est le plus élevé soit, dans le présent cas, le produit P1.
Graphique 1 – Produits médicamenteux ayant la même concentration
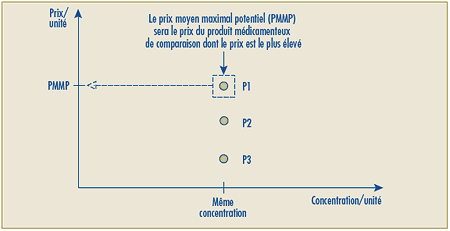
Test 2 : Lorsque la relation du prix/unité est linéaire
Ce test est appliqué lorsqu’un minimum de deux produits médicamenteux sont retenus pour la comparaison de prix, mais qu’aucun de ces produits n’a la même concentration que le nouveau produit médicamenteux breveté.
Ce test comporte les étapes suivantes :
- Comme on peut le voir dans le graphique 2A qui suit, des lignes sont tracées de manière à réunir autant de paires de produits médicamenteux que possible. Ces paires seront utilisées pour la comparaison (par ex. A à B, A à C et B à C).
- C’est la paire créant une pente positive qui est égale à zéro ou plus élevée que zéro et dont le point d’intersection avec l’axe des ordonnées est le plus élevé qui détermine le Prix moyen maximal potentiel. Dans le graphique 2A, le point d’intersection avec l’axe des ordonnées le plus élevé se situe dans la continuité de la ligne qui relie A à B.
Graphique 2A – Test de la relation linéaire – Étapes 1 à 2
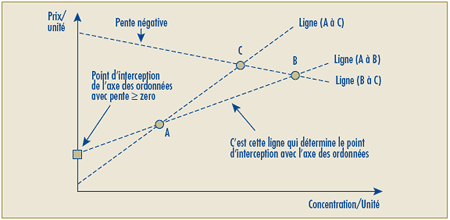
- Une autre ligne est tracée de manière à joindre le point d’intersection sur l’axe des ordonnées avec le point représentant le prix/unité du produit médicamenteux de comparaison dont le prix est le plus élevé. Dans l’exemple du graphique 2B, c’est le produit médicamenteux C qui affiche le prix à l’unité le plus élevé.
- Le Prix moyen de transaction national et le Prix moyen de transaction du marché du nouveau produit médicamenteux breveté ne seront pas excessifs s’ils ne dépassent pas la ligne correspondant au Prix moyen maximal potentiel (PMMP) tracée dans le graphique 2B qui suit.
Graphique 2B – Test de la relation linéaire –Étapes 3 à 4
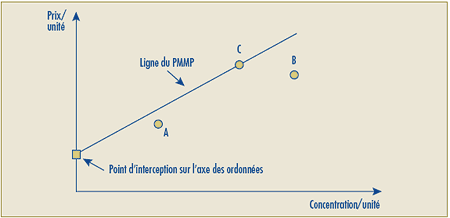
- Il peut arriver qu’aucune des lignes réunissant une paire de produits médicamenteux de comparaison et dont la pente se situe à zéro ou plus que zéro ne croise l’axe des ordonnées au point zéro ou à un point plus élevé (lorsque tous les points d’intersection avec l’axe des ordonnées se situent sous zéro, le prix moyen maximal potentiel pour certaines concentrations sera également négatif). Dans un tel cas, la ligne du Prix moyen maximal potentiel réunira le point d’origine (0) et le prix/unité du produit médicamenteux de comparaison dont le prix est le plus élevé. Dans l’exemple illustré dans le graphique 2C, le point d’origine sur l’axe des ordonnées serait négatif (si on avait utilisé la même méthodologie que pour l’étape 2). L’axe des ordonnées utilisé pour établir la ligne du Prix moyen maximal potentiel ne pouvant se situer sous zéro, en conséquence le nouveau point d’intersection avec l’axe des ordonnées est établi au point d’origine, c’est-à-dire au point zéro (0). Dans cet exemple, la ligne du Prix moyen maximal potentiel relie le point d’origine (0) au point du produit médicamenteux C. La ligne ainsi obtenue sera utilisée pour établir la relation entre la concentration du nouveau produit médicamenteux et son Prix moyen maximal potentiel.
Graphique 2C – Test de la relation linéaire – Étape 5
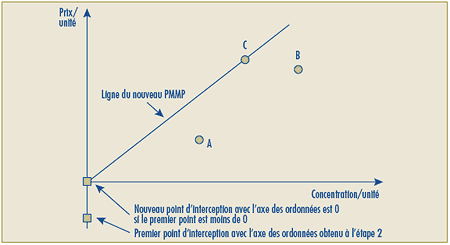
Test 3: Lorsque la concentration du produit médicamenteux utilisé pour la comparaison est différente de celle du nouveau produit médicamenteux breveté
Ce test est appliqué lorsque le produit médicamenteux utilisé pour la comparaison n’est vendu au Canada que dans une seule concentration et que cette concentration n’est pas la même (plus élevée ou moins élevée) que celle du nouveau produit médicamenteux sous examen. Bien qu’une seule concentration du produit médicamenteux utilisé pour la comparaison soit vendue, il pourrait y avoir d’autres produits de cette concentration vendus à des prix différents. Dans ce test, c’est le produit médicamenteux de comparaison dont le prix est le plus élevé qui est retenu pour la comparaison.
Lorsque la concentration du nouveau produit médicamenteux breveté est plus élevée que celle du produit médicamenteux retenu pour la comparaison, le Prix moyen maximal potentiel du nouveau produit médicamenteux breveté sera en fonction de la relation proportionnelle de la concentration du nouveau produit médicamenteux breveté par rapport au produit médicamenteux de comparaison et sera multiplié par le prix du produit médicamenteux utilisé pour la comparaison.
Exemple 1 (lorsque la concentration du nouveau produit médicamenteux breveté est plus élevée) :
Le prix de vente le plus élevé auquel le produit médicamenteux de comparaison d’une concentration de 5 mg est 10 $.
Le nouveau produit médicamenteux breveté a une concentration de 7,5 mg.
Le prix du nouveau produit médicamenteux breveté de 7,5 mg sera considéré excessif s’il dépasse 15 $.
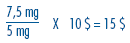
Lorsque la concentration du nouveau produit médicamenteux breveté est moins grande que celle de son produit médicamenteux de comparaison, le Prix moyen maximal potentiel du nouveau produit médicamenteux breveté sera le même que le prix du produit médicamenteux de comparaison présenté dans sa plus grande concentration.
Exemple 2 (lorsque le nouveau produit médicamenteux est présenté dans une concentration moins grande que son médicament de comparaison) :
Le prix de vente le plus élevé du produit de comparaison présenté dans une concentration de 5 mg est 10 $.
Le nouveau produit médicamenteux breveté est offert dans une concentration de 2,5 mg.
Ainsi, le prix de nouveau produit médicamenteux breveté présenté dans une concentration de 2,5 mg sera considéré excessif s’il dépasse 10 $.
Appendice 5 – Test de la médiane des prix internationaux
1. Comparaison du prix du produit médicamenteux au Canada avec la médiane de ses prix dans les pays de comparaison
1.1 C’est la médiane des prix départ-usine des mêmes concentrations et forme posologique du même produit médicamenteux breveté calculée pour chaque pays de comparaison nommé dans le Règlement (France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis) qui établit le Prix moyen maximal potentiel d’un nouveau produit médicamenteux breveté lorsque le principal test appliqué au prix de lancement est la médiane des prix internationaux.
1.2 Lorsque le test appliqué au prix de lancement est la médiane des prix internationaux et que le nouveau produit médicamenteux breveté est vendu dans un nombre pair de pays, le prix médian ou la médiane correspondra à la moyenne simple des deux prix du centre de la fourchette de prix.
1.3 Lorsque le nouveau produit médicamenteux breveté est vendu dans moins de cinq pays au moment de sa première vente du Canada, le prix international médian sera alors fixé sur une base intérimaire. Ainsi, après trois ans ou au moment où le même produit médicamenteux breveté (même concentration et même forme posologique) est vendu dans au moins cinq pays, soit la première de ces deux éventualités, le personnel du Conseil calculera à nouveau le Prix international médian. Dans un tel cas, le prix moyen non excessif du produit médicamenteux sera le moindre des prix suivants :
- le Prix médian international révisé
- le Prix moyen non excessif obtenu avec la méthodologie de rajustement du prix selon l’IPC (appendice 9).
1.4 Lorsque le Prix médian international révisé démontre, suivant l’application du paragraphe 1.3, que le Prix moyen du produit médicamenteux est non excessif, le breveté devrait, de son propre chef, porter le Prix de transaction moyen national et les Prix de transaction moyens du marché au niveau du Prix moyen non excessif calculé de la façon expliquée dans le paragraphe 1.3 ci-dessus et ce, avant la fin du deuxième semestre de rapport qui suit. Si le breveté réduit ainsi le prix de son produit médicamenteux dans le délai imparti, le prix de son produit ne sera pas réputé avoir été excessif.
2. Comparaison indirecte du prix international
2.1 Lorsqu’il n’est pas possible d’effectuer une comparaison directe du prix international du produit médicamenteux sous examen du fait que le produit médicamenteux n’est vendu qu’au Canada, la comparaison doit alors être faite à l’aide des concentrations les plus voisines des formes posologiques comparables (appendice 2) du même produit médicamenteux breveté.
3. Taux de change
3.1 Pour le calcul du Prix international médian d’un nouveau produit médicamenteux breveté, les taux de change utilisés seront la moyenne simple de la moyenne des taux du cours au comptant à midi pour chaque pays (arrondie à la huitième décimale) publiés par la Banque du Canada pour la période de trente-six mois se terminant quatre mois avant la date de la première vente du produit médicamenteux au Canada. Par exemple, si la première vente du nouveau produit médicamenteux breveté sous examen a été effectuée en octobre 2009, les taux de change qui seront utilisés couvriront la période allant de juin 2006 à mai 2009.
3.2 Chaque mois, le CEPMB publie les taux de change Note de bas de page 13 dans son site Web.
Appendice 6 – Comparaison du prix au Canada avec le prix international le plus élevé
1. Comparaison du prix au Canada avec le prix international le plus élevé
1.1 Sous réserve du paragraphe 1.2 de l’appendice 6, tant pour la période de lancement que pour les périodes de rapport subséquentes, le prix de transaction moyen d’un produit médicamenteux breveté à l’échelle nationale, pour les catégories pharmacie et hôpital, et pour chaque province et territoire sera présumé excessif s’il est plus élevé que le plus élevé des prix de la même concentration et de la même forme posologique du même produit médicamenteux breveté pratiqués dans les différents pays de comparaison nommés dans le Règlement (ces pays sont la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis).
1.2 Lorsque le prix d’un produit médicamenteux breveté à l’échelle nationale, pour les catégories pharmacie et hôpital, et pour chaque province et territoire, dépasse le prix international le plus élevé pour le même produit médicamenteux, mais qu’il existe d’autres produits médicamenteux ayant une forme posologique identique du même médicament et du même breveté (DIN multiples) aussi vendus au Canada, le Prix maximal moyen potentiel et/ou le Prix moyen non excessif établis pour le produit médicamenteux breveté sous examen ne seront pas moins élevés que le prix d’un produit médicamenteux de concentration identique ou moins élevée qui figurent dans les Lignes directrices.
2. Taux de change
2.1 Pour la comparaison du prix au Canada avec le prix international le plus élevé, les taux de change utilisés seront la moyenne simple de la moyenne des taux du cours au comptant à midi pour chaque pays (arrondie à la huitième décimale) publiés par la Banque du Canada pour la période de trente-six mois se terminant quatre mois avant la date de la première vente du produit médicamenteux au Canada. Par exemple, si la première vente du nouveau produit médicamenteux breveté sous examen a été effectuée en octobre 2009, les taux de change qui seront utilisés couvriront la période allant de juin 2006 à mai 2009.
2.2 Pour le calcul du prix international le plus élevé d’un produit médicamenteux existant, les taux de change utilisés seront la moyenne simple de la moyenne des taux du cours au comptant à midi pour chaque pays (arrondie à la huitième décimale) publiés par la Banque du Canada pour la période de trente-six mois se terminant le dernier mois de la période d’établissement du prix sous examen. Par exemple, pour une période d’établissement du prix allant de juillet à décembre 2009, les taux de change utilisés seraient ceux des mois de janvier 2006 à décembre 2009.
2.3 Chaque mois, le CEPMB publie les taux de change Note de bas de page 14 dans son site Web.
3. Circonstances exceptionnelles visant les produits médicamenteux existants
3.1 Les Lignes directrices prévoient que les brevetés doivent prendre les mesures qui s’imposent lorsque les résultats d’une enquête démontrent que le prix d’un produit médicamenteux breveté semble excessif. Toutefois, certaines circonstances peuvent faire en sorte que le prix d’un produit médicamenteux breveté ne semble pas excessif au cours d’une période d’examen donnée, mais semble excessif la période suivante à la lumière des résultats de la Comparaison du prix au Canada avec le prix international le plus élevé. Les circonstances à l’origine de la situation peuvent fort bien échapper au contrôle du breveté. Voici trois exemples de telles circonstances :
- Variations du taux de change
- Organisme de réglementation d’un autre pays qui a forcé la réduction du prix du produit médicamenteux sur son territoire, ou
- Le produit médicamenteux qui était vendu au plus fort prix a été retiré du marché.
Lorsque l’une ou l’autre des circonstances susmentionnées se présente, le breveté sera informé que le prix de son produit médicamenteux breveté semble excessif et sera invité à réviser à la baisse le Prix de transaction moyen national de son produit et au Prix de transaction moyen du marché pour les catégories pharmacie et hôpital, et pour chaque province et territoire avant la fin des deux prochaines périodes de rapport, dans lequel cas, le prix de son produit ne sera pas réputé excessif. S’il ne baisse pas tel que demandé le prix de son produit dans les délais impartis, le breveté sera invité à soumettre au Conseil un Engagement de conformité volontaire et à rembourser les recettes excessives qu’il a tirées de la vente de son produit à un prix excessif. La valeur de ces recettes sera calculée rétroactivement à la première période de rapport où le prix était plus élevé que le prix obtenu avec le Test de la comparaison du prix au Canada avec le prix international le plus élevé. Si le breveté choisit de ne pas soumettre au Conseil un Engagement de conformité volontaire, l’affaire sera alors portée à l’attention du président du Conseil aux fins qu’il émette un Avis d’audience.
Appendice 7 – Comparaison du prix au Canada selon la catégorie thérapeutique internationale
1. Concept et application
1.1 La comparaison du prix de vente du produit médicamenteux au Canada avec ses prix de vente dans les différents pays de comparaison (comparaison du prix au Canada selon la catégorie thérapeutique internationale) permet de comparer le prix du produit médicamenteux breveté sous examen avec les prix de vente des produits médicamenteux retenus pour la comparaison dans les sept pays de comparaison nommés dans le Règlement. Ces pays sont la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
1.2 La comparaison du prix au Canada selon la catégorie thérapeutique internationale n’est pas considérée comme un test primaire. Toutefois, son application peut fournir des éléments d’information utiles dans le contexte d’une enquête sur le prix d’un produit médicamenteux qui semble excessif.
2. Sélection des produits médicamenteux aux fins de la comparaison
2.1 Aux fins de la comparaison du prix au Canada selon le Test de la catégorie thérapeutique internationale, les produits médicamenteux retenus pour la comparaison sont ceux utilisés pour le Test de la comparaison du prix selon la catégorie thérapeutique. Vous trouverez aux sections C.8.1 à C.8.13 de plus amples renseignements sur la sélection des produits médicamenteux retenus pour la Comparaison du prix selon la catégorie thérapeutique.
2.2 En ce qui concerne les produits génériques utilisés pour la comparaison, seuls les produits qui sont vendus par le même breveté au Canada et dans le pays de comparaison sont retenus pour la comparaison. Autrement dit, si le produit médicamenteux générique utilisé pour la comparaison est vendu au Canada par la société « X », mais qu’il est vendu dans d’autres pays par les sociétés « X » et « Y », seul le produit médicamenteux générique vendu par la société « X » sera pris en compte dans le Test de la comparaison du prix au Canada selon la catégorie thérapeutique internationale.
3. Méthodes dérivées du Test de la Comparaison du prix selon la catégorie thérapeutique internationale
3.1xi Les deux méthodes suivantes peuvent être utilisées pour calculer le prix à l’aide de la comparaison du prix au Canada selon la catégorie thérapeutique internationale :
- Approche classique selon la catégorie : Les prix auxquels tous les produits médicamenteux utilisés dans les comparaisons sont vendus dans les sept pays de comparaison nommés dans le Règlement sur les médicaments brevetés sont établis. Le prix international médian est calculé et comparés aux prix de transaction moyen national du produit médicamenteux breveté au Canada.
- Approche du ratio : Les prix du produit médicamenteux sous examen dans les sept pays de comparaison nommés dans le Règlement sont déterminés. Les prix auxquels tous les produits médicamenteux retenus pour la comparaison sont vendus dans les sept pays de comparaison sont également déterminés. Les ratios du prix du produit médicamenteux sous examen par rapport aux prix des produits médicamenteux utilisés dans la comparaison sont calculés pour chaque combinaison de produits dans chaque pays de comparaison. La médiane de tous les ratios ainsi obtenus est par la suite appliquée au prix du médicament de comparaison principal (à savoir le médicament utilisé dans le test du prix au Canada pour calculer le Prix moyen maximal potentiel). Le résultat obtenu est par la suite comparé au Prix de transaction moyen national du produit médicamenteux breveté sous examen au Canada.
3.2 Lorsque le prix d’un produit médicamenteux qui devait être utilisé pour la comparaison a été exclu du Test de la comparaison du prix selon la catégorie thérapeutique du fait qu’il semblait excessif, ce produit est également exclu du Test de la comparaison du prix selon la catégorie thérapeutique internationale.
4. Taux de change
4.1 Pour la comparaison du prix d’un nouveau produit médicamenteux breveté selon le Test de la catégorie thérapeutique internationale, les taux de change utilisés correspondent à la moyenne simple de la moyenne des taux du cours au comptant à midi pour chaque pays (arrondie à la huitième décimale) publiés par la Banque du Canada pour la période de trente-six mois se terminant quatre mois avant la date de la première vente du produit médicamenteux au Canada. Par exemple, si la première vente du nouveau produit médicamenteux breveté sous examen a été effectuée en octobre 2009, les taux de change qui seront utilisés pour la comparaison couvriront la période allant de juin 2006 à mai 2009.
4.2 Pour la comparaison du prix d’un produit médicamenteux breveté existant selon le Test de la catégorie thérapeutique internationale, les taux de change utilisés correspondent à la moyenne simple de la moyenne des taux du cours au comptant à midi pour chaque pays (arrondie à la huitième décimale) publiés par la Banque du Canada pour la période de trente-six mois se terminant le dernier mois de la période d’établissement du prix du produit médicamenteux sous examen. Par exemple, pour une période d’établissement du prix qui irait de juillet à décembre 2009, les taux de change utilisés seraient ceux des mois de janvier 2006 à décembre 2009.
4.3 Chaque mois, le CEPMB publie les taux de change Note de bas de page 15 dans son site Web.
Appendice 8 – Tests appliqués aux prix des nouveaux produits médicamenteux
| Niveau d’amélioration des bienfaits thérapeutiques |
Test appliqué au prix d’un nouveau produit médicamenteux breveté |
| Découvert |
Test de la médiane des prix internationaux (MPI) |
| Amélioration importante |
Le prix le plus élevé entre :
- le plus élevé des prix obtenus avec le Test de la comparaison du prix selon la catégorie thérapeutique à laquelle ont été soumis tous les produits médicamenteux identifiés par le GCMUH conformément à la section C.8.6 ; et
- le test MPI.
|
| Amélioration modeste |
Le plus élevé des prix entre :
- la médiane de :
- des prix obtenus avec le Test de la comparaison du prix selon la catégorie thérapeutique de tous les produits médicamenteux identifiés par le GCMUH conformément à la section C.8.7 et
- le test MPI ; et
- le prix le plus élevé obtenu avec le Test de la comparaison du prix selon la catégorie thérapeutique de tous les produits médicamenteux identifiés par le GCMUH conformément à la section C.8.7. Lorsqu’il n’est pas possible d’effectuer le Test de la comparaison du prix selon la catégorie thérapeutique ((c.-à-d. lorsqu’on ne peut établir un régime posologique comparable ou lorsque le prix du produit médicamenteux qui se prête à la comparaison est excessif), utiliser alors le test MPI.
|
| Amélioration minime ou nulle
|
- Le prix le plus élevé obtenu avec le Test de la comparaison du prix selon la catégorie thérapeutique de tous les produits médicamenteux comparables identifiés par le GCMUH conformément à la section C.8.9.
- Dans les cas exceptionnels, lorsque le GCMUH n’a réussi à identifier aucun produit médicamenteux comparable, utiliser alors le prix le moins élevé obtenu avec :
- le Test de la comparaison du prix selon la catégorie thérapeutique des produits médicamenteux de la gamme supérieure identifiés par le GCMUH conformément à la section C.8.10 et
- le test MPI ; et
- Lorsqu’il n’est pas possible d’effectuer le Test de la comparaison du prix selon la catégorie thérapeutique ((c.-à-d. lorsqu’on ne peut établir un régime posologique comparable ou lorsque le prix du seul produit médicamenteux qui se prête à la comparaison semble excessif), utiliser alors le test MPI.
Veuillez noter que les produits médicamenteux sous-mentionnés sont assujettis aux Lignes directrices additionnelles à moins que le breveté n’allègue dans sa présentation que son produit offre de plus grands bienfaits thérapeutiques que les médicaments existants et que le GCMUH confirme que le nouveau produit médicamenteux constitue une amélioration modeste ou importante par rapport aux produits médicamenteux existants :
- produit médicamenteux générique breveté
- produit médicamenteux qui est une nouvelle présentation de la même entité chimique avec une forme posologique identique ou comparable (Appendice 2), le même régime posologique et la même indication ou utilisation.
- produit médicamenteux combiné
Les Lignes directrices qui s’appliquent à ces produits médicamenteux sont présentées à la section C.11.10.
|
| Tous les niveaux d’amélioration thérapeutique |
Nonobstant les tests de prix mentionnés ci-dessus, le Prix de transaction moyen d’un produit médicamenteux breveté à l’échelle nationale, pour les catégories pharmacie et hôpital, et pour chaque province et territoire, sera présumé excessif s’il dépasse le prix le plus élevé du même produit médicamenteux breveté ayant une concentration identique et une forme posologique identique d’un même produit médicamenteux breveté de chaque pays qui figure dans le Règlement (France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis). |
Appendice 9 – Méthodologie de rajustement du prix selon l’IPCNote de bas de page 16 / xii
1. Méthodologie de rajustement du prix selon l’IPC
1.1 Sous réserve du paragraphe 1.5 de l’appendice 9 ci-dessous et de l’appendice 10, le prix de transaction moyen national et les prix de transaction moyens du marché d’un produit médicamenteux breveté existant seront jugés excessifs lorsque leur taux d’augmentation est plus grand que celui autorisé en vertu de la méthodologie de rajustement du prix selon l’IPC, pourvu que le prix ne dépasse pas la comparaison du prix au Canada avec le prix international le plus élevé.
1.2xiii La méthodologie de rajustement du prix selon l’indice des prix à la consommation prévoit les calculs suivants :
- réviser les prix de référence du produit médicamenteux pour tenir compte des variations cumulatives de l’IPC entre l’année de référence et l’année sous examen
(Prix rajusté selon l’IPC) ; et
- imposer une limite annuelle à l’augmentation du prix maximal (1,5 fois le taux de variation du dernier IPC réel retardé). Dans les périodes de grande inflation (plus de 10 %), la limite sera de
5 % de plus que le dernier taux réel retardé de variation de l’IPC.
1.3 C’est le résultat le plus bas des deux calculs qui établit le Prix moyen non excessif pour l’année.
1.4 Un calcul du Prix moyen non excessif sera effectué pour chaque marché (marché national, catégorie de clients (pharmacie, hôpital, grossiste), chaque province et territoire) en tenant compte de l’historique du prix sur le marché.
1.5 Lorsque les recettes excessives sont remboursées en portant le prix du produit médicamenteux sous le Prix moyen non excessif sur un ou sur plusieurs marchés (appendice 13). Lorsque les recettes excessives auront été remboursées, le breveté peut à la prochaine période de rapport augmenter les prix de son produit jusqu’à concurrence des Prix de transaction moyens non excessifs du marché qui étaient pratiqués avant la réduction du prix.
2. Terminologie
2.1 Année de prévision :
Année pour laquelle les prix moyens non excessifs sont déterminés.
2.2 Période de lancement :
Dans le cas des nouveaux produits médicamenteux brevetés, la période de lancement est la période qui s’écoule entre la date de la première vente du produit médicamenteux et la fin du semestre de rapport (soit le 30 juin et le 31 décembre de chaque année) lorsque cette période s’étend sur plus d’un mois. Par exemple, la période de lancement d’un produit médicamenteux breveté vendu pour la première fois en mars 2009 irait de mars à juin 2009. Dans le cas d’un produit médicamenteux breveté lancé sur le marché canadien quelque temps en décembre 2008, sa période de lancement irait de janvier à juin 2009.
2.3 Année de référence :
- Dans le cas de produits médicamenteux brevetés lancés sur le marché canadien plus de trois ans avant l’année de prévision, l’année de référence sera la troisième année précédant l’année de prévision. Par exemple, pour 2009, l’année de référence serait 2006.
- Dans le cas des produits médicamenteux brevetés lancés sur le marché au plus trois ans avant l’année de prévision, l’année de référence sera l’année au cours de laquelle a été faite la première vente du produit au Canada.
2.4 Prix de référence :
- Dans le cas d’un produit médicamenteux breveté dont la première vente au Canada remonte à plus de trois ans avant l’année de prévision, ses prix de référence national et du marché du produit médicamenteux breveté seront respectivement son Prix de transaction moyen national et ses Prix de transaction moyens du marché pour l’année de référence fondés sur le formulaire 2 du breveté, section 4, ou, si ces prix semblent excessifs, le Prix moyen maximal potentiel.
- Dans le cas d’un produit médicamenteux breveté dont la première vente remonte à trois ans ou moins avant l’année de prévision, les prix de référence national et du marché du produit seront respectivement son prix de transaction moyen national et ses Prix de transaction moyens du marché de la période de rapport, fondés sur le formulaire 2 du breveté, section 4, ou, si les prix semblent excessifs, le Prix moyen non excessif.
2.5xiv IPC de base :
Moyenne annuelle des augmentations mensuelles de l’IPC publiée par Statistique Canada pour les deux années précédant l’année de référence. Chaque année, le CEPMB calcule l’IPC de base. Par exemple, un IPC de base de 2010 sera utilisé pour l’année de référence de 2012.
2.6xv IPC réel retardé :
L’IPC réel retardé utilisé pour l’année de prévision est fondé sur le dernier IPC réel publié par Statistique Canada et rajusté en fonction des plus récentes prévisions du taux annuel d’inflation également publiées par Statistique Canada. Le CEPMB publie aussi chaque année l’IPC prévu dans la livraison de janvier de La Nouvelle. Il existe un délai entre l’année où l’IPC réel est utilisé et l’année à laquelle il s’applique. Par exemple, l’IPC réel retardé utilisé pour l’année de prévision 2015 est l’IPC réel de 2013 publié par Statistique Canada en janvier 2014.
2.7xvi Facteur de rajustement selon l’IPC :
L’IPC réel retardé est divisé par l’IPC de base et arrondi à la troisième décimale.
2.8 Prix rajusté selon l’IPC :
Prix de référence multiplié par le facteur de rajustement selon l’IPC pour l’année de référence.
2.9xvii Plafond :
Pour toute année, le prix d’un produit médicamenteux breveté ne peut augmenter de plus de 1,5 fois le dernier taux de variation de l’IPC réel retardé. En période de forte inflation (plus de 10%), l’augmentation du prix du produit médicamenteux ne pourra excéder plus de cinq pour cent le taux de variation réel de l’IPC.
2.10xviii Voici comment est appliquée la méthodologie du prix rajusté selon l’IPC :
- Année de prévision : Janvier à décembre 2015
- Année de la première vente : 1998
- Année de référence : 2012
- Prix de transaction moyen national pour l’année de référence : 10,0000 $
- Prix de transaction moyen national en 2013 : 10,3900 $
- Prix rajusté selon l’IPC : 1,054 (en supposant qu’il s’agit du facteur de rajustement selon l’IPC pour 2012) × 10,0000 $ (PTM national de l’année de référence) = 10,5400 $
- Plafond : 1,020 (1,5 x IPC réel retardé pour 2013 supposé de 1,3%) × 10,3900 $ = 10,5978 $
- Le prix moyen non excessif national pour 2015 du produit médicamenteux breveté est le prix le plus faible entre le prix rajusté selon l’IPC et le prix plafond : 10,5400 $
Appendice 10 – Méthodologie de la majoration
1. Méthodologie de la majoration
1.1 Définition
Lorsque le breveté soutient que le prix de son produit médicamenteux a augmenté dans une mesure plus grande que ne le permet la méthodologie du prix rajusté selon l’IPC parce qu’il a réduit ou cessé d’offrir des avantages à ses clients et qu’il présente des éléments de preuve à l’appui, le Prix moyen non excessif national du produit et (ou) les Prix moyens non excessifs du marché pourront augmenter dans une mesure plus grande que celle autorisée en vertu de la méthodologie de rajustement du prix selon l’IPC.
1.2 Avantages admissibles
Les avantages sont, par définition, « des réductions accordées à titre de promotion ou sous forme de rabais, escompte, remboursement, biens ou services gratuits, cadeaux ou autres avantages
semblables ».
1.3 Éléments de preuve requis
Les brevetés qui souhaitent invoquer la méthodologie de la majoration doivent présenter les éléments suivants :
- Élément démontrant que, avant même de bénéficier de l’avantage, les clients étaient conscients que l’avantage qui leur était offert n’était pas offert à tous les clients ;
- Le type et la valeur de l’avantage, le moment où il a été offert ainsi que la façon dont il a été offert ;
- Éléments prouvant la réduction ou la cessation de l’avantage ;
- Déclaration à savoir si le même client reçoit encore ou non d’autres avantages.
La forme exacte de ces éléments de preuve (par ex. contrat) et le type de données (par ex. quantité du produit offert gratuitement, escompte, rabais) varieront selon le cas.
La méthodologie de la majoration ne s’appliquera pas aux cas où l’augmentation du Prix de transaction moyen national semble n’être attribuable qu’à une modification de l’ensemble des ventes. Elle ne s’appliquera pas non plus lorsque le prix a été réduit pour rembourser les recettes excessives (appendice 13).
1.4 Application de la méthodologie de la majoration au calcul des Prix moyens non excessifs
Lorsqu’un Prix de transaction moyen du marché d’un produit médicamenteux augmente dans une mesure plus grande que celle autorisée avec la méthodologie de rajustement du prix selon l’IPC et que le breveté présente les éléments de preuve exigés, le prix du produit médicamenteux peut augmenter jusqu’au Prix moyen non excessif le plus élevé d’une autre catégorie de client (province et territoire) sans être considéré excessif, pourvu que le prix ne dépasse pas la comparaison du prix au Canada avec le prix international.
La capacité de rebondissement d’un prix pour atteindre le Prix moyen non excessif le plus élevé d’un autre marché dépend de preuves selon lesquelles les avantages ne sont plus offerts sur le marché au moyen de la méthodologie de la majoration. Dans les marchés où des avantages sont continus, la méthodologie de la majoration restreint le rebondissement d’un prix à un prix qui est proportionnel à l’avantage restant. On entend par marché comparable le marché d’un hôpital, d’un grossiste et d’une pharmacie ainsi que chaque province et chaque territoire.
1.5 Exemple de l’application de la méthodologie de la majoration
|
Hôpital
PTMM* |
Grossiste
PTMM* |
Pharmacie
PTMM* |
National
PTM** |
| Année 1 (Lancement) |
8,00 $ |
9,00 $ |
10,00 $ |
9,00 $ |
| Année 2 |
6,00 $ |
8,00 $ |
10,00 $ |
8,00 $ |
| Année 3 |
10,00 $ |
9,00 $ |
10,00 $ |
9,67 $ |
*PTMM veut dire Prix de transaction moyen du marché
** PTM veut dire Prix de transaction moyen national
L’année 3, le Prix de transaction moyen national augmente au-delà de la mesure généralement permise par la méthodologie de rajustement du prix selon l’IPC. Le breveté formule les allégations suivantes avec éléments de preuve à l’appui :
- Hôpital:
- L’année 1, à la date de la première vente, des contrats consentant un escompte de 20 % du prix de liste ont été négociés avec des organismes de groupement d’achats.
- L’année 2, en raison de leurs volumes élevés d’achats, certains hôpitaux ont pu bénéficier d’escomptes plus importants.
- L’année 3, un nouveau compétiteur a investi le marché des hôpitaux et les contrats existants n’ont pas été reconduits. Les hôpitaux qui ont continué d’acheter le produit médicamenteux du breveté ont payé le plein prix, soit 10,00 $. Ce prix est jugé non excessif à la lumière des éléments de preuve fournis.
- Grossiste :
- La première année, les grossistes ont payé le produit médicamenteux 9,00 $ puis, l’année 2, un rabais temporaire a été consenti à certains clients. À l’année 3, le rabais n’était plus offert.
- Le breveté a présenté des éléments de preuve à l’appui du prix préférentiel accordé l’année 2. Aucun élément de preuve n’a été présenté à l’appui d’un avantage consenti l’année où le produit a été lancé sur le marché. Ainsi, le prix de 9,00 $ n’est pas considéré excessif, des éléments de preuve ayant été fournis pour confirmer l’avantage.
Appendice 11 – Critères justifiant la tenue d’une enquête
Les critères énumérés ci-après établissent un juste équilibre entre la latitude accordée aux brevetés au niveau de l’établissement des prix de leurs produits médicamenteux et le mandat du CEPMB de veiller à ce que les produits médicamenteux brevetés ne soient pas vendus au Canada à des prix excessifs. Le Conseil publie les critères qui justifient la tenue d’une enquête sur le prix d’un produit médicamenteux breveté afin d’améliorer la transparence de son processus d’examen du prix et, également, de mieux sensibiliser les brevetés à leurs responsabilités en matière de conformité au Règlement.
Le prix de lancement d’un produit médicamenteux breveté est habituellement considéré non excessif lorsque son prix de transaction moyen national et ses prix de transaction moyens du marché sont égaux ou moins élevés que le prix maximal moyen potentiel. Pour les autres périodes de rapport, ces prix doivent être moins élevés que leurs prix moyens non excessifs.
Pour optimiser l’utilisation qu’il fait des ressources qu’il affecte aux enquêtes, le Conseil a élaboré des critères qui déterminent les circonstances où il y a lieu de tenir une enquête lorsque le prix d’un produit médicamenteux est plus élevé que ne l’autorisent les Lignes directrices.
| Critères qui justifient la tenue d’une enquête sur le prixxix |
|
Le personnel du Conseil entreprend une enquête sur le prix d´un produit médicamenteux breveté lorsqu’un des critères suivants s’applique :
- Le prix de transaction moyen national ou le prix de transaction moyen du marché d’un nouveau produit médicamenteux breveté dépasse de plus de 5 % le prix moyen maximal potentiel pour la période de lancement.
- Dans le cas d’un produit médicamenteux nouveau ou existant, la valeur des recettes excessives totalise 50 000 $ ou plus.
- Le CEPMB reçoit une plainte selon laquelle le prix du produit médicamenteux est excessif.
|
Lorsque, pour une année donnée, le Prix de transaction moyen national dépasse le Prix moyen non excessif national dans une mesure trop modeste pour justifier la tenue d’une enquête, le breveté sera invité à réduire le prix de son produit médicamenteux breveté pour qu’il se situe sous le prix moyen non excessif national ainsi qu’à rembourser les recettes excessives de la façon dont le prévoit la politique du CEPMB sur le remboursement des recettes excessives (section B.7). Lorsqu’il est démontré que des prix sont excessifs de façon continue, même par des montants qui ne justifient pas la tenue d’une enquête, le personnel du CEPMB peut décider de tenir une enquête sur le prix.
Si le Prix de transaction moyen national d’un produit médicamenteux breveté ou si la valeur cumulative des recettes excessives tirées de la vente du produit à un prix excessif est suffisamment élevée pour justifier la tenue d’une enquête, le personnel du Conseil engagera une enquête. Les brevetés seront informés du statut du prix de leur produit médicamenteux ainsi que de la valeur des recettes excessives, ventilées par produit médicamenteux.
Appendice 12 – Examens du prix « sur un marché » xx
En règle générale, les examens du prix « sur un marché », en ce qui concerne les nouveaux produits médicamenteux et les produits médicamenteux existants, ne s’appliqueront qu’aux produits médicamenteux brevetés dont la première vente au Canada est effectuée le 1er janvier 2010 ou après cette date.
En ce qui concerne les nouveaux produits médicamenteux brevetés
Pour les nouveaux produits médicamenteux brevetés, le Prix moyen maximal potentiel sera appliqué à l'échelle nationale, pour les catégories pharmacie, hôpital et grossiste, et pour chaque province et territoire. Dans les situations où le Prix moyen maximal potentiel est établi par les résultats du Test de la comparaison du prix au Canada avec le prix international le plus élevé, la catégorie de client grossistes ne sera pas restreinte par les résultats du test et ce marché sera restreint au lieu par les résultats du test approprié au prix de lancement du produit.
Exemple 1
| Prix moyen maximal potentiel = |
10 $ |
blank |
| PTM* national = |
9 $ |
✔ |
| PTM* du marché (Hôpital) = |
8 $ |
✔ |
| PTM* du marché (Grossiste) = |
9 $ |
✔ |
| PTM* du marché (Pharmacie) = |
10 $ |
✔ |
Prix ne sera pas considéré excessif étant donné que le Prix de transaction moyen national et les prix de transaction moyens du marché ne sont pas plus élevés que le Prix moyen maximal potentiel.
* PTM signifie Prix de transaction moyen
Exemple 2
| Prix moyen maximal potentiel = |
10 $ |
blank |
| PTM* national = |
9 $ |
✔ |
| PTM* du marché (Hôpital) = |
6 $ |
✔ |
| PTM* du marché (Grossiste) = |
9 $ |
✔ |
| PTM* du marché (Pharmacie) = |
12 $ |
X |
Même si le prix de transaction moyen national n'est pas considéré excessif, le prix de transaction moyen du marché (pharmacie) est plus élevé que le prix moyen maximal potentiel et de ce fait sera considéré excessif.
* PTM signifie Prix de transaction moyen
Produits médicamenteux brevetés existants
Après la période de lancement, le personnel du Conseil ne fera l'examen que du Prix de transaction moyen national du produit médicamenteux breveté et le comparera au Prix moyen non excessif national en utilisant la méthodologie du prix rajusté selon l'IPC et le Test de la comparaison du prix avec le prix international le plus élevé.
Le personnel du Conseil fera aussi enquête sur les variations des prix au niveau des marchés (catégorie de clients et (ou) province/territoire) lorsqu'une enquête est engagée ou que c'est demandé aux fins d'un suivi de la conformité à un Engagement de conformité volontaire ou à une Ordonnance du Conseil.
À cette fin, chaque Prix de transaction moyen du marché sera comparé à chaque Prix moyen non excessif du même marché. Le Prix de transaction moyen à l'échelle nationale, pour les catégories pharmacie et hôpital, et pour chaque province et territoire, sera comparé aux résultats du Test de la comparaison du prix au Canada avec le prix international le plus élevé.
Un des trois scénarios suivants peut se produire :
- Aucun Prix de transaction moyen du marché n'est considéré excessif. Ce scénario peut se produire lorsque l'augmentation apparente du Prix de transaction moyen national est exclusivement attribuable à un changement au niveau de la composition des ventes - (c.-à-d. changement du volume des ventes sur chaque marché avec un plus grand volume vendu dans un marché dont le prix de transaction moyen du marché est plus élevé que dans la période de rapport précédente.
- Les prix d'au moins un marché ont été majorés et ainsi portés à un niveau qui semble excessif. En conséquence, le breveté devra baisser le Prix de transaction moyen du marché au niveau du Prix moyen non excessif pour le marché pertinent. Après cette réduction, le Prix de transaction moyen national sera considéré non excessif. Plutôt que de calculer les recettes excessives en se fondant exclusivement sur le(s) marché(s) où le prix du produit a été jugé excessif, les recettes excessives seront calculées sous l'angle du montant généré au niveau du Prix de transaction moyen national.
- Le breveté peut soumettre des éléments de preuve pour démontrer que l'augmentation du prix sur le marché en cause était exclusivement attribuable au fait qu'il a réduit l'avantage offert sur ce marché ou qu'il y a mis fin. Dans un tel cas, il peut être approprié de dévier de la méthodologie du prix rajusté selon l'IPC pour utiliser plutôt la méthodologie de la majoration présentée dans l'appendice 10.
Appendice 13 – Remboursement des recettes excessives
Mesures de remboursement des recettes excessives
1.1 En vertu du paragraphe 1.3.1 ci-dessous, lorsque la valeur des recettes excessives n’est pas suffisante pour justifier la tenue d’une enquête, le breveté sera invité à appliquer une réduction volontaire du prix de son produit médicamenteux afin de rembourser les recettes excessives qu’il a encaissées.
1.2 Par contre, si la valeur des recettes excessives est suffisamment élevée pour justifier la tenue d’une enquête, le breveté pourra rembourser les recettes excessives qu’il a encaissées suivant les modalités prévues dans un Engagement de conformité volontaire approuvé ou selon une Ordonnance du Conseil.
Remboursement des recettes excessives
1.3xxi Les brevetés doivent rembourser avec diligencexxii les recettes excessives qu’ils ont encaissées.
1.3.1 Dans les cas où la valeur des recettes excessives n’est pas suffisante pour justifier la tenue d’une enquête (conformément à la Partie B – Les politiques, section B.5.2), le Conseil assurera la transparence relativement à l’accumulation potentielle de recettes excessives en rapportant le statut « ne justifie pas la tenue d’une enquête » pour ces produits médicamenteux.
1.3.2 Puisque les nouvelles enquêtes sont fondées sur les rapports réglementaires couvrant l’année civile complète, le remboursement des recettes excessives sera également calculé sur l’année civile complète.
1.3.3 Dans le contexte d’un Engagement de conformité volontaire et sous réserve des modalités de l’Engagement, le breveté devra rembourser les recettes excessives qu’il a encaissées dans un des délais suivants :
- dans les trente jours qui suivront l’acceptation de l’Engagement de conformité volontaire par le président du Conseil ; ou
- d’ici à la fin de la prochaine période de rapport lorsque les recettes excessives sont remboursées au moyen d’une réduction du prix. Le reliquat des recettes excessives qui n’auront alors pas été remboursées à la fin de cette période de rapport deviendront exigibles.
Retour au prix normal après le remboursement complet des recettes excessives au moyen d’une réduction du prix
1.4 Lorsque le prix du produit a été réduit sous le Prix moyen non excessif sur un ou plusieurs marchés aux fins de rembourser les recettes excessives. Ainsi, lorsque les recettes excessives auront été complètement remboursées, les Prix de transaction moyens sur ces marchés pourront être rétablis dès la prochaine période de rapport jusqu’à concurrence des Prix moyens non excessifs du marché qui avaient cours avant que ne soit appliquée la réduction du prix.
Modifications apportées au Compendium des politiques, des Lignes directrices et des procédures
Depuis l’entrée en vigueur des Lignes directrices le 1er janvier 2010, le CEPMB surveille de près l’incidence des différentes modifications. Tout ajout, modification ou clarification supplémentaire est communiqué aux brevetés de façon opportune et publié dans La Nouvelle à chaque trimestre. Le Compendium des politiques, des Lignes directrices et des procédures est mis à jour chaque
année au mois de juin.
Le tableau ci-dessous présente un sommaire des modifications apportées à ce jour :
Blank
| Date de la modification |
Objet |
Référence dans le Compendium |
Référence dans La Nouvelle |
| Février 2017 |
Politique sur les médicaments génériques |
Partie B, section B.8 |
Vol. 21, no 1
|
| Août 2016 |
Examen des prix auxquels les nouveaux produits médicamenteux brevetés sont vendus durant la période de lancement |
Partie C, section C.11.14 |
Vol. 20, no 3
|
| Juin 2015 |
Formes posologiques comparables |
Appendice 2, tableau |
Vol. 19, no 3
|
| Juin 2015 |
La méthodologie de rajustement du prix selon l’IPC retardé |
Partie C, section C.12.3; Appendice 9, section 1.2; Appendice 9, section 2.5; Appendice 9, section 2.6; Appendice 9, section 2.7; Appendice 9, section 2.9; Appendice 9, section 2.10 |
Vol. 19, no 1
Blank
Blank
*Le 18 octobre 2013
|
| Juin 2015 |
Précision : Transfert de DIN |
Partie C, section C.12.8 |
Vol. 19, no 1 |
| Avril 2015 |
Exigences relatives à la présentation électronique des rapports |
Appendice 1 |
Vol. 19, no 2 |
| Avril 2014 |
Exigences relatives aux présentations au GCMUH |
Appendice 1 |
Vol. 18, no 2 |
| Janvier 2014 |
Nouvelle méthodologie de rajustement du prix selon l'IPC retardé (mise en œuvre à compter de 2015) |
Appendice 9, note de bas de page |
Vol. 18, no 1* |
| Mai 2012 |
Critères qui justifient la tenue d’une enquête sur le prix |
Appendice 11, tableau |
Vol. 16, no 2* |
| Mai 2012 |
Remboursement des recettes excessives |
Appendice 13, section 1.3 |
Vol. 16, no 2* |
| Avril 2012 |
Examens du prix « sur un marché » |
Appendice 12 |
Vol. 16, no 2 |
| Janvier 2011 |
Produits médicamenteux existants vendus subséquemment par un autre breveté |
Partie C, section C.12.8 |
Vol. 15, no 1 |
| Octobre 2010 |
Précision à l’effet que les recettes excessives sont calculées sur une base annuelle |
Appendice 13, section 1.3
(antérieurement la section 1.3.1) |
Vol. 14, no 4 |
| Octobre 2010 |
Politique sur l’utilisation des produits médicamenteux brevetés et non brevetés dans les tests appliqués aux prix |
Partie B, section B.6.3, Partie C, section C.11.20 |
Vol. 14, no 4 |
| Avril 2010 |
Méthodes dérivées du Test de la Comparaison du prix selon la catégorie thérapeutique internationale |
Appendice 7, section 3.1 |
Vol. 14, no 2 |
*Consultation par le biais d’un Avis et Commentaires
Veuillez noter que le texte est modifié dans la mesure des besoins. Par conséquent, il se peut qu’aucune modification ne soit apportée certaines années. Ce tableau ne tient pas compte des corrections mineures d’ordre formel ou grammatical n’ayant aucune incidence sur le fond du texte.
Notes :
- i Mise à jour : octobre 2010
- ii Mise à jour : février 2017
- iii Mise à jour : août 2016
- iv Mise à jour : octobre 2010
- v Mise à jour : juin 2015
- vi Mise à jour : janvier 2011
- vii Mise à jour : juin 2015
- viii Mise à jour : avril 2014
- ix Mise à jour : avril 2015
- x Mise à jour : juin 2015
- xi Mise à jour : avril 2010
- xii Mise à jour : janvier 2014
- xiii Mise à jour : juin 2015
- xiv Mise à jour : juin 2015
- xv Mise à jour : juin 2015
- xvi Mise à jour : juin 2015
- xvii Mise à jour : juin 2015
- xviii Mise à jour : juin 2015
- xix Mise à jour : mai 2012
- xx Mise à jour : avril 2012
- xxi Mise à jour : octobre 2010
- xxii Mise à jour : mai 2012