L’Observateur des médicaments émergents, 6e livraison – Décembre 2014
ISSN 2292-3144
No cat. : H79-5/2015F-PDF
Résumé
L’Observateur des médicaments émergents (OMÉ) présente des renseignements sur les médicaments en cours de développement qui peuvent avoir une incidence sur les futures dépenses des régimes d’assurance-médicaments au Canada. Elle comprend une liste de médicaments émergents qui sont en essais cliniques de phase III ou à l’étude par la Food and Drug Administration (FDA) des États-Unis et qui sont susceptibles d’avoir une incidence clinique importante. La sélection de médicaments qu’on y retrouve provient principalement de la base de données BioPharm InsightMD.
Cette sixième livraison de l’OMÉ met à jour la liste de médicaments émergents de la livraison de décembre 2013. Le présent rapport fait le point sur les 31 médicaments émergents présentés préalablement et identifie dix ajouts à la liste.
Principales conclusions
1. Parmi les 31 médicaments émergents reportés des livraisons précédentes de l’OMÉ :
- dix-sept (17) sont conservés dans la présente livraison de l’OMÉ, car ils satisfont encore aux critères de sélection des médicaments, dont six (6) sont des médicaments biologiques;
- sept (7) ont été exclus de la liste à la suite d’une mise à jour de l’évaluation scientifique;
- quatre (4) ont été exclus car ils ne sont plus en essais cliniques de phase III aux États-Unis ou à l’étude par la FDA des États-Unis, et ils n’ont pas encore été approuvés au Canada;
- trois (3) ont été retirés de la liste après avoir reçu une autorisation d’introduction sur le marché de Santé Canada.
2. Cette nouvelle livraison de l’OMÉ identifie dix médicaments émergents, dont trois sont des médicaments biologiques.
3. La liste de médicaments émergents actuelle contient au total vingt-sept (27) médicaments émergents qui peuvent avoir une incidence sur les dépenses des régimes d’assurance-médicaments au Canada, dont neuf (9) sont des médicaments biologiques.
Le CEPMB
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987.
Le CEPMB est investi d’un double rôle : veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs et faire rapport des tendances des prix de vente de tous les médicaments ainsi que des dépenses de recherche et développement (R-D) des brevetés.
Le CEPMB rend annuellement compte au Parlement, par l’intermédiaire du ministre de la Santé, de ses activités, des tendances des prix de tous les médicaments et des dépenses de R-D des brevetés.
L’initiative du SNIUMP
Le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) fournit des analyses critiques des tendances des prix des médicaments d’ordonnance, de l’utilisation faite de ces médicaments et des coûts en médicaments au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d’assurance-médicaments fédéraux, provinciaux et territoriaux participants.
L’initiative du SNIUMP est un partenariat entre le CEPMB et l’Institut canadien d’information sur la santé. Elle a vu le jour en 2001 à la suite d’une entente entre les ministres fédéral, provinciaux et territoriaux de la Santé.
Remerciements
Le CEPMB tient à souligner les contributions suivantes :
- Les membres du Comité consultatif du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport
- Le personnel du SNIUMP au CEPMB pour leur contribution au contenu analytique du présent rapport :
- Greg McComb – Analyste économique principal
- Elena Lungu – Gestionnaire du SNIUMP
- Branka Pejcic-Karapetrovic – Analyste pharmaceutique
- Le groupe scientifique et l’équipe de révision du CEPMB
- Patricia Carruthers-Czyzewski (B.Sc.[phm.], M.Sc.) de Sintera Inc., pour son expertise pharmaceutique dans le cadre de l’élaboration de la méthodologie et les contributions scientifiques du rapport
Avis de non-responsabilité
Le SNIUMP est une initiative de recherche qui fonctionne indépendamment des activités de réglementation et de présentation de rapports du CEPMB. Les déclarations et les opinions exprimées dans le présent rapport du SNIUMP ne représentent pas la position officielle du CEPMB.
Des portions de la présente étude se fondent sur les renseignements obtenus de la base de données BioPharm InsightMD, publiée par © Infinata. Les analyses, les conclusions et les énoncés exprimés dans le présent rapport du SNIUMP ne représentent pas la position de © Infinata.
1. Introduction
Voici la sixième livraison de L’Observateur des médicaments émergents (OMÉ), une publication qui présente des renseignements sur les médicaments en cours de développement qui peuvent avoir une incidence sur les futures dépenses des régimes d’assurance-médicaments au Canada. Chaque rapport comprend une liste de médicaments émergents trouvés dans le cadre d’une recherche dans la base de données BioPharm InsightMDFootnote 1, une base de données spécialisée qui présente des renseignements sur plus de 21 000 médicaments ayant atteint la phase des essais cliniques. Cette recherche est appuyée par des documents pharmaceutiques publiés, tout particulièrement des études canadiennes.
Seuls les médicaments qui répondent à un ensemble de critères de sélection pourraient intéresser l’OMÉ. Les critères de sélection ont été préparés par Sintera Inc. pour le CEPMB et approuvés par le Comité directeur du SNIUMP en 2006Note 2. Cette approche normalisée s’applique de façon uniforme à toutes les livraisons de l’OMÉ. Les critères sont les suivants : la phase du développement, l’indication, le mécanisme d’action et l’incidence sur la pratique clinique. Un algorithme sous forme d’arbre décisionnel a été élaboré afin que les critères soient appliqués de façon uniforme. La sélection des médicaments émergents comprend une vaste représentation des domaines thérapeutiques. En outre, une attention est accordée aux nouveaux médicaments à coût élevé qui pourraient avoir une incidence financière sur les budgets, aux catégories auxquelles appartiennent ces médicaments ainsi qu’aux catégories comprenant une part élevée de médicaments génériques.
Tout comme les autres livraisons de l’OMÉ, la présente met à jour l’état des médicaments émergents identifiés dans les livraisons précédentes. Certains médicaments ont été retirés de la liste, soit parce qu’ils ont été introduits sur le marché canadien, soit parce qu’une évaluation scientifique ne soutient plus leur maintien sur la liste de médicaments émergents. Réciproquement, les médicaments ont été conservés dans la liste si les essais en cours soutiennent l’évaluation initiale qui a justifié l’ajout à la liste de médicaments émergents.
Le présent rapport comporte sept sections. Suivant l’introduction, la section 2 fournit un aperçu des critères utilisés aux fins de sélection des médicaments, tandis que la section 3 décrit l’algorithme qui a servi à appliquer les critères. La section 4 porte sur la recherche dans la base de données BioPharm InsightMD ainsi que sur l’examen des documents publiés, tandis que la section 5 fournit une liste des nouveaux médicaments émergents identifiés aux fins du présent rapport. La section 6 donne des mises à jour sur les médicaments émergents identifiés dans les rapports précédents, alors que la section 7 présente une liste des médicaments émergents passés et présents.
2. Critères de sélection des médicaments
La présente section décrit brièvement les critères établis pour sélectionner les médicaments émergents.
2.1 Phase du développement
L’OMÉ ne traitera que des médicaments ayant atteint la phase III des essais cliniques ou qui à l’étude par la Food and Drug Administration des États-Unis (FDA). La plupart des médicaments qui atteignent ce niveau sont plus susceptibles d’obtenir l’approbation réglementaire et d’être commercialisés dans un avenir prochain au Canada. D’autre part, les médicaments se trouvant à des stades de développement moins avancés ne passent pas nécessairement toute la filière de l’approbation.
2.2 Indication et domaine thérapeutique
Les médicaments sont jugés des candidats potentiels de l’OMÉ s’ils peuvent servir à traiter des affections virtuellement mortelles, des affections pour lesquelles il n’existe aucun traitement, des maladies rares ou, encore, s’ils sont susceptibles de faire changer la pratique clinique à l’intérieur d’un domaine thérapeutique.
2.3 Description du médicament
Parmi les éléments descriptifs des médicaments qui indiquent qu’un nouveau médicament pourrait donner lieu à un changement de la pratique clinique, citons les suivants : premier médicament de sa catégorie, mécanisme d’action différent, technologie nouvelle, thérapie d’appoint, médicament-niche, médicament existant administré pour une indication nouvelle.
2.4 Incidence clinique et autre
Les médicaments doivent être susceptibles d’avoir une incidence clinique importante ou une incidence marquée sur d’autres secteurs du régime de soins de santé. Mentionnons, entre autres, une meilleure efficacité par rapport aux médicaments existants, des bienfaits pour la santé des patients, tels qu’une plus grande espérance de vie ou une meilleure qualité de vie, des résultats nouveaux ou redéfinis et un profil d’innocuité amélioré.
3. Méthodologie de sélection des médicaments
L’OMÉ tire surtout son information de la base de données BioPharm InsightMD. Cette base de données fait le suivi des médicaments depuis leur découverte préclinique jusqu’aux données sur leurs ventes, en passant par les essais cliniques et leur commercialisation.
Cette base de données contient de vastes renseignements sur plus de 21 000 médicaments expérimentaux. Les capacités de son moteur de recherche permettent de sélectionner les médicaments selon différents critères, notamment la phase de développement, le domaine thérapeutique, l’indication, le mécanisme du médicament, les médicaments orphelins, la filière d’approbation rapide et le type de molécule.
Vous trouverez dans la Figure 1 l’algorithme établi pour faire la sélection des médicaments. Il combine la capacité de recherche de la base de données BioPharm InsightMD au critère clé utilisé pour identifier les médicaments susceptibles d’avoir une grande incidence. Étant donné que les sources d’information de cette base de données sont en large partie américaines, des sources supplémentaires sont utilisées pour vérifier si les nouveaux médicaments sont en développement au Canada.
Figure 1. Algorithme de sélection des médicaments pour L’Observateur des médicaments émergents*
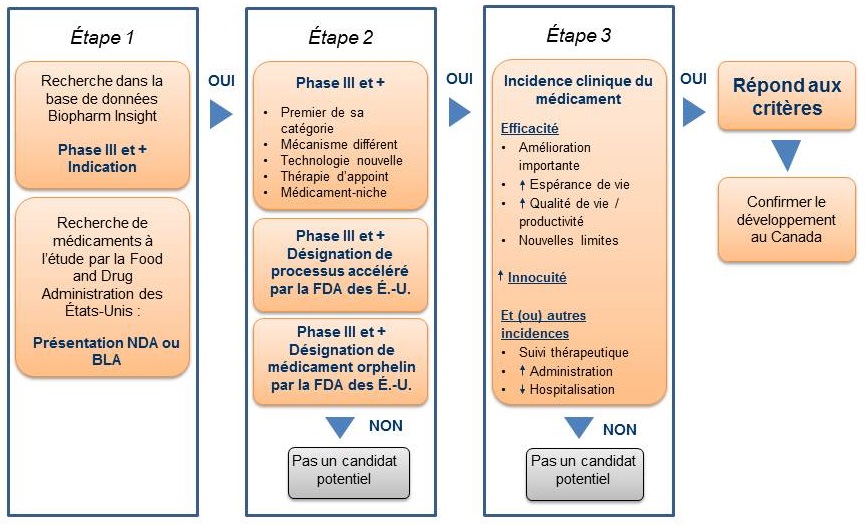
* La Figure 1 modifie le diagramme présenté dans les livraisons précédentes de l’OMÉ. Bien que l’algorithme n’ait pas changé, le diagramme clarifie les étapes suivies pour sélectionner les médicaments.
La première étape consiste à identifier les médicaments auxquels pourrait s’intéresser l’OMÉ. À cette fin, on effectue une recherche dans la base de données BioPharm InsightMD pour trouver les médicaments en phase III du développement ou à l’étude par la FDA pour lesquels une présentation de drogue nouvelle (NDA) ou une demande de licence biologique (BLA) a été déposée. Dans certains cas, les essais en phase III peuvent être à leurs tout débuts et dans d’autres, des résultats seront disponibles.
Pour la deuxième étape, les médicaments en phase III de développement sont soumis à une procédure de sélection selon le système thérapeutique sur lequel agit le médicament et selon l’indication. Un médicament est considéré un candidat potentiel pour l’OMÉ si la FDA l’inscrit comme médicament orphelin (médicament qui traite une maladie rare), si son processus d’approbation est accéléré étant donné qu’il doit traiter une maladie grave ou une maladie virtuellement mortelle ou, encore, si le médicament semble pouvoir traiter des maladies ou des affections pour lesquelles il n’existe encore aucun médicament.
Pour les médicaments en phase III dont le processus de développement n’est pas accéléré ou qui ne sont pas désignés orphelins, la recherche de leur profil est faite à l’aide de mots clés se rapportant à un descripteur précis, comme premier de sa catégorie thérapeutique, mécanisme différent, technologie nouvelle, thérapie d’appoint, médicament-niche, ou médicament existant avec une nouvelle indication. Par la suite, les résultats de la phase III de ces médicaments sont analysés pour valider les caractéristiques du médicament identifiées dans le profil, comme une bien meilleure efficacité ou innocuité. À ce point-ci, les médicaments arrivant au stade des essais cliniques de phase III sont rejetés du fait que l’information n’est pas suffisante pour l’évaluation scientifique.
La troisième étape permet d’évaluer l’incidence clinique de chaque médicament. Les sources canadiennes sont consultées pour déterminer si le médicament est en cours de développement au Canada. La principale source d’information est le Pharmacy Practice, qui publie une liste annuelle de nouveaux médicaments prometteurs ayant atteint les derniers stades de développement (phase III ou au-delà) au Canada. On procède ensuite à l’évaluation scientifique des médicaments identifiés. Si les résultats préliminaires de la phase III révèlent une incidence au niveau de l’efficacité ou de l’innocuité, on examine alors la possibilité d’inclure les médicaments dans l’OMÉ. Enfin, pour confirmer l’ajout d’un nouveau médicament à l’OMÉ, on vérifie si le médicament est susceptible d’être inscrit sur la liste des médicaments admissibles à un remboursement par les régimes fédéral, provinciaux et territoriaux d’assurance-médicaments, à la lumière de l’indication du médicament et de sa forme posologique.
4. Processus de sélection des médicaments
La première étape d’identification des médicaments auxquels pourrait s’intéresser la présente livraison de l’OMÉ consiste en une recherche dans la base de données BioPharm InsightMD pour y trouver les médicaments en phase III du développement ou à l’étude par la FDA pour lesquels une NDA ou une BLA a été déposée. La recherche de médicaments dans la base de données a été effectuée le 3 octobre 2014, conformément à l’algorithme décrit dans la section précédente.
La base de données BioPharm InsightMD est mise à jour régulièrement : certaines données sont mises à jour selon des intervalles de quelques heures, tandis que d’autres sections font l’objet de mises à jour hebdomadaires selon les nouveaux renseignements fournis à la source.Note 3 Peu avant la publication, le statut des médicaments inclus dans l’OMÉ a été vérifié en fonction des renseignements actuels dans la base de données BioPharm InsightMD.
Le Tableau 1 résume les résultats de cette première étape de recherche, par domaine thérapeutique. On a examiné le profil de chacun de ces médicaments dans la base de données, en accordant une attention particulière au champ « drug description » (description du médicament). La recherche a porté sur des mots clés précis comme « premier de sa catégorie » et « mécanisme différent ». Si ces mots clés étaient trouvés, l’étape suivante consistait à déterminer les résultats des essais cliniques de phase III, le cas échéant. Sous le critère « development history » (historique du développement) du profil du médicament, les détails concernant les résultats de la phase III de ces médicaments ont été analysés pour valider de façon plus approfondie les caractéristiques du médicament, p. ex. une meilleure efficacité ou innocuité. Si cette analyse révélait une efficacité insuffisante ou un problème d’innocuité, le médicament était rejeté à la sélection.
Selon ce processus de sélection, 1 262 médicaments au total ont été désignés comme étant en phase III du développement et 592 médicaments comme étant à l’étude par la FDA. Comme le montre le Tableau 1, ces médicaments couvrent un large éventail de domaines thérapeutiques.
Tableau 1. Première étape de sélection des médicaments :
Nombre de médicaments en phase III du développement ou à l’étude par la Food and Drug Administration des États-Unis, par domaine thérapeutique
| Domaine thérapeutique |
En phase III |
Présentation NDA/BLA* |
| Cancer |
251 |
49 |
| Cardiovasculaire |
95 |
39 |
| Système nerveux central |
100 |
90 |
| Dermatologie |
49 |
21 |
| Yeux et oreilles |
54 |
14 |
| Système gastro-intestinal |
59 |
49 |
| Système génito-urinaire |
42 |
31 |
| Hématologique |
65 |
33 |
| Infections au VIH |
13 |
18 |
| Système hormonal |
93 |
42 |
| Système immunitaire |
116 |
40 |
| Maladies infectieuses |
121 |
83 |
| Système musculosquelettique |
75 |
11 |
| Néphrologie |
20 |
7 |
| Douleur |
66 |
42 |
| Système respiratoire |
43 |
23 |
| Total** |
1 262 |
592 |
* Présentation de drogue nouvelle (NDA) ou demande de licence biologique (BLA)
** Le nombre total des résultats pertinents des essais de phase III ou des présentations NDA/BLA ne correspond pas forcément au nombre total rapporté dans chaque catégorie thérapeutique; ceci est attribuable au fait que certains médicaments peuvent être classés dans plus d’une catégorie thérapeutique.
Source : BioPharm InsightMD. Veuillez noter que la recherche de médicaments dans la base de données a été effectuée le 3 octobre 2014.
Le Tableau 2 présente la liste des médicaments du Tableau 1 qui ont été examinés de nouveau dans le cadre de la deuxième étape du processus de sélection. Les médicaments biologiques sont indiqués à part puisqu’il s’agit de médicaments onéreux susceptibles d’avoir une incidence sur les budgets des régimes d’assurance-médicaments. Parmi les 112 médicaments sélectionnés, 38 étaient des médicaments biologiques. Dans la plupart des domaines thérapeutiques, on a identifié un ou plusieurs médicaments biologiques, le plus grand nombre de résultats pertinents ayant été rapporté au chapitre des classifications du cancer (11) et du système immunitaire (5). Quatre médicaments biologiques dans les classifications du système hormonal, des maladies infectieuses et du système musculosquelettique qui étaient en essais cliniques de phase III et en présentation NDA/BLA ont été retenus à cette deuxième étape.
Tableau 2. Deuxième étape de sélection des médicaments :
Nombre de médicaments par domaine thérapeutique
| Domaine thérapeutique |
En phase III |
Présentation NDA/BLA* |
| Médicament |
Médicament biologique |
Médicament |
Médicament biologique |
| Cancer |
11 |
10 |
4 |
1 |
| Cardiovasculaire |
4 |
1 |
0 |
0 |
| Système nerveux central |
4 |
1 |
5 |
0 |
| Dermatologie |
2 |
3 |
1 |
0 |
| Yeux et oreilles |
0 |
0 |
0 |
1 |
| Système gastro-intestinal |
3 |
0 |
2 |
0 |
| Système génito-urinaire |
4 |
0 |
1 |
0 |
| Hématologique |
4 |
2 |
0 |
0 |
| Infections au VIH |
0 |
0 |
2 |
0 |
| Système hormonal |
4 |
3 |
0 |
1 |
| Système immunitaire |
8 |
3 |
0 |
2 |
| Maladies infectieuses |
4 |
3 |
3 |
1 |
| Système musculosquelettique |
5 |
4 |
1 |
0 |
| Néphrologie |
0 |
1 |
0 |
0 |
| Douleur |
2 |
0 |
0 |
0 |
| Système respiratoire |
0 |
1 |
0 |
0 |
| Total : En phase III et présentation NDA/BLA |
55 |
32 |
19 |
6 |
| Total |
112 |
* Présentation de drogue nouvelle (NDA) ou demande de licence biologique (BLA)
Source : BioPharm InsightMD. Veuillez noter que la recherche de médicaments dans la base de données a été effectuée le 3 octobre 2014.
La présente liste a été réduite davantage en vérifiant tous les médicaments sélectionnés par rapport à la plus récente liste de médicaments émergents publiée dans Pharmacy PracticeNote 4 et dans la base de données d’essais cliniques de Santé CanadaNote 5 afin de vérifier qu’il s’y trouvait des renseignements relatifs à des développements sur le marché canadien. L’étape suivante consistait en l’évaluation scientifique de cette liste préliminaire. Dans le cadre de l’évaluation, on a passé en revue les détails concernant les résultats de la phase III tirés des profils de médicaments dans la base de données BioPharm InsightMD, en cherchant tout particulièrement d’importantes améliorations aux résultats en matière d’efficacité et d’innocuité. De plus, on a effectué une recherche dans la base de données MEDLINEMD afin d’avoir une idée de la façon dont le médicament était perçu dans les documents publiés.
À la dernière étape de la sélection, on s’est assuré d’inclure à la liste des médicaments émergents des médicaments tirés d’un ensemble varié de catégories thérapeutiques. On a aussi tenu compte de l’incidence financière potentielle sur les régimes publics d’assurance-médicaments. On peut s’attendre à ce que les nouveaux médicaments introduits dans une catégorie à utilisation élevée (p. ex. cardiovasculaire) ou comportant des médicaments coûteux (p. ex. cancer) augmentent l’ensemble des dépenses associées à un régime d’assurance-médicaments. La même logique s’applique aux médicaments introduits dans un domaine thérapeutique comprenant une part élevée de médicaments génériques.
5. Nouveaux médicaments ajoutés à L’Observateur des médicaments émergents
Selon le processus de sélection des médicaments décrit dans la section précédente, 10 médicaments ont été ajoutés à la présente livraison de l’OMÉ, dont trois sont des médicaments biologiques. Le Tableau 3 présente ces médicaments, identifie clairement ceux qui sont biologiques et fournit des renseignements sur le nom de marque du médicament, l’entreprise, le domaine thérapeutique et la justification de son ajout à l’OMÉ.
Tableau 3. Médicaments ajoutés à L’Observateur des médicaments émergents
Médicament
(nom de marque)* – Entreprises** |
Domaine thérapeutique (ATC) – Indication |
Justification de l’ajout à l’OMÉ |
| Cancer |
|
ABT-199
(Venetoclax)
Abbott Laboratories; AbbVie; Genentech, Inc.; Roche Holdings AG
|
Cancer (L01)
Leucémies
|
- En essais cliniques de phase III
- Nouvelle catégorie : inhibiteur sélectif de la BCL-2 susceptible d’avoir une incidence sur la formation des tumeurs et la croissance et la résistance tumorales
- Pour les patients atteints de leucémie lymphoïde chronique
- Formulation orale; a été utilisé comme thérapie d’appoint (p. ex. en combinaison avec le rituzimab)
- Est à l’étude dans des essais cliniques canadiens (pour le lupus érythémateux disséminé, la leucémie lymphoïde et le lymphome non hodgkinien)Note 6
- Semble épargner les plaquettes tout en présentant une puissante activité antitumoraleNote 7
|
|
Rigosertib (sodium)
(Estybon)
Baxter International, Inc.; Onconova Therapeutics, Inc.; SymBio Pharmaceuticals Limited
|
Cancer (L01)
Tumeurs solides et hématologiques
|
- En essais cliniques de phase III
- Nouvelle catégorie : inhibiteur de la phosphoinositide 3-kinase et des voies de signalisation par les kinases polo-like qui induit l’arrêt de la mitose et l’apoptose dans les cellules néoplasiques tout en épargnant les cellules normalesNote 8
- Peut être particulièrement utile pour traiter les patients réfractaires atteints de syndromes myélodysplasiques qui ne disposent pas d’options efficaces
- Est également efficace sur les tumeurs solides; s’est révélé être un radiosensibilisateur plus efficace que le cisplatine dans le traitement du carcinome cervical, in vitro et in vivo, par radiochimiothérapie concomitanteNote 9
- Administré par injection, mais présente du potentiel comme agent oralNote 10
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
|
| Cardiovasculaire |
|
Betrixaban
Lee’s Pharmaceutical Holdings Limited; Merck & Co., Inc.; Millennium Pharmaceuticals, Inc.; Portola Pharmaceuticals Inc.
|
Cardiovasculaire (C01)
AVC, thrombose
|
- En essais cliniques de phase III
- Fait partie de la catégorie des anticoagulants inhibiteurs directs du facteur Xa
- Actif par voie orale
- Utilisé chez les patients qui présentent un risque d’AVC
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Extrêmement sélectif pour les anticoagulants du facteur Xa avec des caractéristiques pharmacologiques précises, notamment une longue demi-vie, une clairance rénale minimale et un métabolisme hépatique minimalNote 11
- Possibilité d’utilisation plus souple chez les patients présentant une mauvaise fonction rénale; offre la commodité d’une dose quotidienne unique et présente moins d’interactions médicamenteusesNote 12
|
| Dermatologie |
|
Ixekizumab
Eli Lilly & Co.
|
Dermatologie
Psoriasis
Médicament biologique
|
- En essais cliniques de phase III
- Nouvelle catégorie : inhibiteur de l’interleukine 17A (IL-17)
- Administré par injection sous-cutanée
- Nouvelle approche thérapeutique pour les patients atteints de psoriasis
- À l’étude dans le cadre d’essais cliniques canadiens (pour le psoriasis plaque et la spondylarthrite ankylosante)Note 13
- Une forte proportion de patients atteints de psoriasis ont répondu au traitement par ixekizumab et ont maintenu des réponses cliniques après plus d’un an de traitement sans signes inattendus liés à l’innocuitéNote 14
|
| Système gastro-intestinal |
|
DIMS0150
(Kappaproct)
InDex Pharmaceuticals AB
|
Système gastro-intestinal
Colite ulcéreuse (CU)
|
- En essais cliniques de phase III
- Nouvelle catégorie : agoniste du récepteur 9 de type Toll (TLR9)
- Induit la production de cytokines clés comme l’interleukine 10 et rehausse également la sensibilité aux stéroïdes chez les patients atteints de CU réfractaires aux stéroïdesNote 15
- Le Canada présente un des plus hauts taux d’incidence de maladies intestinales inflammatoires (CU et maladie de Crohn) au mondeNote 16
- Formulation rectale
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Option de traitement efficace et non invasive pour les patients gravement atteints de CU qui ne répondent plus au traitement par stéroïdes et dont la seule solution de rechange demeure l’ablation du côlon
|
| Hématologique |
|
Avatrombopag
(E5501)
Eisai Co., Ltd.
|
Hématologique
Thrombocytopénie
|
- En essais cliniques de phase III
- Agoniste du récepteur de la thrombopoiétine de deuxième génération qui stimule la production de plaquettes
- Formulation orale
- Étudié dans le cadre d’essais cliniques canadiens (pour la maladie hépatique)Note 17
- Habituellement bien toléré; augmentation de la numération plaquettaire chez les patients atteints de cirrhose qui subissent des procédures invasives électivesNote 18
|
| Infections |
|
Céthromycine
(Restanza)
Advanced Life Sciences, Inc.; Pfizer, Inc.
|
Infections
Pneumonie communautaire (PC)
|
- En essais cliniques de phase III
- Appartient à la classe des antibiotiques kétolides
- Conçu pour maîtriser la résistance bactérienne émergente aux macrolides et aux pénicillinesNote 19
- Utilisé pour traiter la PC, un défi majeur à l’échelle mondiale et une des principales causes de mortalité
- Formulation orale
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Peut fournir aux médecins prescripteurs un agent supplémentaire pour compléter une sélection de plus en plus limitée d’agents efficacesNote 20
|
| Système musculosquelettique |
|
Ocrelizumab
Biogen Idec Inc.; Genentech, Inc.; Roche Holdings AG
|
Système musculosquelettique
Sclérose en plaques (SP)
Médicament biologique
|
- En essais cliniques de phase III
- Appartient à la catégorie des anticorps monoclonaux humanisés
- Cible sélectivement les cellules B porteuses de la molécule CD20 impliquées dans les processus inflammatoires et neurodégénératifs de la SP
- À l’étude pour une formulation intraveineuse destinée au traitement de la SP et de la polyarthrite rhumatoïde
- Formulation intraveineuse
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Peut avoir éventuellement une incidence sur la progression de la maladie
|
| Douleur |
|
Ranirestat
(AS3201)
Dainippon Sumitomo Pharma Co. Ltd.; Eisai Co., Ltd.; Kyorin Pharmaceutical Co., Ltd
|
Douleur
Neuropathie diabétique
|
- En essais cliniques de phase III
- Premier médicament d’une nouvelle catégorie : inhibiteur d’aldose-réductase (IAR); les IAR sont des modificateurs potentiels de la maladie pour les complications liées au diabèteNote 21
- Options de traitement limitées pour gérer la neuropathie diabétique
- Formulation orale
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Procure un effet inhibiteur plus fort et de plus longue durée par rapport à d’autres médicaments (p. ex. la prégabaline (Lyrica)) dans ce domaine thérapeutique.
|
|
Tanezumab
Eli Lilly & Co.; Pfizer, Inc.
|
Douleur
Médicament biologique
|
- En essais cliniques de phase III
- Anticorps monoclonal humanisé qui inhibe le facteur de croissance du tissu nerveux
- À l’étude pour de multiples indications liées à la douleur, y compris la douleur liée à l’arthrose
- Le tanezumab a un effet modulateur sur la douleur, ne semble pas augmenter les signaux neurologiques liés à l’innocuité et offre une nouvelle approche prometteuse pour le traitement de la douleurNote 22
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Administration sous-cutanée
- Peut avoir une utilité thérapeutique chez les patients souffrant d’arthrose chez qui les médicaments anti-inflammatoires non stéroïdiens ne procurent pas d’analgésie suffisanteNote 23
|
* Si le nom du médicament et le nom de marque sont les mêmes, seulement une entrée figure sur la liste.
** Entreprises qui « développent un médicament » selon la définition de la base de données BioPharm InsightMD. Plus d’une entreprise peut mettre au point un même médicament et le commercialiser, et leur relation peut être définie par voie d’un contrat de licence.
6. Mise à jour
La présente section contient une mise à jour des 31 médicaments contenus dans la livraison précédente (décembre 2013) de L’Observateur des médicaments émergents :
- dix-sept (17) médicaments sont conservés dans la présente livraison de l’OMÉ puisqu’ils satisfont encore aux critères de sélection des médicaments (Section 2), voir le Tableau 4;
- sept (7) médicaments sont exclus de l’OMÉ, car les récentes évaluations scientifiques des résultats des essais cliniques de phase III ne tendent plus à montrer leur potentiel d’incidence clinique marquée, voir le Tableau 5;
- quatre (4) médicaments sont retirés de l’OMÉ, car ils ne sont plus en essais cliniques de phase III aux États-Unis ou parce qu’ils demeurent à l’étude par la Food and Drug Administration des États-Unis, mais qu’ils ne sont toujours pas approuvés au Canada, voir le Tableau 6;
- trois (3) médicaments sont retirés de l’OMÉ, car ils ont reçu une autorisation de mise en marché par Santé Canada, voir le Tableau 7.
Le Tableau 4 présente les dix-sept (17) médicaments (dont six (6) médicaments biologiques) des livraisons précédentes de l’OMÉ qui demeurent des candidats à la liste des médicaments émergents puisqu’ils satisfont toujours aux critères de sélection des médicaments (Section 2). On y trouve une mise à jour fondée sur les recherches effectuées dans la base de données BioPharm InsightMD et les documents scientifiques récemment publiés, ainsi que la raison pour laquelle on a conservé les médicaments dans la liste des médicaments émergents. Les ressources clés consultées comprennent un résumé des médicaments en phases avancées de développement au Canada dans Pharmacy Practice,Footnote 24
et la base de données d’essais cliniques au Canada de Santé CanadaFootnote 25.
Tableau 4. Médicaments conservés dans L’Observateur des médicaments émergents
| Médicament (nom de marque) – Entreprises |
Entreprises Domaine thérapeutique (ATC) - Indication |
Justification de l’ajout à l’OMÉ |
|
Albiglutide
(Syncria)
Tanzeum - GlaxoSmithKline plc; Human Genome Sciences, Inc.
|
Diabète (A10) et thérapie cardiaque (C01)
Diabète de type 2 et insuffisance cardiaque
Médicament biologique
|
Description précédente :
- Taux global de satisfaction plus élevé à l’égard du traitement chez les patients en raison de la facilité d’emploi et de la possibilité de doses moins fréquentesFootnote 26
Mise à jour :
- Commercialisé aux États-Unis en juillet 2010 pour le diabète de type 2; également approuvé en Europe
- Utilise la technologie VELTIS de Novozymes pour atteindre une demi-vie prolongée permettant aux patients de n’avoir à s’injecter leur médicament qu’une seule fois par semaineFootnote 27
- [Traduction] « Les avantages comprennent un dosage hebdomadaire unique et moins d’effets secondaires gastro-intestinaux comparativement au liraglutide, mais il est moins efficace pour réduire les taux d’HbA1c et le poids par rapport à ce dernier. »Footnote 28
Justification : Les documents publiés continuent d’indiquer que l’albiglutide est efficace dans la gestion du diabète de type 2 et qu’il peut améliorer le respect de la posologie en raison de la facilité d’administration et de moins d’effets secondaires.
|
|
Ataluren
(Translarna)
Genzyme Corporation, a Sanofi Company; PTC Therapeutics, Inc.; Sanofi
|
Maladies génétiques (avec mutation non-sens)
Fibrose kystique
|
Description précédente :
- [Traduction] « La modification du gène sous-jacent offre la perspective d’une nouvelle thérapie contre la fibrose kystique. »Footnote 29
Mise à jour :
- Approuvé conditionnellement en Europe (2014-08-14) pour le traitement de la dystrophie musculaire de DuchenneFootnote 30
- Les résultats des essais clinique de phase III pour la fibrose kystique causée par une mutation non-sens ont été publiésFootnote 31
- À l’étude dans des essais cliniques canadiens (phase III pour la fibrose kystique et la dystrophie musculaire de Duchenne).Footnote 32
Justification : Les documents publiés continuent d’indiquer que l’ataluren est une nouvelle thérapie importante pour la fibrose kystique et la dystrophie musculaire.
|
|
Cétilistat
(Cametor)
Norgine BV; Takeda Pharmaceutical Company Limited
|
Agents antiobésité (A08)
Obésité
|
Description précédente :
- A montré une perte de poids similaire à celle observée avec l’orlistat (Xenical), mais avec jusqu’à 90 % moins d’effets secondaires gastro-intestinaux gravesFootnote 33
Mise à jour :
- Approuvé au Japon (2013-09-24).
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- [Traduction] « Le cétilistat a provoqué des événements indésirables légers à modérés, principalement de nature gastro-intestinale (stéatorrhée), avec une incidence plus faible que l’orlistat. »Footnote 34
Justification : Bien que peu de nouveaux documents aient été publiés sur le médicament, celui-ci peut s’avérer une option mieux tolérée pour le traitement de l’obésité.
|
|
Istradefylline
(Nouriast)
Kyowa Hakko Kirin Pharma, Inc.; Valeant Pharmaceuticals International, Inc.
|
Antiparkinsoniens (N04)
Maladie de Parkinson (MP)
|
Description précédente :
- Premier médicament d’une nouvelle catégorie thérapeutique : antagoniste sélectif des récepteurs de l’adénosine A2A
- Incidences sur la progression de la maladie plutôt que sur le traitement des symptômes
Mise à jour :
- À l’étude dans le cadre d’essais cliniques canadiens (phase III)Footnote 35
- Les données obtenues à partir de sept essais comparés randomisés effectués auprès de 2 205 patients ont montré des réductions importantes dans les périodes OFF quotidiennes (résultat primaire). [Traduction] « Sur la base de ces résultats, l’istradefylline pourrait être un médicament d’augmentation de l’efficacité et de l’innocuité qu’on ajoute au traitement par lévodopa ou à d’autres thérapies antiparkinsoniennes existantes. »Footnote 36
Justification : Les documents publiés continuent d’indiquer que l’istradefylline peut constituer une thérapie non dopaminergique prometteuse pour le traitement de la MP.
|
|
Laquinimod
(Nerventra)
Active Biotech AB; Teva Pharmaceutical Industries Ltd.
|
Immunostimulants (L03) et immunosuppres-seurs (L04)
Sclérose en plaques, maladie de Crohn (MC) et lupus
Médicament biologique
|
Description précédente :
- Nouveau composé immunomodulateur administré par voie orale une fois par jour et présentant un profil risques-avantages favorableFootnote 37
Mise à jour :
- Les données d’innocuité à long terme ont été présentées lors d’une réunion scientifique en septembre 2014Footnote 38
- L’étude de phase II pour la maladie de Crohn a été publiée : [Traduction] « Le laquinimod était sûr et bien toléré, et les effets sur la rémission et la réponse à la dose de 0,5 mg suggèrent un bénéfice thérapeutique chez les patients atteints de MC. »Footnote 39
Justification : Les documents publiés continuent d’indiquer que le laquinimod pourrait constituer une thérapie prometteuse pour le traitement de la sclérose en plaques rémittente.
|
|
Lebrikizumab
Chugai Pharmaceutical Co., Ltd; Genentech, Inc.; Roche
|
Système respiratoire (R07)
Asthme
Médicament biologique
|
Description précédente :
- Premier médicament biologique de sa catégorie pour le traitement de l’asthme qui procure des bienfaits aux patients dont l’asthme est mal maîtrisé
Mise à jour :
- À l’étude dans le cadre d’essais cliniques canadiens (phase III)Footnote 40
Justification : Les documents publiés continuent d’indiquer que le lebrikizumab pourrait constituer une thérapie prometteuse pour le traitement de l’asthme.
|
|
Chlorhydrate de lorcasérine
(Belviq)
Arena Pharmaceuticals, Inc.; CY Biotech Company Ltd. ; Eisai Co., Ltd.; Ildong Pharmaceutical Co., Ltd.
|
Système gastro-intestinal (A08)
Obésité
|
Description précédente :
- Population importante; forte demande
- Agoniste du récepteur 5-HT2C de la sérotonine (5-hydroxytryptamine, 5-HT) qui régule la prise d’aliments
Mise à jour :
- À l’étude dans des essais cliniques canadiens (maladie cardiovasculaire et diabète)Footnote 41
- Approuvé aux États-Unis en 2012.
- [Traduction] « Les patients traités par lorcasérine avec une réponse de 12 semaines ont présenté des pertes de poids moyennes sur 52 semaines de 10,6 kg (sans diabète) et de 9,3 kg (avec diabète). »Footnote 42
Justification : Les documents publiés continuent d’indiquer que la lorcasérine pourrait constituer une thérapie prometteuse pour le traitement de l’obésité.
|
|
Mipomersen
(Kynamro)
Genzyme Corporation, a Sanofi Company; Isis Pharmaceuticals, Inc.
|
Hypolipémiant (C10)
Hypercholestérolémie
|
Description précédente :
- [Traduction] « Niveaux de la LDL-C, de l’apolipoprotéine B et de la lipoprotéine A (Lp[a]) sensiblement moindres chez les patients hypercholestérolémiques avec, ou à risque de présenter, une affection cardiovasculaire non maîtrisée par les thérapies actuelles. »Footnote 43
Mise à jour :
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- Approuvé aux États-Unis en 2013 pour l’hypercholestérolémie familiale homozygote
- [Traduction] « La thérapie par mipomersen est efficace pour abaisser les lipoprotéines contenant de l’apoB chez les patients souffrant d’hypercholestérolémie grave. »Footnote 44
Justification : Les documents publiés continuent d’indiquer que le mipomersen pourrait constituer une thérapie prometteuse pour le traitement de l’hypercholestérolémie.
|
|
Nintedanib
(Ofev)
Boehringer Ingelheim GmbH
|
Cancer (L01)
Cancer du poumon à grandes cellules et cancer ovarien
Médicament biologique
|
Description précédente :
- Essais de phase III en cours sur le cancer ovarien et le cancer du poumon à grandes cellules (base de données BioPharm InsightMD)
- À l’étude dans les essais cliniques canadiens (phase III pour le cancer colorectal)Footnote 45
Mise à jour :
- [Traduction] « Chez les patients atteints de fibrose pulmonaire idiopathique, le nintedanib a réduit la baisse de la capacité vitale forcée, ce qui est cohérent avec un ralentissement de la progression de la maladie; le nintedanib était souvent associé à de la diarrhée, ce qui a mené à l’arrêt du médicament à l’étude chez moins de 5 % des patients. » Footnote 46
- Approuvé aux États-Unis pour le traitement de la fibrose pulmonaire idiopathique (FPI).
Justification : Les documents publiés continuent d’indiquer que le nintedanib pourrait jouer un rôle dans le cancer pulmonaire. Il pourrait également s’avérer efficace pour la FPI.
|
|
NX-1207
Nymox Pharmaceutical Corporation; Recordati S.P.A.
|
Système génito-urinaire (G04)
Hyperplasie bénigne de la prostate
|
Description précédente :
- Premier de sa catégorie pour le traitement de l’hyperplasie bénigne de la prostate, une pathologie qui cause des problèmes urinaires associés avec le vieillissement
Mise à jour :
- [Traduction] « ... [l’amélioration symptomatique était] considérablement plus élevée que ce que l’on rapporte généralement pour les médicaments actuellement approuvés pour traiter l’hyperplasie bénigne de la prostate (de trois à cinq points), que l’on doit prendre indéfiniment sur une base quotidienne. »Footnote 47
Justification : Les documents publiés sont limités, mais continuent d’indiquer que le NX-1207 pourrait jouer un rôle dans le traitement de l’hyperplasie bénigne de la prostate.
|
|
Ponésimod
Actelion Pharmaceuticals Ltd; Roche
|
Immunostimulants (L03) et immunosuppres-seurs (L04)
Sclérose en plaques et psoriasis
Médicament biologique
|
Description précédente :
- Possibilité d’une dose administrée par voie orale une fois par jour pour divers troubles auto-immunsFootnote 48
Mise à jour :
- [Traduction] « Un bénéfice clinique important [avec le ponésimod pour le traitement du psoriasis] a été observé à la seizième semaine de traitement et a augmenté avec la thérapie d’entretien. »Footnote 49
Justification : Bien qu’il existe peu de documents publiés à ce sujet, le ponésimod pourrait constituer une thérapie importante pour le traitement de la sclérose en plaques et semble prometteur pour le traitement du psoriasis.
|
|
Rébamipide
(Mucosta)
Acucela, Inc.; Novartis AG; Otsuka Pharmaceutical Co., Ltd.
|
Préparations ophtalmologiques (S03)
Syndrome de l’oeil sec
|
Description précédente :
- Population importante : 22 millions de patients à l’échelle mondiale consultent un ophtalmologue lorsqu’ils souffrent de symptômes associés au syndrome de l’oeil sec
- [Traduction] « L’administration de rébamipide pour traiter le type de syndrome de l’oeil sec associé à un court temps de rupture a considérablement accru la qualité optique en raison de l’amélioration de la stabilité lacrymale. »Footnote 50
Mise à jour :
- [Traduction] « Les résultats de l’étude montrent que le rébamipide 2 % est efficace pour améliorer à la fois les signes objectifs et les symptômes subjectifs des patients souffrant du syndrome de l’oeil sec pendant au moins 52 semaines. En outre, le traitement par rébamipide 2 % a été généralement bien toléré. »Footnote 51
Justification : Les documents publiés continuent d’indiquer que le rébamipide est un traitement efficace du syndrome de l’oeil sec.
|
|
Sacubitril (auparavant désigné LCZ696)
Novartis AG
|
Cardiovasculaire (C09)
Insuffisance cardiaque, hypertension
|
Description précédente :
- Si les essais de phase III font la démonstration de meilleurs résultats cliniques, il pourrait donner lieu à une nouvelle norme de soins; la norme actuelle en matière de soins dans un cas d’insuffisance cardiaque consiste à administrer des inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) (p. ex. l’énalapril)
Mise à jour :
- Supérieur à l’ICECA pour des critères d’évaluation clés dans la plus vaste étude sur l’insuffisance cardiaque jamais réalisée (PARADIGME-HF)Footnote 52
- À l’étude dans le cadre d’essais cliniques canadiens (phase III)Footnote 53
Justification : Les documents publiés continuent d’indiquer que le sacubitril pourrait constituer une thérapie prometteuse pour le traitement de l’insuffisance cardiaque.
|
|
Safinamide
Meiji Seika Pharma Co., Ltd.; Merck Serono SA; Newron Pharmaceuticals; Zambon Group
|
Antiparkinsoniens (N04) et antiépileptiques (N03)
Maladie de Parkinson (MP), épilepsie et syndrome des jambes sans repos
|
Description précédente :
- Population importante
- [Traduction] « Le safinamide pourrait devenir un composé important pour la thérapie de la MP parce que son efficacité symptomatique semble supérieure à celle des inhibiteurs de la monoamine-oxydase de type B et des antagonistes des récepteurs du N méthyl D-aspartate qui sont accessibles comme l’amantadine, selon les résultats des essais cliniques disponibles. »Footnote 54
Mise à jour :
- Présentation d’une demande d’approbation réglementaire en Europe (2013-12-05) et aux États-Unis (2014-05-29)
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
- [Traduction] « Dans les essais de phase III, le safinamide s’est révélé être un adjuvant utile aux agonistes de la dopamine durant les premiers stades de la MP et a montré sa capacité à prolonger les périodes exemptes de dyskinésies gênantes sans en accroître leur nombre lorsqu’on l’utilisait comme traitement d’appoint à la lévodopa chez les patients atteints de Parkinson avancée. »Footnote 55
Justification : Les documents publiés continuent d’indiquer que le safinamide pourrait constituer un traitement efficace de la maladie de Parkinson.
|
|
Selexipag
Actelion Pharmaceuticals Ltd; Nippon Shinyaku Co., Ltd.
|
Antihypertenseurs (C02)
Hypertension artérielle pulmonaire (HAP)
|
Description précédente :
- [Traduction] « L’essai de phase III - GRIPHON - comporte un critère d’évaluation principal de temps, qui est à la fois pertinent sur le plan clinique et hautement robuste, pour les premières occurrences de morbidité ou de mortalité et fournira des renseignements essentiels concernant les effets à long terme qu’a le selexipag sur les patients qui sont atteints d’hypertension artérielle pulmonaire. »Footnote 56
Mise à jour :
- [Traduction] « Le selexipage a atteint son objectif primaire dans une étude de stade avancé. »Footnote 57
- Non-inscrit dans la base de données d’essais cliniques de Santé Canada
Justification : Les documents publiés indiquent toujours que le selexipag pourrait être un traitement efficacement de l’hypertension artérielle pulmonaire.
|
|
Sotatercept
Acceleron Pharma; Celgene Corporation
|
Cancer (L01)
Anémie, cancer des os
Médicament biologique
|
Description précédente :
- Potentiel de stimuler la formation osseuse; besoin médical non satisfait dans le cas du traitement d’une perte osseuse
Mise à jour :
- [Traduction] « Des doses multiples de sotatercept et de thalidomide semblent être sûres et généralement bien tolérées chez les patients atteints de myélomes multiples. »Footnote 58
Justification : Les documents publiés continuent d’indiquer que le sotaterept pourrait être un traitement efficace.
|
|
Vatalanib
Bayer AG; Novartis AG
|
Cancer (L01)
Cancer colorectal
|
Description précédente :
- Potentiellement le premier inhibiteur de la tyrosine kinase administré par voie orale à être utilisé à long terme en association avec une chimiothérapie standard pour le traitement de patients atteints d’un cancer colorectal métastatique
Mise à jour :
- [Traduction] « Le vatalanib a été bien toléré comme traitement de deuxième ligne et a présenté des taux de survie à six mois favorables chez les patients atteints de cancer du pancréas métastatique, par rapport aux témoins historiques. »Footnote 59
Justification : Les documents publiés indiquent toujours que le vatalanib pourrait constituer un traitement efficace du cancer du pancréas.
|
Le Tableau 5 présente les sept médicaments de la livraison précédente de L’Observateur des médicaments émergents (décembre 2013) qui sont exclus de la présente livraison, car les récentes évaluations scientifiques des résultats des essais cliniques de phase III ne tendent plus à montrer leur potentiel d’avoir une incidence clinique importante. À ce stade, on ignore si ces médicaments peuvent avoir une incidence sur les dépenses des régimes d’assurance-médicaments au Canada.
On y trouve une mise à jour fondée sur les recherches effectuées dans la base de données BioPharm InsightMD et les documents scientifiques récemment publiés, ainsi que la raison pour laquelle on a exclu les médicaments de la liste des médicaments émergents. Les raisons du retrait sont liées à l’interruption des essais cliniques pour des raisons d’innocuité ou d’efficacité.
Tableau 5. Médicaments exclus de L’Observateur des médicaments émergents :
Évaluation scientifique actuelle
| Médicament (nom de marque) – Entreprises |
Domaine thérapeutique (ATC) – Indication |
Justification du retrait |
|
Alisporivir
Debiopharm Group; Novartis AG
|
Anti-infectieux (J05)
Sida; hépatite C
|
Essais cliniques interrompus pour des raisons d’innocuité.Footnote 60
|
|
Darapladib
DiaDexus, LLC; GlaxoSmithKline plc; Human Genome Sciences, Inc.
|
Thérapie cardiaque (C01)
Athérosclérose
|
Ne répond pas aux critères d’évaluation primaires des essais de phase III.Footnote 61
|
|
Édivoxétine
(LY2216684)
Eli Lilly & Co.
|
Système nerveux central (N06)
Dépression; trouble d’hyperactivité avec déficit de l’attention
|
Ne répond pas à l’objectif principal de l’étude de présenter une efficacité supérieure dans le traitement de la dépression.Footnote 62
|
|
Ispronicline
AstraZeneca PLC; Targacept, Inc.
|
Psycholeptiques (N05) et psychoanaleptiques (N06)
Maladie d’Alzheimer; trouble d’hyperactivité avec déficit de l’attention; troubles dépressifs, stress et anxiété
|
Programme clinique interrompu.Footnote 63
|
|
Phénoxodiol
Marshall Edwards, Inc.; Novogen Limited
|
Cancer (L01)
Cancer ovarien, cancer du col de l’utérus, cancer de la tête et du cou, cancer du rein, cancer de la prostate, leucémie
|
Le phénoxodiol administré par voie orale n’a montré aucune preuve d’activité clinique lorsqu’il est combiné avec une dose hebdomadaire d’AUC2-carboplatine pour le traitement du cancer de l’ovaire résistant au platine.Footnote 64
|
|
Sérélaxine
(Relaxin)
Novartis AG; Paladin Labs, Inc.
|
Thérapie cardiaque (C01)
Insuffisance cardiaque
|
Un comité consultatif de la FDA a voté contre l’approbation du médicament pour utilisation dans l’insuffisance cardiaque : [Traduction] « Nous recommandons de ne pas approuver la séralaxine pour le moment, car nous ne disposons pas suffisamment de preuves qui appuient l’indication proposée d’améliorer les symptômes de l’insuffisance cardiaque aiguë en réduisant le taux de détérioration de l’insuffisance cardiaque. »Footnote 65
|
|
Voclosporine
(Luveniq)
3SBio Inc.; Iljin Life Science, Co., Ltd.; Isotechnika, Inc.; Lux Biosciences; Paladin Labs, Inc.; Roche
|
Préparations ophtalmologiques (S03) et immunosuppresseurs (L04)
Uvéite, greffes de rein et autres greffes, psoriasis
|
[Traduction] « ... un deuxième essai de phase III n’a pas montré de différence statistiquement significative entre les groupes placebo et de malades. Aucune étude supplémentaire visant à évaluer cet agent n’est prévue pour le moment. »Footnote 66
|
Le Tableau 6 comprend les quatre médicaments de la livraison précédente de L’Observateur des médicaments émergents (décembre 2013) qui ont été retirés de la présente livraison, car ils ne sont pas en essais cliniques de phase III aux États-Unis ou parce qu’ils ne sont pas à l’étude par la Food and Drug Administration des États-Unis et qu’ils ne sont pas encore approuvés au Canada. Ces médicaments pourraient éventuellement recevoir des autorisations de mise en marché au Canada, auquel cas ils pourraient avoir une incidence sur les dépenses des régimes d’assurance-médicaments. Le tableau fournit une justification du retrait des médicaments de la liste.
Tableau 6. Médicaments exclus de L’Observateur des médicaments émergents:
Pas en essais cliniques de phase III aux États-Unis ou présentation de NDA/BLA*; autorisation de mise en marché non accordée par Santé Canada
| Médicament
(nom de marque) – Entreprises |
Justification du retrait |
|
Agomélatine
(Valdoxan)
Les Laboratoires Servier; Novartis AG
|
Développement pour le marché américain abandonnéFootnote 67; déjà approuvé en UEFootnote 68; non-inscrit à la base de données d’essais cliniques de Santé Canada.
|
|
Ecallantide
(Kalbitor)
Dyax Corporation; Sigma-Tau Pharmaceuticals
|
Ce médicament est approuvé aux États-UnisFootnote 69; il n’est pas répertorié dans la base de données d’essais cliniques de Santé Canada.
|
|
Satraplatine
Celgene Corporation; Spectrum Pharmaceuticals, Inc.
|
Outre les études de phase II qui ont été présentéesFootnote 70,Footnote 71, il n’y a pas de nouvelles données publiées sur ce composé et celui-ci n’est pas répertorié dans la base de données d’essais cliniques de Santé Canada.
|
|
Disulfide de mesna
(Tavocept)
BioNumerik Pharmaceuticals; Takeda Pharmaceutical Company Limited
|
Il n’y a pas de nouvelles données publiées sur ce composé depuis 2012, et celui-ci n’est pas répertorié dans la base de données d’essais cliniques de Santé Canada.
|
Le Tableau 7 présente les trois médicaments (y compris un médicament biologique) de la livraison précédente de L’Observateur de médicaments émergents (décembre 2013) qui ont été retirés de la présente livraison, car ils ont reçu une autorisation de mise en marché par Santé Canada. On y trouve la date de l’avis de conformité (AC) fournie par Santé Canada ainsi que la date de la première vente.
Il contient également les renseignements relatifs aux recommandations faites par le Programme commun d’évaluation des médicaments (PCEM). Le PCEM procède à des examens de l’innocuité clinique et du rapport coût-efficacité des médicaments ainsi que de la rétroaction des patients relativement à ceux-ci, et fournit des recommandations sur les listes de médicaments aux régimes d’assurance-médicaments publics. Le PCEM fait partie de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS).
Le tableau indique aussi le statut de l’examen du prix réalisé par le Conseil d’examen du prix des médicaments brevetés (CEPMB) pour les nouveaux médicaments. Le CEPMB veille à ce que les prix des médicaments brevetés vendus au Canada ne soient pas excessifs en examinant les prix demandés par les brevetés aux grossistes, aux hôpitaux et aux pharmacies pour chaque médicament breveté. Une fois l’examen terminé, le médicament peut (i) présenter un prix conforme aux Lignes directrices du CEPMB, (ii) dépasser les Lignes directrices d’un montant qui ne justifie pas la tenue d’une enquête ou (iii) dépasser les Lignes directrices et faire l’objet d’une enquête.
Tableau 7. Médicaments retirés de L’Observateur des médicaments émergents :
Autorisation de mise en marché accordée par Santé Canada
Médicament (nom de marque) –
Entreprises |
Domaine thérapeutique
– Indication |
Date de l’AC* /
date de la première vente** |
Recommandations du Programme commun d’évaluation des
médicaments (PCEM)† |
Statut de l’examen par le CEPMB |
|
Aflibercept
(Eylea)
Bayer Inc.
|
Ophtalmologie (S01)
Dégénérescence maculaire néovasculaire, liée à l’âge
Médicament biologique
|
AC accordé le 2013-11-08Footnote 72
Date de la première vente : 2013-12-23
|
Le PCEM a recommandé l’inscription 2014-10-20, sous réserve de la condition suivante :
[Traduction] « Le coût du régime d’assurance-médicaments pour le traitement de la dégénérescence maculaire humide liée à l’âge par aflibercept devrait fournir des économies par rapport au traitement de la DMLA avec le ranibizumab. »
Deux nouvelles indications sont actuellement à l’étude : (i) oedème maculaire secondaire à une occlusion veineuse rétinienne et (ii) oedème maculaire diabétique.
|
Prix conforme aux Lignes directrices
|
|
Macitentan
(Opsumit)
Actelion Pharmaceuticals Ltd.
|
Antihypertenseurs (C02)
Hypertension artérielle pulmonaire
|
AC accordé le 2013-11-06Footnote 73
Date de la première vente : 2014-01-15
|
Sous examen
2014-11-05 : Période d’embargo et validation des rapports d’examen expurgés du PCEM. Les fabricants peuvent présenter des demandes de réexamen et les régimes d’assurance-médicaments peuvent présenter des demandes de renseignements pour obtenir des précisions quant à la recommandation.
|
Prix conforme aux Lignes directrices
|
|
Tofacitinib
(Xeljanz)
Pfizer Canada Inc.
|
Immunosuppresseurs (L04)
Polyarthrite rhumatoïde
|
AC accordé le 2013-04-17Footnote 74
Date de la première vente : 2014-06-06
|
Sous examen
2014-10-27: Réception du sommaire des commentaires sur la rétroaction des patients.
|
Pas actuellement sous examen
|
* Un avis de conformité émis par Santé Canada indique qu’un produit médicamenteux satisfait aux exigences réglementaires relatives à l’usage humain ou vétérinaire et que la vente dudit produit est autorisée au Canada.
** La date de la première vente correspond à la date déclarée au CEPMB. Cette date peut précéder la date d’émission de l’AC par Santé Canada puisqu’un produit peut être vendu en vertu du Programme d’accès spécial ou d’une demande d’essais cliniques, ou peut constituer une drogue nouvelle de recherche.
† Les recommandations du PCEM sont faites par le Comité canadien d’expertise sur les médicaments (CCEM), un organisme consultatif indépendant formé de spécialistes de la pharmacothérapie et de l’évaluation de médicaments. Les présentations par les fabricants sont déposées volontairement, certaines recommandations peuvent donc ne pas être disponibles pour certains médicaments. Les renseignements sur l’état actuel de l’examen du PCEM se trouvent à l’adresse suivante : http://www.cadth.ca/fr/products/cdr/
7. Examen des médicaments passés et présents dans l’OMÉ
À ce jour, un total de 61 nouveaux médicaments ont été retenus dans six rapports de l’OMÉ publiés depuis 2007. Au moment de leur ajout à l’OMÉ, ceux-ci étaient en phase III des essais cliniques ou à l’étude par la FDA des États-Unis et susceptibles d’avoir une incidence clinique importante. Parmi ceux ci :
- dix (10), soit 16,4 %, sont de nouveaux médicaments identifiés dans la présente livraison de l’OMÉ;
- dix-sept (17), soit 27,9 %, continuent de satisfaire aux critères de l’OMÉ pour la sélection de médicaments;
- dix-sept (17), soit 27,9 %, ne satisfont plus aux critères de l’OMÉ pour la sélection de médicaments;
- dix-sept (17), soit 27,9 %, ont ensuite reçu une autorisation de mise en marché par Santé Canada.
Cela suggère que la majorité des médicaments dans l’OMÉ (72,1 %) continue de présenter des évaluations scientifiques prometteuses ou a reçu une autorisation de mise en marché par Santé Canada. Une proportion relativement faible des médicaments (27,9 %) a été exclue de l’OMÉ, car (i) l’évaluation scientifique ne soutient plus leur maintien sur la liste ou (ii) ils ne sont plus en essais cliniques de phase III aux États-Unis ou à l’étude par la FDA, et ils n’ont pas encore été approuvés au Canada.