Modernisation des Lignes directrices du CEPMB – Document de discussion – Juin 2016
Repenser les Lignes directrices : Commentaires du public dans le cadre de la phase 1 maintenant disponibles!
La phase 1 de l’initiative Repenser les Lignes directrices a pris fin le 31 octobre 2016. Consultez la section Repenser les Lignes directrices pour lire les présentations reçues sur le document de discussion et pour de plus amples renseignements sur les prochaines étapes du processus de consultation.

ISBN : 978-0-660-05294-6
No cat. : H82-21/2016F-PDF
Juin 2016
PDF - 3.19 MB
Vision
Un système pharmaceutique durable dans le cadre duquel les tiers payants obtiennent l’information dont ils ont besoin pour faire de bons choix en matière de remboursement et grâce auquel les Canadiens ont accès à des médicaments brevetés à des prix abordables.
Énoncé de mission
Nous sommes un organisme public respecté qui contribue de façon unique et précieuse à la durabilité des dépenses en produits pharmaceutiques au Canada au moyen des mesures suivantes :
- Fournir aux intervenants des renseignements sur les prix, les coûts et l’utilisation pour les aider à prendre en temps opportun des décisions éclairées en matière de prix des médicaments, d’achat et de remboursement.
- Assurer un contrôle efficace sur les droits de brevet des fabricants pharmaceutiques grâce à l’exercice responsable et efficient de ses pouvoirs en matière de protection des consommateurs.
Devise
Protéger, habiliter, s’adapter
Avertissement
Le présent document est prévu uniquement à des fins de discussion, pour obtenir la rétroaction du public et des intervenants quant au besoin d’une réforme et à la nature et à la portée des changements qui pourraient être apportés aux Lignes directrices. Il ne représente pas un énoncé définitif de la position du CEPMB sur le sujet.
Message de la présidente
On dit souvent que le CEPMB a été établi en tant que « pilier » de la protection du consommateur du projet de loi C-22. Le projet de loi était alors un sujet litigieux, et la crédibilité et l’efficacité du CEPMB à titre d’organisme de réglementation étaient considérées comme éléments essentiels pour assurer la viabilité à long terme du compromis stratégique que le projet de loi incarnait. Toutefois, avec les prix des médicaments brevetés au Canada qui dépassent ceux de nos pays de comparaison et de nos partenaires de l’OCDE, le creux record de l’investissement dans la recherche et développement (R et D) pharmaceutique et les tiers payants publics et privés qui essaient de composer avec l’arrivée de médicaments onéreux, l’efficacité du CEPMB à réaliser les objectifs stratégiques du gouvernement est remise en question par plusieurs. Alors que nous entreprenons la réforme et le renouvellement décrits dans notre Plan stratégique 2015-2018, nous menons des consultations sur les changements à apporter aux lignes directrices du CEPMB, comme le prévoit le paragraphe 96(5) de la Loi sur les brevets, afin d’atteindre plus facilement ces objectifs stratégiques. Nous nous réjouissons à la perspective de travailler avec tous nos intervenants tout au long du processus afin de réaliser notre vision d’un système pharmaceutique durable dans le cadre duquel les tiers payants obtiennent l’information dont ils ont besoin pour faire de bons choix en matière de remboursement et grâce auquel les Canadiens peuvent avoir les moyens de se payer les médicaments brevetés dont ils ont besoin pour avoir une vie saine et productive.
Sommaire
Les changements récents et importants à l’environnement opérationnel du Conseil d’examen du prix des médicaments brevetés (CEPMB) entraînent la nécessité d’apporter les changements correspondants afin de moderniser et de simplifier son cadre de réglementation. Comme première étape dans ce processus, le CEPMB effectue des consultations publiques pour obtenir les observations des intervenants et du grand public au sujet de l’éventuelle réforme de son Compendium des politiques, des Lignes directrices et des procédures (les « Lignes directrices »). Le processus de consultation publique est une invitation à toutes les parties intéressées de repenser collectivement les Lignes directrices afin de s’assurer qu’elles continuent d’offrir au CEPMB un moyen pertinent et efficace pour protéger les consommateurs contre les prix excessifs dans un marché pharmaceutique dynamique et évolutif.
Le présent document de discussion fournit un cadre pour les consultations en cernant les aspects des Lignes directrices qui semblent être particulièrement désuètes et en posant une série de questions formulées de façon générale dont les réponses permettront d’éclairer la deuxième phase du processus de consultation lorsque des changements spécifiques aux Lignes directrices seront proposés. Bien que le CEPMB soit déterminé à réformer ses Lignes directrices, il n’a pas d’idées préconçues sur les changements précis qui peuvent résulter de ce processus.
Les consultations sur le document de discussion visent à servir de plate-forme pour permettre aux intervenants et au public de s’engager dans un dialogue ouvert, franc et transparent pour échanger des vues et des idées sur la nature et la portée de la réforme des Lignes directrices. Toute rétroaction qui ne respecte pas ces paramètres sera transmise aux autorités compétentes pour examen.
Objet
Le présent document a pour objet de mettre en œuvre les obligations du CEPMB en vertu du paragraphe 96(5) de la Loi sur les brevets en consultant les intervenants et les membres intéressés du public sur les changements qui pourraient être apportés aux politiques, aux lignes directrices, aux procédures et à l’approche d’application de la réglementation du CEPMB. Le titre du document, Modernisation des Lignes directrices du CEPMB, reflète l’intention du CEPMB de jeter un regard neuf sur la façon dont il protège les consommateurs contre le prix excessivement élevé des médicaments brevetés en se fondant sur les facteurs énoncés à l’article 85 de la Loi sur les brevets.
Voici les objectifs du document :
- Susciter un débat éclairé sur les changements qui ont eu lieu dans l’environnement opérationnel du CEPMB;
- Cerner les articles des Lignes directrices requérant particulièrement une réforme à la lumière de ces changements;
- Encourager la participation du public afin d’obtenir un large éventail de points de vue sur l’orientation de la réforme des Lignes directrices;
- Appuyer les efforts continus du CEPMB pour protéger les consommateurs contre le prix excessivement élevé des médicaments brevetés.
Introduction
Qui sommes-nous?
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en vertu de la Loi sur les brevets (la « Loi »). Même s’il fait partie du portefeuille de la Santé, le CEPMB, en raison de ses responsabilités quasi judiciaires, exerce son mandat en toute indépendance vis-à-vis du ministre de la Santé (qui est néanmoins responsable de l’application des dispositions de la Loi se rapportant au Conseil). Le CEPMB fonctionne également d’une façon indépendante de Santé Canada, qui vérifie l’innocuité et l’efficacité des médicaments; d’autres organismes du portefeuille de la Santé, comme l’Agence de la santé publique du Canada et les Instituts de recherche en santé du Canada; et des régimes d’assurance-médicaments des provinces, qui approuvent l’inscription des médicaments sur leurs formulaires respectifs aux fins de remboursement. Selon le cadre pangouvernemental, les activités de programme du CEPMB cadrent avec les résultats de haut niveau d’un système de santé responsable, facile d’accès et durable.
Le CEPMB a été créé en 1987 dans le cadre d’une réorganisation majeure du régime de brevets sur les médicaments du Canada qui visait à maintenir l’équilibre entre des objectifs de politiques susceptibles d’être en concurrence. D’une part, le gouvernement a renforcé la protection que confèrent les brevets aux médicaments afin d’encourager davantage d’investissement en R et D de la part de l’industrie pharmaceutique au Canada. D’autre part, le gouvernement a créé le CEPMB en vue d’atténuer pour les Canadiens les répercussions financières des changements apportés à la Loi. Le CEPMB était décrit comme le pilier de la protection des intérêts des consommateurs du projet de loi C-22. Cette description a été appuyée à de multiples occasions par les tribunaux, y compris la Cour suprême du Canada en 2011. L’objectif énoncé du CEPMB était de veiller à ce que les brevetés n’abusent pas de leurs droits de brevet nouvellement renforcés en imposant aux consommateurs des prix « excessifs » pendant la période de monopole de droit.
Au moment où le projet de loi C-22 a été adopté, les décideurs étaient d’avis que la protection conférée par brevet et les prix étaient les facteurs clés de l’investissement de l’industrie pharmaceutique en R et D. On a donc décidé d’offrir un niveau de protection et de prix pour les médicaments comparable à celui d’autres pays ayant une industrie pharmaceutique forte parce qu’on croyait que le Canada aurait des niveaux comparables de R et D. En échange des changements apportés à la Loi, lesquels ont renforcé la protection que confèrent les brevets aux médicaments, Compagnies de recherche pharmaceutique du Canada (récemment rebaptisé « Médicaments novateurs Canada » ou MNC) s’est engagé à doubler son niveau de R et D à 10 % des ventesNote de bas de page 1.
Pourquoi tenons-nous des consultations?
Les répercussions de la politique au fil du temps ont été à l’opposé de ce qui était prévu. Le prix des médicaments brevetés au Canada a augmenté de façon constante par rapport aux prix observés dans les sept pays auxquels se compare le Canada en vertu de sa réglementation (France, Allemagne, Suède, Suisse, Royaume-Uni et États-Unis – les sept pays de comparaison du CEPMB) et se trouve maintenant au troisième rang, n’étant devancé que par l’Allemagne et les É.-U. Depuis 2000, les dépenses en médicaments brevetés du Canada exprimées en pourcentage du PIB ont connu une hausse de 184 %, dépassant les sept pays de comparaison du CEPMB au cours de cette période. Outre les sept pays de comparaison du CEPMB, les prix en Australie, en Autriche, en Espagne, en Finlande, aux Pays-Bas et en Nouvelle-Zélande sont de 14 à 34 % inférieurs à ceux du Canada. Si l’on tient compte de tous les médicaments prescrits et non seulement des médicaments brevetés, les dépenses par habitant au Canada et en tant que pourcentage du PIB sont plus élevées que celles de la plupart des autres pays.
Tandis que les prix au Canada augmentent, l’investissement en R et D diminue. Depuis 2003, les membres de MNC n’ont pas respecté leur engagement de 10 %, et le ratio actuel s’établit à 5 % des ventes. Il s’agit du ratio enregistré le plus faible depuis 1988, quand le CPEMB a commencé à faire rapport sur la R et D. Par opposition, le ratio moyen de R et D des sept pays de comparaison du CEPMB est constamment supérieur à 20 %.
Le prix élevé des médicaments brevetés et le creux record de l’investissement en R et D remettent beaucoup en question l’efficacité du CEPMB pour atteindre les objectifs de la politique du gouvernement de 1987. Ces préoccupations ont été exprimées à nouveau récemment par le Groupe consultatif sur l’innovation des soins de santé dans son rapport du 17 juillet 2015 intitulé Libre cours à l’innovation : Soins de santé excellents pour le Canada; qui conclut que le CEPMB doit être renforcé afin de mieux protéger les consommateurs des prix élevés des médicaments brevetés. Ces mêmes préoccupations sont ce qui a incité le CEPMB à entreprendre un processus de planification stratégique d’un an, qui permettra à l’organisation de s’affirmer à nouveau en tant que garantie efficace contre l’abus des prix excessifs des fabricants pharmaceutiques et en tant que source précieuse de renseignements sur le marché pour les décideurs et les tiers payants. Pour atteindre le premier de ces deux objectifs, il faudra apporter des changements au cadre juridique du CEPMB. Ces changements sont en harmonie avec les efforts en cours des ministres de la Santé fédéral, provinciaux et territoriaux consistant à « réduire le prix des produits pharmaceutiques » tout en « améliorant la capacité financière, l’accessibilité et l’utilisation appropriée des médicaments d’ordonnanceNote de bas de page 2 » et sont complémentaires à ces efforts.
Ce que nous faisons
À cette étape initiale des consultations, le CEPMB souhaite obtenir des commentaires d’ordre général sous la forme de réponses à une série de questions définies en termes larges et portant sur des sujets qui façonneront par la suite la deuxième étape des consultations, lorsque les intervenants seront invités à se prononcer sur les modalités techniques des changements à apporter aux Lignes directrices. Tout au long du processus, les intervenants et les membres du public qui souhaitent présenter leurs points de vue sont priés d’examiner attentivement le mandat de protection des consommateurs du CEPMB, l’interprétation de la Cour suprême de son objectif, les questions d’abordabilité, de transparence des prix et d’écart de prix à l’échelle internationale et nationale, les tendances en R et D, le fardeau réglementaire et les pratiques exemplaires à l’échelle internationale.
Le processus de consultation comportera trois phases distinctes afin de veiller à ce que les intervenants et le public aient amplement l’occasion d’exprimer leurs préoccupations et leurs points de vue, conformément à la lettre et à l’esprit du paragraphe 96(5) de la Loi.
| Phase |
Étapes |
Échéanciers proposés |
| Phase 1 : Consulter les intervenants sur les enjeux |
Publier le document de discussion
Rencontrer divers groupes d’intervenants au Canada
Obtenir des commentaires écrits des principales parties intéressées et du public sur les questions figurant dans le document de discussion
Recueillir et analyser tous les résultats de la phase 1 des consultations |
Été/automne 2016 |
| Phase 2 : Mobiliser les intervenants et recueillir les commentaires des experts |
Audience publique sur la politique – inviter les intervenants à se présenter devant le Conseil et à faire des observations à l’appui de leurs commentaires écrits |
Automne 2016/hiver 2017 |
| Phase 3: Présentation des changements proposés |
Publier les changements proposés aux Lignes directrices pour recueillir des commentaires au moyen d’un processus de diffusion d’avis offrant la possibilité de faire des commentaires
Tenir un ou plusieurs forums multipartites sur des questions précises et les modifications aux Lignes directrices proposées |
Printemps/été 2017 |
Le CEPMB aimerait recevoir des commentaires du plus grand nombre possible de gens et il organisera une consultation nationale à laquelle sera convié un large éventail d’intervenants, y compris :
- les consommateurs et les groupes de patients;
- l’industrie et les associations de l’industrie;
- les gestionnaires des régimes d’assurance-médicaments publics et privés;
- le milieu universitaire;
- les professionnels de la santé et les organismes connexes;
- les organismes d’évaluation des technologies de la santé;
- les ministères de la Santé fédéral, provinciaux et territoriaux;
- les autres ministères fédéraux;
- les partenaires internationaux.
Le cadre de réglementation du CEPMB
Le pouvoir juridique du CEPMB lui est conféré par la Loi sur les brevets (la « Loi ») et le Règlement sur les médicaments brevetés (le « Règlement »). Le Compendium des politiques, des Lignes directrices et des procédures (les « Lignes directrices ») constituent une orientation interprétative non contraignante et des directives du Conseil aux brevetés et au personnel sur la façon de se conformer à la Loi et au Règlement.
La Loi
La Loi dans son ensemble relève du ministre de l’Industrie, à l’exception des articles 79 à 103 qui portent sur le CEPMB et qui relèvent du ministre de la Santé. Ces articles de la Loi exigent que le CEPMB prenne des mesures correctives, à la suite d’une audience publique, s’il est conclu que le fabricant d’un médicament breveté exige un prix trop élevé. Le paragraphe 85(1) de la Loi stipule que pour décider si le prix d’un médicament est excessif, le Conseil doit tenir compte des facteurs suivants (« facteurs de fixation du prix ») :
- le prix de vente du médicament sur un tel marché;
- le prix de vente de médicaments de la même catégorie thérapeutique sur un tel marché;
- le prix de vente du médicament et d’autres médicaments de la même catégorie thérapeutique à l’étranger;
- les variations de l’indice des prix à la consommation (« IPC »);
- tous les autres facteurs précisés par les règlements d’application du présent paragraphe.
Le paragraphe 85(2) de la Loi stipule que si un panel composé de membres du Conseil n’est pas en mesure de déterminer si le prix de vente du médicament est excessif après avoir examiné ces facteurs lors d’une audience, le Conseil peut tenir compte des coûts de réalisation et de mise en marché ainsi que d’autres facteurs précisés par les règlements d’application du paragraphe ou qu’il estime pertinents.
Le Règlement
Le Règlement précise les renseignements et les documents que les brevetés doivent fournir au CEPMB afin que ce dernier puisse bien réaliser son mandat de réglementation. Il comporte des exigences relatives aux prix de tous les médicaments brevetés vendus au Canada et aux prix dans les pays étrangers où ils sont également vendus. Le Règlement précise également les pays que le Canada examine pour comparer ses prix. Actuellement, ce sont les sept pays de comparaison du CEPMB, qui, comme il a été mentionné, ont été choisis en fonction de leur niveau de R et D pharmaceutique.
Bien que l’article 85 de la Loi prévoie d’autres facteurs de prix excessifs à prescrire dans le Règlement ou dont les membres du Conseil doivent tenir compte dans un contexte d’audience, aucune orientation n’a été donnée à ce jour. En vertu de l’article 101 de la Loi, seul le gouverneur en conseil a le pouvoir de créer et de modifier le Règlement, sous réserve de la recommandation du ministre de la Santé sur certaines questions clés. Toutefois, le ministre ne peut faire une telle recommandation qu’après avoir consulté les ministres de la Santé provinciaux, des représentants de l’industrie pharmaceutique et d’autres intervenants concernés.
Lignes directrices
L’article 85 de la Loi envisage une intervention seulement lorsque le prix d’un médicament breveté est considéré comme « excessif », ce qui est déterminé en fonction d’un ensemble de facteurs exprimés en termes généraux. En raison du caractère indéfini de l’exercice envisagé par la Loi, bon nombre des concepts administratifs fondamentaux qui permettent la mise en application du mandat de protection des consommateurs du CEPMB ont été élaborés à partir des Lignes directrices, ce que le Conseil est autorisé à faire en vertu du paragraphe 96(4) de la Loi, sous réserve d’une consultation préalable auprès des intervenants concernés.
Bien que les Lignes directrices, par définition, n’aient pas force de loi, elles ont été jugées utiles par la Cour fédérale pour le CEPMB et le public. Elles peuvent légitimement influencer le raisonnement du Conseil lors d’une audience sur le prix excessifNote de bas de page 3.
En vertu des Lignes directrices actuelles du CEPMB, un prix plafond est assigné aux nouveaux médicaments brevetés en fonction du niveau d’avantages thérapeutiques par rapport aux médicaments existants, selon ce qui a été déterminé par un comité d’experts scientifiques. Selon les Lignes directrices, une fois que le prix plafond de lancement est fixé et que le médicament est lancé sur le marché, une augmentation annuelle du prix conforme à l’IPC est permise pourvu que cette augmentation ne mène pas à ce que le prix canadien devienne plus élevé que le prix du même médicament dans les sept pays de comparaison du CEPMB.
L’objectif des Lignes directrices est de veiller à ce que les brevetés soient au courant des politiques et des procédures normalement mises en application lors des processus scientifiques et d’examen des prix qui permettent au personnel de déterminer si un prix semble excessif. Les Lignes directrices sont importantes pour le fonctionnement quotidien du CEPMB, car :
- elles établissent les principes de base de l’application équitable, uniforme et prévisible de la Loi;
- elles incitent à la conformité volontaire en donnant aux brevetés une compréhension suffisante des exigences réglementaires pour fixer les prix à des niveaux qui sont peu susceptibles de déclencher une enquête;
- elles favorisent la prise de décisions administratives cohérentes.
En cas de non-respect des Lignes directrices, le personnel du CEPMB peut renvoyer l’enquête à la présidente, laquelle doit décider s’il est dans l’intérêt du public de tenir une audience pour déterminer si le prix du médicament breveté est réellement excessif. Lorsqu’une telle audience débute, les Lignes directrices peuvent faire partie de l’évaluation des membres du Conseil sur la question du caractère excessif des prix, dans la mesure où elles représentent une application raisonnable de la Loi et des facteurs de l’article 85 aux faits en cause, mais en fin de compte elles ne lient ni le Conseil ni le breveté.
Bien que les facteurs de la Loi soient immuables (sauf modification par le Parlement), leur caractère non limitatif permet, dans le cadre des Lignes directrices, une interprétation de « prix excessif » souple et mue par le contexte, qui évolue avec le temps et les nouvelles circonstances. À ce point-ci, les Lignes directrices actuelles demeurent ancrées sur une compréhension du secteur pharmaceutique mondial et canadien vieille de plusieurs décennies, comme cela sera expliqué ci-après. La modernisation des Lignes directrices est une première étape nécessaire à l’harmonisation du cadre juridique général du CEPMB avec les pratiques exemplaires à l’échelle internationale et le milieu pharmaceutique d’aujourd’hui.
Changements au contexte de réglementation du CEPMB
Au moment de la création du CEPMB, on connaissait peu de choses sur la relation entre le prix, la protection de la propriété intellectuelle (PI) et l’investissement en R et D. Les tiers payants publics et privés commençaient tout juste à déployer des efforts pour contrôler le coût des médicaments d’ordonnance, et le concept de « l’établissement des prix en fonction des références internationales » (c.-à-d. la comparaison des prix dans un pays aux prix d’autres pays) était tout nouveau. Les efforts en R et D du secteur se concentraient sur la mise en marché de médicaments qui traitaient les maladies et les problèmes les plus courants, tels que le taux élevé de cholestérol, l’hypertension artérielle et la dépression, et dont le prix était en général à la portée des consommateurs et des tiers payants. Les prix courants officiels pour les médicaments se rapprochaient du véritable prix payé sur le marché et ne variaient pas de façon considérable entre les différents tiers payants (p. ex. publics par rapport à privés). Enfin, le gouvernement croyait que les sociétés pharmaceutiques tendraient à éviter d’abuser de leurs droits de brevet nouvellement renforcés par égard aux intérêts politiques investis pour assurer l’adoption des lois et règlements connexes.
Par contre, à l’heure actuelle, les données empiriques ne confirment pas l’idée que le prix et la propriété intellectuelle sont des leviers politiques particulièrement efficaces pour attirer la R et D pharmaceutique. D’autres facteurs, comme l’emplacement du siège social, l’infrastructure des essais cliniques et les grappes scientifiques, semblent être des déterminants beaucoup plus importants des secteurs où les investissements pharmaceutiques sont effectués dans une économie mondiale. Les rabais confidentiels des prix courants sont devenus la norme de l’industrie, ce qui fait obstacle aux efforts déployés sur la scène internationale afin de maîtriser les dépenses pharmaceutiques en fonction des prix courants publics et permet aux entreprises d’exercer une discrimination entre différents tiers payants selon une perception du pouvoir de négociation de l’autre partie et sa capacité de payer. Au Canada, cela entraîne un écart de prix croissant entre les tiers payants publics, qui sont en mesure de négocier collectivement par l’entremise de l’Alliance pancanadienne pharmaceutique (APP), les tiers payants privés, qui peuvent ne pas avoir la souplesse nécessaire pour le faire en vertu des lois sur la concurrence, et les clients payants, qui ne disposent d’aucune capacité de négociation. Dans les pays où les prix sont déterminés au niveau national pour l’ensemble de la population, ce phénomène est évidemment moins prononcé. En ce qui a trait à l’industrie, l’ère des « médicaments vedettes » commercialisés en masse a évolué vers une ère où le rendement de l’investissement le plus rentable découle des médicaments spécialisés très onéreux. Ces « médicaments de niche », comme sont souvent appelés ceux qui connaissent le plus de succès, ciblent des maladies et des affections graves, moins communes et non traitées, mais à un prix que même les tiers payants bien nantis ont du mal à payer. Enfin, la position de l’industrie pharmaceutique canadienne d’aujourd’hui est que toutes les obligations découlant des réformes de la fin des années 1980 et du début des années 1990 doivent tenir compte du passage du temps et du fait qu’un bon nombre de ces changements se sont depuis ancrés comme des normes minimales en vertu des accords commerciaux bilatéraux et multilatéraux (p. ex. ALENA et ADPIC de l’OMC).
La réalité d’aujourd’hui est que la seule contrainte significative sur le prix que les entreprises pharmaceutiques peuvent demander pour leurs produits est ce que le marché peut supporter ou ce que les organismes de réglementation peuvent imposer avec efficacité. Dans les cas où une société détient un monopole sur la seule option de traitement d’une maladie ou d’un trouble particulier, les tiers payants n’ont parfois pas d’autre choix que de payer le prix demandé, peu importe s’il est exorbitant. Bien que le système soit peut être en mesure d’absorber un, deux, ou même des dizaines de nouveaux médicaments très onéreux, il risque de s’effondrer sous le poids de centaines de ces médicaments, même si ces derniers sont habituellement très rentables ou bénéfiques sur le plan thérapeutique. L’inquiétude croissante au sujet de la durabilité a mené d’autres pays ayant des systèmes de santé publique à prendre des mesures pour résoudre les problèmes d’accessibilité financière, optimiser les ressources et suivre le rythme d’un marché pharmaceutique qui évolue rapidement Note de bas de page 4.
Modernisation des Lignes directrices
Bien que les Lignes directrices aient été modifiées récemment, soit en 2010, leur approche générale pour l’application des facteurs de l’article 85 n’a pas changé de façon considérable depuis 1993. Certains des éléments essentiels de cette approche, qui sont décomposés ci-dessous, mettent en évidence les aspects des Lignes directrices qui peuvent avoir grandement besoin d’une réforme.
Avantage thérapeutique
La justification sous-jacente au classement par catégories des nouveaux médicaments brevetés selon l’avantage thérapeutique perçu est de tenter d’harmoniser les prix plafond à l’innovation. En d’autres termes, plus le médicament est efficace, plus le breveté peut demander un prix élevé pour celui-ci. Cette approche peut paraître logique du point de vue de la politique industrielle et de la propriété intellectuelle, mais elle semble être en contradiction avec la jurisprudence récente de la Cour suprême sur la nature et le but du CEPMB. Selon la Cour suprême, le mandat du CEPMB est « d’équilibrer le monopole détenu par le breveté d’un médicament avec les intérêts des acheteurs de ce médicamentNote de bas de page 5 ». En interprétant le mandat de protection des consommateurs du CEPMB, la Cour suprême a conclu par la suite que le CEPMB doit accorder une importance prépondérante à sa responsabilité qui consiste à veiller à ce que les brevetés n’abusent pas de leur monopole « au détriment financier des patients canadiens et de leurs assureurs ».
Tandis que les brevets existent pour récompenser l’innovation par l’entremise des droits exclusifs qu’ils confèrent aux brevetés, le CEPMB existe pour veiller à ce que les brevetés n’abusent pas de ces droits en faisant payer aux consommateurs des prix « excessifs » pour les médicaments brevetés pendant la période de monopole de droits, de la même manière que les licences obligatoires cherchent à parvenir à la limitation des prix par la concurrence sur le marchéNote de bas de page 6. Autrement dit, le CEPMB n’intègre pas d’équilibre entre deux objectifs de la politique fédérale en concurrence; au contraire, il agit comme une moitié de cet équilibre en servant de contrepoids et de contrôle raisonnable sur les droits exclusifs accordés aux brevetés de produits pharmaceutiques.
En tant qu’organisme de réglementation responsable d’une forme de surveillance sur la façon dont un type particulier de breveté (une personne ayant droit aux retombées d’un brevet pour une invention liée à un médicament) exerce ces droits, le CEPMB se distingue des autres organismes de réglementation des produits pharmaceutiques au Canada, tels que l’Institut national d’excellence en santé et en services sociaux (INESSS) au Québec et l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) dans le reste du Canada, dont la fonction principale est de mener des évaluations économiques des nouveaux médicaments en fonction de leurs mérites thérapeutiques par rapport aux traitements existants.
Une approche de classement par catégories des nouveaux médicaments brevetés qui pourrait être plus conforme à l’interprétation de la Cour suprême de la raison d’être du CEPMB et de son rôle unique de réglementation au sein du système canadien serait de mener une vérification préliminaire selon les indicateurs d’éventuel abus de monopole de droits, plutôt que de s’appuyer sur les données cliniques de supériorité thérapeutique. Dans le cadre d’une telle approche, des indicateurs qui sont rationnellement et directement liés aux facteurs prévus par la loi seraient appliqués comme point de départ de l’analyse pour déterminer si un médicament présente un prix excessif, plutôt qu’une étape complémentaire de l’évaluation du degré d’amélioration thérapeutique, qui n’est pas explicitement envisagée dans la Loi et qui double le travail de l’ACMTS et de l’INESSS. Par exemple, un médicament avec un prix de lancement au Canada au-delà du seuil préétabli ou qui est susceptible de provoquer un rationnement par les régimes d’assurance-médicaments publics et privés en fonction du coût ou l’utilisation prévue pourrait attirer une plus grande surveillance réglementaire en matière d’établissement d’un prix plafond. La même approche pourrait s’appliquer à un médicament avec peu ou pas de concurrents dans sa catégorie thérapeutique, peu importe la définition de cette catégorie. Dans ce contexte, l’avantage thérapeutique pourrait encore être pris en compte, mais plutôt comme indicateur qu’une surveillance réglementaire plus rigoureuse peut être justifiée que comme une autorisation de demander un prix plus élevé.
Tout porte à croire que la capacité des brevetés pharmaceutiques à facturer des prix élevés a augmenté au cours des dernières années. La concentration accrue du secteur résultant des fusions et des acquisitions ainsi que la plus grande spécialisation des projets de recherche et développement (R et D) appuient cette observation au Canada, quatre sociétés pharmaceutiques représentent plus de 65 % de tous les revenus dans neuf des dix plus grands sous-groupes pharmaceutiquesNote de bas de page 7 (que 65 % des revenus soient contrôlés par quatre entreprises ou moins est en général reconnu comme un risque élevé pour les consommateurs). Selon un autre outil de mesure (l’indice de Herfindahl-Hirschman), sept des dix principaux sous-groupes pharmacologiques ont des notes supérieures à 2 500 (le seuil pour déterminer un risque élevé pour les consommateurs). Au niveau de l’entreprise, en 2014, les brevetés pharmaceutiques canadiens représentaient 58 % de leur revenu, en moyenne, à partir d’un seul sous-groupe pharmacologique, par rapport à 47 % en 2007.
La possibilité de prix élevés entraînée par la concentration du marché est aggravée par l’attention accrue que porte l’industrie à la R et D aux médicaments spécialisés très onéreux, comme on l’a mentionné plus tôt. Les dépenses mondiales en médicaments spécialisés devraient quadrupler d’ici 2020. En 2014, les dépenses canadiennes en médicaments oncologiques et produits biologiques ont connu une croissance à deux chiffres, et les dépenses liées aux nouveaux médicaments ont décuplé, principalement en raison des traitements de l’hépatite C qui sont très coûteux. Le nombre croissant de médicaments à coût élevé lancés sur le marché canadien au cours de la dernière décennie est illustré à la figure 1 (où l’expression « à coût élevé » indique un médicament pour lequel les régimes d’assurance privés paient plus de 50 000 $ par année par bénéficiaire)Note de bas de page 8.
Figure 1 – Ventes de médicaments à coût élevé au Canada depuis 2005
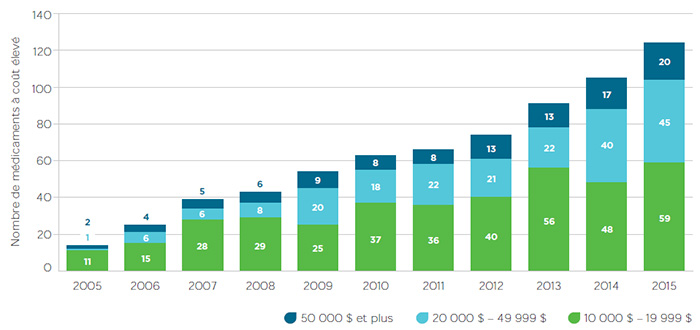
Source : Base de données des régimes privés d’assurance-médicaments d’IMS Brogan, 2005-2014, IMS AG. Tous droits réservés.
Description de la figure
Ce diagramme à barres segmentées montre le nombre de médicaments à coût élevé mis en marché chaque année au Canada entre 2005 et 2015. Chaque bande est divisée en trois segments, représentant chacun une plage de coûts annuels en médicaments, soit entre 10 000 $ et 19 999 $, entre 20 000 $ et 49 999 $ et 50 000 $ ou plus.
Le nombre de médicaments dans les trois groupes a augmenté au cours de la décennie :
- entre 10 000 $ et 19 999 $ : 11 médicaments en 2005, et 59 en 2015;
- entre 20 000 $ et 49 999 $ : 1 médicament en 2005, et 45 en 2015;
- 50 000 $ ou plus : 2 médicaments en 2005, et 20 en 2015.
L’incidence de cette tendance est particulièrement saisissante dans le marché privé de l’assurance, où les dépenses consacrées aux médicaments dont le coût dépasse 50 000 $ par année sont passées de 1 % du total des dépenses en médicaments brevetés en 2005 à 7,4 % en 2015Note de bas de page 9. De façon similaire, alors qu’en 2005 sur 100 000 bénéficiaires actifs d’un régime privé d’assurance-médicaments moyen, seulement trois avaient des coûts annuels en médicaments de 50 000 $ ou plus, ce nombre était passé à 48 en 2015. Il y a également eu une montée en flèche du nombre de bénéficiaires actifs d’un régime privé d’assurance-médicaments dont les coûts annuels en médicaments variaient entre 20 000 $ et 49 999 $. De 4,2 % qu’elle était en 2005, la part des coûts totaux du régime d’assurance-médicaments attribuables à ces patients est passée à 13,9 % en 2015.
Toutes ces tendances soulignent la nécessité d’une plus grande coordination et collaboration entre les organismes de réglementation aux niveaux fédéral, provincial et territorial, ainsi qu’entre tous les tiers payants, tant du secteur public que du secteur privé.
Malgré le raisonnement de la Cour suprême et les changements dans le marché pharmaceutique décrits précédemment, l’approche actuelle de classement par catégorie des médicaments par avantage thérapeutique du CEPMB n’est pas adaptée aux aspects de la dynamique du marché, des prix élevés ou de l’abordabilité. Il en résulte un fardeau réglementaire indu pour les brevetés et cela hypothèque la capacité du CEPMB à attribuer ses ressources d’application de la loi en priorité aux tiers payants qui ont le plus besoin d’un allègement de la réglementation.
Comparaisons des prix à l’échelle internationale
La plupart des pays industrialisés procèdent à une certaine forme de comparaison de prix à l’échelle internationale afin de limiter le coût des médicaments, bien qu’il s’agisse de plus en plus d’un complément à d’autres formes de contrôle des coûts, en raison de la pratique mondiale de remises et de rabais consentis sur une base confidentielle et de la non-fiabilité concomitante des prix courants publics. Le point de référence dont se sert depuis longtemps le CEPMB pour déterminer s’il exécute efficacement son mandat consiste à ce que, en moyenne, les prix canadiens ne dépassent pas les prix moyens des sept pays de comparaison du CEPMB. Cet objectif semble découler de la notion que les Canadiens ne doivent pas payer plus que leur « juste part » des coûts internationaux liés à la R et D et aux nouveaux médicaments.
Même si les prix au Canada demeurent légèrement en deçà des prix médians dans les sept pays de comparaison du CEPMB, c’est seulement parce que les prix aux États-Unis sont beaucoup plus élevés en moyenne que ceux de tous les autres pays de comparaison du CEPMB, ce qui fausse le calcul de la médiane. Cet écart a nettement augmenté au cours des dernières années, alors que les prix américains étaient en moyenne 60 % plus élevés que les prix canadiens en 2000, et 247 % plus élevés en 2014Note de bas de page 10. À l’heure actuelle, parmi les nombreux pays développés qui recourent à la comparaison des prix à l’échelle internationale, le Canada et la Corée du Sud sont les seuls pays à effectuer une comparaison avec les prix américains.
La justification stratégique du recours à la comparaison des prix à l’échelle internationale est d’établir la gamme de prix que les sociétés pharmaceutiques trouvent acceptable en contrepartie de leurs médicaments. La comparaison des prix à l’échelle internationale peut être révélatrice à la fois de ce qu’une société est prête à accepter, et, inversement, du maximum pour lequel elle peut s’attendre à être payée. Toutefois, la réalité actuelle est que les prix réels payés dans les pays européens sont inférieurs aux prix publics que le CEPMB est contraint d’utiliser à des fins de comparaison internationale. En outre, alors que les Lignes directrices actuelles du CEPMB fixent les plafonds de prix en fonction des prix médians et les plus élevés à l’échelle internationale en fonction de l’avantage thérapeutique perçu du médicament, d’autres pays sont beaucoup plus restrictifs. Par exemple, la Suisse exige que les prix soient inférieurs à la moyenne d’un ensemble de pays où les prix sont moyens ou bas.
Compte tenu de ce qui précède, il n’est peut-être pas surprenant que les Canadiens comptent parmi ceux qui paient le plus cher au monde pour leurs médicaments brevetés, comme l’illustre la figure 2, qui montre que les prix canadiens étaient de 35 % plus élevé que la moyenne de l’OCDE pour les mêmes médicaments en 2014.
Figure 2 – Ratios des prix moyens des pays étrangers par rapport aux prix canadiens en 2014
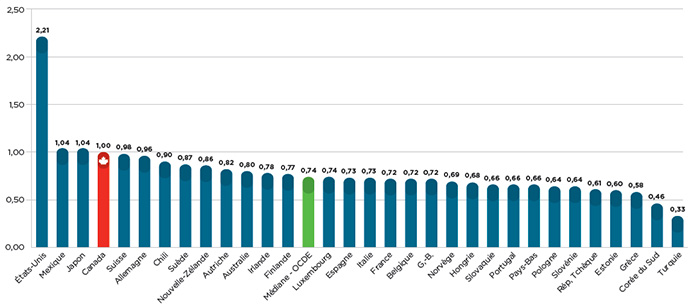
Source : Base de données MIDASMC d’IMS AG, 2005-2014. Tous droits réservés.
Description de la figure
Ce diagramme à barres indique les ratios des prix moyens des pays étrangers par rapport aux prix canadiens en 2014, par pays membre de l’Organisation de coopération et de développement économiques (OCDE), ainsi que la valeur médiane de l’OCDE.
| États-Unis |
2,21 |
| Mexique |
1,04 |
| Japon |
1,04 |
| Canada |
1,00 |
| Suisse |
0,98 |
| Allemagne |
0,96 |
| Chili |
0,90 |
| Suède |
0,87 |
| Nouvelle-Zélande |
0,86 |
| Autriche |
0,82 |
| Australie |
0,80 |
| Irlande |
0,78 |
| Finlande |
0,77 |
| Médiane – OCDE |
0,74 |
| Luxembourg |
0,74 |
| Espagne |
0,73 |
| Italie |
0,73 |
| France |
0,72 |
| Belgique |
0,72 |
| Grande-Bretagne |
0,72 |
| Norvège |
0,69 |
| Hongrie |
0,68 |
| Slovaquie |
0,66 |
| Portugal |
0,66 |
| Pays-Bas |
0,66 |
| Pologne |
0,64 |
| Slovénie |
0,64 |
| République tchèque |
0,61 |
| Estonie |
0,60 |
| Grèce |
0,58 |
| Corée du Sud |
0,46 |
| Turquie |
0,33 |
Pour mettre cette différence en perspective, précisons que les ventes de médicaments brevetés ont atteint 13,7 milliards de dollars au Canada en 2014. Si les Canadiens avaient payé le prix moyen de l’OCDE pour ces médicaments, les consommateurs auraient économisé près de 3,6 milliards de dollars, dont 2,8 milliards de dollars répartis également entre les régimes d’assurance public et privés et 800 millions de dollars économisés directement par les ménages.
Alors que le prix des médicaments au Canada connaît une hausse par rapport aux comparateurs internationaux, l’investissement de l’industrie pharmaceutique en R et D au pays connait un déclin constant.
Figure 3 – Ratio des dépenses en R et D par rapport aux recettes tirées des ventes en 2000 et en 2013
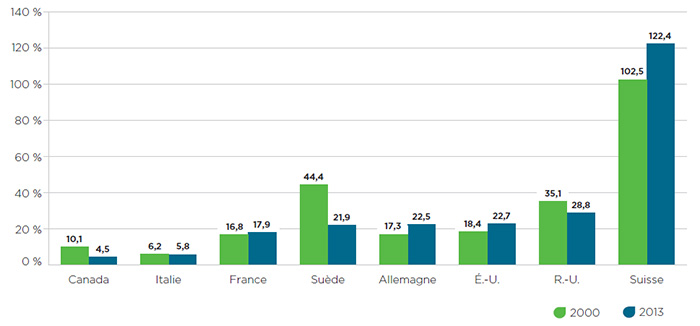
Description de la figure
Ce diagramme à barres indique le ratio des dépenses en recherche et développement par rapport aux recettes tirées des ventes, pour le Canada et pour les sept pays de comparaison du CEPMB, en 2000 et en 2013.
| Pays |
2000 |
2013 |
| Canada |
10,1 % |
4,5 % |
| Italie |
6,2 % |
5,8 % |
| France |
16,8 % |
17,9 % |
| Suède |
44,4 % |
21,9 % |
| Allemagne |
17,3 % |
22,5 % |
| États-Unis |
18,4 % |
22,7 % |
| Royaume-Uni |
35,1 % |
28,8 % |
| Suisse |
102,5 % |
122,4 % |
En général, au cours des dernières années, l’investissement en R et D a été de plus en plus concentré dans les pays où se trouvent les sièges sociaux multinationaux de grandes sociétés pharmaceutiques, comme l’Allemagne, les États-Unis et la Suisse. Avec une sagesse rétrospective, on réalise que l’approche du Canada consistant à comparer les prix à ceux de pays dont il souhaite reproduire le niveau de R et D est fondée sur une politique reposant sur une fausse présomption. À la lumière de ce fait et de la liste des prix publics artificiellement gonflés dans ces pays, il y a lieu de penser que soit la composition des sept pays de comparaison du CEPMB doit changer de façon à mieux cadrer avec le niveau de R et D actuel au Canada et les indicateurs clés économiques et du système de santé, soit la manière dont les Lignes directrices établissent les prix plafond des sept pays de comparaison du CEPMB doit être revue à la baisse pour s’harmoniser avec l’approche plus restrictive prise dans les pays tels que la Suisse.
Comparaisons des prix à l’échelle nationale
Selon les Lignes directrices actuelles, les nouveaux médicaments brevetés qui présentent une « amélioration nulle ou minime » peuvent être vendus à un prix correspondant à la limite supérieure de la catégorie thérapeutique. Cette pratique pose problème pour deux raisons. D’abord, il y a un décalage par rapport à la façon dont bon nombre d’autres pays réglementent l’établissement des prix et le remboursement des médicaments appelés « succédanés », ce qui entraîne un écart important entre les prix canadiens et les prix médians des sept pays de comparaison du CEPMB pour cette catégorie de médicamentsNote de bas de page 11. Ensuite, comme c’est le cas pour les comparaisons à l’échelle internationale, les prix auxquels se fie le CEPMB aux fins de comparaison nationale ne reflètent pas les remises et les rabais confidentiels que les brevetés accordent régulièrement à leurs clients les plus importants. L’incidence de la tarification confidentielle est peut-être le plus pernicieuse dans cette catégorie étant donné qu’elle représente plus de 80 % des médicaments relevant de la compétence du CEPMB.
La transparence des prix est un problème auquel tous les pays industrialisés sont confrontés, et il faudra sans aucun doute faire appel à une coopération internationale si l’on veut trouver une solution. Toutefois, les changements possibles aux Lignes directrices peuvent contribuer à atténuer l’incidence du manque de transparence des prix en réduisant les plafonds de prix comme indicateurs des prix réels nets des rabais et des remises. Si l’objectif de la comparaison de la catégorie thérapeutique est de protéger les Canadiens contre le risque que les nouveaux médicaments brevetés augmentent les coûts de traitement à des niveaux excessifs, alors le fait de faire une comparaison avec le prix le plus élevé d’un groupe thérapeutique pousse les prix plafond dans la mauvaise direction. Ce n’est que lorsque les comparaisons selon la catégorie thérapeutique se produisent en fonction d’une certaine mesure de la centralité de la catégorie (tels que les prix moyens ou médians) ou du caractère minimal (tels que les prix les plus bas) que la tendance à la hausse des prix découlant de l’introduction de succédanés successifs est maîtriséeNote de bas de page 12.
Parallèlement, le fait que les succédanés ayant plusieurs comparateurs thérapeutiques à l’échelle nationale sont confrontés à une certaine concurrence, quoiqu’imparfaite (le marché des médicaments d’ordonnance est unique dans le sens que ceux qui choisissent ne paient pas et ceux qui paient ne choisissent pas), pourrait plaider en faveur d’une réduction de la surveillance réglementaire de cette catégorie de médicaments, et non d’une augmentation. Une solution à ces considérations contradictoires serait d’offrir un prix plafond inférieur pour les succédanés inclus aux Lignes directrices au lancement de ces derniers, mais d’adopter une approche plus souple pour les surveiller d’une manière progressive, compte tenu du moindre risque d’établissement de prix excessifs. Cette approche permettrait une utilisation plus stratégique et ciblée des ressources du CEPMB tout en préservant l’exercice éventuel de sa juridiction sur tous les médicaments brevetés.
Hausses des prix en fonction des variations de l’indice des prix à la consommation
Chaque pays a un intérêt à veiller à ce que les prix des médicaments soient stables et prévisibles au fil du temps. Au Canada, cela est pris en compte dans la Loi et les Lignes directrices dans la mesure où les prix des médicaments brevetés ne peuvent augmenter davantage que le taux d’inflation moyen (selon l’IPC) au cours d’une année donnée. Toutefois, d’autres pays, comme la France, la Suède et la Suisse, adoptent une approche plus rigoureuse : les prix des produits pharmaceutiques ne peuvent soit pas augmenter ou doivent diminuer à des intervalles déterminés. Cela paraît logique, étant donné qu’au fil du temps, les coûts différentiels de production d’un médicament devraient diminuer et la concurrence des prix découlant de la venue des nouveaux médicaments devrait se faire sentir sur le marché. Les politiques qui normalisent ces attentes se distinguent comme de bons exemples de la protection des consommateurs.
Le bien-fondé de la politique pour l’examen des prix canadiens des médicaments brevetés dans le contexte de l’évolution de l’IPC est d’empêcher que le prix de tout médicament augmente à un taux supérieur au niveau moyen des prix pour tous les biens et services vendus au Canada (pour lequel l’IPC est un indicateur bien établi). Cela est lié au rôle de protection des consommateurs du CEPMB : si les brevetés de produits pharmaceutiques sont en mesure d’augmenter les prix de leurs produits à un taux supérieur à celui des autres biens et services, cela pourrait être un indicateur de prix excessifs.
La pratique actuelle du CEPMB à cet égard est généralement considérée comme la réalisation de ses objectifs : depuis 1992, le taux moyen de variation des prix des produits pharmaceutiques brevetés au Canada a été inférieur à l’IPC. Toutefois, cette approche de la question dissimule de graves préoccupations à un niveau supérieur. Plus particulièrement du fait qu’à l’exception des États-Unis, les régimes de réglementation des prix des produits pharmaceutiques privilégient la diminution des prix. Par exemple, entre 2008 et 2014, les prix de 64 % des médicaments brevetés vendus au Canada et en Suisse ont diminué en Suisse, mais ont augmenté au CanadaNote de bas de page 13. Cette tendance est similaire parmi les sept pays de comparaison du CEPMB (à l’exception des États-Unis).
De plus, la pratique du CEPMB qui consiste à examiner tous les médicaments brevetés annuellement par rapport à l’IPC et par rapport au prix le plus élevé à l’échelle internationale, mais seulement une fois (au lancement) selon la catégorie thérapeutique, ne cadre pas avec l’approche adoptée dans de nombreux autres pays. Par exemple, la Suisse réévalue complètement les prix d’un tiers des médicaments d’ordonnance chaque année (de telle sorte que l’ensemble du Portefeuille est réévalué aux trois ans). La France réévalue les médicaments au minimum aux deux ans et au maximum aux cinq ans, selon si des données cliniques ou des observations supplémentaires ont été élaborées. Bien que la Loi prévoie clairement que le CEPMB devrait tenir compte de l’IPC pour déterminer si le prix d’un médicament breveté est devenu excessif, cela n’empêche pas le CEPMB de l’examiner d’une manière différente de celle actuellement prescrite en vertu des Lignes directrices, pourvu que cela soit tout aussi raisonnable, ou d’assurer la réévaluation périodique des prix des médicaments pour déterminer, en fonction d’autres facteurs de l’article 85, si une diminution peut être justifiée. Cela pourrait être le cas si, par exemple, à la suite de l’examen du prix de lancement d’un nouveau médicament par le CEPMB, ce médicament est approuvé ou prescrit pour des indications supplémentaires, de telle sorte que la catégorie de médicaments à laquelle il doit être comparé à des fins d’établissement des prix a changé ou que son profil d’accessibilité financière pour les tiers payants est considérablement touché.
Examen du prix sur un marché
Comme mentionné, le manque de transparence des prix dans le système pharmaceutique canadien permet aux brevetés d’introduire une distinction entre les différentes catégories de consommateurs. La Loi confère le pouvoir au CEPMB d’évaluer si le prix d’un médicament breveté est excessif « sur un marché » au Canada. Les Lignes directrices actuelles mettent en application cette autorité grâce à l’examen minutieux des prix aux niveaux du grossiste, de la pharmacie et de l’hôpital et dans chaque province et territoire. Toutefois, cela se fait seulement lors du lancement. Au cours des années qui suivent, l’examen sur un marché n’est effectué que si un médicament fait déjà l’objet d’une enquête.
Selon les données que les brevetés présentent au CEPMB (qui doivent comprendre les prix moyens à l’échelle provinciale), si les consommateurs de toutes les provinces avaient accès au prix que les consommateurs paient dans la province où le prix est le plus bas, les dépenses canadiennes totales pour les produits pharmaceutiques brevetés diminueraient de plus de 600 millions de dollars, ce qui représente une réduction globale de presque 5 %.
Étant donné que la Loi prévoit une évaluation des prix « sur un marché », il pourrait être utile d’accorder plus d’importance à la question d’équité entre les catégories de clients, que ce soit par région ou par type de tiers payants, pour déterminer si le prix d’un médicament breveté est excessif.
Vers une modernisation du cadre
Comme il a été mentionné, les changements récents et importants au fonctionnement du CEPMB nécessitent des changements correspondants pour moderniser et simplifier son cadre de réglementation. Il est admis qu’il y aura des divergences d’opinions des intervenants et du public sur ce point et qu’il est peu probable qu’un consensus émerge de consultations sur un ensemble unique de changements que toutes les parties croient justifiées dans les circonstances. C’était prévisible, compte tenu des enjeux et des intérêts politiques, économiques, sociaux, juridiques, commerciaux et technologiques interreliés et concurrentiels qui sont en jeu. Le présent document n’a pas pour objet d’examiner de manière exhaustive les arguments en faveur du changement, ni d’indiquer quelle forme il pourrait prendre. C’est précisément à cela que servent les consultations et le CEPMB attend avec impatience d’avoir l’occasion de s’engager dans un dialogue approfondi à l’échelle nationale avec les parties intéressées et le public dans les mois à venir, pour faire en sorte que toutes les voix soient entendues et que tous les éléments soient pris en compte.
Questions aux fins de discussion
Comme première étape pour donner effet à son obligation de consulter en vertu du paragraphe 96(5) de la Loi, le CEPMB pose les questions suivantes afin d’amorcer la discussion sur la modernisation des Lignes directrices. Les commentaires reçus en réponse à ces questions éclaireront la phase initiale du processus de consultation du CEPMB, ainsi que cela a été expliqué précédemment dans le cadre de la section « Ce que nous faisons » du présent document.
- Que signifie le mot « excessif » pour vous dans le cadre de l’établissement du prix des médicaments au Canada aujourd’hui? Par exemple :
- Un médicament qui coûte plus cher par année qu’une certaine valeur de mesure financière convenue doit-il être considéré comme pouvant être d’un prix excessif?
- Un médicament dont le coût est exponentiellement plus élevé que celui d’autres médicaments utilisés pour traiter la même maladie doit-il être considéré comme étant d’un prix excessif?
- En examinant les deux questions susmentionnées, cela vous importe-t-il lorsqu’un médicament coûteux ne traite qu’un petit groupe de patients s’il ne représente qu’une fraction de l’ensemble des dépenses en médicaments au Canada?
- À l’inverse, si le prix d’un médicament est inférieur à une valeur de mesure financière convenue et qu’il correspond au prix d’autres médicaments utilisés pour traiter la même maladie, ce médicament devrait-il être considéré comme étant d’un prix excessif s’il représente une part disproportionnée de l’ensemble des dépenses en médicaments au Canada?
- Quelles considérations économiques devraient être prises en compte pour déterminer si un médicament est d’un prix excessif?
- Puisque c’est pratique courante dans le secteur pharmaceutique mondial d’insister pour que les prix ne reflètent pas les rabais et les remises, le CEPMB devrait-il en général accorder moins d’importance à la liste des prix courants à l’échelle internationale lorsqu’il établit le prix maximum non excessif d’un médicament?
- À votre avis, compte tenu de l’environnement opérationnel actuel du secteur pharmaceutique, y a-t-il un facteur particulier énoncé à l’article 85 auquel les Lignes directrices devraient donner priorité ou qui devrait peser plus lourd lorsqu’on détermine si le coût d’un médicament pourrait être excessif?
- Le CEPMB devrait-il fixer les prix maximums non excessifs des médicaments à l’échelon inférieur, intermédiaire ou supérieur de l’échelle des prix des sept pays de comparaison du CEPMB (États-Unis, Royaume-Uni, Suède, Suisse, Allemagne, France et Italie)?
- La différence entre le montant que l’industrie pharmaceutique investit dans les travaux de recherche et de développement au Canada et celui qu’elle investit dans ces autres pays influe-t-il sur votre réponse à la question ci-dessus et dans l’affirmative, pourquoi?
- Quelles sont les solutions de rechange à l’approche actuelle de catégorisation des nouveaux médicaments brevetés (en fonction du niveau d’avantages thérapeutiques) qui pourraient être utilisées pour appliquer les facteurs prévus par la Loi dès le départ et régler les problèmes de prix relativement élevés, de dynamique du marché et d’abordabilité?
- Le CEPMB devrait-il envisager divers niveaux de surveillance réglementaire pour les médicaments brevetés en se fondant sur les indicateurs de risque d’établissement de prix excessifs?
- Le prix plafond d’un médicament breveté devrait-il être révisé au fil du temps et, dans l’affirmative, à quelle fréquence, dans quelles circonstances et dans quelle mesure?
- La discrimination par les prix entre les provinces/territoires et les types de tiers payants devrait-elle être considérée comme une forme d’établissement de prix excessif et, dans l’affirmative, dans quelles circonstances?
- Y a-t-il d’autres aspects des Lignes directrices non mentionnés dans le présent document qui nécessitent un examen à la lumière des changements dans l’environnement opérationnel du CEPMB?
- Les changements apportés aux Lignes directrices à la lumière de ce processus de consultation devraient-ils s’appliquer à tous les médicaments brevetés ou seulement à ceux qui sont lancés après les changements?
- L’une ou plusieurs des questions soulevées dans le présent document devraient-elles être réglées également ou autrement par des changements sur le plan de la réglementation ou de la législation?
Directives pour la présentation de commentaires
Les commentaires écrits doivent être envoyés par courriel, par courrier ou par télécopieur au plus tard le 24 octobre 2016 à l’adresse suivante :
Conseil d’examen du prix des médicaments brevetés
(Repenser les Lignes directrices)
Case postale L40, 333, avenue Laurier Ouest, bureau 1400
Ottawa (Ontario) K1P 1C1
Télécopieur : 613-952-7626
Courriel : PMPRB.Consultations.CEPMB@pmprb-cepmb.gc.ca
Annexe 1 : Plan stratégique 2015-2018
En 2014, le CEPMB a entrepris un processus de planification stratégique d’un an qui a abouti à la publication du Plan stratégique 2015-2018. Ce plan permettra d’orienter la progression des travaux du CEPMB au cours des prochaines années et reflète la vision quant à la manière dont le CEPMB peut optimiser ses forces et ses compétences législatives uniques pour compléter les efforts de ses partenaires fédéraux, provinciaux et territoriaux et des autres intervenants en vue de la réalisation de l’objectif commun consistant à établir un système de santé durable. Le document Plan stratégique 2015-2018 complet est disponible sur le site Web du CEPMB.